进样量和信号强度对气相色谱-燃烧-同位素比值质谱测定δ13C和δ15N的影响
杜屹原,孟宪菁,杨 斌,宋 亮,朱光旭,周 晓,张嫒萍,潘 洁,江琳琳
(1.中国科学院西双版纳热带植物园热带森林生态学重点实验室,云南 勐仑 666303;2.中国科学院大学,北京 100049;3.赛默飞世尔科技(中国)有限公司,上海 201206;4.中国科学院核心植物园,云南 勐仑 666303;5.贵阳学院生物与环境工程学院,贵州 贵阳 550005;6.普洱学院,云南 普洱 665000;7.沈阳农业大学,辽宁 沈阳 110866)
具备连续流进样技术的同位素比值质谱(isotope ratio mass spectrometry, IRMS)具有自动化程度高、分析速度快和稳定性好等特点,已被广泛应用于地球化学[1-2]、环境科学[3-4]和食品科学[5-6]等领域。以往研究大多数基于元素分析(elemental analyzer)-同位素比值质谱(EA-IRMS)联机系统的快速燃烧原理,可对样品总体碳(δ13C)、氮(δ15N)同位素进行测定,极大地拓展了同位素技术的指示、示踪和整合功能[7-8]。但是,由于研究对象在物种、时间和空间上的变化,导致了其体系内部不同化合物代谢过程的差异性与复杂性,仅依赖总体同位素分析往往缺乏代表性和可信性,甚至可能造成分析过程的误判。体系内特定化合物通常具有较固定或明确的生物化学过程,针对特定化合物的同位素分析具有更好的指向性。尽管如此,目前的EA-IRMS无法检测复杂体系中特定化合物的同位素组成。
气相色谱-燃烧-同位素比值质谱仪(GC-C-IRMS)联机系统可对复杂体系中的不同化合物进行色谱分离,依次燃烧转化为气态的CO2或N2,实现特定化合物δ13C和δ15N的测定[5,9-10],具有灵敏度高、检测范围宽和重现性好等优点[9,11-14]。精度和准确度是评价GC-C-IRMS性能的关键指标,对于评价GC-C-IRMS对特定化合物的检测能力具有重要意义[7,15-17]。考虑到节省成本或待测样品稀缺,目标化合物浓度(或C、N元素含量)较低时,会导致分析测试时进样量也较低。此外,某些化学结构相似的化合物在色谱柱上的保留时间接近,即使优化色谱条件也可能无法使相邻色谱峰间实现完全的基线分离,峰-峰交互干扰会影响测定结果的准确性。为实现完全的基线分离,样品进样量或由其转化的CO2或N2信号强度应尽量低。
GC-C-IRMS对微量化合物检测的不确定性限制了特定化合物同位素分析技术的应用。咖啡因(C8H10N4O2)是一种黄嘌呤生物碱有机化合物,因其化学成分和结构简单,在GC-C-IRMS中可以完全地气化、洗脱和燃烧转化,可作为大多数特定化合物C、N同位素质谱测定的公认标准[18]。氨基酸(RCHNH2COOH)是构成蛋白质的基本单元,也是联系生物界和非生物界的重要枢纽物质,利用特定氨基酸C、N同位素技术可以精准识别生态系统中不同生物的营养级位置[19-20]。生物体内氨基酸种类繁杂、浓度差异大,过高进样量会导致出峰时间接近的氨基酸化合物无法实现峰-峰完全分离,过低进样量会降低信噪比而影响δ13C和δ15N测量的精准度。
基于此,迫切需要综合评价进样量和信号强度对GC-C-IRMS测定δ13C和δ15N的影响。本工作拟以咖啡因化合物为研究对象,在保证δ13C和δ15N测定精准度的前提下,探讨GC-C-IRMS对进样量和信号强度变化的响应特征,并结合多种氨基酸衍生物测定,揭示GC-C-IRMS测定复杂体系内特定化合物δ13C和δ15N的性能表现。
1 实验部分
1.1 仪器与装置
GC-C-IRMS联机系统:美国Thermo Fisher Scientific公司产品,主要由TriPlus RSH自动进样器、Trace 1310 GC气相色谱仪、GC IsoLink Ⅱ燃烧转化单元、ConFlo IV连续流通用接口和DELTA V Advantage同位素比值质谱仪5部分组成。特定化合物通过TriPlus RSH自动进样器自动注入Trace 1310 GC,色谱分离后进入GC IsoLink II燃烧转化单元,经过填装Ni和Cu的微型氧化管燃烧转化为CO2或N2气体后进入ConFlo Ⅳ连续流通用接口,再经开口分流器引入DELTA V Advantage同位素比值质谱仪。DELTA V Advantage可将CO2气体电离为[12C16O2]+、[13C16O2]+和[12C16O18O]+,或将N2气体电离为[14N2]+、[14N15N]+和[15N2]+,经由通用三杯接收器采集和不同电阻值的放大器转化为电压信号后实现δ13C或δ15N的测定。
1.2 材料与试剂
将IAEA-600咖啡因标准物质(国际原子能机构产品)溶解于丙酮溶剂待测;丙氨酸(Ala)、甘氨酸(Gly)、α-氨基丁酸(α-ABA)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile)、天冬氨酸(Asp)、苏氨酸(Thr)、丝氨酸(Ser)、蛋氨酸(Met)、谷氨酸(Glu)和苯丙氨酸(Phe)共12种氨基酸及其混合物:纯度≥ 99.9%,均为美国Sigma-Aldrich公司产品。氨基酸衍生化过程:首先将上述氨基酸混合物充分干燥后溶解于1 mL亚硫酰氯-异丙醇溶液(1∶4,V/V)中,于110 ℃酯化2 h;经氮气吹干后,再加入1 mL新戊酰氯-二氯甲烷溶液(1∶4,V/V),于110 ℃酰化2 h;氮吹仪去除多余的衍生化试剂,最后将生成的O-异丙醇酯(NPP)衍生物溶解于0.5 mL二氯甲烷溶剂中待测[17,20]。使用USGS-40和USGS-41标准物质(美国地质调查局产品)对CO2(纯度99.995%)和N2(纯度99.999%)工作标气(液化空气上海有限公司产品)进行标定。标准物质信息列于表1。
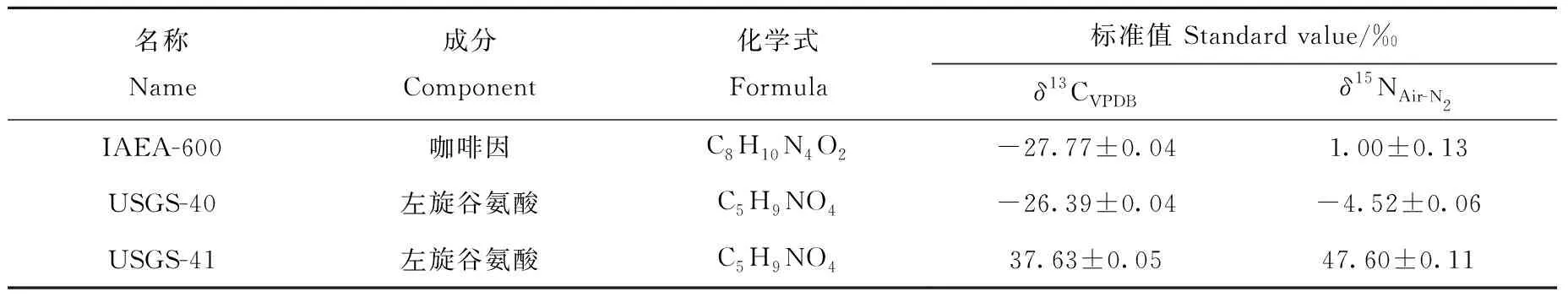
表1 标准物质的同位素信息Table 1 Isotopic information of the standards
1.3 实验条件
1.3.1色谱条件 咖啡因和氨基酸混合物均采用TG-5MS毛细管色谱柱(30 m×0.25 mm×0.25 μm)进行分离,以高纯氦气(99.999%)为载气。
咖啡因分析的色谱参数:载气流速1.2 mL/min;进样口温度260 ℃;程序升温:起始温度50 ℃,保持1 min,以10 ℃/min升温至260 ℃,保持3 min,总时长25 min。
氨基酸分析的色谱参数:载气流速2 mL/min;进样口温度250 ℃;程序升温:起始温度60 ℃,保持2.5 min,以15 ℃/min升温至110 ℃后,立即以3 ℃/min升温至150 ℃,再立即以6 ℃/min升温至230 ℃,保持6 min,最后以25 ℃/min升温至300 ℃,保持1 min,总时长42.3 min。为保证不同氨基酸的色谱分离效果,每隔24 h进行200~300 ℃梯度升温烘烤约2 h以活化色谱柱。
1.3.2燃烧转化单元 燃烧转化温度为1 000 ℃。为确保待测化合物充分燃烧转化,分析咖啡因时,每隔7~10天注入O2约1 h以活化氧化管;分析氨基酸混合物时,每隔24 h注入O2约1 h以活化氧化管。测定δ15N时,须使用液态氮冷冻去除样品燃烧产生的CO2气体,防止[CO]+碎片离子对相同质荷比的[N2]+分子离子造成干扰。
1.3.3质谱条件 电子轰击离子源(EI);加速电压2.98 kV;发射电流1.50 mA;电子能量123.95 eV;引出电压大于80%;质谱真空度1.6×10-4Pa;识别起、止色谱峰的斜率0.2、0.4 mV/s;最小检出信号20 mV;咖啡因δ13C和δ15N分析的本底值扣除方法采用Calc Mean BGD,即取出峰前5 s内所有本底值(BGD)信号数据点的平均值;氨基酸δ13C和δ15N分析的本底值扣除方法采用Individual BGD,即取出峰前5 s内最小的连续5个BGD信号数据点的移动平均值。
1.4 实验方法
1.4.1咖啡因测定 称取IAEA-600咖啡因标准物质,配制成14种浓度(0.5~150 mg/L)的咖啡因-丙酮溶液,用于测定δ13C。采用不分流进样模式,进样体积1 μL。咖啡因(C8H10N4O2)C含量为49.44%,可以实现不同C质量(0.25~74.16 ng)的柱上进样量。用同样方法配制14种浓度(5~350 mg/L)的咖啡因-丙酮溶液用于δ15N测定,咖啡因N含量为28.86%,可以实现不同N质量(1.44~101.01 ng)的柱上进样量。咖啡因标准物质浓度梯度信息列于表2。
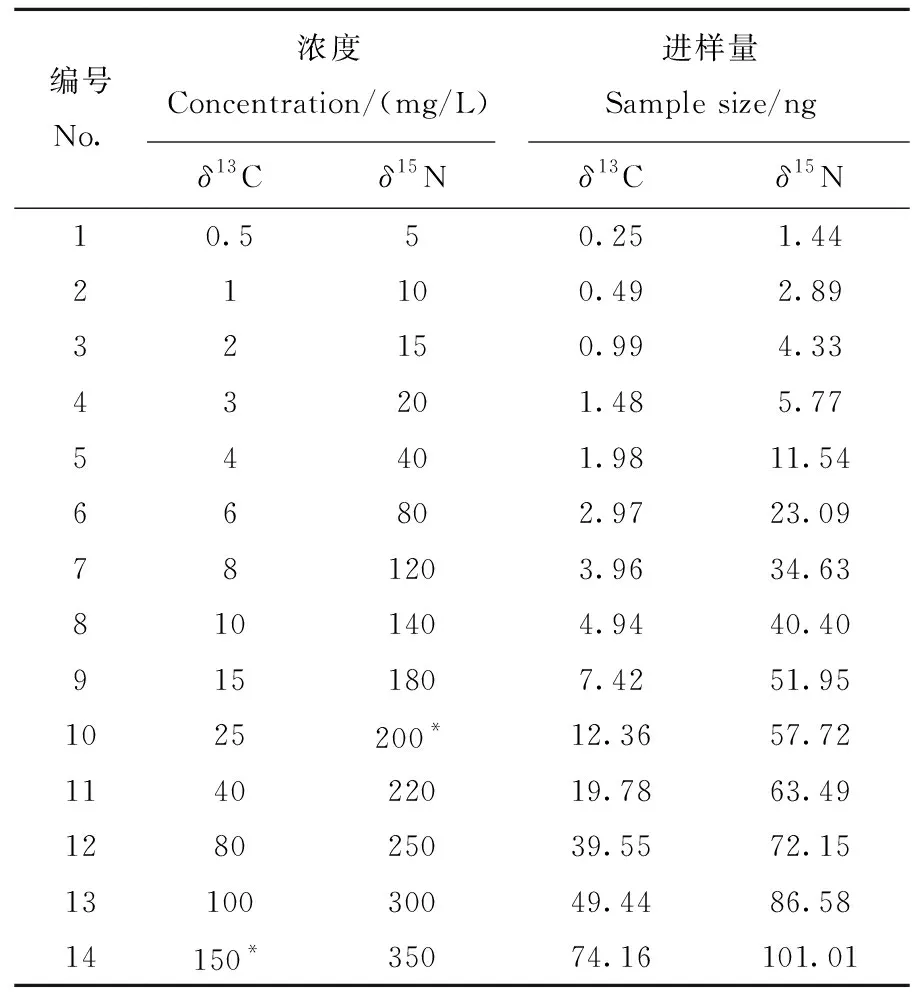
表2 咖啡因标准物质浓度梯度信息Table 2 Concentration gradient of the caffeine standards
1.4.2氨基酸测定 为检验信号强度对混合体系内特定化合物δ13C测定的影响,以12种氨基酸混合物为研究对象,采用5种模式进样,即进样体积1 μL,不分流;进样体积0.2 μL,不分流;进样体积0.1 μL,不分流;进样体积0.5 μL,分流比10∶1;进样体积0.1 μL,分流比10∶1。前3种模式测试1次,后2种模式测试2次。
由于氨基酸N含量较低,且IRMS对N2的离子化效率较低[21],若进样体积小于1 μL或采用分流模式,将导致N2信号强度过低而无法检出。因此,本研究仅采用进样体积为1 μL且不分流模式,每隔12 h测试1次上述氨基酸δ15N,共测试8次,以评价GC-C-IRMS对混合体系内特定氨基酸δ15N测定的时间稳定性。每种氨基酸的分子结构由气相色谱-同位素比值质谱(GC-IRMS)[22]分析得到。
EA-IRMS是目前精准测定样品总体同位素最重要的系统之一,其测定结果常被作为公认结果。EA-IRMS对δ15N的测定基于快速燃烧原理,将样品在1 000 ℃高温和过氧环境下瞬间燃烧,经Cu还原形成N2等气体,并通过除卤除硫剂及H2O和CO2吸附剂,纯化后的N2进入IRMS测定。作为对比,基于EA-IRMS[15]对12种氨基酸δ15N进行单独测定,主要参数设定参考文献[15,21],每种氨基酸重复测定6次,交叉验证GC-C-IRMS与EA-IRMS对混合体系内特定氨基酸δ15N测定结果的一致性。
1.5 数据处理
采用GC-C-IRMS和EA-IRMS测量δ13C和δ15N时,需要使用CO2和N2工作标气进行标定,溯源至国际标准,计算公式如下:
δSpl-ST(‰)=δSpl-WG+δWG-ST+
δSpl-WG×δWG-ST× 10-3
式中,Spl表示咖啡因或氨基酸;WG表示工作标气;ST表示国际标准,如VPDB或Air-N2。工作标气δWG-ST采用两点线性内插法进行校准:使用USGS-40和USGS-41同位素标准物质,通过EA-IRMS测量后建立标准值与测量值的线性方程,将工作标气初始值代入该方程后得到校准后的δWG-ST,其δ13C和δ15N校准值分别为(-30.36 ± 0.03)‰和(-1.27 ± 0.05)‰(n=5)。以上数据处理通过同位素比值质谱仪专用软件Isodat 3.0(美国Thermo Fisher Scientific公司产品)完成。
2 结果与讨论
2.1 GC-C-IRMS测定咖啡因δ13C和δ15N
GC-C-IRMS测定IAEA-600咖啡因标准物质δ13C的进样量和信号强度响应特征示于图1。随着进样C质量从0.25 ng增加到74.16 ng时,CO2的信号强度由23 mV逐渐增大到7 706 mV。较低且稳定的CO2本底值是保证小样品量样品δ13C测定精度和准确度的重要前提[7]。本研究中,咖啡因δ13C产生的CO2本底值(BGD 44)平均为(3.8 ± 0.4) mV。测定结果表明,当C质量< 1 ng或m/z44信号<100 mV时,能够实现对样品的检测,但是过低的信噪比会导致咖啡因δ13C测定值精度较差;当C质量≥1 ng或m/z44信号≥100 mV时,咖啡因δ13C的测定精度和准确度可达到实验室分析要求[5,12-13],其平均精度为0.16‰,平均分析误差为0.09‰。值得注意的是,即使C质量高达70 ng或m/z44信号高达7 800 mV以上,该系统仍能保证δ13C的测定精准度,表明在进样量较大时,GC-C-IRMS仍可将目标化合物完全燃烧转化。
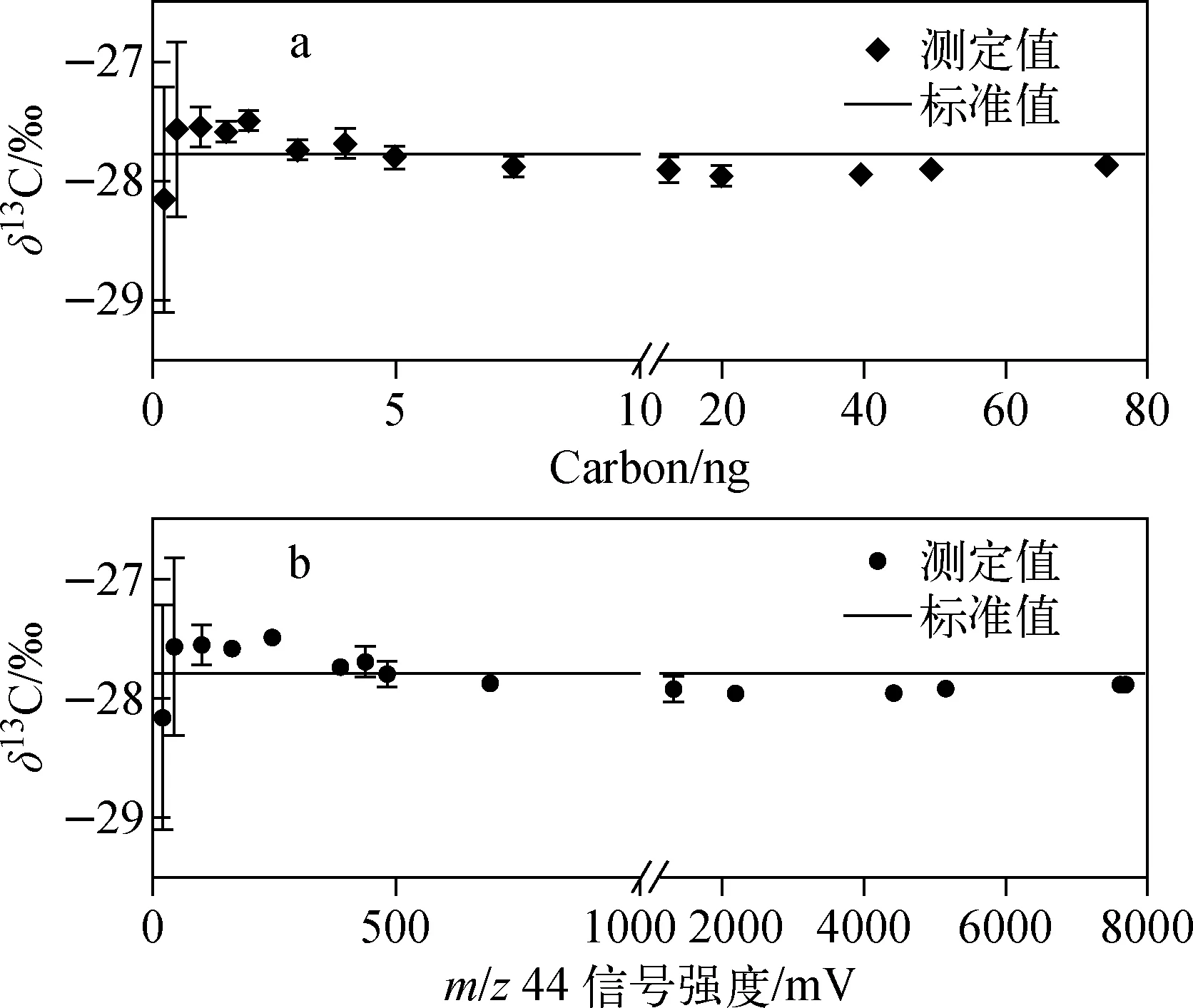
图1 GC-C-IRMS测定咖啡因δ13C的进样量(a)和信号强度(b)响应特征Fig.1 Response of GC-C-IRMS on caffeine δ13C measurement to sample size (a) and signal intensity (b)
GC-C-IRMS测定IAEA-600咖啡因标准物质δ15N的进样量和信号强度响应特征示于图2。随着进样N质量从1.44 ng 增加到101.01 ng,N2信号强度由18 mV逐渐增大到1 926 mV。本研究测定δ15N时,本底值(BGD 28)平均为(38±4) mV。由于本底效应的影响较大,而且IRMS对N2的离子化效率较低[21,23],GC-C-IRMS在小样品量条件下测定咖啡因δ15N时的精准度相对δ13C略低。测定结果表明,只有当N质量≥ 5 ng或m/z28信号≥ 100 mV时,该系统对咖啡因δ15N的测定精度和准确度才能满足实验室测试要求[7,14-15],其平均精度为0.27‰,平均分析误差为0.13‰。当进样量较大(N质量≥100 ng)时,该系统仍然可以将目标化合物中的N完全转化为N2,并能够保证δ15N的精准度。
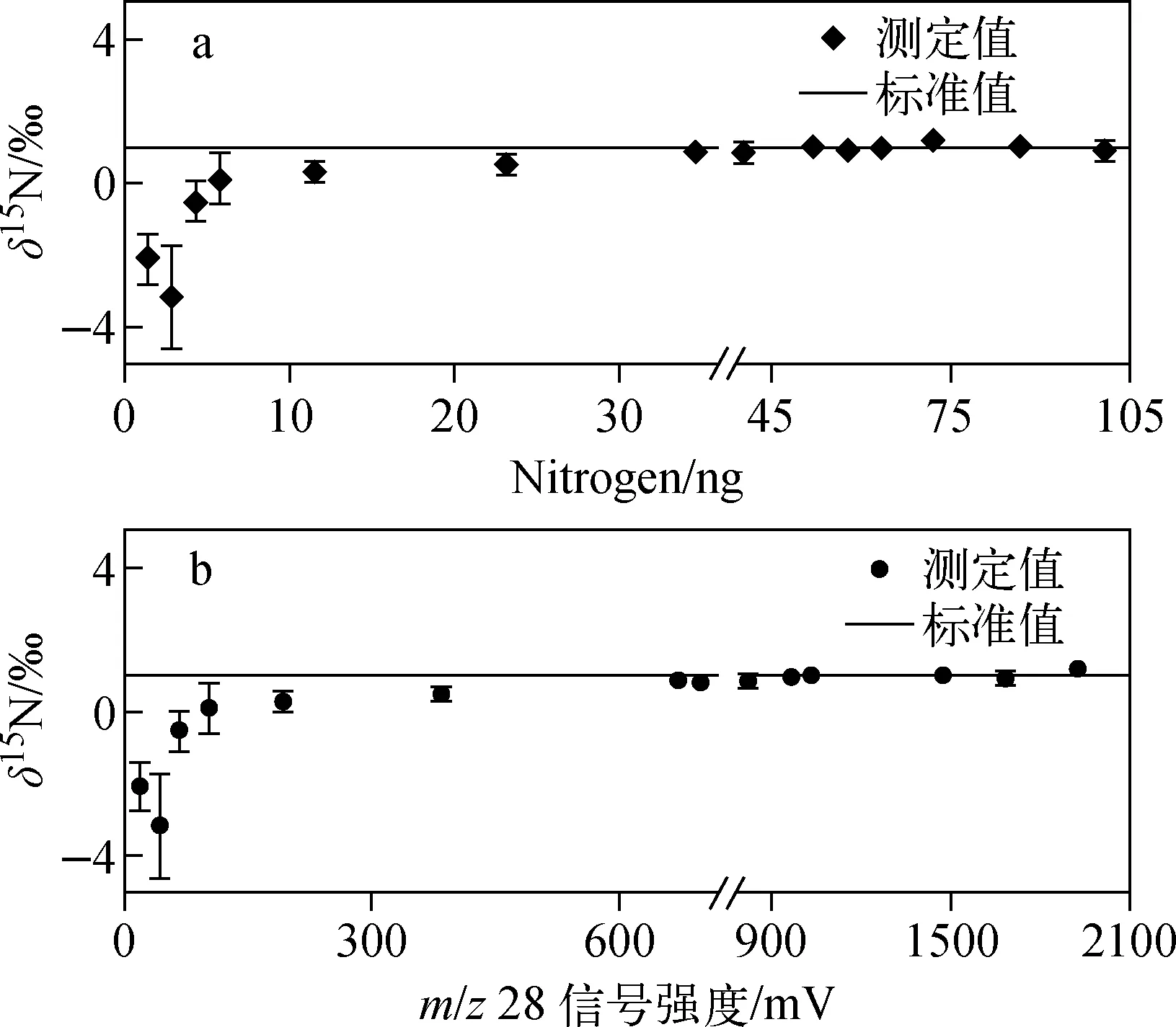
图2 GC-C-IRMS测定咖啡因δ15N的进样量(a)和信号强度(b)响应特征Fig.2 Response of GC-C-IRMS on caffeine δ15N measurement to sample size (a) and signal intensity (b)
2.2 GC-C-IRMS测定氨基酸混合体系δ13C
GC-C-IRMS测定12种氨基酸混合体系中δ13C的色谱图示于图3。由于氨基酸极性强、不易挥发、热稳定性差,在进行GC-C-IRMS分析之前需要将其衍生化为弱极性、易挥发、热稳定性好的氨基酸衍生物。测定结果表明,12种氨基酸的出峰时间在750~1 700 s之间,峰宽一般在10~15 s之间。每种特定氨基酸重复测量的出峰时间漂移一般不超过1 s,每种氨基酸m/z44的信号强度在100~1 000 mV之间,根据2.1节分析结果,上述12种氨基酸δ13C的测定精度和准确度均可达到实验室分析要求。增加进样量有助于提高单一体系氨基酸δ13C的测定精准度,但进样量过高会导致混合体系内色谱保留时间相近的氨基酸不能实现完全的峰-峰分离。为确保每个特定化合物的色谱峰能够完全基线分离,在满足GC-C-IRMS实验室测试精准度要求的前提下,由待测化合物转化的CO2信号强度应尽量低[5,10]。
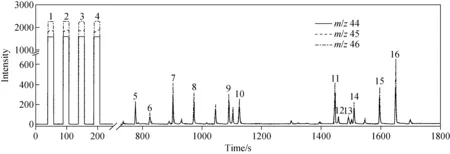
注:1~4为CO2参比峰,5~16分别为丙氨酸、甘氨酸、α-氨基丁酸、缬氨酸、亮氨酸、异亮氨酸、天冬氨酸、苏氨酸、丝氨酸、蛋氨酸、谷氨酸和苯丙氨酸的CO2样品峰图3 GC-C-IRMS测定混合体系中特定氨基酸δ13C的色谱图Fig.3 Chromatogram of specific amino acid δ13C by GC-C-IRMS
GC-C-IRMS测定12种氨基酸混合体系中δ13C的信号强度依赖性特征示于图4。氨基酸δ13C测定过程中CO2本底(BGD 44)值较低,其平均值为(7.0±7.5) mV。在不同进样模式下,12种氨基酸的m/z44信号强度主要在50~5 000 mV范围内呈梯度变化。其中,甘氨酸、苏氨酸和丝氨酸的m/z44信号强度出现低于50 mV的情况,α-氨基丁酸、天冬氨酸、谷氨酸和苯丙氨酸的m/z44信号强度可达3 000 mV以上。当m/z44信号强度≥ 100 mV,上述12种氨基酸δ13C的测定值依次为(-22.73 ± 0.85)‰、(-29.56 ± 0.85)‰、(-25.44 ± 0.99)‰、(-21.37 ± 0.32)‰、(-21.44 ± 0.73)‰、(-21.96 ± 0.31)‰、(-24.28 ± 0.35)‰、(-24.14 ± 0.62)‰、(-23.80 ± 0.58)‰、(-27.56 ± 0.50)‰、(-6.89 ± 0.21)‰和(-18.94 ± 0.44)‰,δ13C测定结果的平均精度为0.56‰,且未表现出对m/z44信号强度的依赖性(斜率接近0)。可见,GC-C-IRMS可以实现对混合体系中特定氨基酸δ13C的有效测定。需要注意的是,氨基酸衍生化过程中会引入新的碳源,GC-C-IRMS测定氨基酸衍生物δ13C后,可依据同位素质量守恒原理扣除外源碳δ13C所占权重,得到氨基酸δ13C校准值[22]。

图4 GC-C-IRMS测定混合体系中特定氨基酸δ13C的信号强度依赖性特征Fig.4 Signal intensity dependence of specific amino acid δ13C by GC-C-IRMS
2.3 GC-C-IRMS测定氨基酸混合体系δ15N
GC-C-IRMS测定12种氨基酸混合体系中δ15N的色谱图示于图5。12种氨基酸的出峰时间在750~1 700 s之间,峰宽一般在15~25 s之间。每种特定氨基酸重复测量的出峰时间漂移为3 s左右,每种氨基酸样品峰对应的本底值(BGD 28)约为50 mV。仅丝氨酸产生的m/z28信号强度略低于100 mV,其余11种氨基酸的m/z28信号强度均在100~400 mV之间,能够保证氨基酸δ15N的分析精准度。为实现氨基酸峰-峰之间的最佳基线分离,由样品转化的N2信号强度同样不应过高。需要指出的是,氨基酸δ15N测定过程中,m/z28信号强度会受到GC-C-IRMS使用年限以及衍生化方式等因素影响[9-10,16,20]。
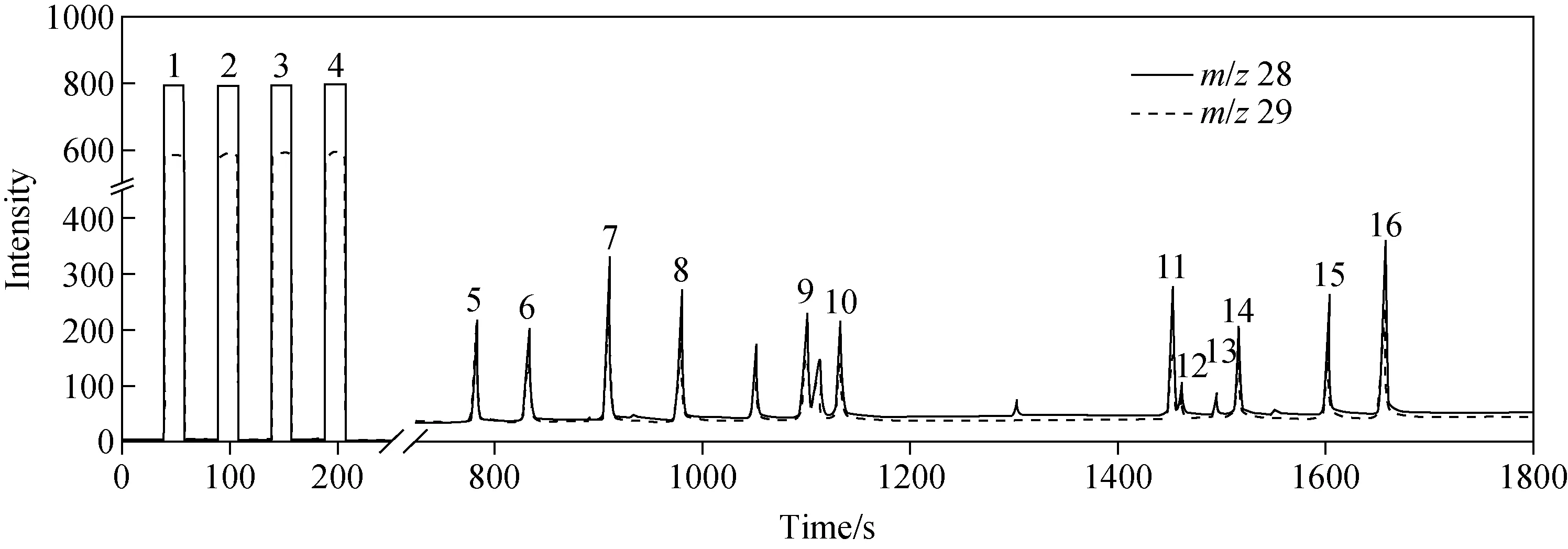
注:1~4为N2参比峰,5~16分别为丙氨酸、甘氨酸、α-氨基丁酸、缬氨酸、亮氨酸、异亮氨酸、天冬氨酸、苏氨酸、丝氨酸、蛋氨酸、谷氨酸和苯丙氨酸的N2样品峰图5 GC-C-IRMS测定混合体系中特定氨基酸δ15N的色谱图Fig.5 Chromatogram of amino acid δ15N by GC-C-IRMS
GC-C-IRMS测定12种氨基酸混合体系中δ15N与EA-IRMS单独测定的一致性特征示于图6。GC-C-IRMS在较低检测信号(即较低柱上进样量)条件下对特定氨基酸δ15N测定结果表明,12种氨基酸δ15N连续4天(间隔12 h)的测定值依次为(40.52±1.04)‰、(-25.51±1.05)‰、(8.17±0.57)‰、(0.46±0.91)‰、(1.90±0.89)‰、(-1.99±0.97)‰、(-0.92±1.13)‰、(1.86±1.50)‰、(4.31±1.33)‰、(-2.48±0.92)‰、(43.63±0.63)‰和(3.15±0.57)‰,平均精度为0.96‰。GC-C-IRMS对混合体系内12种氨基酸δ15N测定结果与EA-IRMS单独测定结果相当,平均偏差仅为(0.77±0.34)‰,2种方法的氨基酸δ15N测定值具有较高的一致性(R2=0.997),验证了GC-C-IRMS测定混合体系中氨基酸δ15N的可信性。GC-C-IRMS具有高灵敏度、宽检测范围和极低耗样量等优势[5,9,12],将为特定化合物同位素技术在地球化学和生命科学等领域的应用发挥重要作用。

图6 GC-C-IRMS与EA-IRMS测定氨基酸δ15N的对比Fig.6 Comparison of amino acid δ15N by GC-C-IRMS and EA-IRMS
3 结论
本研究基于GC-C-IRMS系统测定了咖啡因化合物和氨基酸混合体系中δ13C和δ15N。结果表明,在极小进样量和极低信号强度的情况下,该系统对于测定δ13C和δ15N具有良好的精准度。在对氨基酸混合体系δ13C和δ15N的测定过程中,GC-C-IRMS可保证m/z44和m/z28具有足够的信号强度并避免了峰-峰交互干扰现象。在不同进样模式下,12种特定氨基酸δ13C测定值为-29.56‰~-6.89‰,平均测定精度为0.56‰。在较低检测信号条件下,GC-C-IRMS可以保证氨基酸δ15N测定结果具有良好的时间重现性,与EA-IRMS测定结果的平均偏差为0.77‰。
致谢:感谢中国科学技术大学张忠义博士对本研究中氨基酸样品前处理及其同位素测定提供的帮助。

