预测HBV相关肝细胞癌生存的列线图模型的建立
陈松海, 王春艳, 郭 畅, 张 珊,2, 邓 亚, 陆荫英,2, 纪 冬,2,
1 解放军总医院第五医学中心 肝病医学部, 北京 100039; 2 北京大学三〇二临床医学院,北京 100039; 3 南方医科大学第二临床医学院, 广州 510515
肝细胞癌(HCC)是全球最常见的恶性肿瘤之一,占癌症死亡第三位[1-2],目前我国一般人群HBsAg流行率为5%~6%,其中慢性乙型肝炎(CHB)患者2000万~3000万例,HCC年发生率为3%~6%,严重影响我国人民的健康[3-7]。 目前已有较多检查手段针对HCC高危人群进行筛查,治疗效果也在进一步提升,但整体诊治情况不容乐观,仍有大量患者发现HCC时已经处于中晚期甚至是终末期[8]。目前国内外模型如REACH-B、mPAGE-B、THRI等[9-10],主要用于预测发生HCC的风险,尚缺乏对已经发生HCC患者长期预后预测的生存预测模型,而明确HCC预后的危险因素并个体化评估生存率具有重要的临床意义。本研究回顾性收集HBV相关HCC患者的病历资料并进行随访分析,旨在探索HCC死亡的危险因素并构建预测患者1、3、5年生存率的列线图,有助于个体化评估临床结局。
1 资料与方法
1.1 研究对象 回顾性选取2010年1月—2020年1月在解放军总医院第五医学中心首次确诊的HBV相关HCC患者,纳入标准:(1)依据《慢性乙型肝炎防治指南(2010年版)》[11]诊断为慢性HBV感染者;(2)已接受核苷(酸)类似物(NUC) 治疗并获得持续病毒学应答(HBV DNA<20 IU/mL);(3)依据我国2009年版《原发性肝癌规范化诊治的专家共识》[12]明确诊断为HCC的患者。排除标准:(1)合并其他病毒性肝炎、自身免疫性肝病、酒精性肝病或脂肪性肝病等;(2)继发性肝癌、其他系统肿瘤;(3)基线资料严重缺失者;(4)随访信息不完整。
1.2 研究方法 收集患者首次诊断HCC时的一般情况、实验室指标以及肝脏硬度值(liver stiffness measurement, LSM)作为基线资料,其中 LSM≥17.5 kPa定义为肝硬化[10]。按照巴塞罗那(Barcelona clinic liver cancer,BCLC)进行分期[13]给予相应治疗,所有患者均接受随访直至终点事件发生或随访时间截止。以首次诊断HCC的时间为起点,死亡为终点事件,随访截止时间至2021年1月1日。根据随访结果分为死亡组和生存组。
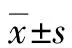
2 结果
2.1 基本资料 本研究共纳入HBV相关HCC患者700例,死亡组407例,生存组293例,两组的性别构成、Alb、TBil、ALT、AFP、胆碱酯酶(CHE)、LSM及BCLC分期均具有统计学差异(P值均<0.05)(表1)。
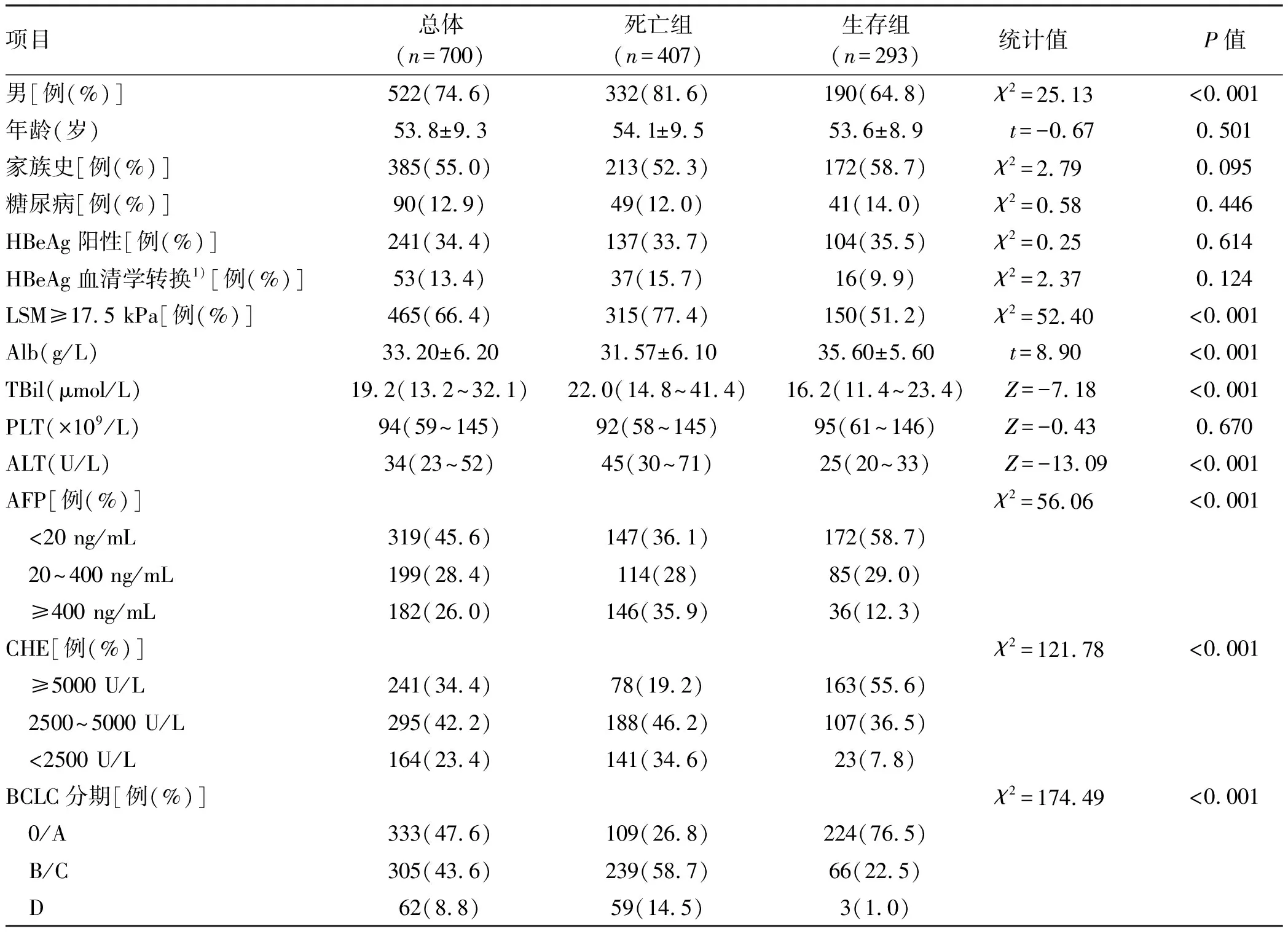
表1 纳入患者的基线资料
2.2 HBV相关HCC预后的危险因素 使用多因素Cox回归筛选危险因素,结果显示:男性、CHE(2500~5000 U/L)、CHE<2500 U/L、AFP≥400 ng/mL、LSM≥17.5 kPa、BCLC分期B/C期、BCLC分期D期为死亡的独立危险因素(P值均<0.05)(图1)。
2.3 生存分析 总体中位生存时间为35.8个月,将上述独立危险因素分别绘制Kaplan-Meier生存曲线,结果显示:AFP升高程度不同者的中位生存时间,≥400 ng/mL为8.3个月,20~400 ng/mL为37.7个月,<20 ng/mL为69.9个月,两两比较差异均有统计学意义(P值均<0.05);不同BCLC分期的中位生存时间,0/A期为93.5个月,B/C期为12.4个月,D期为6.0个月,两两比较差异均有统计学意义(P值均<0.05);CHE下降程度不同的中位生存时间,CHE<2500 U/L为8.2个月,2500~5000 U/L为25.8个月,CHE≥5000 U/L组总体生存率>50%,两两比较差异均有统计学意义(P<0.05);男性中位生存时间为25.8个月,明显小于女性的79.7个月(P<0.05);LSM≥17.5 kPa的中位生存时间为18.7个月,显著小于LSM<17.5 kPa的87.1个月(P<0.05) (图2)。
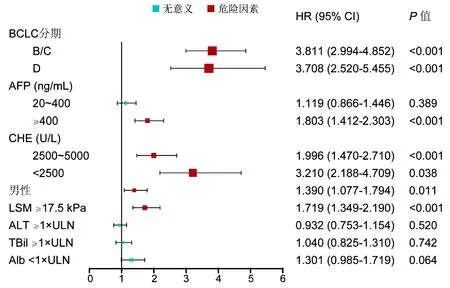
注:ULN,正常值上限。各因素的参照(HR=1):BCLC 0/A期;AFP<20 ng/mL;CHE≥5000 U/L;女性;LSM<17.5 kPa;ALT<1×ULN;TBil<1×ULN;Alb≥1×ULN。
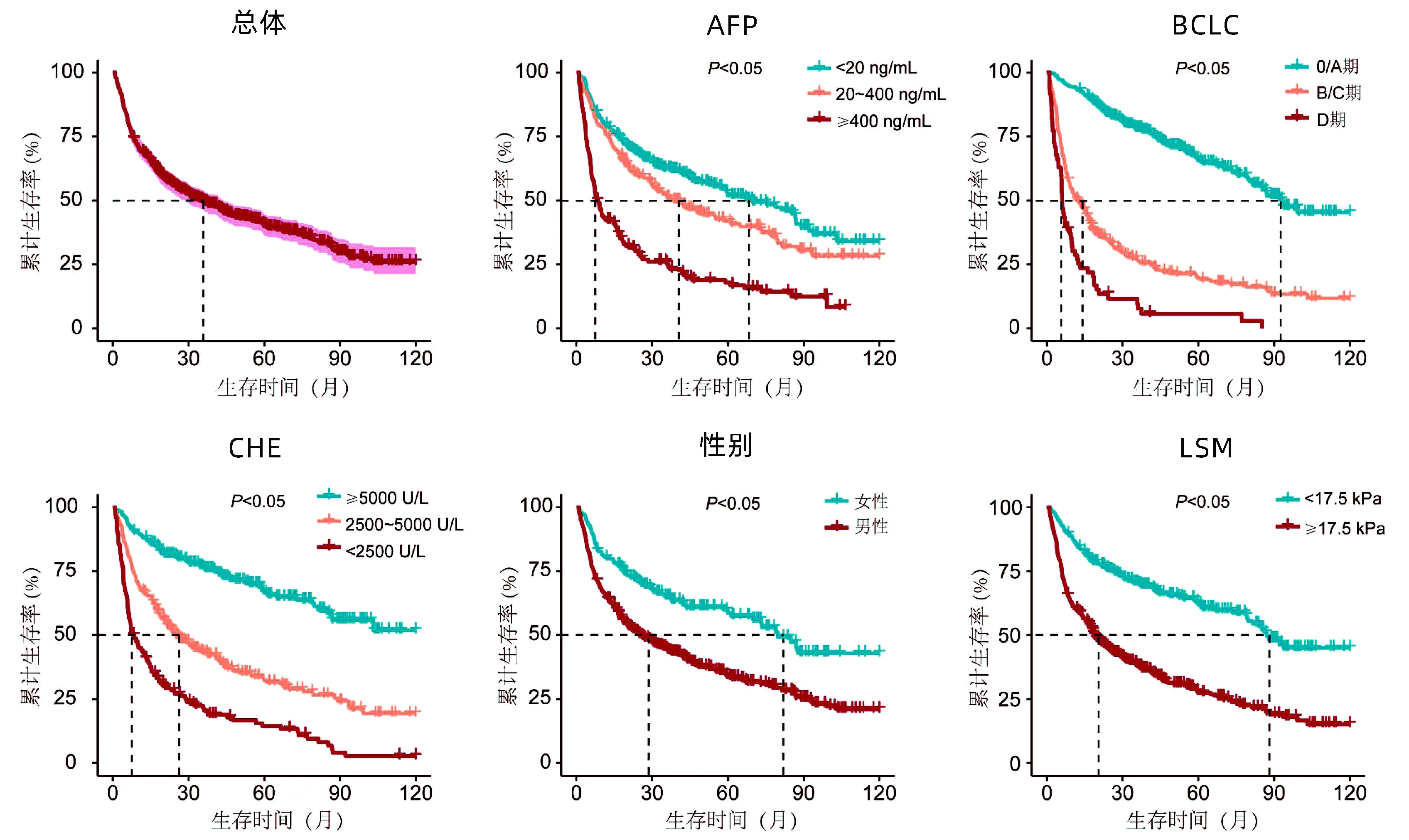
图2 HBV相关HCC的生存曲线
2.4 列线图的构建与验证 基于Cox回归结果,将5个独立危险因素构建个体化列线图模型用于预测HBV相关HCC患者1、3、5年生存率并绘制校准曲线,结果显示,校正曲线贴近于理想曲线(对角线),表明列线图模型准确度好。应用Bootstrap方法对列线图模型进行内部验证,C-index指数为0.789(95%CI:0.769~0.809) (图3)。200次10折交叉验证计算的平均AUC值分别为0.862、0.860、0.841,表明列线图模型可重复性强(表2)。
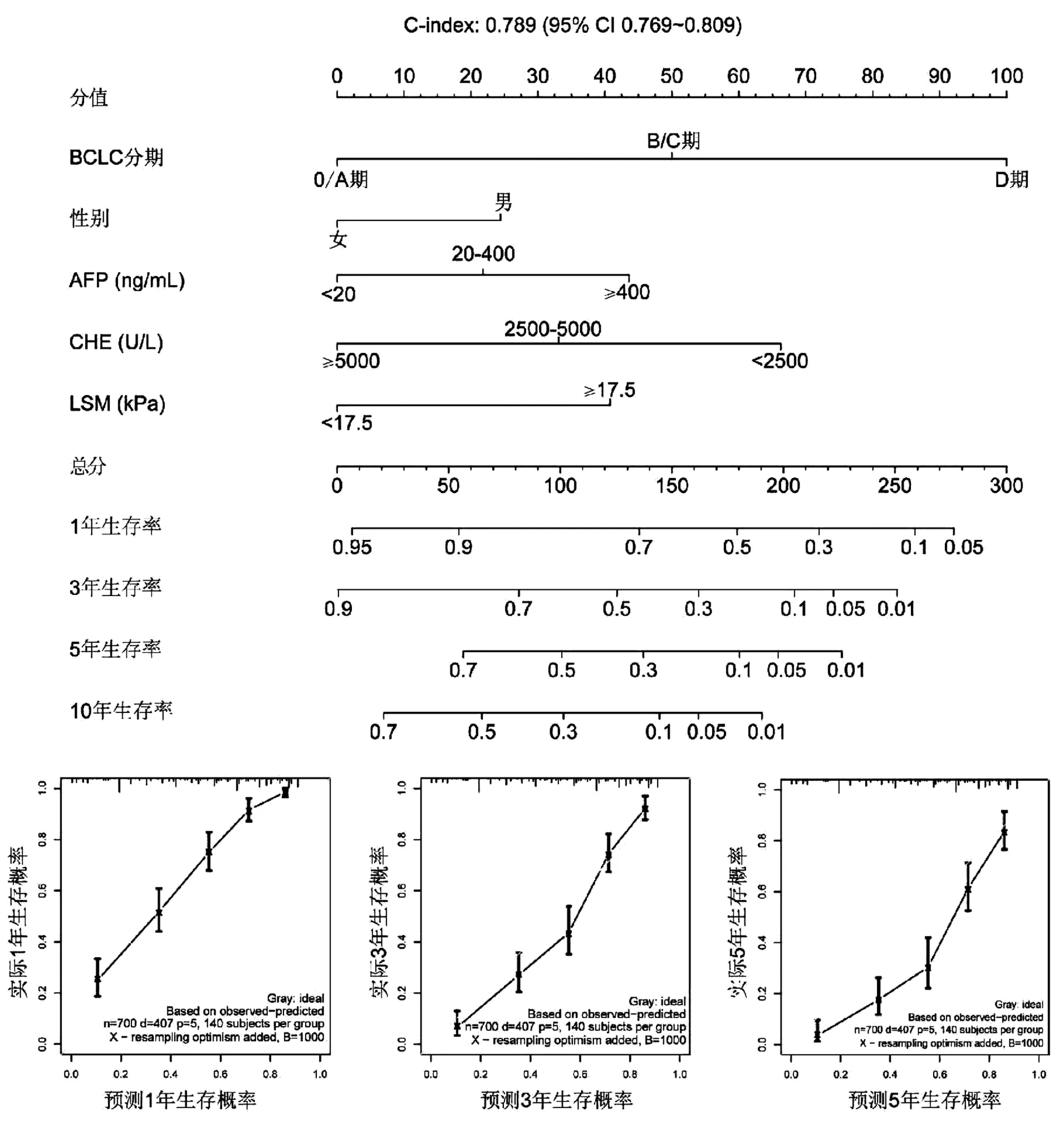
图3 预测HBV相关HCC生存率的列线图及校正曲线
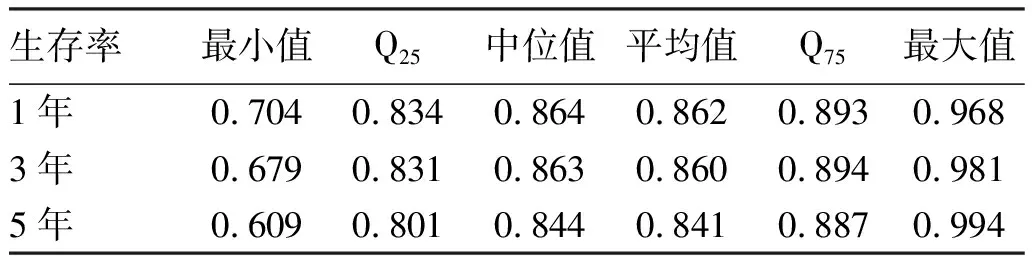
表2 200次10折交叉验证的AUC值
3 讨论
我国肝癌总发病和死亡数约占全球一半[14-15],研究[16-17]表明我国超半数的患者在诊断肝癌时已处于中晚期,可能的原因与未接受规律的肝癌筛查及监测有关。本研究同样发现52.4%的患者首次确诊HCC即处于BCLC 分期B~D期,一定程度反映了我国肝癌的就诊现状。目前肝癌患者筛查及分层管理对于提高总体生存率的重要性已得到充分认可[18],但如何实现对此类患者长期预后的监测及评估显得尤为重要[19]。
本研究筛选出5个HBV相关HCC患者(经NUC治疗获得持续病毒学应答)预后的危险因素,包括性别、AFP、CHE、LSM及BCLC分期。我国HCC发病的平均男女比为3∶1,本研究发现男性中位生存时间明显小于女性,死亡风险是女性的1.39倍,说明性别不仅是影响HCC发生率的危险因素,也是影响生存的危险因素,与既往报道相符[20-21]。AFP作为目前诊断HCC特异性最强的肿瘤标记物,也用于HCC的随访[22-23]。本研究发现死亡组的AFP水平明显高于存活组,尤其是AFP≥400 ng/mL可作为预测HCC死亡的独立危险因素(HR=1.803)。有报道[24-25]显示,HCC患者的CHE越低其生存时间越短,这点与本研究结果一致,推测原因可能为CHE水平与肝硬化程度负相关、肝癌患者肝细胞受损或变性坏死可导致CHE水平降低。LSM 在HCC风险分层中的价值逐渐显现[26-29],本研究发现LSM≥17.5 kPa的中位生存时间明显低于LSM<17.5 kPa的患者(18.7个月vs 87.1个月),提示LSM可用于评估HCC患者的长期预后。BCLC分期是目前将肿瘤分期、治疗方案和预期生存结合最好的系统,对于HCC治疗有重要的指导意义。本研究依据BCLC分期予以患者相应的规范化治疗,发现较高分期的HCC患者其生存期短,预后差,而BCLC早期的中位生存时间长达93.5个月,预后相对较好,与既往研究[30]一致。有研究[31]表明BCLC早期的5年生存率可高达69.0%~86.2%,因此应更加重视肝癌的早诊断及早治疗,这可能成为提高HCC生存率的关键环节。HCC结局是否与年龄相关,现仍存在争议[32-33]。本研究暂未发现年龄对肝癌死亡结局产生影响,可能与纳入患者的年龄较轻有关。
列线图能够将回归方程的结果转变为可视化的图形,具有方便、可重复性及临床实用性强等优点,有助于医务人员准确判断预后[33-34]。本研究中建立的列线图可用于预测HBV相关HCC患者的1、3、5年生存率,通过个体化计算每位患者的评分,充分评估其预后,便于对HCC患者进行分层管理。有研究[35]显示10折交叉验证综合性能较好,本研究不仅采用了Bootstrap重复抽样法,同时也采用了交叉验证法,通过多个统计学方法证实了列线图模型具有良好的效能。
本研究仍存在一定的局限性。首先,这是一项单中心的回顾性分析,仍需进一步验证,但本研究为多中心前瞻性研究提供了线索;其次,纳入的患者虽然依据BCLC分期进行规范化治疗,但仍无法避免不同的治疗方案(如介入联合消融、介入联合放疗、介入联合靶向免疫治疗等)对肝癌的预后产生影响,但本研究来源于真实世界,通过长期随访观察,对预后进行分析,能够客观真实地反映实际的临床情况,并且不会因治疗方式分类过多而导致临床易用性下降。
综上所述,本研究筛选出在获得持续病毒学应答后,HBV相关HCC患者生存的独立危险因素并构建了可预测1、3和5年生存概率的列线图,能够个体化评估患者的预后,具有良好的临床应用价值。
伦理学声明:本研究于2020年7月14日通过解放军总医院第五医学中心伦理委员会审批,批号为2020055D。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:纪冬负责课题设计及拟定写作思路;陈松海、王春艳、郭畅进行资料分析及撰写论文;所有作者均参与收集及分析数据;陆荫英指导撰写文章并最后定稿。

