原发性胆汁性胆管炎患者发生桥本氏甲状腺炎的临床特征及预后分析
张静怡, 唐映梅
昆明医科大学第二附属医院 消化内科, 昆明 650000
原发性胆汁性胆管炎(PBC)是一种以肝脏为主要靶器官的慢性进展性自身免疫性胆汁淤积性疾病。目前,PBC的发病原因尚未完全阐明,一般认为有环境、遗传、免疫等多种因素参与。PBC患者常伴发肝外自身免疫性疾病,可累及各个系统,自身免疫性甲状腺疾病发病率较高,其中以桥本氏甲状腺炎(Hashimoto’s thyroiditis,HT)最为多见。甲状腺作为人体重要的内分泌代谢器官,与肝脏在脂质代谢、糖代谢等生化反应中相互作用、相互影响。然而,目前尚无针对PBC合并HT的相关研究报道,本研究旨在探讨PBC合并HT的临床特征、相关因素以及预后特点。
1 资料与方法
1.1 研究对象 回顾性选取2018年1月—2020年12月于本院确诊为PBC并完善甲状腺功能检查的患者。纳入标准:PBC的诊断符合《原发性胆汁性肝硬化(又名原发性胆汁性胆管炎)诊断和治疗共识(2015)》[1]。HT的诊断符合《中国甲状腺疾病诊治指南》[2],其他自身免疫疾病的诊断分别符合干燥综合征、系统性红斑狼疮、多发性肌炎、抗磷脂综合征相关诊治指南[3-6]。排除标准:同时合并其他病毒性肝炎、代谢相关性肝病、药物性肝损伤、布加综合征等其他肝病患者。
1.2 研究方法 收集患者的一般资料(性别、年龄、吸烟史、饮酒史)、病史[糖尿病史,高血压病史,PBC病程,熊去氧胆酸(UDCA)用药、疗程和应答情况,经颈静脉肝内门体分流术(TIPS)治疗史,其他自身免疫疾病史、激素使用史]、临床症状、实验室检查(血常规、生化、凝血功能、Ig、补体、IL-6、甲状腺激素、甲状腺抗体、ANA谱、自身免疫性肝病相关抗体)、影像学资料(腹部B超、腹部CT、甲状腺超声),预后分析采用Mayo风险评分。Mayo风险评分=0.871×ln[胆红素(mg/dL)]-2.53×ln(白蛋白(mg/dL))+0.039×年龄+2.38×ln[凝血酶原时间(s)]+0.859×是否出现腹水(是=1,否=0)[7]。对UDCA治疗后生化指标应答的评价采用北京标准[8]:UDCA治疗6个月,ALP≤3倍正常值上限,胆红素或/和白蛋白水平恢复正常。
根据甲状腺疾病累及情况对患者进行分组,发生HT的PBC患者为HT组,甲状腺未受累及的PBC患者为非HT组,分析两组患者的一般资料、病史、临床特征、实验室检查、影像学检查,分析PBC和HT之间的相关因素,探讨PBC合并HT对患者预后的影响。
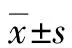
2 结果
2.1 一般资料 共纳入PBC患者301例,其中,男40例,女261例,平均年龄(55.76±11.53)岁。其中,未受甲状腺疾病累及患者88例(29.24%),低T3综合征患者41例(13.6%),HT患者83例(27.6%),甲状腺结节患者37例(12.3%),原因不明的临床型甲状腺功能减退患者9例(3%),原因不明的亚临床甲状腺功能减退症患者23例(7.6%),胶质性潴留囊肿患者9例(3%),甲状腺癌患者8例(2.7%),甲亢患者3例(1%)。合并其他自身免疫系统疾病患者57例(18.9%),其中合并干燥综合征患者44例(14.62%),合并系统性红斑狼疮患者6例(1.99%),合并类风湿性关节炎患者6例(1.99%),合并抗磷脂抗体综合征患者5例(1.66%);其中4例(1.33%)患者同时合并两种及以上其他自身免疫系统疾病。
2.2 PBC患者中非HT与HT组一般资料比较 PBC患者中,HT组女性患者数量、Child-Pugh评分、肝硬化发生率均明显高于非HT组(P值均<0.05)。吸烟史、饮酒史、高血压史、糖尿病史、合并其他自身免疫性疾病史、PBC病程、UDCA应答情况、激素使用史、BMI水平两组患者无明显差异(P值均>0.05)(表1)。

表1 PBC患者中非HT组与HT组一般临床资料比较
2.3 PBC患者中非HT与HT组患者实验室指标的比较
PBC患者中,HT组TC、TG、LDL、C3水平均明显低于非HT组(P值均<0.05),HT组患者IgA、IL-6、甲状腺球蛋白抗体(TgAb)、甲状腺过氧化物酶抗体(TPOAb)水平均明显高于非HT组(P值均<0.05)。ALT、AST、ALP、GGT、总蛋白(TP)、TBil、HDL、IgG、IgM、C4水平,AMA-M2、ANA、SSA、SSB、gp210、sp100阳性率两组患者无明显差异(P值均>0.05)(表2)。
2.4 PBC肝硬化患者中非HT组与HT组失代偿症状比较 PBC肝硬化患者中,脾肿大、食管胃底静脉曲张、腹水、消化道出血、肝性脑病发生率非HT组与HT组患者均无明显差异(P值均>0.05)(表3)。
2.5 PBC患者中非HT与HT组临床症状比较 PBC患者中,HT组患者乏力、纳差、腹胀、水肿症状的发生率均明显高于非HT组(P值均<0.05)。黄疸、瘙痒症状的发生率两组患者均无明显差异(P值均>0.05)(表4)。

表4 PBC患者中非HT与HT组临床症状比较
2.6 PBC患者发生HT的危险因素分析 以PBC患者是否合并HT为因变量,将上述相关性分析有统计学意义(P<0.05)的变量作为自变量带入二元logistic回归方程分析,结果显示,Child-Pugh评分、TgAb、TPOAb升高是PBC患者发生HT的独立危险因素(P值均<0.05)(表5)。
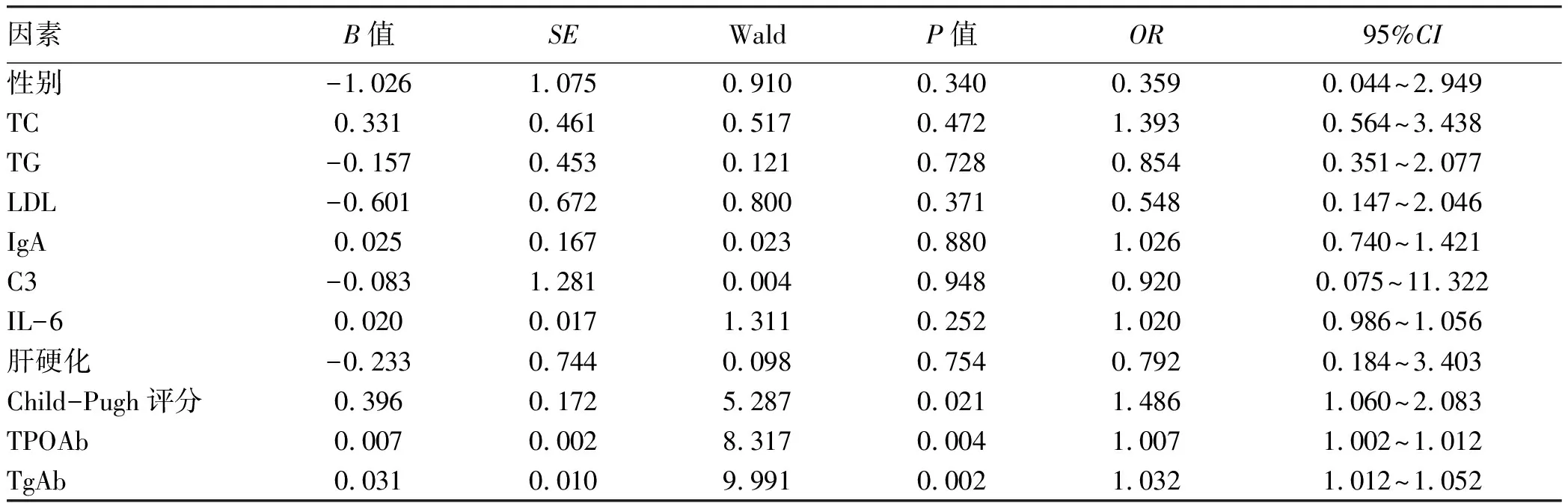
表5 PBC患者发生HT的多因素分析
2.7 合并HT对PBC患者预后的分析
2.7.1 各影响因素与Mayo风险评分的相关性分析 以Mayo风险评分评估PBC患者的预后情况,分析各影响因素与Mayo风险评分的相关性。Spearman相关性分析显示,年龄、AST、ALP、TBil、IgA、IL-6、脾肿大、食管胃底静脉曲张、腹水、消化道出血、肝性脑病、肝硬化、TIPS治疗、合并HT、gp210阳性率与Mayo风险评分呈正相关(P值均<0.05),UDCA治疗应答情况、TP、TC、HDL、LDL、C3、C4、BMI水平与Mayo风险评分呈负相关(P值均<0.05)(表6)。

表6 各影响因素与Mayo风险评分的相关性分析
2.7.2 相关因素与Mayo风险评分多元线性回归分析 以Mayo评分为因变量,将上述有统计学意义(P<0.05)的相关变量作为自变量纳入方程进行多元线性回归分析,结果显示,高龄、UDCA治疗不应答、高AST、ALP、TBil、IgA、IL-6水平、低TP、HDL、C3、C4水平,合并腹水、肝性脑病,gp210抗体阳性是PBC患者Mayo风险评分的独立危险因素(P值均<0.05),合并HT不是Mayo风险评分升高的独立危险因素(P>0.05)(表7)。

表7 PBC患者Mayo风险评分相关危险因素的多元线性回归分析
3 讨论
PBC是一种肝内小胆管自身免疫性疾病,以肝内进行性非化脓性小胆管破坏、门静脉炎症和纤维化为特点。60%以上的PBC患者常合并肝外自身免疫性疾病[9]。据报道[10],PBC合并干燥综合征的患者发病率为3.5%~73%,合并类风湿性关节炎的发病率为1.8%~17%,合并系统性红斑狼疮发病率为1.3%~5.2%,合并甲状腺疾病发病率为5.6%~42.3%。PBC合并甲状腺疾病的发病率较高,其中又以自身免疫性甲状腺疾病最常见,尤其是HT,患者常伴有甲状腺相关抗体阳性,早期可无甲状腺功能异常,后期常伴有甲状腺功能减退。研究[9]发现,PBC患者HT的患病率高达20.4%。另据统计[11],PBC患者中甲状腺抗体阳性率为26%。美国一项大样本、多中心、回顾性研究[12]通过对患者性别、年龄、种族、地区匹配后发现,PBC患者较正常对照组患者甲状腺疾病的发病率明显升高(9% vs 1%,P<0.001)。在本研究301例PBC患者中,合并其他自身免疫系统疾病患者57例(18.9%),合并甲状腺疾病患者213例(70.8%),明显高于前者。在合并的甲状腺疾病中,以HT(27.6%)最为多见,与既往研究[9]结果相符;低T3综合征患者41例(13.6%),该综合征被认为是一种甲状腺功能正常的病态综合征,患者常表现为甲状腺激素水平(FT3、FT4、TT3、TT4)下降,多与肝病患者肝脏合成功能下降有关,通常认为患者的甲状腺并无实质病变[13]。合并其他自身免疫疾病的PBC患者与不合并患者的HT患病率无统计学差异,因此,合并其他自身免疫性疾病并不增加PBC患者HT患病风险,与既往研究[14]结果相同。
PBC患者发生HT的机制目前尚不清楚,一般认为与遗传基因和共享自身免疫反应机制有关。肝脏和甲状腺存在共享自身免疫机制,即在肝脏和甲状腺存在相同自身反应性T淋巴细胞和相似上皮抗原的基础上,抗甲状腺自身抗体具有交叉反应性。T淋巴细胞及其细胞因子等免疫因素在PBC的发病中发挥重要作用,辅助性T淋巴细胞(Th)中的Th1和Th2类细胞因子的变化以及CD4+调节性T淋巴细胞(Treg)/Th17比例失衡对于PBC胆管损伤的发病可能发挥重要作用[15],而CD4+Treg/Th17轴的免疫失衡也存在于自身免疫性甲状腺炎患者的不同病程阶段,且Th17/Treg值与甲状腺自身抗体TPOAb、TgAb呈明显相关性[16]。近年来,随着分子遗传学、人类全基因组学关联研究的深入,遗传基因在PBC患者发生HT中的作用也逐渐受到关注。研究[17]发现,蛋白质络氨酸磷酸酶非受体22(PTPN22)(rs2476601)基因的多态性与PBC、PBC合并自身免疫性甲状腺疾病的发生风险明显相关。人类染色体2q32的信号转导和转录激活因子4、干扰素调节因子5是自身免疫甲状腺疾病、PBC的突出风险基因[18]。既往研究[19]显示,美国白种、亚裔人群PBC患者HT发生率较非裔人群明显升高,且女性的患病率是男性的8倍。本研究中,女性PBC患者较男性患者的HT患病率也明显升高。以上结果均可能与遗传基因对疾病的影响有关。
本研究中,HT组患者C3水平较非HT组患者明显降低,IL-6、IgA、TgAb、TPOAb水平较非HT组明显增加。IL-6、IgA水平升高、C3水平降低提示自身免疫反应的活动,提示PBC患者合并HT时可能较单纯PBC患者具有更严重的自身免疫反应,其中TgAb、TPOAb水平的升高是PBC患者发生HT的独立危险因素。此外,合并HT患者较未合并患者TC、TG、LDL水平明显降低,可能与患者肝脏合成功能下降有关。既往研究[20]显示,74%~95%的PBC患者合并有血脂异常,在病变早期常以极低密度脂蛋白和LDL升高为主,HDL也可升高,中期以LDL及脂蛋白X升高为主,HDL水平开始下降,疾病晚期时随着肝功能的下降,血脂水平逐渐下降[21]。高胆固醇水平和LDL水平可能使患者心血管风险增加。但目前针对PBC患者心血管事件发生率是否增加仍存在争议[22-23]。也有研究[24]指出,合并有糖代谢异常、脂代谢异常、腹型肥胖等代谢综合征时,PBC患者的心血管发生率升高。 本研究中,PBC合并HT患者较未合并HT患者的TC、TG、LDL水平明显降低,HDL水平无明显差异,因此笔者猜测对患者的心血管可能具有一定的保护作用,血脂水平不仅受高甲状腺激素水平的调节,还与患者肝脏疾病的严重程度相关,因此,在合并HT的PBC患者中血脂水平变化的影响机制应从多方面考虑,但目前相关研究较少,未来需要更多高质量的研究来证实。
本研究中,高Child-Pugh评分是PBC患者发生HT的独立危险因素,随着PBC疾病的进展,肝功能的恶化、严重的未控制的自身免疫反应可增加HT的发生风险。 此外,PBC合并HT组患者乏力、纳差、腹胀、水肿症状的发生率明显高于PBC甲状腺功能正常组患者,主要由于PBC患者合并HT时的甲状腺激素水平降低,加重了部分临床症状。
本研究结果提示,合并HT并不影响患者对UDCA治疗的应答率,通过Mayo风险评分对PBC患者的预后分析提示,合并HT并不影响PBC患者的预后。目前,对合并HT是否会影响PBC患者自然进程及预后仍存在争论,相关研究尚少。Floreani等[25]长期随访合并甲状腺功能不全的PBC患者,其肝癌发生率、肝移植率、生存率、病死率与甲状腺功能正常的PBC患者相较未见显著差异。
综上所述,PBC患者中HT发病率较高,合并其他自身免疫性疾病并不增加PBC患者合并HT风险。PBC与HT可能存在相同的发病机制,PBC患者随着肝功能恶化,其HT发生率显著增加,通过检测TPOAb、TgAb可有助于早期识别HT高危患者。合并HT患者自身免疫反应相关指标明显升高,血脂水平紊乱,乏力、纳差、腹胀、水肿等症状增加,,但合并HT并不影响PBC患者的预后。希望未来能够开展更多大样本、多中心、高质量的临床研究以验证PBC与HT的关系。
伦理学声明:本研究经由昆明医科大学第二附属医院伦理委员会批准,批号:审-PJ-2019-38。所纳入患者均知情同意。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:张静怡负责课题设计,收集数据,资料分析,拟定写作思路,撰写论文;唐映梅负责指导撰写文章并最后定稿。

