血清Sox2、p53、ST2水平变化与肺腺癌化疗预后转归的关系
庄大洁 李玉婷 宋忠全 李秀凤 吴立平
肺癌是我国发病率和死亡率较高的疾病[1],其中肺腺癌是肺癌中常见的类型,其多起源于支气管粘膜上皮或大支气管粘液腺[2]。常见症状有两侧胸壁疼痛、胸闷、胸痛、呼吸困难等,若肺腺癌出现转移则会引发对应器官的疼痛。在肺腺癌早期可通过手术切除达到治疗的目的,但由于多数肺腺癌患者确诊后,已是晚期且伴随着转移,因此肺腺癌也具有较低的治愈率和生存率[3]。肺癌转归是由多基因调控的过程,p53 抑癌基因53(tumor suppressor gene 53,p53)是较为明确的与肿瘤相关的抑癌基因[4];Sox2 干细胞转录因子(SRY⁃ box containing gere 2)是SOX 基因家族的成员,其所编码的蛋白参与了早期胚胎形成、决定性别、决定细胞命运及肿瘤发生等生物学过程,并已证实多种恶性肿瘤发生和发展。同时,致癌抑制因子2(suppression of tumorigenicity 2,ST2)是IL⁃33 的特异性受体,而IL⁃33 与肺癌、肝癌、头颈部鳞癌、结肠癌、乳腺癌、胰腺癌等众多肿瘤的转归也有着密切联系[5]。本文对血清中Sox2、p53、ST2 水平变化与肺腺癌化疗预后转归的相关性进行分析,报道如下。
1 资料与方法
1.1 临床资料
分析2020年7月至2021年12月到潍坊市人民医院进行肺腺癌化疗的患者120 例,纳入标准:①病理诊断为肺腺癌的患者;②初次化疗的患者;③肿瘤TNM 分期明确的患者[6]。排除标准:①临床资料不完整的患者;②合并有其他恶性肿瘤的患者。化疗后随访3 个月后,根据实体肿瘤评价标准[7],将患者分为预后良好组和预后不良组,预后效果评估标准[7]如下:①肿瘤消除且持续1 个月则判定为完全缓解;②无其他病情恶化,且肿瘤最大直径和最大垂直直径乘积缩小≥50%,并持续时间大于等于30 天则判定为部分缓解;③肿瘤最大直径和最大垂直直径乘积缩小<50%,或增大≤25%则判定为稳定;④肿瘤最大直径和最大垂直直径乘积增大>25%则判定为进展。将化疗后完全缓解、部分缓解和稳定的患者分为预后良好组,将化疗后进展的患者分为预后不良组。其中预后良好组患者39 例,预后不良组81 例;其中预后良好组男性24 例、女性15 例,患者年龄平均(55.38±9.88)岁。预后不良组男性53 例、女性28 例,患者年龄平均(56.91±10.52)岁。两组患者一般资料比较差异无统计学意义(P>0.05)。所有入试者均知情并签署同意书。本实验经伦理委员会批准。
1.2 观察指标
抽取所有患者化疗前空腹状态下的静脉血4~6 mL,以10 cm 离心半径、3 000 r/min 下离心15 min,取上清液于-80℃的冰箱中待测。检测技术人员严格按照ELISA 检测试剂盒上的酶联免疫吸附法检测血清中的Sox2、p53、ST2、MAGEA1(黑色素瘤抗原A1)、肿瘤/睾丸抗原G 抗原7(GAGE7)和PGP9.5(蛋白基因产物9.5)水平;其中Sox2(杭州凯保罗生物科技有限公司)、p53(杭州凯保罗生物科技有限公司)、ST2(北京利德曼生化股份有限公司)、MAGEA1(杭州凯保罗生物科技有限公司)、肿瘤/睾丸抗原G 抗原7(杭州凯保罗生物科技有限公司)、PGP9.5 杭州凯保罗生物科技有限公司)。
化疗三个周期后观察患者的预后转归情况。
1.3 统计学方法
采用统计学软件SP SS 25.0 对数据进行处理,其中计量资料采用()表示,组间比较独立行t检验;计数资料采用n(%)表示,组间比较行χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者的一般资料及血清Sox2、p53、ST2表达水平比较
预后不良组的血清Sox2、p53、ST2 表达水平明显高于预后良好组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者的一般资料及血清Sox2、p53、ST2 表达水平比较[n(%),(±s)]Table 1 Comparison of general information and expression levels of Sox2,p53 and ST2 in serum between 2 groups[n(%),(±s)]

表1 两组患者的一般资料及血清Sox2、p53、ST2 表达水平比较[n(%),(±s)]Table 1 Comparison of general information and expression levels of Sox2,p53 and ST2 in serum between 2 groups[n(%),(±s)]
指标性别男女年龄TNM 分期Ⅱ期Ⅲ期Ⅳ期Sox2(U/mL)p53(U/mL)ST2(pg/mL)MAGEA1 GAGE7 PGP9.5预后良好组(n=39)24(61.5)15(38.5)55.38±9.88 15(38.5)14(35.9)10(25.6)8.62±1.51 7.91±1.36 352.69±88.36 12.26±4.07 4.28±1.58 1.47±0.44预后不良组(n=81)53(65.4)28(34.6)56.91±10.52 28(34.6)32(39.5)21(25.9)15.42±3.26 16.88±2.87 655.36±156.29 13.43±4.16 4.81±1.63 1.64±0.52 χ2/t 值0.174 0.761 0.290 12.382 18.513 11.244 1.453 1.685 1.760 P 值0.677 0.448 0.772 0.000 0.000 0.000 0.149 0.095 0.081
2.2 肺腺癌患者转归的多因素分析
以单因素分析中有意义的因素作为自变量,分别影响肺腺癌患者转归的变量进行多因素分析。结果显示,血清Sox2、p53、ST2 表达水平高是晚期肺腺癌化疗患者预后不良的影响因素(P<0.05)。见表2。

表2 肺腺癌患者预后转归的多因素分析Table 2 Multivariate analysis of prognosis in patients with lung adenocarcinoma
2.3 血清Sox2、p53、ST2 表达水平对肺腺癌患者化疗预后转归的预测价值分析
以血清Sox2、p53、ST2 表达水平的数据建立ROC 分析模型,结果显示血清Sox2、p53、ST2 表达水平与肺腺癌患者化疗预后转归具一定的预测价值。见表3、图1。

图1 ROC 曲线Figure 1 ROC curve
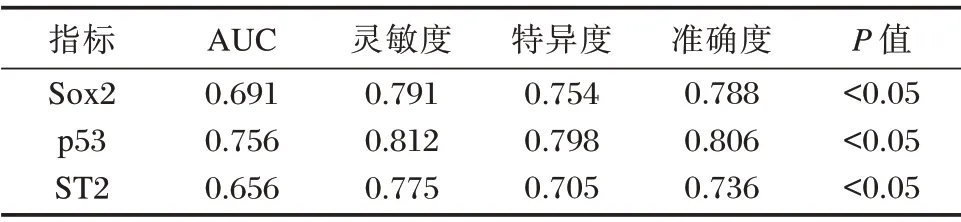
表3 血清Sox2、p53、ST2 表达水平对肺腺癌患者化疗预后转归预测的ROC 曲线Table 3 ROC curve of serum Sox2,p53 and ST2 expression levels in predicting prognosis of lung adenocarcinoma patients after chemotherapy
3 讨论
近年来肺腺癌的发病率逐渐升高,且在确诊时多已到中晚期或已出现转移的状况,具有强侵袭性,转移速度快,高复发率的特点[8]。辅助化疗治疗是癌症治疗中的常用手段,可有效改善患者病情,杀死或抑制肿瘤的发展。因此明确肺癌的发生发展机制,并及时的作出对应的预防和治疗,对提高肺癌患者预后等有重要意义。
本研究显示血清中Sox2、p53、ST2 表达水平高是肺腺癌患者预后转归的危险因素,同时以血清Sox2、p53、ST2 表达水平的数据建立ROC 分析模型,三者曲线下面积分别为0.691、0.756、0.656,可见Sox2、p53、ST2 表达水平对肺腺癌患者化疗预后转归具有一定的预测价值。Sox2 作为Sox 基因家族成员,其参与着细胞的增殖、癌性转变和恶性肿瘤的发生和发展。王永芳等在研究中表明[9],Sox2 通过多因子、多通路的网络系统调控,可控制细胞增殖和恶性转化促进肺癌的发生,并可引发肺癌细胞迁移和发展。Sox 是关键的胚胎干细胞转录因子,其可维持干细胞的增值、更新和分化。肿瘤干细胞假说中提出,肿瘤干细胞可通过不对称分裂,产生有相同性质的肿瘤干细胞以及不同分化程度且非致瘤性的肿瘤细胞。在肺癌的发生发展中,肺癌干细胞对肿瘤的抗化疗及转归有着重要影响。而Sox2 等胚胎干细胞自我更新的核心转录因子,与肺癌的转归及恶性转移也有着重要的关系。因此,Sox2 的表达可能与肺腺癌的化疗后的预后和转归密切相关。陈国萍等在研究中指出[10],肺癌患者血清中的p53、Sox2 抗体阳性检出率明显高于肺部良性病变患者,且具有良好的灵敏度和特异度。P53 基因是具有高突变率的抑癌基因,临床研究发现其在多种癌症肿瘤病灶组织中均具有明显的阳性表达特点。肺腺癌也属于非小细胞癌(non⁃smallcelllungcancer,non⁃smallcell⁃lungcarcinoma,NSCLC),约占肺癌总数的80%~85%。在NSCLC 患者的血清中P53 基因大多有过表达或突变等现象,且p53 普遍存在于不同时期的NSCLC 患者体内[11]。同时,研究显示在p53 水平表达较高时,患者的生存时间及1~5年生存率低于平均水平[12]。本研究结果显示,在肺腺癌化疗的预后不良组患者的p53 水平明显高于预后良好组,可见p53 水平与肺腺癌的预后转归有着明显联系。徐思璞等[13]也在研究中证实,通过ELISA法检测血清p53(S⁃p53)基因证实了其可作为无症状、高风险的肺癌群体的常规筛查标志物。IL⁃33 受体ST2 是Toll 样受体(Toll⁃like re⁃ ceptor,TLR)/IL⁃1 受体家族的一员,其包含跨膜性ST2、可溶性ST2(solubleST2,sST2)及变异性ST2 三种亚型。主要表达于肥大细胞、Th2 和ILC2 表面。以往研究中发现,IL⁃33 在多种肿瘤中表达异常,IL⁃33/ST2 信号通路参与了肿瘤的转归,其对应的信号通路也是多种致瘤信号的交汇点。本研究结果显示,ST2 水平是肺腺癌患者转归的主要影响因素。胡霞等研究表明[14],IL⁃33 除通过肿瘤细胞自分泌促进肿瘤的增殖及转移外,还可以通过旁分泌的方式参与肿瘤的生长,同时IL⁃33/ST2 可在作用于调节性T 细胞、骨髓来源的抑制细胞等多种免疫细胞,调节肿瘤微环境参与肿瘤转归。其中,IL⁃33 可通过促进肺ST2+Tregs 细胞的增值,从促进肺转移性肿瘤生长。同时,凌夏君等[15⁃16]的研究结果显示,Th2 免疫反应参与了非小细胞肺癌形成与发展,ST2 主要表达Th2 细胞中,ST2 是Th2 免疫反应的“开关”,ST2 介导的Th1/Th2 细胞因子漂移有参加肺癌发生和发展的可能。
综上所述,血清SOX2、p53、ST2 水平变化与肺腺癌的转归密切相关,临床可通过检测血清SOX2、p53、ST2 水平变化预测肺腺癌化疗患者的预后转归情况。

