高效乳酸生物传感器的制备及其在发酵组分检测中的应用
徐 欣,杨 璐,马婕妤,陈敏皎,周 杰,3
(1.江苏省生产力促进中心,江苏 南京 210018;2.南京工业大学 生物与制药工程学院,江苏 南京 211800;3.南京工业大学 材料化学工程国家重点实验室,江苏 南京 211800)
乳酸广泛存在于生物体内,是无氧呼吸条件下的碳代谢中间产物,也是参与人体内循环的代谢物质。乳酸浓度的检测在临床诊断[1-2]、食品风味评估[3-4]和工业发酵生产[5-6]中都尤为重要。然而,传统的乳酸检测方法,如比色法[7]、伏安法[8]和液相色谱法[9],都存在操作复杂、技术要求高或便携性差等问题。生物传感器由于具有使用方便、特异性强及检测准确等优点,是乳酸有效检测手段之一[10]。目前,已经报道的乳酸生物传感器能够实现复杂组分中的乳酸含量检测[11-13],但仍存在响应时间长、检测范围窄等问题,且主要应用于临床检测,尚缺乏应用于发酵过程中高浓度乳酸含量检测的生物传感器。
乳酸生物传感器的检测元件多为乳酸氧化酶(LOX)。LOX专一性地催化底物乳酸产生丙酮酸和过氧化氢(H2O2),并伴有电子转移。这种电子转移信号被电极采集,经电化学换能器转化为可视的电流波动。高活力的酶元件在维持传感器的灵敏度和稳定性方面至关重要[14]。目前,绿色气球菌来源的乳酸氧化酶(AvLOX)已实现商业化,并广泛应用于电化学传感器检测,然而其制备困难、价格昂贵。此外,在生物传感器工作过程中,除了面临物理性洗脱外,复杂的检测环境也会严重影响酶的检测活力。因此,建立合适的酶固定化技术,可以有效提高传感器的稳定性能,对于生物传感器的制备具有重要意义[14]。
本文首先在大肠杆菌中实现了AvLOX的异源可溶性表达,并对其酶学性质进行了表征,然后考察戊二醛(GA)交联法、聚赖氨酸吸附以及壳聚糖(CS)包埋法等不同固定化策略对AvLOX固定化效率的影响。在此基础上,通过层层组装技术将检测酶元件、氧化石墨烯(GO)固定于玻碳(GC)电极上,制备AvLOX/CS/GO/GC乳酸生物传感电极,对其电化学性能参数,包括灵敏度、线性关系、响应时间、抗干扰性、重现性以及使用寿命等进行表征,并考察其在不同工作条件下的检测灵敏度。最后将制备的乳酸生物传感器在模拟和真实的乳酸发酵体系中进行检测,为其规模化应用提供基础数据。
1 材料与方法
1.1 主要试剂与仪器
酵母粉和蛋白胨,北京拜尔迪生物技术有限公司;壳聚糖(50 000)和聚赖氨酸(<5 000),上海麦克林生化科技有限公司;25%戊二醛溶液和氧化石墨烯(>99%),阿拉丁试剂(上海)有限公司;5% Nafion溶液(全氟磺酸树脂,D-250),杜邦公司;NaCl、Na2HPO4、KH2PO4、L-乳酸、谷氨酸、苹果酸、蔗糖和乳糖均为分析纯,国药集团化学试剂有限公司。
Biometra-T Gradient PCR仪,德国TRobot公司;MQD-M2R型恒温振荡培养箱,上海旻泉仪器有限公司;JY92-2D型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;CHI660E型电化学工作站,上海辰华仪器有限公司;UltiMate 3000 型高效液相色谱,美国Dionex公司。
1.2 AvLOX的克隆与表达
提取绿色气球菌WDCM 00061的基因组作为模板,参照NCBI的基因登录号(WP_003142047)设计引物AvLox-F(GGTGCCGCGCGGCAGC CATATGATGCCTATCACCCAGAAGATT)和AvLox-R(GTGGTGGTGGTGGTG CTCGAGAAGCTTGACGATGGCGG),并用该引物进行PCR扩增出目的基因AvLox。利用NdeI和XhoI对pET-28a(+)质粒进行双酶切并回收线性载体片段,随后通过一步克隆将目的基因AvLox与表达载体pET-28a(+)相连,转化至E.coliDH5α中。将测序无误的pET-28a(+)-AvLox转化至E.coliBL21(DE3)感受态细胞中,构建表达菌株,用于下一步的蛋白表达。重组菌接种在37 ℃培养至OD600达到0.5~0.6后,加入终浓度为 0.5 mmol/L IPTG,转移至恒温振荡培养箱中,于20 ℃、160 r/min低温诱导24 h。发酵完成后,离心收集菌体,使用超声细胞破碎仪进行破碎,随后在4 ℃、12 000 r/min条件下离心20 min获得破碎上清液。破碎上清液利用Ni-NTA柱纯化,在4 ℃条件下以截留分子量为1.0×104的超滤管进行超滤以去除咪唑,浓缩后得到AvLOX纯酶。
AvLOX的酶活单位的定义:在37 ℃下,每分钟催化生成1 μmol/L H2O2所需的酶量。蛋白浓度采用考马斯亮蓝法测定,酶活测定参照文献[15]的方法进行。AvLOX的温度稳定性为在相应温度下孵育30 min后的相对酶活,pH稳定性为AvLOX在相应pH的缓冲液下孵育30 min后的相对酶活,以最适温度和最适pH时的酶活为100%。
1.3 乳酸生物传感器的制备
用Al2O3粉末抛光处理玻碳电极,得到镜面的玻碳电极,分别于50%(体积分数)硝酸溶液、无水乙醇和超纯水中进行超声处理,并于N2氛围下干燥。为了进一步提高传感电极的电子传导能力与比表面积,将5 mg氧化石墨烯粉末溶于20 mL超纯水中,超声分散均匀后,取5 μL滴至洁净的玻碳电极上,室温下干燥。再取一定量的AvLOX纯酶与不同固定化试剂混合滴加在电极表面,在4 ℃下静置3~4 h至其表面干燥。以上述制备的电极为工作电极,Ag/AgCl为参比电极,铂丝为对电极,搭建乳酸生物传感三电极体系。
1.4 AvLOX的固定化性能表征
分别配制2.5、5.0、7.5、10.0和12.5 g/L的壳聚糖溶液和聚赖氨酸溶液,体积分数为0.25%、0.50%、0.75%、1.0%和1.25%的戊二醛溶液和Nafion溶液,超声30 min,使其完全溶解,放入4 ℃冰箱保存待用。
生物相容性计算:所制备的AvLOX分别与上述4种固定化试剂等体积混合,静置10 min后检测剩余酶活,以不添加固定化试剂的酶活作为对照(100%),计算相对酶活。
固定化率计算:所制备的AvLOX分别与上述4种固定化试剂等体积混合,取6 μL混合液滴于所制备的电极上,待酶液晾干后,将电极完全浸入50 mL磷酸盐缓冲液(PBS,50 mmol/L,pH 7.0)中,搅拌速度为200 r/min,24 h后检测电极上残留酶活,以不添加固定化试剂的酶活作为对照(100%),计算相对酶活。
酶负载量计算:根据上述优化的检测酶元件固定化方式,分别滴加2、4、6、8、10和12 μL预混液于所制备的电极上,待酶液晾干后,检测对L-乳酸的灵敏度,获取最优酶负载量。以上所有实验均重复3次。
1.5 乳酸生物传感器电化学性能表征
传感电极的电化学性能检测在含有50 mL磷酸盐缓冲液(50 mmol/L,pH 7.0)的反应池中进行,工作电压为-0.05 V,持续搅拌转速为200 r/min,检测温度为20 ℃。采用计时电流法观察酶电极对乳酸溶液的响应情况,计算其灵敏度、线性范围和响应时间。抗干扰性根据依次加入等浓度的乳酸、干扰物(苹果酸、谷氨酸、蔗糖以及乳糖)和乳酸后的电流变化进行评估。重复稳定性为连续重复实验电极对乳酸的响应情况。生物传感器的使用寿命通过每隔12 h测试实验电极对乳酸的响应灵敏度进行考察。
进一步考察所制备电极的最佳工作条件,包括工作温度和工作pH。将AvLOX/CS/GO/GC乳酸电化学生物传感器分别在不同温度(20、30、40、50和60 ℃)和不同pH(5.0、6.0、7.0、8.0和9.0)下进行乳酸灵敏度测试,将工作条件为20 ℃和电极缓冲液pH 7.0下的灵敏度定义为100%。
1.6 发酵体系乳酸浓度检测
利用所制备的电极对模拟和真实乳酸发酵体系进行检测。在50 mL谷氨酸棒状杆菌发酵液中加入500 μL乳酸溶液(10 mol/L),配制成0.1 mol/L乳酸的模拟发酵液,在反应池中添加不同体积的模拟发酵液进行检测。
对真实发酵液中乳酸含量进行检测,通过对凝结芽孢杆菌发酵产乳酸过程定时取样(每隔24 h取发酵上清液),利用时间-电流拟合标准曲线计算出模拟和真实发酵液中的乳酸含量。将传感检测数据与实际含量或高效液相色谱法测试出的乳酸含量做对比,以评估乳酸生物传感器检测性能的准确性。
2 结果与讨论
2.1 AvLOX的重组异源表达与酶学性质
乳酸生物传感器的检测酶元件AvLOX的重组表达与蛋白质纯化情况如图1所示。由图1可知:与空载菌株的破碎上清液相比,目的菌株在IPTG的诱导下成功实现了可溶性表达,蛋白大小为4.25×104左右,与AvLOX的理论大小一致,且粗酶液酶活达18.5 U/mL。利用载体pET-28a(+)上的His-Tag标签,通过Ni-NTA亲和柱进行纯化,经200和250 mmol/L咪唑溶液洗脱,成功获得了较纯的AvLOX重组蛋白。进一步通过超滤去除咪唑,浓缩后得到AvLOX纯酶。经酶活测定,纯化浓缩后的AvLOX酶活和比酶活分别为34.0 U/mL和28.8 U/mg。
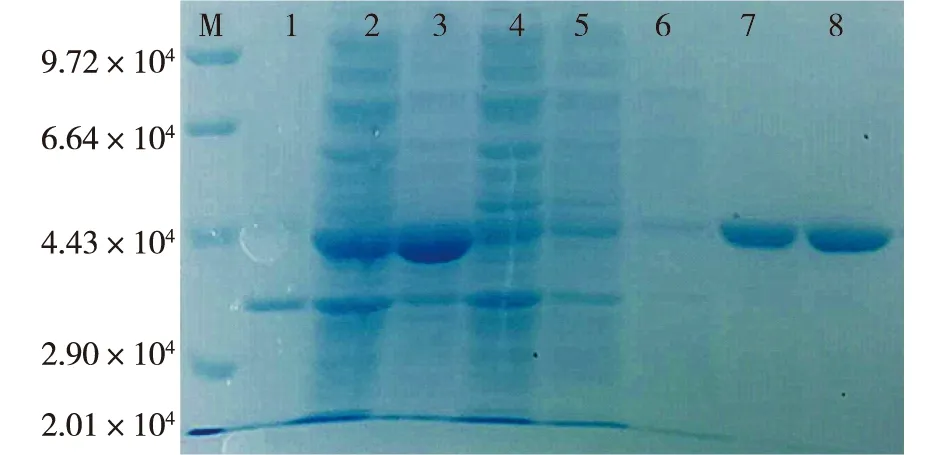
M—标准蛋白;1—空载上清液;2—粗酶液;3—破碎沉淀;4—穿过液;5~8—50、100、200和250 mmol/L咪唑洗脱液图1 AvLOX重组蛋白的表达与纯化分析Fig.1 SDS-PAGE analysis of recombinant protein AvLOX
为了更好地匹配应用场景,对所制备的AvLOX酶学性质进行考察,结果如图2所示。由图2可知:所制备的AvLOX最适催化温度为40 ℃,在35~65 ℃时,其相对酶活的变化较小且维持在90%以上,能够适应较宽温度范围的催化环境。此外,该AvLOX的最适pH为6.5。酶生物传感器需要在一定温度和pH的环境下才能连续工作,因此也要求酶元件具备一定的温度和pH耐受性。AvLOX的耐受性结果表明:所制备的AvLOX在30~60 ℃时孵育30 min,AvLOX仍可以保持80%以上的相对酶活;AvLOX在pH 6.0~7.5时具有较好的稳定性,能维持90%以上的相对酶活。综上所述,在大肠杆菌中异源重组表达的AvLOX具有优良的温度和pH稳定性,能适应更多的检测应用场景。

图2 AvLOX的酶学性质Fig.2 Enzymatic properties of recombinant AvLOX
2.2 AvLOX固定化方式优化结果
优异的检测酶元件的固定化策略可以稳定酶活,缓解酶的脱落,是实现电化学生物传感器高检测性能的关键。因此从固定化材料的生物相容性、固定化率和酶负载量等方面详细考察戊二醛、壳聚糖、聚赖氨酸和Nafion这4种固定试剂的固定效果,结果如图3所示。
由图3可知:将2.5~15 g/L的壳聚糖与AvLOX等体积混合后,酶活均保持在90%以上。低质量浓度的聚赖氨酸(<7.5 g/L)与AvLOX混合,对其酶活的影响也较小,酶活可保持在80%以上。当聚赖氨酸的质量浓度高于10 g/L,酶活则下降到70%以下。而戊二醛和Nafion对酶活影响较大,体积分数0.75%戊二醛与酶混合后,酶活仅保留30%;体积分数0.25% Nafion与酶混合后,酶活仅保留20%,表明戊二醛与Nafion对重组AvLOX蛋白的生物相容性较差,不适合作为其固定化材料。根据生物相容性确定了最优的2种固定化材料,即12.5 g/L壳聚糖和2.5 g/L聚赖氨酸。
进一步以不添加固定化材料的酶液直接滴加的玻碳电极作为对照,未固定的AvLOX的酶活已经降至50%以下。其中,利用12.5 g/L壳聚糖固定化制备的酶电极在5 d后能保持80%以上的酶活,而2.5 g/L聚赖氨酸固定化制备的酶电极在2 d后酶活就已经降至60%左右。综上,优选12.5 g/L壳聚糖与AvLOX等体积混合的固定化方式进行固定。
测定不同酶负载量对传感器电极响应电流的影响,以确定乳酸生物传感器最优的酶负载量,结果如图3(c)所示。由图3(c)可知:在酶负载量为0.33、0.67和1.0 U(蛋白质加量分别为0.96、1.92和2.9 mg)时,电流响应随着酶量的增加而上升,其原因是电流信号的增加效果大于电阻的增加;而当酶量大于1.0 U时,电极对电子转移的捕捉已经达到饱和,酶量的增加只会导致电阻的增加,进而导致电流响应的减小。根据电流响应与酶负载量的关系,确定了所制备电极的最优酶负载量为1.0 U(蛋白量为2.9 mg)。
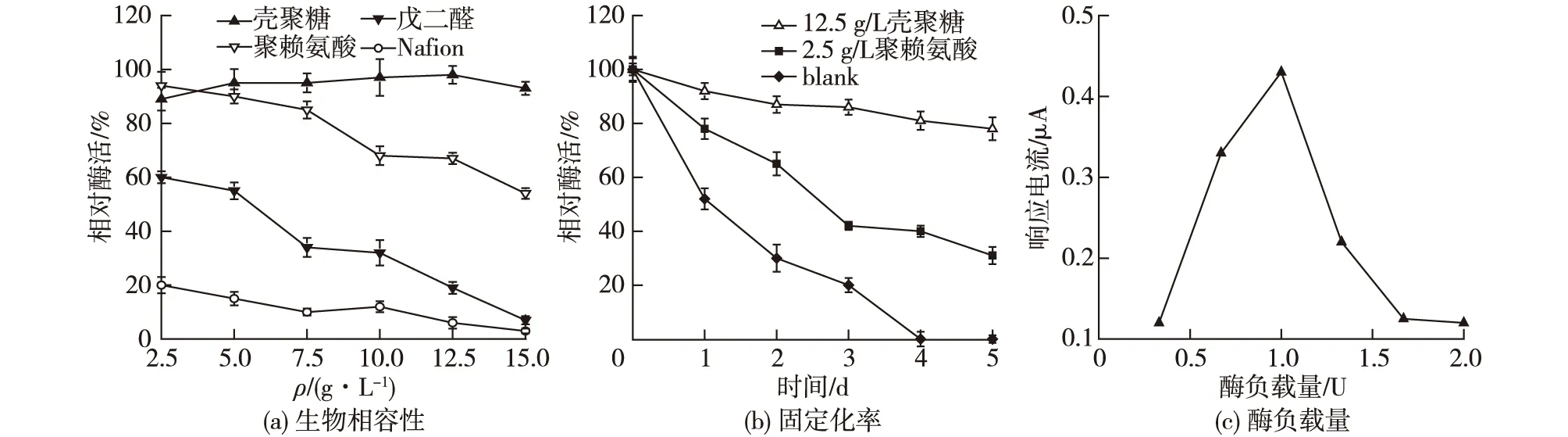
图3 AvLOX的固定化优化Fig.3 Optimization of immobilization strategy for recombinant AvLOX
2.3 乳酸生物传感器电化学性能表征结果
氧化石墨烯具有比表面积大、生物相容性好以及电学特性优异等特点,可为酶的固定提供高容量和稳定作用。结合上述优化的最佳AvLOX固定化方案,在玻碳电极通过层层组装,将氧化石墨烯、壳聚糖、AvLOX固定于玻碳电极上,制备AvLOX/CS/GO/GC乳酸电化学生物传感器,对该传感器性能进行测试,结果如图4所示。由图4可知:当加入0.1 mmol/L底物乳酸时,AvLOX/CS/GO/GC乳酸传感器有明显阶跃,且响应信号平稳,对乳酸浓度和响应电流进行线性拟合得到I=0.317 9C+0.403(R2=0.999),线性关系良好,线性范围为0.1~0.9 mmol/L,灵敏度为45 μA·L /(mmol · cm2)。该电极的响应时间仅为4 s。一般来说,乳酸生物传感器的响应时间通常在20 s以上[11-12]。该电极较短的响应时间可归功于较高的比酶活与氧化石墨烯良好的导电性与大的比表面积。因为比酶活越高,底物与酶反应的速率就越高,氧化还原反应进行得越快,进而达到稳态电流的时间就越短。
该乳酸生物传感器对苹果酸、谷氨酸、蔗糖以及乳糖等发酵液中常见的干扰物质均无响应(图4(d)),表明其具有良好的抗干扰性能,可用于发酵过程复杂环境中乳酸含量的特异性检测。由重复稳定性检测结果可知,所制备电极在10次重复性检测中,相对灵敏度均保持在96%以上,能够满足连续多次检测的要求。此外,将电极浸泡在持续搅拌的电极缓冲液中,每隔12 h取出进行测试,该电极在0~96 h内均保持95%以上的相对灵敏度。由此可见,本研究制备的乳酸生物传感器具有较长使用寿命与检测稳定性。
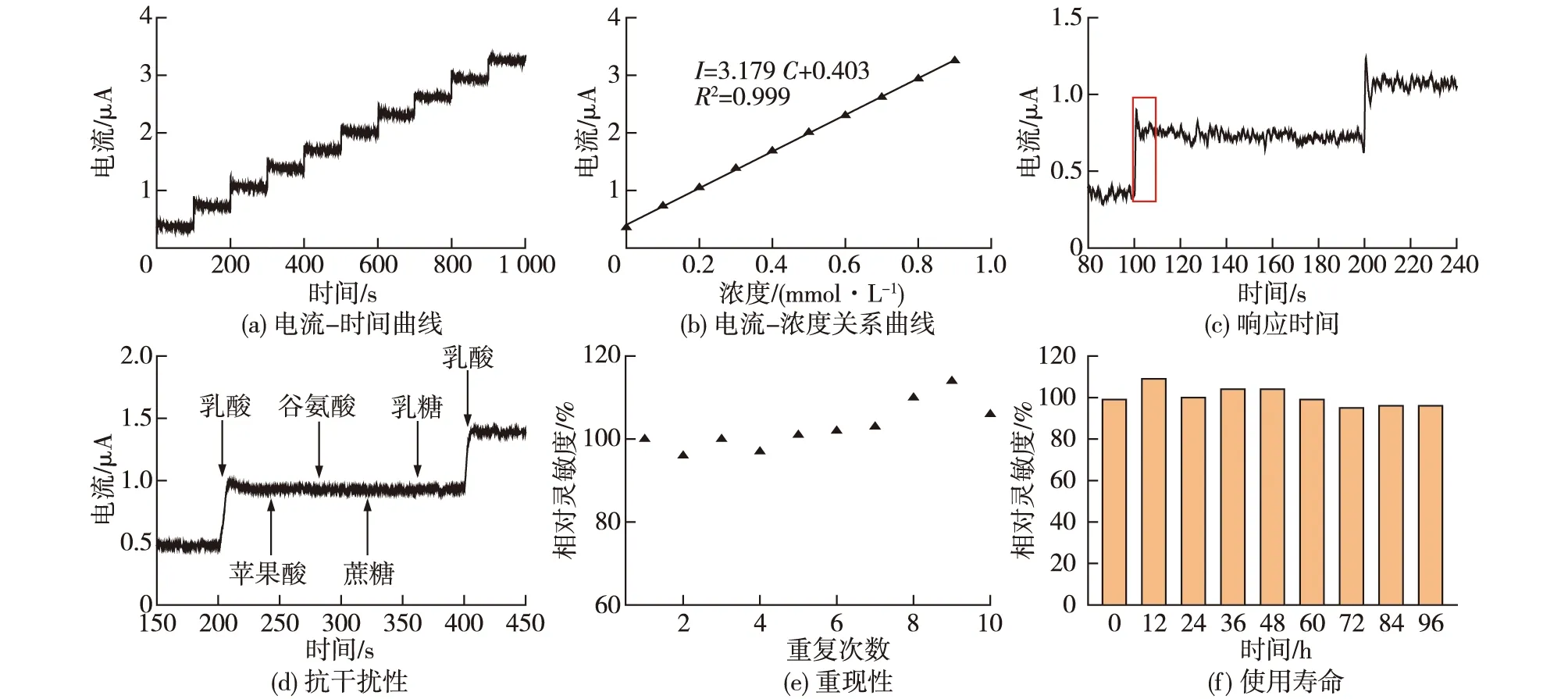
图4 所制备的乳酸生物传感器的电化学性能表征Fig.4 Electrochemical performance of the as-prepared lactic acid biosensor
再对制备的乳酸生物传感器的工作pH与温度环境进行了研究,结果如图5所示。由图5可知:AvLOX/CS/GO/GC乳酸生物传感器在酸性条件下灵敏度下降较为明显,当pH为5.0时,相对检测灵敏度低于60%;在偏碱性(pH 7.0~9.0)条件下,该电极可以保持80%以上的相对灵敏度,表明所制备的电极不适宜在酸性条件下工作,而在中性以及偏弱碱性条件下可以保持较高的检测灵敏性。此外,在20~40 ℃时,该电极的相对灵敏度随温度的升高而增加,但在40 ℃以后灵敏度逐渐下降。综上,本研究所制备的AvLOX/CS/GO/GC乳酸生物传感器较适用于40 ℃和弱碱性的工作环境。
2.4 实际发酵体系中乳酸含量的检测结果
在谷氨酸棒状杆菌发酵液中添加已知浓度的乳酸溶液作为测试的模拟体系和在凝结芽孢杆菌发酵产乳酸的真实发酵体系中考察乳酸生物传感器的性能,结果见表1~2。由表1~2可知:当乳酸浓度为0.20~0.80 mmol/L时,所制备的AvLOX/CS/GO/GC乳酸生物传感器对模拟体系中乳酸的检测较为准确,相对误差维持在6.5%以下。在凝结芽孢杆菌发酵产乳酸的真实发酵体系中,AvLOX/CS/GO/GC乳酸生物传感器的检测与高效液相色谱检测的结果较为吻合,在24、48和72 h的发酵样品中,检测相对误差分别为9.7%、4.07%和8.61%,表明传感器在低浓度底物下误差相对较大,总体检测误差较小(表2)。与高效液相色谱检测相比,该传感器可以快速获取发酵液中乳酸含量。由此可知,所制备的乳酸生物传感器能够实现复杂发酵体系中的乳酸检测,检测准确性良好,具有良好的应用潜力。

表1 乳酸生物传感器在模拟发酵体系中的检测结果Table 1 Detection results in simulated fermentation broth by as-preparedlactic acid biosensor

表2 乳酸生物传感器在真实发酵体系中的检测结果Table 2 Detection results in real fermentation broth by as-preparedlactic acid biosensor and HPLC
将AvLOX/CS/GO/GC乳酸生物传感器与目前文献中的乳酸生物传感器的性能进行对比,结果见表3。由表3可知:AvLOX/CS/GO/GC乳酸生物传感器表现出较好检测低浓度乳酸的能力,相比于其他乳酸生物传感器,本研究所构建的乳酸生物传感器响应时间短,可实现发酵液中乳酸含量的快速检测。

表3 乳酸生物传感器检测性能参数比较Table 3 Analytical characteristics of the lactic acid biosensors.
3 结论
通过高效检测酶元件表达与固定化方案优化制备了灵敏度高、响应时间短且稳定性强的乳酸生物传感器。在大肠杆菌中异源重组表达的AvLOX比酶活高达28.8 U/mg,在温度为30~60 ℃和pH为6.0~7.5时,具有良好的稳定性,为电极的高灵敏度和快速响应提供了优异的检测酶元件。进一步,从生物相容性、固定化率和酶量3个方面优化了重组AvLOX酶的固定化条件,确定了1.0 U的酶负载量与12.5 g/L壳聚糖固定化试剂的组合固定化方式,可有效提高电极的检测灵敏性与稳定性。最后,通过层层组装,将氧化石墨烯、壳聚糖和AvLOX固定于玻碳电极上,制备了AvLOX/CS/GO/GC乳酸电化学生物传感器,其灵敏度为45 μA·L /(mmol· cm2),线性范围为0.1~0.9 mmol/L,响应时间为4 s,储存96 h后仍可以维持95%以上检测活性,最佳工作温度和pH分别为40 ℃和7.0。所制备的乳酸生物传感器实现了在模拟和真实发酵体系中乳酸含量的快速检测,相对误差分别小于6.5%和10%,具有应用于乳酸发酵过程检测的潜力。

