微粒促进培养(MPEC)联合Triton X-100原位萃取竹红菌素
李信萍,张 响,王 玥,王剑文,郑丽屏
(1.苏州大学 药学院,江苏 苏州 215006;2.苏州大学 金螳螂建筑学院,江苏 苏州 215006)
微粒促进培养(microparticle-enhanced cultivation,MPEC)技术是指将固体微粒如Al2O3、CaCO3、滑石粉(talc)添加到发酵培养体系中以提高真菌代谢物产量的一种新型调节方法。当用CaCO3处理根霉菌(Rhizopusoryzae)种子液后,乳酸的产量最高达72.62 g/L[1]。Dong等[2]用10 g/L的Al2O3处理深绿木霉(Trichodermaviride)的种子液,促进纤维素的产生。土曲霉(Aspergillumterreus)的种子液经过滑石粉(直径10 μm)处理,洛伐他汀的产量比对照组提高3.5倍[3]。MPEC已逐渐成为工业发酵生产重要代谢物的新型培养方式[4]。
萃取发酵常用于真菌发酵培养中,即在常规发酵的同时,对目标产物进行原位去除(insituproduct removal),可有效缓解底物抑制作用,也有利于下游产物的分离纯化,降低分离纯化难度,节约生产成本[5-6]。水-有机溶剂两相萃取发酵是增加真菌代谢产物的有效途径[7]。近年来,非离子表面活性剂Triton X-100(TX100)作为一种有效的真菌发酵萃取剂,已成功用于红曲霉(Monascus)[8]和黄丝曲霉(Talaromyces)[9]胞内色素的渗透萃取,在酿酒酵母(Saccharomycescerevisiae)生物转化甲苯以及分枝杆菌(Mycobacteriumsp.NRRL B-3683)转化胆固醇中[10-11]中亦有应用。
竹黄菌菌丝和子实体中的主要苝醌色素为竹红菌素(hypocrellin),具有抗炎、抗菌、抗病毒、抗肿瘤等生物活性,现已研发出“竹红菌素软膏”,在临床上用于治疗外阴白斑、皮肤白色病变和瘢痕疙瘩等皮肤病[12-13]。由于竹红菌素颜色鲜艳、着色能力强且无毒,也可作为食品添加剂[14]。竹红菌素还具有开发为新型、低毒、高效的光活化农药的潜力[15-17]。竹红菌甲素(HA)是一种非卟啉类的新型光敏化合物,具有吸收光谱广、光暗毒性小、产单线态氧能力强等优点,在抗癌、抗病毒、治疗皮肤病等光化学疗法中有很好的应用前景[18]。
目前,由于野生竹黄资源非常有限,从野生竹黄菌提取竹红菌素已无法满足医药工业的需求。竹黄菌无性菌丝的液态发酵已成为生产竹红菌素的首选。在无性菌丝培养中,种子液培养的变化,包括接种量、培养基成分、摇床转速、通气效率等都显著影响真菌的生长和代谢物的积累[1,19]。在竹黄菌的发酵生产中,目前没有关于竹黄菌种子液优化处理的报道,且鲜少有竹黄菌萃取发酵的相关研究。因此,笔者选用了固体颗粒Al2O3、talc以及竹炭微粉(bamboo charcoal powder,BCP)处理竹黄菌种子液,考察这些颗粒对竹黄菌生长和HA合成的影响;另一方面,为了提高发酵体系中HA的产量并简化下游分离纯化步骤,笔者采用两段发酵法对竹黄菌进行萃取发酵,即在种子液培养期,应用BCP处理竹黄菌种子液,促进HA的合成,在发酵生产期添加TX100对竹黄菌进行萃取发酵。笔者研究了TX100萃取发酵对HA合成的影响和竹红菌素在浊点系统中的分配,以期为药用真菌活性代谢物产量的提高及分离纯化步骤的简化提供理论基础和技术方法。
1 材料与方法
1.1 材料
菌株:竹黄菌(Shiraiasp.S8),保藏于中国微生物菌种保藏管理委员会普通微生物中心,编号CGMCC No.3984。
种子液培养基(g/L):马铃薯100、可溶性淀粉20、NaNO34、KH2PO41.5、CaCO30.5、VB10.01;pH自然。
生产培养基(g/L):马铃薯100、可溶性淀粉20、NaNO34、KH2PO41.5、CaCO30.5、VB10.01;pH自然。
以上培养基都在121 ℃条件下灭菌25 min。
1.2 实验方法
1.2.1 种子液制备
将保种于PDA斜面培养基的竹黄菌在28 ℃条件下进行活化,取少量菌丝接种于新配制的PDA平板中,28 ℃培养10 d。用10 mL无菌水洗下培养10 d后的竹黄菌孢子,计数后配制成2×107个/mL的孢子悬液,吸取200 μL孢子悬液接种于种子培养基中(150 mL锥形瓶,装液量50 mL),于28 ℃、150 r/min培养2 d即得竹黄菌种子液,用于后续实验。
1.2.2 MPEC与TX100处理
为了研究不同固体颗粒处理对竹黄菌生长和产HA的影响,分别向竹黄菌的种子液培养基中添加2 g/L的Al2O3、talc、BCP,按上述方法得种子液后接种1 mL于生产培养基中,于28 ℃、150 r/min下培养8 d,用纱布过滤收集菌丝与发酵液用于生物量和HA含量的测定。
在BCP联合TX100的萃取发酵实验中,在接种BCP处理的种子液后的第2、3、4、5、6、7和8天分别添加25 g/L的TX100启动萃取发酵,培养9 d,用于生物量和HA含量的测定。
1.2.3 菌丝球形态观察和直径的测定
1)形态观察。在竹黄菌生产发酵的第1、3、5和7天中的同一时间点,取适量菌丝球于培养皿中,在体视显微镜下观察其形态并拍照。
2)菌丝球直径测定。在竹黄菌生产发酵的第1、3、5和7天中的同一时间点,取适量菌丝球于培养皿中,通过刻度尺测量菌丝球直径,绘制菌丝球直径-时间图。
1.2.4 浊点萃取及苏丹黑B染色
1)浊点萃取竹红菌素。取一定量的经TX100萃取发酵9 d后的发酵液,5 000 r/min离心10 min去除菌丝体,取上清液用于浊点萃取竹红菌素。具体操作:取上清液于玻璃试管中,置于水浴锅中并缓慢升温,当溶液变浑浊时,可观察到分层现象,静置一段时间并拍照。
2)苏丹黑B染色[11]。相分离后,浊点系统可分为稀相(dilute phase)和凝聚层相(coacervate phase),取两相溶液分别用苏丹黑B染色后于显微镜下观察并拍照。
1.2.5 HA提取和含量测定
1)胞内HA的提取。将烘干的菌体取出,放入研钵,加液氮研磨成粉,精确称取粉末,加10倍体积无水乙醇后超声避光提取2 h,浸提24 h,提取液用0.45 μm的有机相针头过滤器过滤,并用高效液相色谱法(HPLC)检测HA含量。
2)胞外HA的提取。用3倍体积的乙酸乙酯萃取发酵液,旋蒸除去乙酸乙酯,所得提取物浸膏用2 mL无水乙醇重新溶解,提取液用0.45 μm的有机相针头过滤器过滤,并用HPLC检测HA含量。
3)色谱检测条件。Agilent HC-C18色谱柱(250 mm× 4.6 mm),柱温25 ℃;流动相为乙腈-水溶液(体积比65∶ 35),流速1 mL/min,检测波长465 nm,进样量20 μL。
1.2.6 统计分析
本实验中,对照组和处理组均有3次独立的重复实验验证(每次重复至少3个平行,n≥3)。采用Student’st-test分析实验结果。每组数据表示为平均数±标准差。P<0.05代表具有统计学意义。
2 结果与讨论
2.1 竹黄菌液体发酵中竹红菌素的生产
竹黄菌生长曲线及竹红菌甲素合成动态曲线如图1所示。由图1可知:当接种1 mL的竹黄菌种子液后,菌丝在发酵的前5天快速生长,之后进入生长稳定期。在接种后第2天开始菌丝内HA快速积累,呈指数增长,同时释放到胞外的HA也显著增多,至第8天HA总产量积累最多,产量达峰值309.49 mg/L。
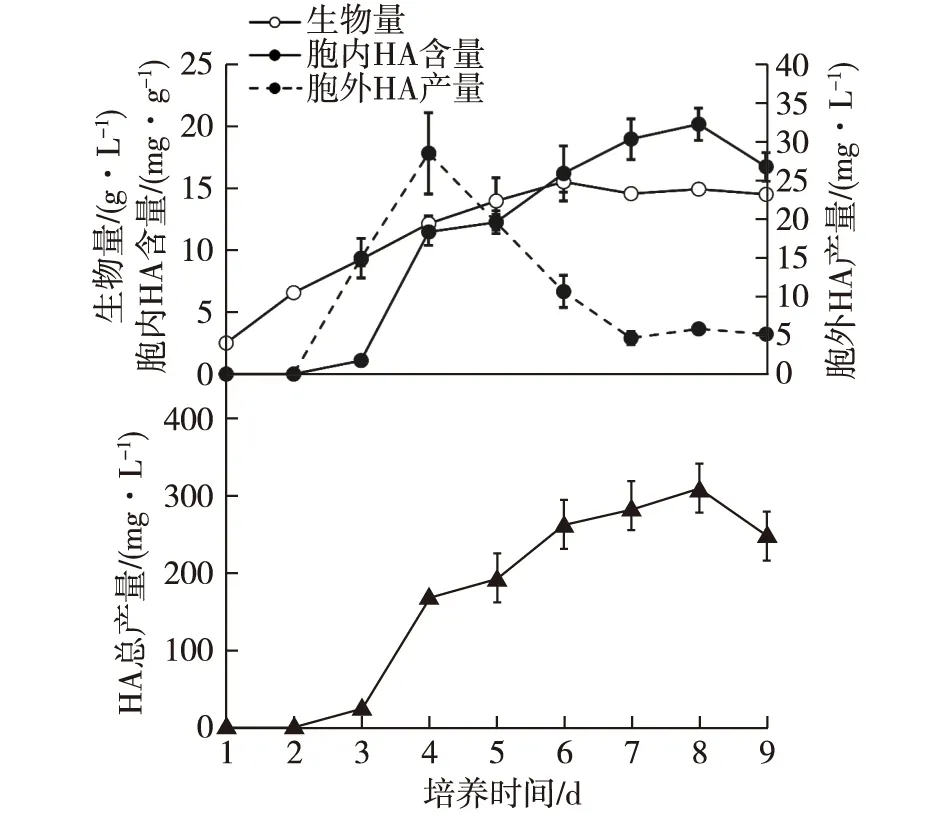
图1 竹黄菌生长曲线及竹红菌甲素合成动态曲线Fig.1 Time-courses of mycelia growth and HA biosynthesis of Shiraia sp.S8
2.2 固体颗粒对竹黄菌生长和竹红菌素生产的影响
为了研究不同固体颗粒对竹黄菌生长和产HA的影响,分别使用Al2O3、talc和BCP处理竹黄菌的种子液,微粒对竹黄菌生长和产HA的影响如表1所示。由表1可知:在培养液中加入2 g/L的Al2O3、talc或BCP颗粒对竹黄菌的生物量均无显著影响。Al2O3颗粒对竹黄菌HA总产量几乎无影响,但talc和BCP颗粒均能显著促进HA的合成,产量分别为556.31和619.64 mg/L,比对照组分别提高了104.05%和127.27%。后期我们采用BCP进一步优化发酵条件(加入浓度和时间)。

表1 微粒对竹黄菌生长和产HA的影响Table 1 Effects of microparticles on biomass and HA production in Shiraia cultures
2.3 竹炭微粉处理发酵种子液的优化
用0~20 g/L竹炭微粉(BCP)处理竹黄菌种子液,结果见表2。由表2可知:竹黄菌的生物量不受影响,胞内HA含量和胞外HA产量均呈现出剂量依赖性,且2 g/L的竹炭微粉对HA的促进作用最显著。用BCP处理竹黄菌种子液显著影响其生产培养基中的菌球形态,即对照组中的菌丝球更大、更蓬松且菌丝分枝更多,而BCP处理组中的菌丝球更小、更紧密、菌丝分枝也少(图2)。经BCP(2 g/L)处理3 d后,竹黄菌胞内HA含量和胞外HA产量分别增加了63.0%~64.9%和63.5%~147.4%,发酵8 d后HA总产量可达604.8 mg/L,是对照组的1.65倍(表3)。

表2 不同浓度BCP对竹黄菌生长和产HA的影响Table 2 Effects of BCP concentration on mycelia growth and HA production in Shiraia cultures
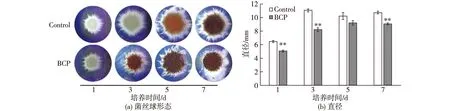
图2 BCP(2 g/L)处理对生产培养基中菌丝球形态和直径的影响Fig.2 Effects of 2 g/L BCP treatment on fungal morphology and average pellet diameters in the production culture
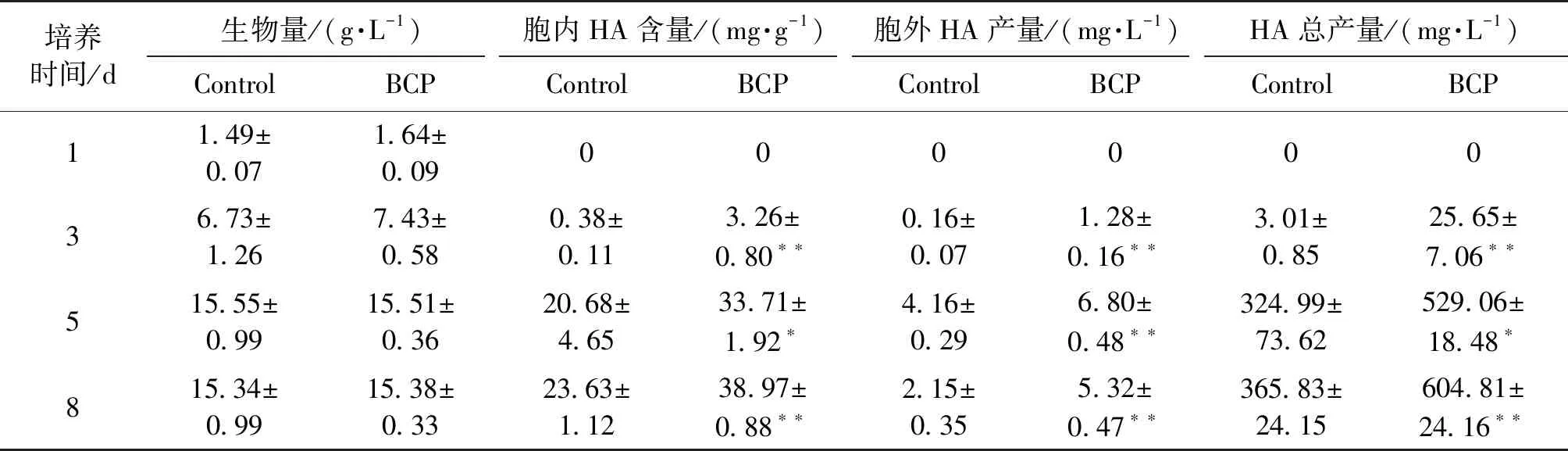
表3 竹炭微粉(2 g/L)对竹黄菌生长和HA合成的影响Table 3 Effects of 2 g/L BCP on fungal biomass and HA production in Shiraia cultures
2.4 竹炭处理竹黄菌种子液与Triton X-100萃取发酵的联合
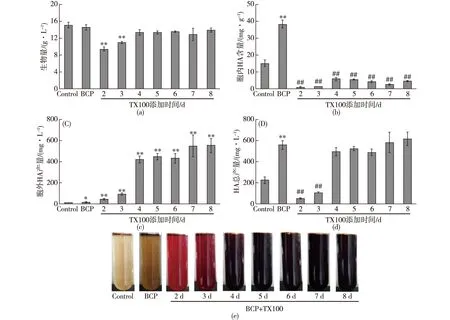
注:##表示P<0.01(与竹炭处理组比较)图3 不同时间添加TX100萃取发酵对BCP(2 g/L)处理的竹黄菌生长和HA生产的影响Fig.3 Effects of 2 g/L TX100 addition time on the cell growth and HA production in Shiraia cultures treated with 2 g/L BCP in extractive fermentation
为了提高HA的产量,同时减轻产物抑制效应和节约下游分离纯化产物的成本,笔者将MPEC技术与萃取发酵相结合,即前期采用BCP(2 g/L)处理竹黄菌种子液,后期在生产发酵阶段加入TX100(25 g/L)进行萃取发酵,结果如图3所示。由图3可知:与单独BCP处理组相比,在不同时间添加TX100对竹黄菌生物量和HA总产量均有影响,添加时间越迟,菌体受抑制的程度越小,HA总产量也越高。在第2、3天添加TX100显著抑制菌体生物量和HA总产量,菌体生物量抑制程度分别为35.8%和24.7%。HA总产量抑制程度分别为90.9%和81.4%,其发酵液呈鲜红或暗红色。在第4~8天添加TX100对竹黄菌菌体生物量无显著影响,胞内HA含量显著减少,均低于10 mg/g(以每克干质量计算),胞外HA产量显著增加,其发酵液呈暗黑色,HA总产随发酵时间的延长逐渐增加。在第8天添加TX100发酵1 d后,胞内HA含量为4.38 mg/g,胞外HA产量为554.41 mg/L,HA总产量达615.29 mg/L,与BCP处理组(563.95 mg/L)无显著差异。由此可见,TX100可将大多数菌丝内的HA萃取到胞外的表面活性剂胶束溶液中。
2.5 竹红菌素在浊点系统中的分配
TX100胶束溶液的相分离和竹红菌素在浊点系统中的分配关系如图4所示。由图4可知:在BCP(2 g/L)处理竹黄菌的第8天添加TX100(25 g/L)发酵1 d后,发酵液经75 ℃水浴1 h可分为两层,形成浊点系统(上层的水相(dilute phase)和下层富含表面活性剂的油相(coacervate phase)),由于HA是疏水性产物,所以大都聚集于下层,故下层油相颜色明显较深。用油溶性染料苏丹黑B对上下层进行染色观察,发现上层水相中存在水包油现象,下层油相中存在油包水现象。HPLC分析结果显示,浊点萃取可有效地将HA富集到富含表面活性剂的油相中。
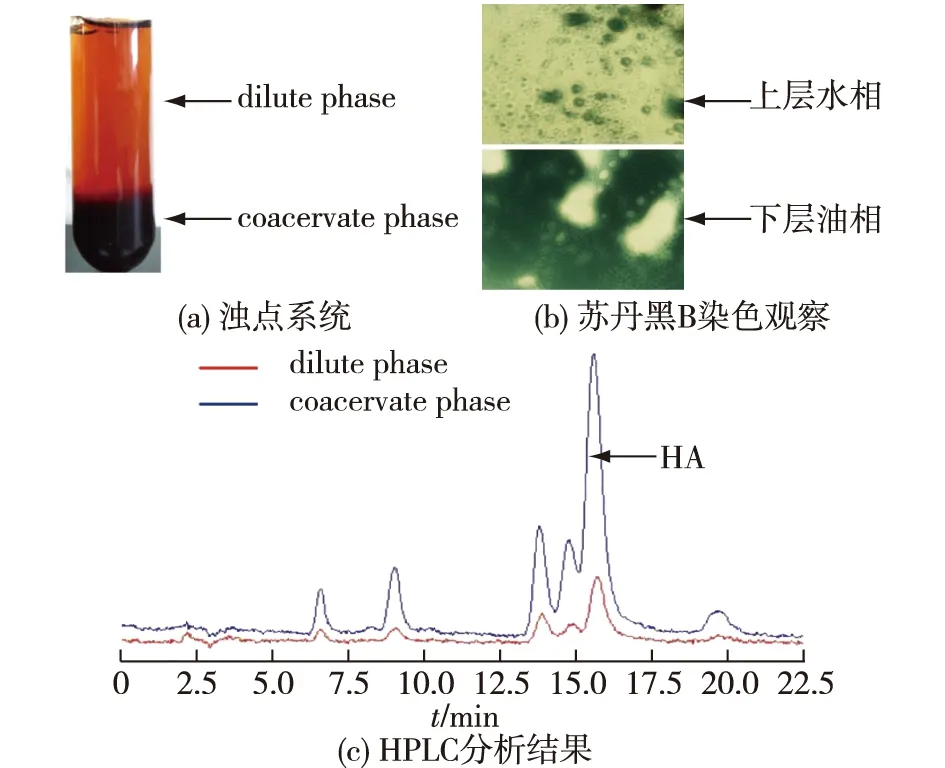
图4 TX100胶束溶液的相分离结果和竹红菌素在浊点系统中的分配Fig.4 Phase separation of TX100 micelle solution and pigments partitioning in cloud point system
2.6 讨论
MPEC技术是调控真菌形态以及提高真菌代谢物产量的有效方法。Bai等[1]研究发现,利用CaCO3处理根霉菌(R.oryzae)种子液可减小其在生产培养基中的菌丝球直径,并使乳酸的产量最高,可达72.62 g/L;在深绿木霉(T.viride)的种子液中添加10 g/L的Al2O3有利于纤维素的产生[2];talc(12 g/L,10 μm)处理土曲霉(A.terreus)种子液可使其菌丝球直径减小3倍以上,同时使洛伐他汀含量增加3.5倍[3]。此外,在裂褶菌(Schizophyllumcommune)的生产培养基中直接添加Al2O3(20 g/L,小于30 μm)可使裂褶菌的多糖产量从10 g/L增加至15 g/L,发酵周期从10 d缩减至7 d[20]。在本研究中,笔者分别用2 g/L的Al2O3(75~150 μm)、talc(45 μm)和BCP(2.3~5.5 μm)颗粒处理竹黄菌的种子液,研究这些颗粒对竹黄菌生长和HA合成的影响,发现talc和BCP颗粒均能促进HA的产量,其中BCP的促进效果最显著,而Al2O3对竹黄菌的代谢无显著影响。通过筛选BCP的最佳质量浓度后,发现2 g/L的BCP处理竹黄菌种子液对HA的促进作用最显著,且胞内外HA产量均显著增加,最终HA产量可达604.8 mg/L。
竹炭是一种环境友好的、低成本的可再生生物资源[21],一般用作燃料,但它还可用于净化水质、居室调湿、吸附异味、制作保健产品和美容护肤等方面[22]。将粒径为25~125 μm的竹炭作为吸附剂或除臭剂可以除去苯、甲苯、吲哚和含硫化合物等有毒物质[23-24]。Kishimoto[25]研究发现竹炭可在不改变橄榄油外观的情况下改善高酸性橄榄油的品质,进而可减少未售出橄榄油的处置量。在本研究中,笔者首次应用MPEC技术,将BCP作为一种固体颗粒刺激真菌的代谢产物。在笔者课题组前期的研究中,非生物诱导子如超声、光暗比和红光处理竹黄菌后,HA的产量为175.53~247.67 mg/L[26-28]。与这些非生物诱导子相比,BCP处理具有易制备、成本低和最有效的优势。因此,笔者的研究为BCP在菌丝无性发酵生物技术生产次生代谢物方面提供了新的应用数据和实例。
微生物发酵中存在产物的负反馈抑制效应,低底物溶解度、底物或产物的抑制和产物的降解是导致终产物产量较低的关键原因[7],因此在萃取发酵时将表面活性剂添加到发酵液中,同时具有增加底物溶解度和萃取产物的作用,能有效解决上述问题。浊点萃取作为一种新型的液-液萃取技术,具有应用范围广、萃取效率高、富集倍数大、有机溶剂用量小等优点,它利用非离子表面活性剂胶束水溶液的溶解性和“浊点”特性,通过改变实验条件(如温度)达到其浊点时引发相分离,从而将待测物与基质分离,并得到一定程度的富集[29]。Yang等[30]利用非离子表面活性剂Brij 35(4 g/L)对红曲霉(Monascussp.NJ1)进行萃取发酵10 d,胞外红色、橙色和黄色色素的产量相比于对照组分别增加了1.47、1.71和2.07倍。胡梦花等[31]发现在竹黄菌S.bambusicola(GDMCC 60438)生长的第70小时添加1%(体积分数)的TX100启动萃取发酵,菌丝体内HA含量为0.88 mg/g,发酵液中HA的质量浓度为101.03 mg/L,而对照组中菌丝体内HA含量为17.40 mg/g,发酵液中未检测到HA。将笔者在本研究中的结果与胡梦花等[31]的结果对比,可见MPEC技术与萃取发酵技术联合使用更有利于HA的生物技术生产。笔者对胞外发酵液进行浊点萃取,发现发酵液在75 ℃水浴1 h的条件下可分为两层,形成浊点系统:上层的水相和下层富含表面活性剂的油相。HPLC实验结果表明,浊点萃取可有效地将HA富集到富含表面活性剂的油相中,是一种环境友好、成本低、条件温和的真菌次生代谢成分萃取技术。
3 结论
通过Al2O3、talc和BCP颗粒处理竹黄菌种子液以建立竹黄菌液体发酵的MPEC技术,发现talc和BCP均可显著促进HA合成,其中BCP对HA合成的促进作用更显著。通过对BCP浓度的筛选后,发现2 g/L的BCP处理可使竹黄菌菌丝球直径减小,HA总产量最高(可达604.8 mg/L),是对照组的1.65倍。将MPEC技术与萃取发酵技术相结合,发现在BCP处理组竹黄菌生长的第8天添加25 g/L的TX100启动萃取发酵1 d,菌丝体内HA含量仅为4.38 mg/g,而胞外HA产量可达554.41 mg/L,可见TX100可将大多数菌丝体内的HA(约90%)萃取至发酵液中。通过本研究的发酵策略,可简化HA的提取过程、节约生产成本、提高生产效率,并为真菌活性次生代谢物的增产、分离提供一种新型生产工艺。

