纤维素基固定化酶载体的研究进展
刘飞翔,董其惠,吴 蓉,邱益彬,黄燕燕,苏二正,4
(1.南京林业大学 轻工与食品学院 食品科学与工程系,江苏 南京 210037;2.亳州学院 生物与食品工程系,安徽 亳州 236800;3.南京林业大学 南方现代林业协同创新中心,江苏 南京 210037;4.南京林业大学 林业资源高效加工利用协同创新中心,江苏 南京 210037)
酶作为一种生物催化剂,具有选择性强、催化效率高、反应条件温和以及催化活性调节方便等优点,在食品、化工、医学、造纸、农业和纺织业等领域有着广泛的应用。然而,游离酶不仅对所处的环境十分敏感,在高离子强度、强酸、强碱、高温以及一些有机溶剂中稳定性差,而且游离酶不容易回收再利用,混入产品后纯化困难,大大限制了酶在更多工业方面的应用[1-2]。固定化酶技术的出现可克服游离酶的上述不足,一定程度上提高了酶的催化稳定性、储存稳定性和重复使用率,在食品工业、精细化工、生物工程和医药等领域的应用前景广阔[3]。
酶的固定化是通过物理或者化学的方法,将原来的水溶性酶与固态不溶性载体进行包埋或者结合,使酶不溶于水,但仍然可以起到催化作用,并能反复使用的过程。固定化载体作为固定化酶最重要的一个组成部分,具体的载体材料的选择、载体材料的结构和性能都会对酶的固定化产生影响[4]。基于载体材料对酶固定化的重要性,很多学者一直致力于不同固定化载体材料的开发和应用。
纤维素及其衍生物是一类理想的基质,因为它具有成本低、无毒、可再生、可降解和生物相容性好等优点,常常被用作载体材料,尤其适于用作固定化酶的载体[5-7]。因为纤维素分子含有大量的羟基,通过氧化纤维素不同位置上的羟基,可以改变纤维素的结构,从而赋予纤维素许多新的功能,同时也使得纤维素及其衍生物作为载体时,能够有更多的变化方式。本文就改性纤维素、纤维素膜、纤维素小球等载体在酶固定化领域的研究进展、催化机制及应用进行总结和分析,为相关的研究者提供参考。
1 改性纤维素作为载体
1.1 氧化纤维素
Crook等[8]早在1970年就尝试用高碘酸钠、脲和甲醛溶液氧化处理纤维素,制成高反应活性的纤维素衍生物用于固定化胰凝乳蛋白酶和胃蛋白酶。徐凤彩等[9]也尝试用高碘酸钠、尿素、甲醛溶液氧化甘蔗渣纤维素用于固定木瓜蛋白酶。纤维素主链上的葡萄糖环基上有3个反应活泼的羟基,可以通过不同的氧化剂将纤维素进行部分氧化,引入如醛基、酮基、羧基或烯醇基等新的官能团。为此,根据引入官能团的不同,用于固定化酶的氧化纤维素载体可分为醛基氧化纤维素、醛基环氧化纤维素、重氮化化纤维素、羧甲基纤维素和乙基纤维素。
1.1.1 醛基氧化纤维素
在纤维素主链的C2和C3位上,使用高碘酸钠进行氧化,使C2、C3位的羟基被氧化后生成双醛基(图1)[10]。这有利于酶分子上非活性中心的氨基和氧化纤维素上的醛基直接发生共价反应,形成共价固定化酶,达到固定酶的目的。

图1 纤维素的羟基氧化及其酶的固定化Fig.1 Hydroxyl oxidation of cellulose and its immobilized enzyme
李珊珊等[11]使用双醛基氧化纤维素作为载体固定胰蛋白酶时发现,当氧化时间为3.5 h、pH为2、温度为35 ℃时,醛基氧化纤维素的质量分数高达74.06%,固定的胰蛋白酶表现出了较高的稳定性,在最适反应条件下,重复使用性也有所提高。
郭庆启等[12-13]使用双醛基氧化纤维素固定β-半乳糖苷酶和木瓜蛋白酶,并且研究了固定化酶的性质,结果发现:与游离β-半乳糖苷酶和木瓜蛋白酶相比,固定化酶的热稳定性和耐酸碱性都增强,虽然与底物的亲和力有所降低,但是重复使用5次之后,残余的酶活性仍较高。
1.1.2 醛基环氧化纤维素
在碱性条件下,纤维素C6位的羟基比C2和C3位的羟基更活泼,环氧氯丙烷可以和纤维素C6位的羟基发生亲核取代生成环氧化纤维素(图2)[13],生成的环氧化纤维素与高碘酸钠继续进行氧化反应,使得C2和C3位上的羟基发生氧化,生成含有醛基的环氧化纤维素。醛基环氧化纤维素的环氧基与酶分子结构上的非活性中心的氨基可直接发生共价结合进行固定化,省去中间交联活化工艺步骤,使固定化程序一步完成,且发生的是共价键反应,所以酶结合得比较牢固。
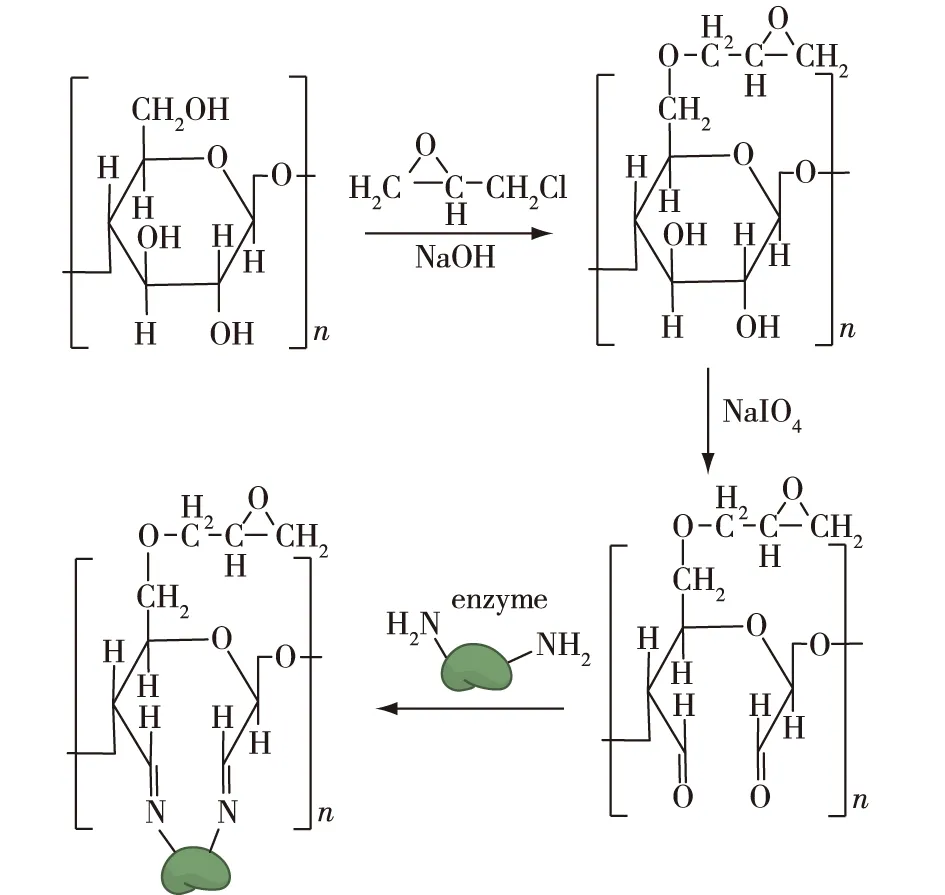
图2 醛基环氧化纤维素的生成及其酶的固定化Fig.2 Formation process of aldehyde epoxide cellulose and its immobilized enzyme
郭庆启等[14]使用环氧氯丙烷和高碘酸钠先后对纤维素进行环氧化和双醛氧化,得到双醛环氧化的纤维素,并以此作为载体,共价法固定β-半乳糖苷酶,结果发现:与游离酶相比,固定化酶反应的最适温度升高,热稳定性和耐酸碱性增强,在重复使用5次之后,相对酶活还保持初始酶活的64%左右,较为稳定。
1.2 重氮化纤维素
重氮法活化纤维素载体,具有方法简便、偶联率较大、稳定性良好等优点。郭海学[15]利用重氮化纤维素固定葡萄糖淀粉酶,固定后的酶热稳定性和最适温度都有所提高。郭桥等[16]以纤维素为载体,利用重氮法活化后再固定糖化酶和α-淀粉酶,在pH为4~5时,可以得到高活性的共固定化酶,在60 ℃时,固定化酶表现出最高活性。
1.3 羧甲基纤维素
左秀凤等[17]使用羧甲基纤维素作为载体,固定胰凝乳蛋白酶,固定后的胰凝乳蛋白酶的最适温度提高了5 ℃,在2 ℃储存放置20 d后,酶活仍能保持75%以上。
张锐等[18]用羧甲基纤维素-壳聚糖电解质复合物作为载体,使用戊二醛作为交联剂,固定乳糖酶并优化固定化条件,分析固定化酶的性能,结果发现,固定化酶的热稳定性和pH稳定性都优于游离酶,重复使用性也有所提高。
1.4 乙基纤维素
郭青等[19]用乙基纤维素包埋法固定α-淀粉酶,固定后的α-淀粉酶具有良好的热稳定性和存储稳定性,而且固定化的方法相对简单,大大减少了酶变性的可能,最大程度地保留了酶的活力。
2 纤维素膜作为载体
近年来,纤维素膜载体是固定化酶领域比较热的一种载体[20]。使用醋酸纤维素膜固定化酶有以下优点:第一,酶的损失小。当酶处于微结构时,微结构中的流体速度基本为零,因此凭借有机相和水相的剪切力,并不能将酶从微结构中移出。同时醋酸纤维素膜较为紧密,酶不易脱落进入水相。第二,单位膜面积上的酶负载量比较大,单位面积的酶活较高。第三,由于固定之后的酶处在有机相和水相的界面,这些酶可以不经过交联而固定,所以可以最大程度地保持游离态,从而达到最高的酶活性和酶活回收率[21]。
细菌纤维素膜可与海藻酸盐、壳聚糖、淀粉、丝素蛋白、丝胶蛋白和木聚糖等材料结合形成生物复合材料,以提高该纤维素基功能材料的力学和生物学性能[22]。除了传统的植物基纤维素膜外,许多微生物产生的胞外聚合物被称为细菌纤维素膜,也被广泛用于酶的固定化。与植物纤维素及其纳米纤维(以纸浆形式获得)相比,细菌纤维素膜独特而复杂的三维纳米孔结构更有利于生物分子的固定化[23-24]。
2.1 纤维素膜吸附固定化酶
时敏等[25]以醋酸纤维素-聚四氟乙烯复合膜作为载体,对磷脂酶进行吸附固定,结果发现:这种复合膜具有一定的吸附性和疏水性,化学稳定性和力学稳定性都比较好。以此种复合膜吸附固定磷脂酶,可提高酶的活性和稳定性,控制和调节酶的活性和选择性,从而有利于酶的回收和再利用[26-27]。
叶麟等[28]采用物理吸附法将麦麸中的植物酯酶固定于玻璃纤维素膜上,利用Box-Behnken试验,确定最佳固定化条件:固定化温度29 ℃、固定化时间4 h、磷酸盐缓冲液pH 7.0,在该条件下酶活回收率的预测值为28.21%,验证值为27.51%。该研究为利用固定化麦麸酯酶快速检测有机膦和氨基甲酸酯类农药残留提供了技术参考。
然而,固定在膜表面的酶分子受表面吸附力的影响较大,其结构和催化性能均可能受到损害。因此,为了避免表面的负面影响,通常采用一种增加额外间隔的方法。Konovalova等[29]采用壳聚糖作为间隔物,通过共价结合固定在氧化后的纤维素膜表面,而后使用辛巴蓝F3G-A染料作为亲和配体对淀粉酶进行吸附固定,并将该固定化酶后的纤维素膜应用于淀粉超滤,极大提高了淀粉的传质系数和通过量。
由此可见,纤维素膜吸附固定化酶制备工艺简单、快捷,酶的负载量较大,是一种较有前景的膜固定化酶制备方法。
2.2 纤维素膜交联固定化酶
张永刚等[30]使用醋酸纤维素膜作为材料,用氨基硅烷偶联剂对该膜进行化学修饰[31],改性之后的醋酸纤维素膜表面带有氨基,然后使用戊二醛作为交联剂固定脂肪酶(图3),结果发现,硅烷偶联剂浓度过高或者反应时间过长都会破坏醋酸纤维素膜的空间结构,但当优化偶联剂浓度之后,成功实现了脂肪酶的固定化,并且酶活回收率较高。
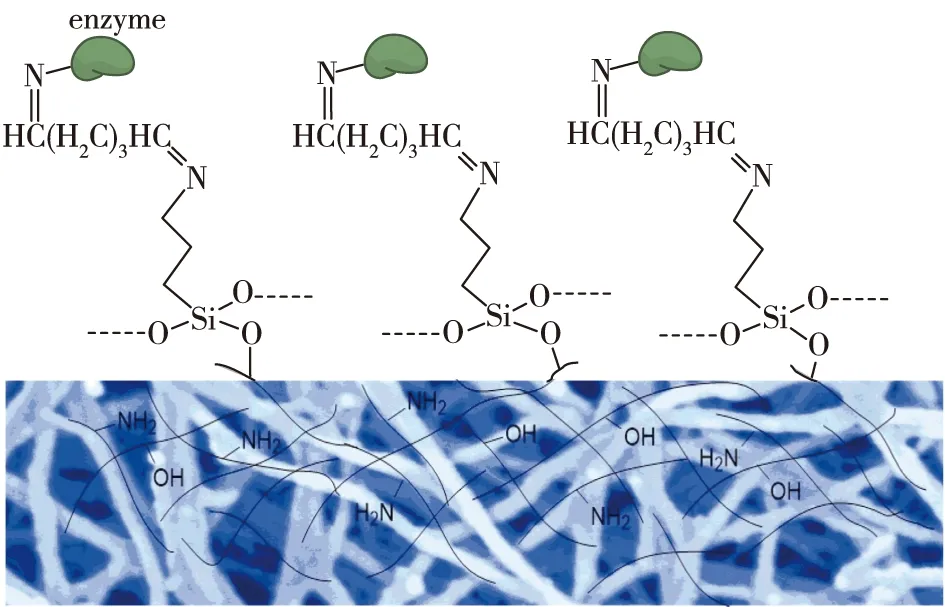
图3 纤维素膜的化学修饰及其酶的固定化Fig.3 Chemical modification of cellulose membrane and its immobilized enzyme
梁单琼等[32]使用醋酸纤维素和聚四氟乙烯为材料制备复合膜,采用吸附-交联的方法固定脂肪酶,并研究温度、吸附时间、交联时间、交联剂等条件对脂肪酶固定化效率和催化效果的影响,结果发现,固定化之后的酶重复使用10次之后,相对酶活保持在55.5%左右。
时敏等[33]使用醋酸纤维素-聚丙烯复合膜固定谷氨酰胺酶,采用先吸附后交联的方法进行固定,并对固定化酶和游离酶的酶学性质进行比较后发现:游离酶最适温度为35~40 ℃,而固定化酶膜最适温度为45~50 ℃;游离酶最适pH为6~7,固定化酶膜最适pH为5~6,固定化酶的最适pH向酸性偏移。
程浩等[34]采用二氯亚砜和乙二胺将细菌纤维素薄膜进行氯化和氨基化,并对β-半乳糖苷酶进行固定,结果发现:在最佳固定化酶的条件下,最高酶活回收率为 78.4%,吸附酶量为63.1 mg/g;经固定化后,酶的最适温度为40 ℃,比游离酶高10 ℃,最适pH提高 0.5,重复使用7次后剩余77.8%的相对酶活。
2.3 纤维素膜包埋固定化酶
王杰等[35]使用醋酸纤维素作为载体材料,采用相转移制膜技术,结合包埋法制作脲酶固定化膜,并对膜的酶活收率和稳定性进行研究,结果发现,固定化之后的脲酶最适反应温度和最适pH都略好于游离脲酶,并且稳定性也有所增强。
郭永胜等[36]考察铸膜液配比对醋酸纤维素固定化氨基酰化酶微孔滤膜的影响,结果发现,在最佳铸膜液配比时,相对酶活的产率高达98.2%,重复使用10次后仍保留初始酶活的79.7%,并且其储存稳定性也大大提高。
王超等[37]研究醋酸纤维素膜作为载体,使用包埋-交联组合法固定木瓜蛋白酶,经过实验和优化,该固定化酶的稳定性、相对酶活都较高。
2.4 纤维素膜共价结合固定化酶
采用共价法将酶固定在醋酸纤维素膜上,形成的酶膜比较稳定,比酶活也比较高。王顺光等[38]采用该方法制备了葡萄糖氧化酶膜,稳定性及重复使用性都较好。
Sternberg等[39]使用高碘酸钠氧化的方法,在纤维素膜上引入活性基团,将酶共价固定在膜上。Vasconcelos等[40]通过傅里叶变换红外光谱证实了氧化后的细菌纤维素膜可以共价固定化木瓜蛋白酶,固定化后的酶活可保持93.1%,并且相对于原始的细菌纤维素膜,氧化膜可固定更多的木瓜蛋白酶。
使用共价法将酶固定在纤维素膜上,虽然可解决酶分子的脱落问题,使得制成的酶膜稳定性有所提高,但是该方法较为繁琐,一定程度上增加了操作的难度。
3 纤维素微球作为载体
纤维素微球颗粒直径一般在微米至毫米范围内[41],可用于固体载体的合成、蛋白质的固定以及色谱分析等领域。微球的制备可以通过引入大量的化学官能团或者将纤维素与有机、无机化合物混合来实现。
3.1 纤维素微球的制备
纤维素微球的制备过程可以大致分为三步:溶解纤维素(或者纤维素的衍生物)、将纤维素多糖溶液塑造成球形颗粒、颗粒固化成微球。
3.1.1 球形颗粒成形
纤维素微球可以通过纤维素多糖溶液形成球形小液滴,并且在凝固浴中凝固而获得(图4)[41]。当纤维素溶液以很高的速度从一个细小的出口喷出后,经过一个旋转装置,被切割成球形颗粒,随后落入凝固浴(介质)之中。液体的喷射和切割液可以直接在凝固介质中完成,微球的形状和尺寸可以通过喷嘴的直径、喷射和旋转的速度以及切割刀的几何形状来进行控制。另外一种让颗粒成形的方式是使用高速分散法,因为纤维素溶液或者纤维素衍生物在与它们极性相反的、不能互溶的溶剂中会形成乳状液,这些含有可溶性多糖的乳液滴,可以通过加入水或者改变pH和温度,从而引起中间衍生物的裂解形成大小相同的纤维素微球。分散后的液滴直径大小从十几到几百毫米,它的大小是由混合的速度、纤维素溶液的黏度、表面活性剂的类型和用量、疏水和亲水性溶剂所占比例共同决定的[42-43]。与滴入法相比,分散法所制备的微球大小是前者的1/10左右,而且分散法不需要其他设备就可以获得很好的产品。

图4 纤维素的溶解和成球途径[41]Fig.4 General routes for dissolution of cellulose and shaping into beads[41]
3.1.2 纤维素的溶解和再生
为了控制微球能够更好地成形,研究人员研究了多种可以溶解纤维素的溶剂(图4),这些溶剂大致可以分成三类[41]:①衍生化纤维素溶剂。纤维素依次经过碱化、老化和CS2处理之后,被衍生为黄原酸纤维素,可以溶解在NaOH中。当溶液形成所需要的纤维素微球之后,黄原酸酯取代基可以通过酸处理或者提高温度(90 ℃)来实现裂解,进而再生成纤维素。由于使用了CS2,这种工艺缺点较大,因此寻找绿色环保的替代品成为近年来人们所关注的热点。②非衍生化溶剂。经常使用非衍生化纤维素的溶剂,如铜铵氢氧化物和其他含有铜、镉、镍或铁等的金属盐的水合物,通过络合纤维素上的羟基而溶解纤维素[41]。但是由于重金属的存在,它们的应用也受到了一定的限制。③稳定的纤维素衍生物。醋酸纤维素常被用来制备纤维素微球,因为它非常稳定,而且制备后的微球不需要处理就可以储存起来。与黄原酸酯和氨基甲酸酯基团不同的是,乙酰基在再生时并不需要裂解,用水置换有机溶液就可以使得醋酸纤维素沉淀。但这样做的缺点就是,在制备微球时需要其他的工艺处理去除乙酰基或甲硅烷基。
3.1.3 纤维素微球性能调节
纤维素微球的尺寸大小主要是由形成球形液滴时使用的方法决定的,而微球的物理特性,如比表面积、密度、孔径大小和结构等都是由凝结工艺决定的。因此,可以通过调节凝固浴的温度和组成调节微球的内表面积和形态等,还可以通过在纤维素微球中加入无机物成分来改变其物理特性[45]。
3.2 纤维素微球的功能化
3.2.1 纤维素微球的化学修饰
为了使纤维素微球能够适应各种不同类型的应用,可以通过引入不同的化学基团来实现。
①醚化。纤维素微球可以通过在碱性条件下与乙烯基化合物(烷基化)、环氧乙烷(羟烷基化)或者卤素发生反应进行醚化,醚键能够在较低或者较高pH的体系中保持稳定。纤维素微球化学改性最常用的一种方法是用氯乙酸对其羧甲基化,会产生用于离子交换的阴离子材料[46-47]。纤维素微球和一些带有双功能化基团的试剂中一个基团进行连接醚化后,可以让另外一个活性基团继续进行功能化的反应,比如纤维素微球与环氧氯丙烷在碱性条件下就是分两个步骤进行反应的,与多糖的羟基进行环氧开环反应形成卤代醇取代,随后去除HCl得到了一种新的环氧乙烷基[48]。另外,纤维素与烯丙基溴和二乙烯砜进行衍生化反应可引入活性烯烃基团[49-50]。
②酯化。纤维素微球与无机酸衍生物酯化能产生带电的材料,如,与硫酸或磷酸反应形成带电材料,这些带电材料可用于离子交换或亲和吸附色谱[51-52]。纤维素微球还能与对甲苯磺酰氯反应使它们更容易进行亲核取代反应。同时,甲苯磺基是一个很好的离去基团,可以被胺和氨所取代[53]。通过与羧酸衍生物酯化制备功能化纤维素微球的研究报道较少,这可能是由于酯键在碱性水溶液中稳定性较低,从而影响衍生化纤维素微球的稳定性[54]。
③氧化。高碘酸钠氧化已被广泛用于活化纤维素微球,特别是用于酶的偶联[55-57]。该反应导致纤维素的构成单元中萄葡糖环的C2—C3键选择性裂解,得到2个活性羰基[58],再经过哌啶氧合氨盐氧化,纤维素的伯醇羟基可被选择性地转化,得到6-脱氧-6-羧基纤维素[59]。
3.2.2 功能化基团引入
①烯烃。用过氧化物引发剂活化后,烯烃基团比较容易地通过自由基加成机制与硫醇反应[60]。纤维素微球能与烯丙基溴或二乙烯基砜反应,随后再连接各种巯基化合物。烯烃基团还能迅速与溴或N-溴代琥珀酰亚胺反应,在水环境里,卤化产生溴代醇,去除HBr即可得环氧乙烷[61-62]。这种活化方法已被应用于微球与含氨基的取代基偶联中[50]。
②环氧乙烷。环氧乙烷对纤维素微球的活化反应通常在温度较低的环境中或者反应较短的时间内即可实现。将环氧乙烷基团链接到纤维素的主链,是一种对活性微球进行官能化的最主要、最常用的方式。更直接一点的方式是用环氧氯丙烷对纤维素异构进行醚化[49]。
③胺类和羰基衍生物。胺类和羰基衍生物都是非常通用的活性基团,它们之间可以相互发生反应,从而生成亚胺,而且亚胺通常可以直接还原成胺,以提高纤维素主链的化学稳定性[63]。胺基或羰基衍生物官能团中的某一种可以连接在纤维素主链上,这样官能化之后的纤维素微球就能很容易与靶分子进行反应。
基于具有“绿色”材料的优势,纤维素微球凭借其良好的理化性质,应用的领域也越来越广泛。曲红波等[63]使用多孔纤维素微球作为固定化酶的载体,用NaIO4氧化法活化来固定糖化酶,制成的固定化酶稳定性较好、成本较低、使用方便。张中勤等[64]以球状纤维素为基体,通过醚化和胺化反应,制备出一种新的固定化酶载体——球状纤维素单宁树脂,这种载体对酶的吸附性比较强,可以用来固定化酶。
对于新型的纤维素微球载体材料的制备、研制、开发和应用还在不断探索之中。
4 磁性纤维素微球作为载体
磁性高分子微球是指通过适当的方法使有机高分子与无机磁性物质结合形成的具有一定磁性及特殊结构的微球。因磁性高分子微球同时兼具高分子微球的特性和磁响应性,所以它不但能通过共聚及表面改性等方法赋予其表面新的功能基团(如—OH、—COOH、—CHO、—NH2和—SH等),还能在外加磁场下方便、迅速地分离[65]。纳米磁性Fe3O4具有量子尺寸效应、超顺磁性、磁有序颗粒的小尺寸效应和宏观量子隧道效应等特殊磁性能,一般使用水滴法进行合成。磁性纤维素微球作为一种新型的固定化酶载体,有着良好的应用前景,其制备与固定化过程如图5所示。
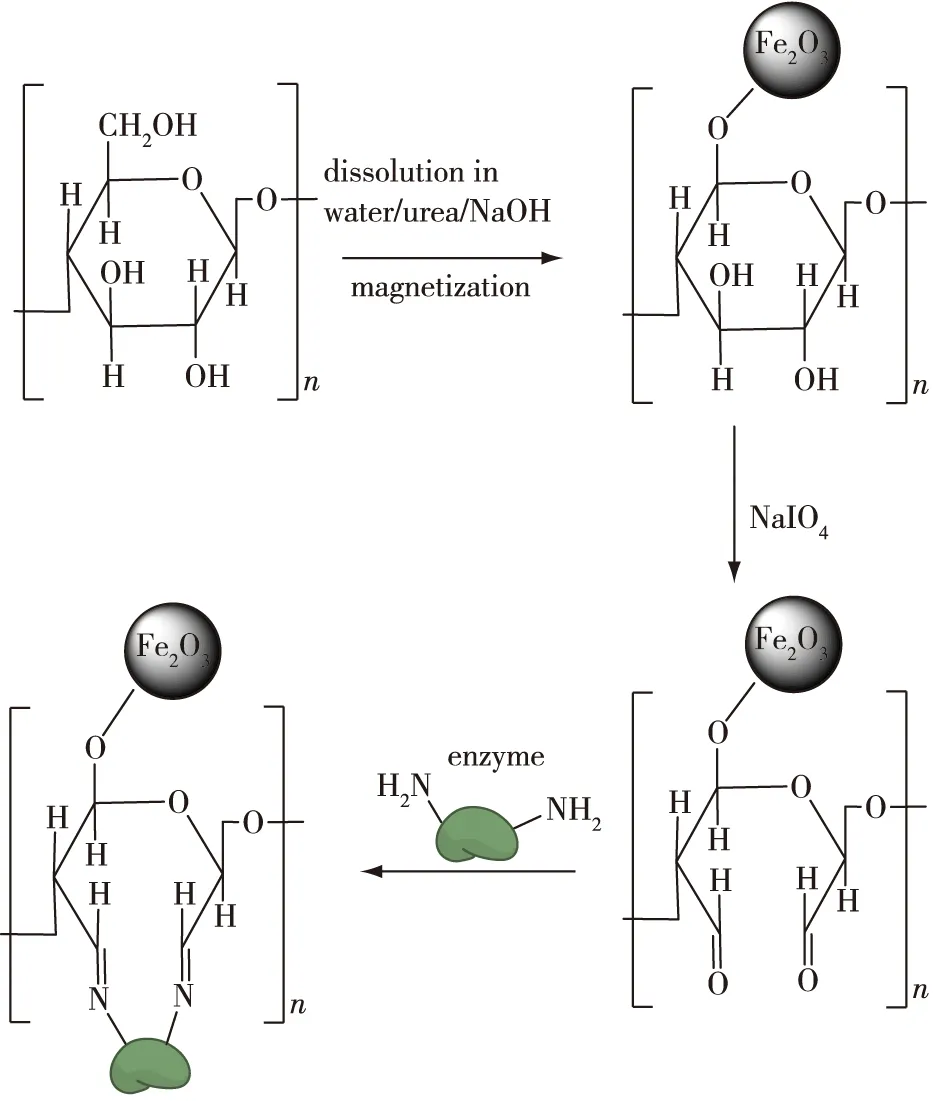
图5 磁性纤维素微球载体的制备及其酶的固定化Fig.5 Preparation of magnetic cellulose microsphere carrier and its immobilized enzyme
Zhang等[66]采用改性的多孔磁性纤维素微球对产自南极假丝酵母的脂肪酶B进行固定化,固定化脂肪酶的催化比酶活可达1.0 U/mg,并用于文冠果种油的酯交换反应制备生物柴油,在最佳反应条件下,制备的生物柴油收率高达92.3%。
Tamaddon等[67]采用磁性微纤维素微球和纳米纤维素微球对脲酶进行固定化,固定化的脲酶经6个循环后仍然保持了75%~80%的酶活。
与传统的固定化载体相比,磁性纤维素微球载体有易回收、成本较低、操作简便等优点[68]。虽然现在对磁性纤维素微球的研究仍然处于起步的阶段,还不能针对不同类型的酶准确地选择磁性载体和固定化方法,但是,随着相关研究的深入,相信很快这些问题都能得到解决。
5 总结
本文介绍了改性纤维素、纤维素膜、纤维素微球和磁性纤维素微球作为固定化酶载体的研究进展,这些纤维素载体形式可以通过吸附、交联、共价结合以及包埋等不同方式实现对酶的固定化,经纤维素基载体材料固定化的酶,在热、酸碱、贮藏稳定性上有所提高,重复使用性能也得到不同程度的提高。由于纤维素具有可再生、可降解、价廉等优势,纤维素基载体材料用于固定化酶的研究将得到更多关注,新的纤维素载体形式也必将不断涌现。

