一株高效羽毛降解菌的筛选与鉴定
李 洋,胥晓雯,杨凯晴,陈星宇,宋天顺,谢婧婧
(南京工业大学 生物与制药工程学院,江苏 南京 211800)
羽毛是鸟类与禽类表皮细胞角质化的衍生物[1],占其总体质量的5%~7%[2]。全球家禽养殖场的废弃羽毛年产量约有2 000 000 t[3],这些羽毛被随意堆弃,导致病毒、细菌滋生,继而产生大量的有害物质,危害人类健康及引起环境污染[4-5]。羽毛的主要成分是蛋白质和氨基酸,其中粗蛋白含量更是达到了90%以上[6]。羽毛中的角蛋白由复杂的三维超螺旋结构组成,使得一般的蛋白酶不易被完全降解[7-8]。目前降解羽毛的主要方法包括:物理法、化学法和微生物法。物理法主要是通过高温高压对羽毛进行加工处理,其生产成本较高,持续的高温高压会破坏部分热敏性氨基酸,降低某些氨基酸的消化率[9],继而降低营养价值。化学法工艺复杂,所需设备多,对设备的损耗大,还会破坏一些热敏性的氨基酸,降低部分氨基酸的利用率或消化率[10]。微生物法是目前最为常用的羽毛降解方法,其反应条件较为温和,对环境的破坏小,降解效率高,具有多样化的降解产物并拥有良好的应用前景。羽毛通常含有20余种氨基酸[11],经微生物法降解后,仍可以保留丰富且较为全面的氨基酸,用作氨基酸肥不会导致土壤累计无机氮,并且氮循环的效益更为显著,因而可以避免传统化肥所带来的环境污染[12]。
本研究从堆积羽毛的土壤中筛选出一株羽毛高效降解菌,分析其降解产物的成分,确认其具备成为氨基酸肥的潜力,通过黑叶葵扇白菜盆栽试验,评估羽毛降解产物对小白菜的促生作用,以期为实现羽毛废弃物的资源化利用提供参考途径。
1 材料与方法
1.1 材料
完整羽毛,江苏翠谷鸽业有限公司提供;羽毛粉,经清洗烘干后的完整羽毛,被粉碎机粉碎后,过150 μm筛备用。
1.2 培养基
筛选培养基(L):脱脂奶粉10 g,琼脂20 g,K2HPO41 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O(100 g/L) 0.1 mL,NaCl 0.5 g,蒸馏水1 L;pH 8.0~8.1;分别经脱脂奶粉与琼脂溶解,再经高压后混匀。
复筛培养基(L):完整羽毛2 g,K2HPO41 g,KH2PO40.4 g,NaCl 1 g。
LB液体培养基(L):酵母浸粉5 g,蛋白胨 10 g,NaCl 1 g。
发酵培养基(L):羽毛粉10 g,K2HPO41 g,KH2PO40.4 g,NaCl 1 g。
LB固体培养基(L):酵母浸粉5 g,蛋白胨 10 g,NaCl 1 g,琼脂 20 g。
1.3 羽毛降解菌的分离筛选
从长期堆积腐烂鸽毛的土壤样品中称取新鲜土壤5 g,加入50 mL离心管中(含15 mL无菌水)。置于30 ℃、160 r/min培养的摇床中30 min,制成悬浮液。取0.1 mL置于20 mL的种子培养基中,于30 ℃、160 r/min的摇床中培养24 h。取悬浮液按10-4~10-8梯度进行稀释。取各梯度悬浮液0.1 mL于筛选培养基上涂布,将平板放入30 ℃恒温培养箱中培养48 h,挑取有明显水解圈的菌落进行划线分离,并保存菌株。
测定菌株生长曲线,将菌株富集培养,取对数期种子液(OD600=0.8),按1%接种量接种于复筛培养基中摇瓶发酵,观察5 d内培养基内羽毛的降解情况,发酵后仍存在于培养基中的羽毛通过高速滤纸过滤。依据文献[13]失质量率的测定方法加以修改。失质量率为羽毛降解前后的质量差的百分比;失质量率与羽毛降解率呈正相关。具体测定方法是将发酵液以8 000r/min转速离心20 min,弃上清液,向沉淀中加入20 mL蒸馏水,于8 000 r/min的转速离心10 min,反复离心清洗3次。将处理后的样品于65 ℃的烘箱中烘干至恒质量,称质量,计算失质量率,从而筛选出降解率最高的菌株,失质量率按式(1)计算。
X=(m1-m2)/m1×100%
(1)
式中:m1为羽毛降解前的质量,m2为羽毛降解后剩余的质量。
1.4 菌株鉴定
1.4.1 形态学的鉴定分析
将筛选出的菌株在LB固体培养基上30 ℃培养 24 h,观察其形态。参照文献[14]的方法对菌株进行生理生化鉴定。
1.4.2 16S rDNA测序
采用引物1492R和27F,以X-Y4菌株的全基因组序列为模板进行PCR扩增,纯化后送测,在NCBI网站进行序列比对,使用MEGA 7.0构建系统发育树。
1.5 羽毛降解菌的单因素试验
采用单因素试验考察菌株的羽毛添加量、摇床转速、初始pH、接种量和发酵温度对可溶性蛋白产量的影响,每个试验分别做3组平行。摇瓶初始发酵条件:羽毛添加量1.0 g,160 r/min,pH 7.0,菌株的接种量1%(体积分数),OD6000.8,30 ℃,摇瓶发酵72 h。
1.5.1 羽毛添加量的确定
发酵条件为初始发酵条件,采用250 mL摇瓶装液,装液量为100 mL,羽毛添加量分别为5、10、15、20、25和30 g/L,测定培养后溶液中可溶性蛋白含量,以确定最佳羽毛添加量。
1.5.2 摇床转速的确定
羽毛添加量取上述试验确定的最佳结果,其他发酵条件为初始发酵条件,摇床转速分别为140、160、180、200、220和240 r/min,考察摇床转速对菌种降解羽毛生成可溶性蛋白的影响。
1.5.3 初始pH的确定
羽毛添加量和摇床转速确定的最佳结果,其他发酵条件为初始发酵条件,经过前期试验,初步调整初始pH分别为6.0、7.0、8.0、9.0和10.0,考察pH对菌种降解羽毛生成可溶性蛋白的影响。
1.5.4 接种量的确定
羽毛添加量、摇床转速和初始pH取上述试验确定的最佳结果,其他发酵条件为初始发酵条件,接种量分别为1%、2%、3%、4%和5%,考察摇床转速对菌种降解羽毛生成可溶性蛋白的影响。
1.5.5 温度的确定
羽毛添加量、摇床转速、初始pH和接种量取上述试验确定的最佳结果,其他发酵条件为初始发酵条件,分别在25、30、35、40和45 ℃摇床中进行发酵培养后测定可溶性蛋白,考察温度对菌种降解羽毛生成可溶性蛋白的影响。
1.6 制备羽毛降解成氨基酸肥
将保藏的羽毛降解菌涂布划线,挑单菌落接种于20 mL种子培养基中,培养至OD600为0.8。按接种量1% 接种于发酵培养基中,经验证菌株降解羽毛第3天时氨基酸的含量最高,故选择第3天收集发酵液。将发酵液8 000 r/min 离心15 min,得上清液,上清液即为羽毛降解氨基酸肥溶液。
1.7 黑叶葵扇白菜盆栽试验
去除表层土壤,取用耕层3~30 cm的土壤,将土壤晒干然后砸碎,分装于15个花盆(口径140 mm,高115 mm)中,每盆填入650 g土壤。每盆氮肥、钾肥施用量为NH4NO30.571 g/kg、KH2PO40.439 g/kg、KCl 0.141 g/kg,将肥料与土壤拌匀装盆,放入适量的水使土壤完全浸湿。将15盆盆栽随机分成5组:处理组1(CK)为普通土壤;处理组2(P1)为普通土壤+叶面喷洒0.1 L/m2氨基酸肥;处理组3(P2)为普通土壤+叶面喷洒0.2 L/m2氨基酸肥;处理组4(P3)为普通土壤+灌根施加0.1 L/m2氨基酸肥;处理组5(P4)为普通土壤+灌根施加0.2 L/m2氨基酸肥,未经叶面喷洒和灌根施肥处理的均用等量水进行同样操作。将撒5颗黑叶葵扇白菜种籽,待4 d发芽后间苗至2颗,待其过两叶期(14 d)后,用不同浓度羽毛降解氨基酸溶液进行叶面喷洒和灌根施加,叶面喷洒每3天进行1次,灌根施加每7天进行1次。黑叶葵扇白菜生长培养30 d后,对其基本指标进行测定分析。
1.8 分析方法
1.8.1 可溶性蛋白含量的测定
采用文献[15]的方法测定羽毛的发酵液中可溶性蛋白的浓度。
1.8.2 游离氨基酸的测定
取5 mL发酵液于4 ℃、8 000 r/min离心15 min,将质量分数10%磺基水杨酸(10.00 g磺基水杨酸溶于100 mL蒸馏水中)与上清液按4∶1的体积比例均匀混合,于4 ℃的冰箱保存1 h,离心取上清液用0.22 μm滤膜过滤稀释适当倍数后,再用0.22 μm滤膜过滤,最后参考文献[16]的方法进行测定。
2 结果与讨论
2.1 高效羽毛降解菌的筛选与鉴定
在筛选培养基上根据形态区别,挑选6个单菌落,分别命名为X-Y1、X-Y2、X-Y3、X-Y4、X-Y5和X-Y6。进行多次划线纯化后,保存以备复筛使用。将上述筛选出的6株菌接种于复筛培养基中,根据降解率高低再筛选出2株菌(X-Y1、X-Y4)。羽毛的降解是一个持续进行的过程,在一定时间内,羽毛降解率与发酵时间基本呈正相关性(图1)。由图1可知:发酵1 d时,菌群浓度积累到一定程度,羽毛开始降解。发酵2 d时,降解速率加快,X-Y4菌株的降解率已经明显高于X-Y1菌株。到3 d时,X-Y4菌株降解基本停止,降解率达到(93.85±1.07)%,相比于国内外报道的其他羽毛降解菌[17-19]有较高的降解效率。例如王继勇等[17]发现,4 d后,天然羽毛的降解率达71.3%。周莲等[18]发现,132 h天然羽毛的降解率为70.12%。Oliveira等[19]发现,9 d后,天然羽毛的降解率为95%。X-Y1菌株在4 d时仍在缓慢降解,降解率为(79.33±1.99)%,由图1还可知:X-Y4菌株降解速率明显优于X-Y1菌株,故选取X-Y4菌株作为后续的研究对象。

图1 X-Y1和X-Y4菌株对羽毛降解率的比较Fig.1 Comparison of degradation rate of feathers by X-Y1 and X-Y4 strains
筛选得到的1株高效降解羽毛的X-Y4菌株,将其划线培养于LB固体培养基上,观察可知:其菌落呈圆形,金黄色,边缘整齐,表面光滑,中间突起,不透明且黏稠。其生理生化特性见表1。由表1可知:X-Y4菌株可降解酪蛋白、酪氨酸、麦芽糖、乳糖、甘露醇、葡萄糖和淀粉,H2O2酶试验呈阳性,甲基红和乙酰甲基甲醇试验均呈现阴性。经测序结果比对发现,X-Y4菌株与产吲哚金黄杆菌(Chryseobacteriumindologenes)的同源性达到98%。通过构建系统发育树(图2),观察菌株形态和生理生化特征,初步确定X-Y4菌株为产吲哚金黄杆菌。进一步研究发现,X-Y4菌可在温度为15~45 ℃、pH 4.5~11.0条件下生长发育。

图2 X-Y4菌株的系统发育树Fig.2 Phylogenetic tree of strain X-Y4

表1 X-Y4菌株的生理生化特征Table 1 Physiological and biochemical properties of strain X-Y4
2.2 羽毛降解发酵培养条件的优化
2.2.1 不同羽毛添加量对X-Y4菌株产可溶性蛋白的影响
不同羽毛添加量对X-Y4菌株产可溶性蛋白的影响结果见图3。由图3可知:对于不同羽毛添加量,X-Y4的可溶性蛋白含量是随着羽毛添加量先增加后减少的,其中羽毛添加量为10 g/L时,可溶性蛋白含量最高,达到(122.35±3.53) μg/mL。添加量在10 g/L后处于下降趋势,可能是由于羽毛含量过大,水含量相对较低。当羽毛含量过多时,传质过程不能顺利进行,影响发酵体系的供氧,因此菌株降解羽毛能力开始减弱[20]。因此,选择10 g/L为最佳羽毛添加量。
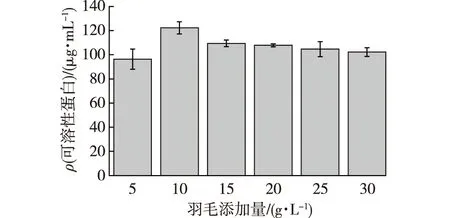
图3 不同羽毛添加量对X-Y4菌株产可溶性蛋白的影响Fig.3 Effects of different feather addition amount on soluble protein production of X-Y4 strain
2.2.2 不同转速对X-Y4菌株产可溶性蛋白的影响
不同转速对X-Y4菌株产可溶性蛋白的影响见图4。由图4可知:对于不同转速,X-Y4的可溶性蛋白含量是随着转速的增加,呈先增加后减少趋势。当转速为200 r/min时,可溶性蛋白含量最高,为(121.32±20.76) μg/mL。适宜的转速可以增加溶氧,因此选择200 r/min为最佳转速。
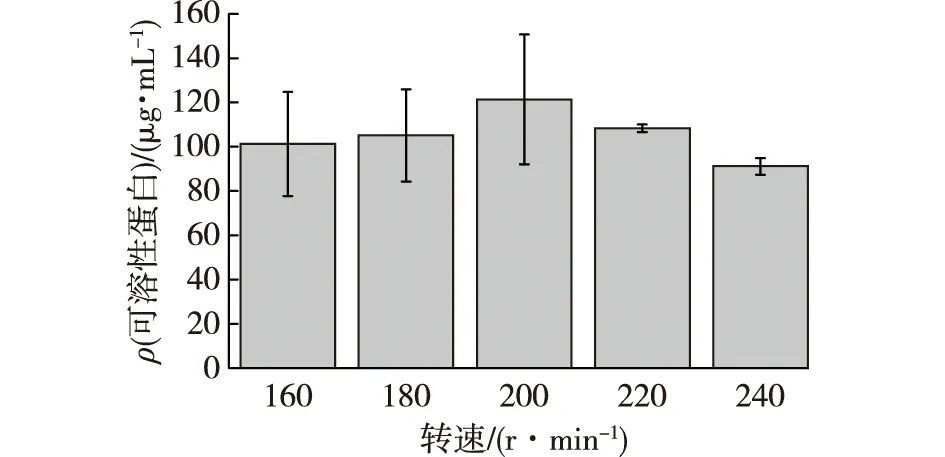
图4 不同转速对X-Y4菌株产可溶性蛋白的影响Fig.4 Effects of different rotation speeds on soluble protein production by X-Y4 strain
2.2.3 不同pH对菌株产可溶性蛋白的影响
不同pH对菌株产可溶性蛋白的影响见图5。参考文献[21-23],并由图5可知:当培养基的初始pH 为8.0~10.0时,可溶蛋白含量差异不大,表明在碱性条件下,X-Y4菌株降解羽毛的能力较强。菌株在生长过程中,会逐渐调节pH,最后稳定在pH 9.0,故选择pH 9.0为最佳pH。本试验所采用的产吲哚金黄杆菌X-Y4在碱性条件下更有利于角蛋白酶的积累和加速菌体的生长,并能提高羽毛的降解效率。
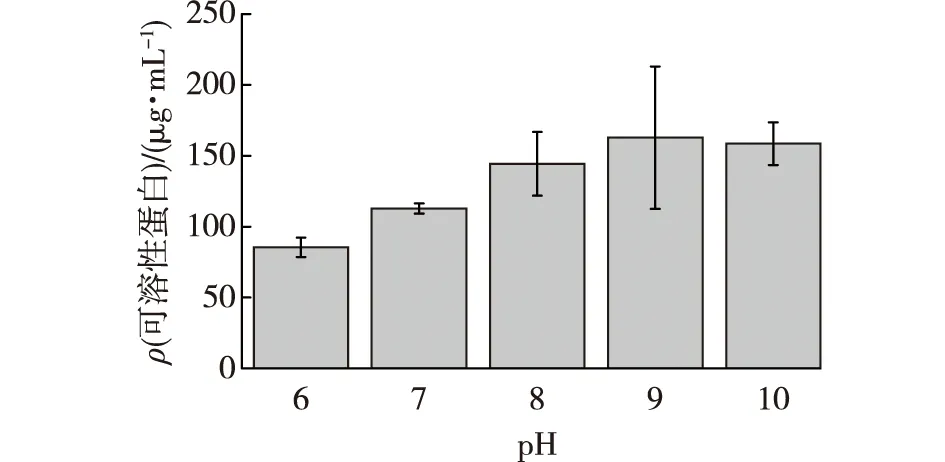
图5 不同pH对X- Y4菌株产可溶性蛋白的影响Fig.5 Effects of different pH on soluble protein production by X-Y4 strain
2.2.4 不同接种量对X-Y4菌株产可溶性蛋白的影响
不同接种量对X-Y4菌株产可溶性蛋白的影响见图6。由图6可知:对于不同接种量,X-Y4的可溶性蛋白含量是随着接种量的增加,呈先增加后减少的趋势,其中接种量为2%时,可溶性蛋白含量最高,达到(168.56±7.82) μg/mL。因此,选择2%时为最佳接种量。
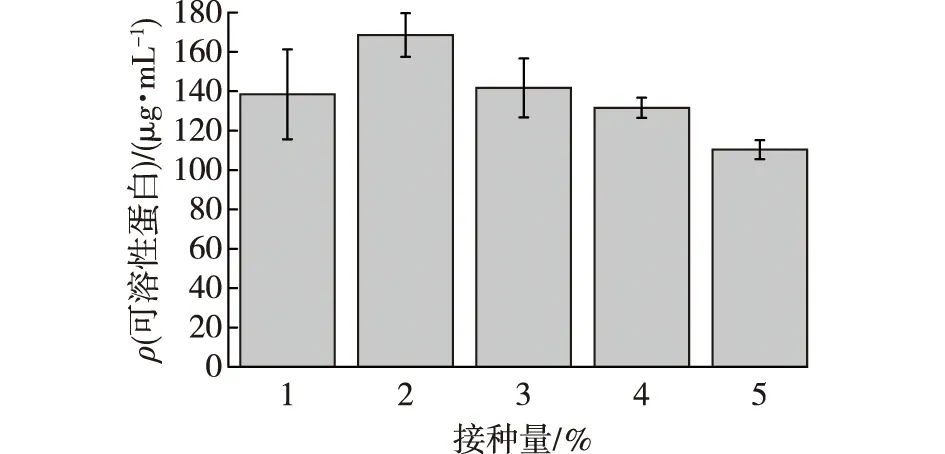
图6 不同接种量对X- Y4菌株产可溶性蛋白的影响Fig.6 Effects of different inoculation amount on soluble protein production by X-Y4 strain
2.2.5 不同温度对X-Y4菌株产可溶性蛋白的影响
温度能够影响微生物体内进行的许多生化反应,从而影响微生物的代谢活动。本试验分别设置25、30、35、40和45 ℃,考察不同温度对可溶性蛋白含量的影响结果见图7。由图7可知:对于不同温度,X-Y4的可溶性蛋白含量是先增加后减少的,其中温度为35 ℃时,可溶性蛋白含量最高,可达(173.27±2.95) μg/mL。

图7 不同温度对X- Y4菌株产可溶性蛋白的影响Fig.7 Effects of different temperatures on soluble protein production by X-Y4 strain
2.3 X-Y4菌株发酵液中氨基酸的分析
使用全自动氨基酸分析仪测定发酵上清液中的氨基酸种类和含量,结果见表2。由表2可知:羽毛填量10 g/L,转速200 r/min,初始pH 9.0,接种量2%,温度35 ℃,在此条件下72 h后发酵液中游离氨基酸总含量达到437.7 nmol/mL,其中Asp、Glu和Tyr含量最高,均超过10%;Ser、Ala、Val、Phe、Lys含量也较高,均超过了5%,说明具有应用于有机肥和动物饲料蛋白的潜力。
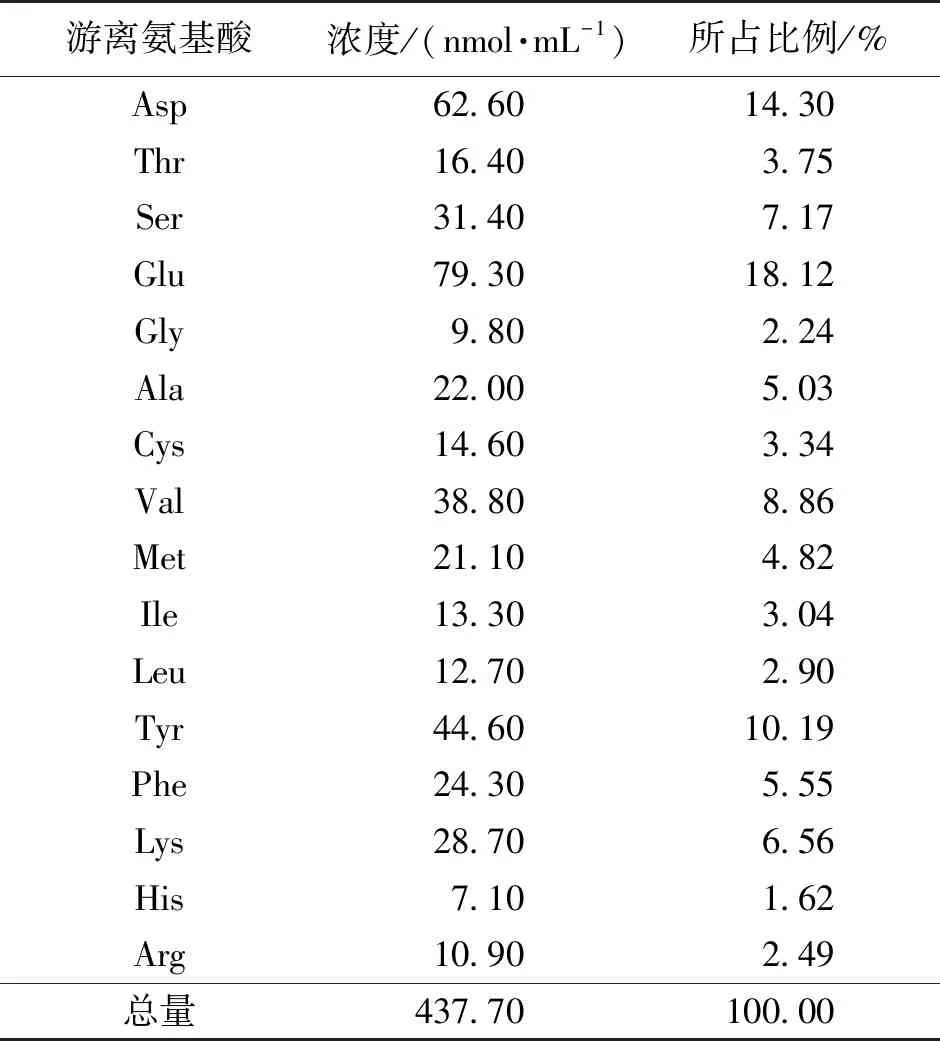
表2 羽毛经X-Y4菌发酵后氨基酸的组成和含量Table 2 The composition and content of amino acids in feathers after fermentation by X-Y4
2.4 X-Y4氨基酸肥对黑叶葵扇白菜生长的影响
在黑叶葵扇白菜盆栽试验中,添加一定浓度的氨基酸肥可以提高黑叶葵扇白菜的株高和鲜质量,并具有促进其生长发育的功能。盆栽试验中经不同处理条件后的黑叶葵扇白菜的生长情况见表3。由表3可知:试验组P1、P2、P3和P4的株高分别高出对照组CK 8.24%、17.42%、17.79%和29.91%,虽然实验组长势优于对照组,但由于株高的限制,所以株高数据进行分析未达到显著差异水平(P<0.05)。试验组P1、P2、P3和P4的鲜质量高出对照组CK的2.42%、22.21%、51.16%和63.48%,采用叶面喷洒处理的P1、P2试验组,虽有增加一定的鲜质量,但不明显,采用灌根施加的P3、P4试验组优于前者且达到显著性差异(P<0.05),其中灌根处理优于叶面处理,0.2 L/m2的浓度优于0.1 L/m2,结果表明:X-Y4菌株降解后的羽毛发酵产物能够促进作物生长,灌根施加0.2 L/m2氨基酸肥的效果最佳。王东方等[24]、魏启舜等[25]、圣亚男等[26]研究结果表明:植物施用氨基酸可提高其生理活性,增加叶片的叶绿素含量,促进作物对养分的吸收利用,有利于植物干物质的积累,从而增加生物量。本研究采用的黑叶葵扇白菜盆栽试验结果与上述报道一致,含有氨基酸成分的P3、P4试验组的地上部分鲜质量均显著高于CK对照组。
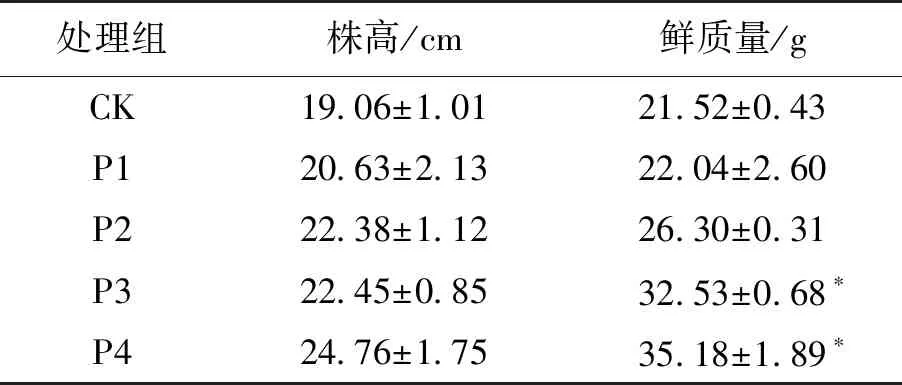
表3 盆栽试验中不同处理条件下黑叶葵扇白菜的生长情况Table 3 Chinese cabbage growth indicators in various treatments in the pot experiment
3 结论
本研究从堆积腐烂羽毛的土壤中筛选出1株高效羽毛降解菌X-Y4,经鉴定其为产吲哚金黄杆菌。该菌株最适发酵条件:羽毛填量10 g/L、转速200 r/min、pH 9.0、接种量2%、温度35 ℃。在此条件下,可溶性蛋白产量为(173.27±2.95) μg/mL。将该羽毛降解菌制得的氨基酸肥施用于黑叶葵扇白菜盆栽,并对其基本指标进行分析后发现:试验组施加0.2 L/m2叶面处理,0.1 L/m2灌根施加和0.2 L/m2灌根施加的鲜质量均高出对照组的鲜质量22.21%、51.16%、63.48%,其中0.2 L/m2灌根施加,对黑叶葵扇白菜的促生效果最为明显。

