问题链在高中化学教学中的应用研究
——以“铁的重要化合物”教学为例
江苏常州市第一中学(226001) 顾晓怿
随着国家迅速发展,社会对创新型人才的需求已上升至战略层面,如何培养创新型人才成为教育教学工作的重要目标。我国著名教育家陶行知认为“问题”可以培养人的创造性,这说明在创新型人才的培养中“问题”具有重要作用。在高中化学教学中,高质量的问题可以引发学生的好奇心,促使学生主动地学习、观察、思考,踊跃参与到课堂中来,从而提高课堂教学效率。在此情况下,问题链教学模式应运而生[1]。
一、问题链设计的原则
(一)情境性原则
问题链中的问题需要通过创设情境来引出。真实情境的创设,有助于学生在真实的情境中思考、讨论和解决问题[2]。化学与生活紧密相连,创设贴近生活的情境,既可以帮助学生快速掌握理论知识,又可以促进学生在日常生活中学以致用。
(二)基础性原则
基础性原则是指要基于学生的学习基础来设计问题链。在教学中,如果不基于学生的学习基础设计问题链,就会使问题失去它原有的意义。因此,问题链的设计要贴合学生的实际情况,要基于学生的学习基础且要循序渐进,使不同基础的学生都能得到发展。
(三)适度性原则
适度性原则是指问题链中问题的数量和难度均要适度。每节课的时间是有限的,教师不应在问题上花费过多的时间,而且大量的提问会使得学生的精神一直处于紧绷状态,会使学生感到疲累,所以问题不宜过多,否则达不到预期的教学效果。问题不宜过难,否则不仅会耽误教学进程,还会打击学生的学习热情,但也不宜过于简单,因为过于简单的问题没有提出的必要。可见,在设计问题链时教师对问题的数量和难度应有一个准确的把握。
(四)梯度性原则
班级中的学生人数众多,且学生之间存在着差异性,如果教师要保证全班学生都能得到不同程度的发展,就要在设计问题链时遵循梯度性原则。
教师应依据化学学科的知识逻辑和学生的认知逻辑设计具有一定梯度的由浅入深、由已知到未知的一连串问题,做到前一个问题是后一个问题的基础和铺垫,后一个问题是前一个问题的延伸和拓展,以使不同层次的学生都得到全面的发展。
除了这几项基本原则,问题链的设计还需要遵循开放性原则、目标性原则及整体性原则。即教学中设置的问题应源于课本知识,但又不能局限于课本知识,须有一定的创新性,同时一切问题的提出都要服务于教学目标的实现。
二、问题链的类型
(一)导入型问题链
导入型问题链是指在正式进入课堂前,基于问题链设计原则所设置的一连串的引导性问题,其目的是使新旧知识顺利衔接,吸引学生进入课堂[3]。
如在教学氧化还原反应前,教师可以提出如下问题:初中学习的氧化还原反应的基本原理是什么?CuO 与CO 的反应中,各元素有无化合价的变化?它属不属于氧化还原反应?这样,既能引导学生回顾有关知识和思考有关问题,又能为后续的知识讲解做好铺垫。
(二)探究性问题链
探究性问题链多用于探究性实验教学中,以引导和鼓励学生积极探索,逐步提高学生的创新思维。
如在钠与水的反应实验中,教师可以就钠发生着火这一现象提出问题:为什么不能利用水来灭火?钠与水在反应过程中有哪些明显现象?根据这些现象,可以推导出钠有哪些特点?反应产生的气体是氧气还是氢气?如何书写化学方程式?这样的问题链,可让学生在探究过程中培养问题意识和创新思维。
(三)总结性问题链
一般来说,总结性问题链用于课堂总结阶段或复习阶段,是为了唤醒学生对课堂重点内容的记忆,引导学生进行归纳总结而设计的一系列问题。对于学生在学习过程中遇到的孤立、分散的知识点,教师也可以采用总结性问题链,帮助学生将其串联起来形成结构化的知识网络。
如在烃的结构与性质的复习教学中,教师可以依照“通式—结构—性质—鉴别”的顺序设计“结构简式为C6H6的烃可能有哪些?它们有哪些结构特点,又有哪些不同的性质?如何加以区分?”等总结性问题链,帮助学生梳理、归纳出各种烃的共性与特性,提高复习效率。
三、问题链在“铁的重要化合物”教学中的应用分析
(一)课前分析
学情分析:通过前期的学习,学生已基本掌握了金属及其氧化物的性质,这为学习铁盐的相关知识打下了基础。但是,学生对部分知识并未达到灵活运用的程度,预计在“铁的重要化合物”的学习中对离子方程式的书写、铁盐性质的预测等会产生困难。
教学目标:
(1)理解Fe2+和Fe3+的化学性质,掌握其检测方法;
(2)掌握“铁三角”变换关系,明确Fe2+和Fe3+之间的相互转化条件及反应;
(3)掌握铁的重要化合物的基本性质及日常应用。
[其中(1)、(2)既是教学重点,又是教学难点]
目标分析:具体如图1所示。
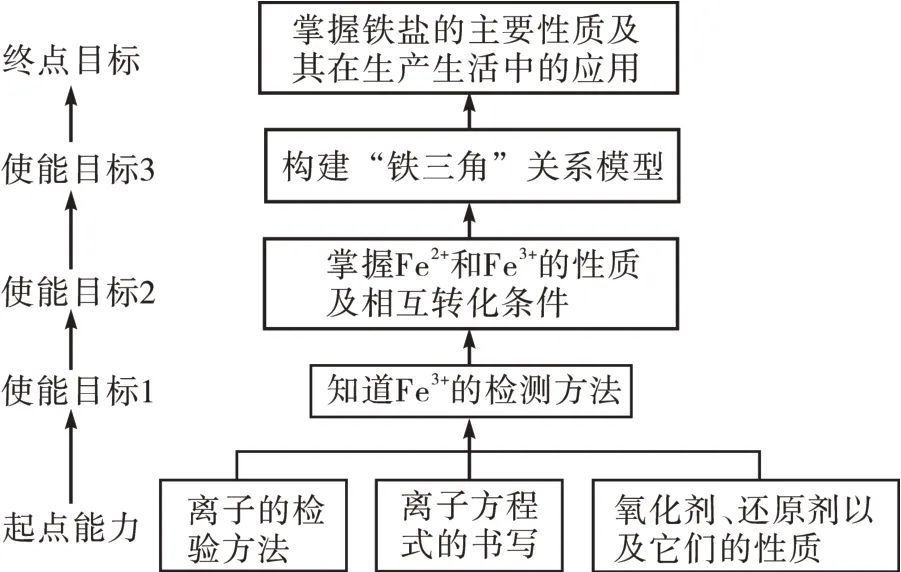
图1
(二)教学流程设计
1.新课导入
教师利用PPT展示刚配制好的FeSO4溶液和因长时间放置而颜色变黄的FeSO4溶液。
问题1:之前我们讲解过4 种常见的有色离子,其中Fe2+和Fe3+分别是什么颜色?
生1:浅绿色和黄色。
问题2:FeSO4溶液变为黄色说明其中包含了什么离子?
生2:Fe3+。
师:回答正确。当FeSO4溶液中存在Fe3+时,就会逐步变为黄色。
问题3:既然我们知道Fe2+可以转化为Fe3+,那么该怎么检验Fe2+有没有发生改变呢?
生3:检测有没有Fe3+。
师:下面我们就来学习一下Fe3+的检测方法。
2.探究Fe3+的检测方法
师:阅读书本内容,找出检测Fe3+常用的方法。
问题4:常用的检测Fe3+的方法是什么?
生4:用KSCN 溶液来检测。
师:没错。下面我们就进行实验并观察其现象。
进行实验:取两支试管,分别加入1 mL FeSO4溶液和1 mL FeCL3溶液,而后往两支试管中加入1滴KSCN溶液,观察现象。
问题5:通过实验,你能够得到哪些结论?
生5:Fe3+遇到KSCN 变为血红色,而Fe2+遇到KSCN没有明显现象,因此可以利用KSCN溶液来检测溶液中是否含有Fe3+。
问题6:既然Fe2+和Fe3+的颜色不同,为什么还要用KSCN溶液来检测呢?
生6:当溶液中Fe3+的含量较低时,并不会产生明显的颜色,而引入KSCN可使现象变得明显。
师:回答得很好。KSCN不受其他离子的干扰,能准确检验出是否含有Fe3+,其反应原理为:Fe3++3SCN-=Fe(SCN)(3红色)。
3.分析Fe3+转化为Fe2+的条件
问题7:我们在配制硫酸亚铁溶液时,通常会加入少量的铁粉,这是为什么?
生7:防止硫酸亚铁溶液中的Fe2+转化为Fe3+。
问题8:相关反应的离子方程式是怎样的?
生8:2Fe3++Fe=3Fe2+。
问题9:铁粉在这个反应中起到什么作用?有没有其他化学物质可以替代铁粉?
生9:铁粉在整个反应中作还原剂,可以用KI来替代。
本次试验结果表明,复方丁香开胃贴治疗1~2周,即可显示出减少腹痛频率、缓解腹痛程度、改善脾胃虚寒证证候的效果。停药后随访4周,其腹痛复发率,试验组也低于安慰剂对照组,只限于样本量的原因,组间比较差异无统计学意义,建议设计和实施新试验,以评价其减少复发的有效性。试验中,两组均发现皮肤刺激反应,组间比较差异无统计学意义,提示可能与敷料贴或基质有关。
进行实验验证:
实验1:取一支装有1 mL FeCl3溶液的试管,加入少量维生素C并振荡。
实验2:取一支装有1 mL FeCl3溶液的试管,滴入KI 溶液。
问题10:通过这两个实验我们可以得到哪些结论?
生10:维生素C 和KI 均能使溶液中的Fe3+转化为Fe2+。
师:可见,在铁粉、维生素C 以及KI 溶液等还原剂的作用下,Fe3+可以转化为Fe2+。
创设情境:现有一溶液,颜色为浅绿色,当往其中加入溶液A 时,溶液变为黄色,再加入溶液B,溶液又转为红色。
问题11:若无色试剂为KSCN 溶液,那浅绿色溶液和黄色溶液中存在什么离子?
生11:存在Fe2+和Fe3+。
问题12:溶液A具有什么性质?在整个反应中起到什么作用?
生12:具有氧化性,可将Fe2+转化为Fe3+。
师:没错。实际上溶液A 是氯水,具有氧化性,能把Fe2+氧化为Fe3+。
问题13:除了氯水,还有哪些氧化剂可以将Fe2+氧化为Fe3+?
生13:高锰酸钾。
问题14:除了高锰酸钾,过氧化氢、硝酸这些试剂是否也可以呢?
而后学生通过实验进行验证,得到“过氧化氢、硝酸可以将Fe2+氧化为Fe3+”的结论。
问题15:我们已经学习了Fe3+的检验方法,那如何检验Fe2+呢?
生14:加入氧化剂,再加入KSCN 溶液,看溶液是否变色。
师:方法是正确的,不过需要调整一下思路,应该先加入KSCN 溶液,判断溶液中是否一开始就含有Fe3+。如果颜色没有变化,再加入氧化剂,若溶液变红,就说明溶液中含有Fe2+。
5.构建“铁三角”关系模型
问题16:Fe2+处在中间价态,它具有哪些性质?
生15:既有氧化性,又有还原性。
师:也就是说,Fe2+既能转化为Fe,又能转化为Fe3+,Fe2+和Fe3+之间也可以互相转化,加上之前我们学过Fe 能和稀盐酸反应生成Fe2+以及Fe2O3能和CO 反应生成Fe,由此可见Fe、Fe2+和Fe3+之间存在“铁三角”关系(如图2)。
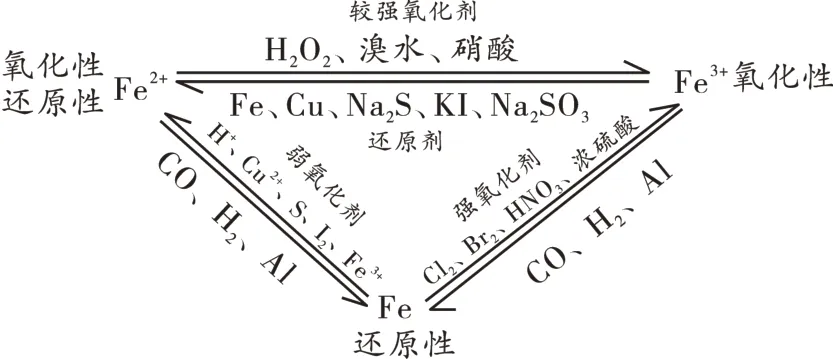
图2
(三)总结归纳
问题17:根据“铁三角”关系模型,若想除去FeCl3溶液中少量的FeCl2,应该怎样做?
生16:通入少量氯气,将Fe2+转化为Fe3+。
问题18:那反过来呢?
生17:加入铁粉。
师:Fe2+与Fe3+的相互转化原理在生产生活中具有较大的应用价值,比如补铁剂和维生素C 一起服用效果更好、印刷电路板的制作等。
该教学设计中,问题和实验贯穿整节课,内容衔接紧凑,问题链引领学生主动思考,让学生在课堂中有事可做、有问可思,最终帮助学生逐步掌握知识点。
综上所述,在高中化学课堂教学中设置一连串层次分明、难度适宜、具有开放性和拓展性的问题,可以吸引学生积极参与课堂,加深学生对知识的理解。由浅入深的问题链可以降低知识的学习难度,增强学生的问题意识,培养学生的思维能力。
要设置高效问题链,需要教师潜心研究教材内容,了解学生的认知水平及思维障碍,制订适宜的教学目标,这对教师而言也是一个不断自我提升的过程。

