极度低氧条件下基质细胞衍生因子-1α 过表达对间充质干细胞迁移的影响
王 辉 徐亮亮 孙大明 孟 一 张成龙 许海甲 宁 宇 李章华
1.武汉大学同仁医院骨科,湖北武汉 430000;2.武汉体育学院研究生院,湖北武汉 430000;3.湖北省襄阳市中医医院骨科,湖北襄阳 441000
目前临床研究表明,组织坏死常伴有缺血缺氧环境形成,如缺血性股骨头坏死局部氧分压可降至1%~2%,甚至无氧,导致骨再生效果降低[1-3]。间充质干细胞(mesenchymal stem cells,MSCs)因有多向分化潜能,而在细胞移植方面备受关注。本课题组前期实验证实,静脉移植的MSCs 可向股骨头坏死区迁移、存活及增殖[4]。但此种方法需要大量纯度高、活性强的MSCs,且需要多次移植,这些或与局部低氧、趋化因子表达不足有关。因此,提高MSCs 归巢能力、增加局部MSCs 数量逐渐成为研究的方向。基质细胞衍生因子-1α(stromal cell-derived factor-1α,SDF-1α)是趋化因子CXC 亚家族的一员,主要通过与其受体4(CXC subfamily receptor 4,CXCR4)结合促进细胞迁移[5-8]。研究表明,低氧环境会导致缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)分解受阻而发生富集,富集的HIF-1α 进而激活下游SDF-1α 蛋白,提高CXCR4 的表达并促进细胞迁移[9-10]。Wang 等[11]发现,SDF-1 和血管内皮生长因子(vascular endothelial growth factor,VEGF)表达水平更高的M2 型巨噬细胞比M1 型巨噬细胞对骨髓源性细胞的募集作用更强,且能新生更多血管。之前,本课题组证实在常氧环境下,过表达SDF-1α 可通过HIF-1α/VEGF/SDF-1α/CXCR4 信号轴促进MSCs 迁移[12],但该研究主要在常氧下进行,目前临床在极度低氧条件下进行的研究尚不多见。因此,本研究旨在观察极度低氧条件下SDF-1α 过表达对MSCs 迁移的影响,为改善MSCs 体内移植提供参考。
1 材料与方法
1.1 实验材料
MSCM 培养基(Sciencell,美国,7501);RNA 提取试剂盒(OMEGA,美国,R693401);逆转录试剂盒及实时荧光定量PCR 试剂盒(TOYOBO,日本,QPK-201);引物均由生工生物工程(上海)股份有限公司合成;Lipofectamin TM 2000(Invitrogen,美国,2145903);AMD3100(Sigma,德国,A5602);Transwell 小室(Corning,美国,35022254);SDF-1α腺病毒(SDF-1α adenovirus,Ad-SDF-1α)由吉凯基因(上海)有限公司制作;HIF-1α 单克隆抗体(abcam,美国,179483);VEGF单克隆抗体(碧云天,中国,AF0312);CXCR4 单克隆抗体(NOVUS,美国,10074396);CO2培养箱(Thermo Fisher,美国,311);实时荧光定量PCR 仪器(BIORAD,美国,788BR06733);荧光倒置显微镜(Leica,德国,D35578);酶标仪(Molecular,美国,301-2431241)。
1.2 实验方法
1.2.1 MSCs 培养及转染 普通级雄性日本大耳白兔两只,两周龄,体重(250±30)g,合格证号:420100000053 84,由武汉市万千佳兴生物科技有限公司提供[SCXK(鄂)2016-0011],独笼饲养,自由饮水,温度控制在(25±1)℃,湿度控制在40%~70%,每日观察其生活及精神状态,定期打扫卫生,保持饲养环境清洁。所有动物实验均遵循实验动物护理和使用指南,所有动物实验均在武汉大学同仁医院进行,均经武汉大学同仁医院伦理委员会批准(伦理批号:SY2019-025)。
按课题组前期方法分离、培养MSCs[13]。将第三代MSCs 计数后以2×105/孔密度接种于6 孔板,分为四组:①空白组,不进行干预;②AMD3100 组,加入CXCR4特异性抑制剂AMD3100 并使其终浓度为60 μmol/L;③Ad-SDF-1α 组,将Ad-SDF-1α 溶于无血清培养基后以感染复数为60 MOI 对MSCs 进行转染,转染6 h后,将无血清培养基更换为MSCM 培养基;④Ad-SDF-1α+AMD3100 组,将Ad-SDF-1α 溶于无血清培养基后以感染复数为60 MOI 对MSCs 进行转染,同时加入AMD3100。各组均在37℃、5% CO2、1% O2环境中培养48 h,然后观察细胞状态,同时记录腺病毒转染效果。
1.2.2 Transwell 实验 将四组细胞采用1×PBS 洗涤两遍并用无血清L-DMEM 培养基稀释至浓度1×105/ml,每组细胞取200 μl 加入Transwell 板的上室,用无血清培养基稀释SDF-1α 蛋白,使其终浓度为100 μg/L,取500 μl 加入下室。在37℃、5% CO2、1% O2环境中孵育12 h,擦去上室中未迁移的MSCs,1×PBS 润洗两遍后多聚甲醛固定,0.1%结晶紫染色10 min,1×PBS洗去结晶紫,显微镜下观察并记录迁移的MSCs,用400 μl 33%冰醋酸溶解结晶紫,选择565 nm 波长,酶标仪下检测光密度(optical density,OD)值。每组3个复孔。
1.2.3 实时荧光定量PCR 检测迁移信号轴HIF-1α、VEGF、CXCR4 mRNA 表达 四组细胞培养完成后,1×PBS洗涤两遍,根据RNA 提取试剂盒说明书提取总mRNA,各取1 μg mRNA 进行逆转录获取cDNA。引物设计,按照NCBI GENE 查HIF-1α、VEGF、CXCR4 及GAPDH 基因序列,引物序列见表1。PCR 体系各组分SYBR MIX、上下游引物混合液及cDNA 分别为10、1、1 μl,加入DEPC 水补至20 μl,以GAPDH 为内参。反应程序为95℃预变性60 s,95℃变性15 s,72℃退火15 s 及60℃延伸15 s,共40 个循环,以2-ΔΔCt法得出mRNA 表达量。
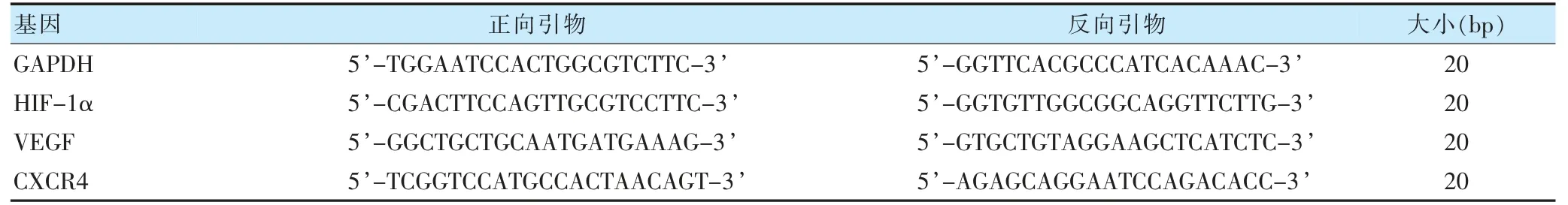
表1 引物序列
1.2.4 Western blot 检测迁移信号轴HIF-1α、VEGF、CXCR4 蛋白表达 四组细胞培养完成后,1×PBS洗涤两遍,加入RIPA 蛋白裂解液,冰上裂解30 min,蛋白浓度用BCA 法定量,将蛋白与上样缓冲液以4∶1比例混合,100℃煮5 min,SDS-PAGE 电泳后200 mA恒流电转膜,用5%脱脂奶粉封闭1 h。分别加入GAPDH 及HIF-1α、VEGF、CXCR4单克隆抗体,以GAPDH 为内参,4℃摇床孵育过夜。TBST 洗膜后用二抗室温孵育1 h,再次洗膜后加入显影剂,在Biorad化学发光系统显影。
1.3 统计学方法
采用SPSS 23.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,比较采用t 检验,多组计量资料比较采用单因素方差分析,组间两两比较采用LSD-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 MSCs 形态及Ad-SDF-1α 转染效果观察
MSCs 贴壁后为梭形、多角形,呈克隆式生长,Ad-SDF-1α 转染后可观察到均一且明亮的绿色荧光。见图1。

图1 间充质干细胞形态及基质细胞衍生因子-1α 腺病毒转染效果
2.2 四组迁移情况比较
AMD3100 组OD 值低于空白组,Ad-SDF-1α 组OD 值高于空白组,Ad-SDF-1α+AMD3100 组OD 值高于AMD3100 组且低于Ad-SDF-1α 组,差异均有统计学意义(P <0.05)。见图2。

图2 四组迁移情况比较(n=3)
2.3 四组HIF-1α、VEGF、CXCR4 mRNA 表达比较
AMD3100 组VEGF、CXCR4 mRNA的表达低于空白组,Ad-SDF-1α 组HIF-1α、VEGF、CXCR4 mRNA表达均高于空白组,差异有统计学意义(P <0.05 或P <0.01)。Ad-SDF-1α+AMD3100 组VEGF、CXCR4 mRNA表达均高于AMD3100 组,HIF-1α、VEGF、CXCR4 mRNA 表达均低于Ad-SDF-1α 组,差异有统计学意义(P <0.05 或P <0.01)。见图3。
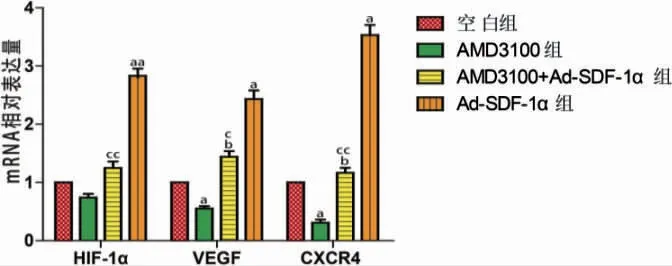
图3 四组HIF-1α、VEGF、CXCR4 mRNA 表达比较(n=3)
2.4 四组HIF-1α、VEGF、CXCR4 蛋白表达比较
AMD3100 组HIF-1α、VEGF、CXCR4 蛋白表达低于空白组,Ad-SDF-1α 组HIF-1α、VEGF、CXCR4 蛋白表达均高于空白组,差异有统计学意义,Ad-SDF-1α+AMD3100 组HIF-1α、VEGF、CXCR4 蛋白表达均高于AMD3100 组且均低于Ad-SDF-1α 组,差异有统计学意义(P <0.05 或P <0.01)。见图4。

图4 四组HIF-1α、VEGF、CXCR4 蛋白表达比较(n=3)
3 讨论
HIF-1α/VEGF/SDF-1α/CXCR4 轴对调节细胞迁移具有重要作用。HIF-1 是启动基因,由HIF-1α 和HIF-1β 两个亚基构成,其中HIF-1α 是目前已知最重要的缺氧受体和缺氧诱导转录因子,HIF-1α 被激活后可以增加细胞在缺氧环境中生存能力,维持氧的内环境平衡,使机体适应缺氧,进而促进细胞黏附、迁移和血管生成[14-17]。当其被敲除或抑制后,细胞的迁移明显被抑制,SDF-1α 和CXCR4 的mRNA 和蛋白水平也显著降低[18]。研究发现,HIF-1α 并不是直接作用于细胞,当组织或器官缺氧时,HIF-1α 会与HIF-1β结合,并易位到细胞核中,与VEGF 基因5’侧翼区域的特定序列结合,激活VEGF,促进血管形成[19-21]。VEGF 是一种约40 kD 的二聚糖蛋白,作为一种高效的内皮细胞有丝分裂原,可刺激增殖、迁移和导管形成[22-23]。如Hong 等[24]研究VEGF 对肿瘤细胞的直接作用时发现,VEGF 除了可促进肿瘤细胞形成血管外,还可上调肿瘤细胞SDF-1α 及CXCR4 的表达,进而促进细胞转移。Lima 等[25]的研究也认为VEGF 可招募CXCR4 阳性细胞。VEGF 激活SDF-1α 后,SDF-1α 可诱导CXCR4 从细胞内部转移到细胞表面并与之结合,进而激活下游信号促进细胞迁移[26-27]。研究发现,SDF-1 及其受体CXCR4 与VEGF 的作用是相互的,在组织缺血缺氧区,SDF-1/CXCR4 可刺激VEGF 的表达进而促进血管形成[28-29]。这些研究阐明了SDF-1对细胞迁移的重要性及基本作用原理。
MSCs 移植入体内时,决定治疗效果的关键在于MSCs 向损伤或坏死区域定向归巢的数量及活性的维持[30]。目前,对低氧环境下MSCs 分化能力的意见尚不统一。有研究认为低氧环境可抑制MSCs 成骨活性,下调成骨因子表达[31-32]。也有研究发现,低氧利于MSCs成骨分化,随着缺氧时间进展,MSCs 中骨桥蛋白、骨钙素及碱性磷酸酶的表达增加,并上调ColⅠ、Ⅲ表达,从而提高MSCs 成骨效应[33-34]。因此增强低氧环境下MSCs 归巢能力,提高归巢数量就显得很有必要。基于此目的,本研究将前期构建的SDF-1α 腺病毒[35]转染入MSCs,建立过表达SDF-1α 细胞体系,并将MSCs置于极度低氧环境培养以观察其迁移能力变化。Transwell 实验结果显示,Ad-SDF-1α 组MSCs 迁移数目最多,AMD3100 组最少,Ad-SDF-1α 与AMD3100共同转染相对于AMD3100 组有所提高,提示极度低氧条件下SDF-1α 过表达可促进MSCs 迁移,并在一定程度上逆转AMD3100 的抑制效应。另外,本研究在基因层面对迁移信号轴HIF-1α、VEGF、CXCR4 进行了检测,结果显示SDF-1α 过表达不仅可上调其受体CXCR4 表达,同时可上调HIF-1α、VEGF 表达,提示SDF-1α 与HIF-1α 及VEGF 之间存在相互作用,共同促进MSCs 的迁移,这与本课题组前期常氧下研究结果相符[12]。
综上所述,本研究提示,在极度低氧条件下SDF-1α 过表达仍然具有促进MSCs 迁移的能力,为优化MSCs 体外移植提供参考。后续实验中,本课题组将通过体内实验及示踪技术,观察SDF-1α 过表达后MSCs 的治疗效果及其对循环中MSCs 的影响。

