早期胃癌患者内镜黏膜下剥离术后复发的相关危险因素
钟碧波 钟 芳
武汉科技大学附属孝感医院消化内科,湖北孝感 432000
胃癌在临床较为常见,随着人们生活方式及饮食习惯改变,发病率逐年递增,病死率位居所有癌症的第2 位,对患者健康及生命安全造成较大影响[1]。尽早明确胃癌诊断并在早期进行治疗可改善患者预后,但胃癌早期缺乏特异性表现,导致确诊时已处于中晚期,错失最佳治疗时机,预后较差[2-3]。近些年,随着诊疗技术不断发展,内镜技术在胃癌早期检查中得到广泛应用,大大提高了早期胃癌检出率。大部分早期胃癌不会出现转移,经手术切除病灶后可获得理想预后,内镜技术不仅在早期诊断中具有优势,用于手术中可准确定位病灶,术者在通过内镜可一次性切除病灶,且创伤较小、患者恢复快[4]。虽然内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗优势突出,但受诸多因素影响,可能残留病灶组织,导致术后复发,影响患者预后[5]。全面分析术后复发的危险因素,并针对高危因素制定干预措施,对预防术后复发有重要意义。鉴于此,本研究进一步探讨早期胃癌患者ESD 后复发的相关危险因素。
1 资料与方法
1.1 一般资料
回顾性分析2019年6月至2020年8月武汉科技大学附属孝感医院收治的176 例早期胃癌患者的临床资料。本研究经医院医学伦理委员会批准同意。其中男92 例,女84 例;年龄38~78 岁,平均(60.04±5.83)岁;体重43~87 kg,平均(69.34±4.21)kg;临床分期:Ⅰ期79 例,Ⅱ期97 例;病理类型:黏液腺癌34例,乳头状腺癌44 例,印戎细胞癌61 例,管状腺癌37例。纳入标准:①符合《胃癌规范化诊疗指南(试行)》[6]诊断标准,具有ESD 指征,并顺利完成手术;②生命体征平稳,耐受手术治疗;③首次进行ESD 治疗;④临床资料无丢失情况。排除标准:①伴有其他恶性病变;②合并视听障碍或精神疾病;③预计生存期<6 个月;④重要脏器功能衰竭。
1.2 方法
所有患者均顺利完成ESD,由同一手术组完成操作,术后通过电话、复诊对患者进行1年随访,根据有无复发分为复发组与未复发组。统计两组患者一般资料,包括性别、年龄、肿瘤部位、合并糖尿病、肿瘤直径、分化程度、肿瘤浸润深度、吸烟史、术前是否进行内镜检查、手术切缘性质、阳性淋巴结数。分析早期胃癌ESD 后复发的相关危险因素。
1.3 观察指标及评价标准
复发判断标准:定期通过电话提醒患者进行内镜复查,观察病情有无复发,一旦发现可疑病灶需进行病理检查。复发率=复发例数/总例数×100%。分化程度判断标准[7]:可分为高分化、中分化、低分化,高分化是肿瘤细胞接近正常发源组织;低分化则区别与正常发源组织,恶性程度较高;中分化介于二者之间。手术切缘性质判断标准:基底切缘或任一切缘显示异型细胞残留。阳性淋巴结数判断标准:术中进行淋巴结清扫,并将淋巴结组织进行活检。
1.4 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,两组比较采用t 检验;计数资料用率表示,组间比较采用χ2检验;多因素分析采用logistic 回归分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 ESD 后复发情况
176 例胃癌患者经ESD 治疗后,有25 例出现复发,复发率为14.20%(25/176)。
2.2 早期胃癌ESD 后复发的单因素分析
复发组肿瘤直径≥3 cm、肿瘤浸润深度为黏膜下层、术前未行内镜检查、手术切缘阳性、阳性淋巴结数≥6 个占比均高于未复发组,差异有统计学意义(P<0.05);两组患者性别、年龄、肿瘤部位、合并糖尿病、分化程度、吸烟史等比较,差异无统计学意义(P>0.05)(表1)。
2.3 早期胃癌ESD 后复发的多因素分析
以早期胃癌ESD 后复发作为因变量(复发=1,未复发=0),以肿瘤直径(≥3 cm=1,<3 cm=0)、肿瘤浸润深度(黏膜下层=1,黏膜固有层=0)、术前是否进行内镜检查(否=1,是=0)、手术切缘性质(阳性=1,阴性=0)、阳性淋巴结数量(≥6 个=1,<6 个=0)作为自变量,进行logistic 回归分析,结果显示,肿瘤直径≥3 cm、肿瘤浸润深度为黏膜下层、术前未行内镜检查、手术切缘阳性、阳性淋巴结数≥6 个是早期胃癌ESD 后复发的独立危险因素(P<0.05 且OR≥1)(表2)。
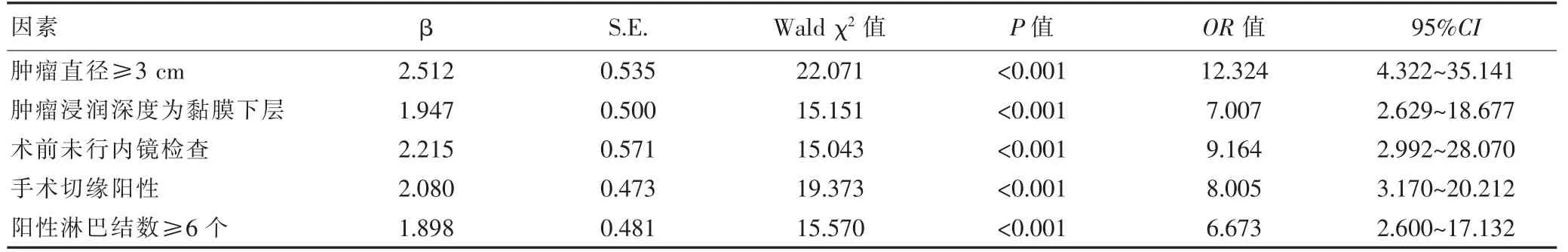
表2 早期胃癌ESD 后复发的多因素分析
3 讨论
随着生活压力增加及饮食结构改变,胃癌的发病率不断升高,且逐渐趋于年轻化,由于缺乏特异性症状,在早期难以及时发现,导致病死率较高,患者预后较差[8]。随着内镜技术不断发展,临床应用越发广泛,使得胃癌早期检出率得到提高,确诊后及时采取胃癌根治术治疗,利于改善患者预后,提高生存率及生活质量。但传统胃癌根治术创伤较大,术中出血量多,并发症发生率高,影响患者术后恢复,整体效果并不理想[9-10]。随着内镜技术的成熟,临床不仅将其用于疾病诊断,在手术中也得到广泛应用,使得胃癌根治术向微创手术发展[11]。ESD 是近些年治疗早期胃癌的主要术式,由内镜下黏膜切除术演变而来,可通过高频电刀与辅助设施可将病灶整块剥离[12-14]。但传统内镜黏膜下切除术无法完全切除大块病灶,病灶残留后导致术后复发率较高,临床应用存在一定局限性。
ESD 临床经验不断积累,适应证逐渐扩大,具有微创、术后恢复快等优势,一定程度上弥补了内镜黏膜下切除术的弊端,治疗效果备受认可,但并不能完全杜绝术后复发[15-17]。ESD 术后复发是一种较为复杂的病理过程,影响因素较多,深入分析危险因素,并针对高危因素采取预防措施,在降低术后复发率、改善患者预后方面意义重大。本研究结果显示,176 例胃癌患者经ESD 治疗后,有25 例出现复发,复发率为14.20%(25/176);复发组肿瘤直径≥3 cm、肿瘤浸润深度为黏膜下层、术前未行内镜检查、手术切缘阳性、阳性淋巴结数≥6 个占比均高于未复发组,差异有统计学意义(P<0.05);两组患者性别、年龄、肿瘤部位、合并糖尿病、分化程度、吸烟史等比较,差异无统计学意义(P>0.05)。logistic 回归分析显示,肿瘤直径≥3 cm、肿瘤浸润深度为黏膜下层、术前未行内镜检查、手术切缘阳性、阳性淋巴结数≥6 个是早期胃癌ESD 后复发的独立危险因素(P<0.05 且OR≥1)。提示早期胃癌患者ESD 术后复发风险较高,主要受肿瘤直径≥3 cm、肿瘤浸润深度为黏膜下层、术前未行内镜检查、手术切缘阳性、阳性淋巴结数≥6 个等因素影响。究其原因:①肿瘤直径越大,病灶组织浸润程度越深,癌细胞可穿透浆膜层深入腹腔,极易出现远处种植转移,导致无法完全消灭癌细胞;另外肿瘤直径≥3 cm 会增加术中切除难度,无法完整剥离病灶,病灶易出现残留,导致术后复发风险较高[18]。②随着肿瘤浸润深度加深,术中内膜剥离难度随之增加,当病灶浸润达到黏膜下层时,术中外科医师进行剥离操作时会担心剥离过深引发胃穿孔,为避免胃穿孔发生,可能会造成病灶残留,无法彻底剥离深处病灶组织,大大增加术后复发风险[19]。③术前准确评估患者病灶情况是减少病灶残留、预防术后复发的关键,早期胃癌术前诊断多依赖超声内镜检查,在内镜辅助下能够直接观察病灶位置、大小、表面血管形态结构及病灶边界。内镜检查系统具有放大功能,术前医师通过内镜检查可准确判断病灶切除范围及深度,尽可能减少病灶残留,从而降低术后复发率[20]。④手术切缘阳性是术后进行病理检查时发现切缘为阳性,术中切除未能完整清除病灶,导致病灶组织残留,术后残留的组织会再次增殖,增加复发风险。针对切缘阳性的患者应予以放化疗、二次手术等方法干预,避免患者再次复发,保持无瘤状态。⑤阳性淋巴结数量越多,淋巴结转移风险越大,手术操作过程中需大范围清扫淋巴结,增加手术创伤,但无法完全清除远传转移的淋巴结,增加术后复发风险。
综上所述,早期胃癌患者ESD 术后复发风险较高,肿瘤直径≥3 cm、肿瘤浸润深度为黏膜下层、术前未行内镜检查、手术切缘阳性、阳性淋巴结数≥6 个是其独立影响因素,临床需针对高危因素制订预防措施,以降低术后复发率。

