强还原土壤灭菌处理对连作病土改良效果的影响因素①
闫元元,周开胜,5,6,张金波,3,4,蔡祖聪,3,4,黄新琦,3,4,刘亮亮,2*
强还原土壤灭菌处理对连作病土改良效果的影响因素①
闫元元1,周开胜1,5,6,张金波1,3,4,蔡祖聪1,3,4,黄新琦1,3,4,刘亮亮1,2*
(1 南京师范大学地理科学学院,南京 210023;2 宜春学院生命科学与资源环境学院,江西宜春 336000;3 江苏省地理信息资源开发与利用协同创新中心,南京 210023;4 江苏省土壤利用与农业可持续发展工程研究中心,南京 210023;5 蚌埠学院土木与水利工程学院,安徽蚌埠 233030;6 农田生态保育与污染防控安徽省重点实验室,安徽蚌埠 233030)
以西瓜和草莓连作病土为研究对象,设置不同处理时间 (3、4、5、7周)、处理温度 (10、20、30、40℃)、含水量(80% 和100% 田间最大持水量、淹水)以及物料类型 (稻草、稻草+牛粪、稻草+铁粉) 的强还原土壤灭菌 (reductive soil disinfestation,RSD)处理,通过冗余分析和随机森林分析探讨RSD处理对不同土壤类型的改良效果及其共性影响因子。结果表明:与对照相比,RSD处理能显著降低两种土壤的电导率和提高土壤pH,且能有效减少土壤真菌/细菌比、尖孢镰刀菌数量及其在真菌中的占比。然而,各因素RSD处理间的土壤性状也呈显著差异,其中pH、电导率以及杀菌效果的整体变化幅度分别为6.48 ~ 8.64、0.15 ~ 0.22 mS/cm及0.6% ~ 99.9%。RSD在处理温度高于10 ℃ 且处理时长为3周时可显著提高土壤pH;在淹水处理时土壤盐渍化去除效果最佳;在处理温度40℃条件下,尖孢镰刀菌的杀灭效果于两种土壤中均达99.7% 以上。相关性分析进一步表明,处理温度与RSD处理后的土壤pH和微生物性质相关性最高,且各因素对RSD处理杀菌效果的重要性排序为:温度>时间>物料类型>含水量。综上,温度是影响RSD处理对不同连作病土改良效果的主要因素。
强还原土壤灭菌处理;尖孢镰刀菌;杀菌效果;共性因子;设施栽培
设施栽培因受季节气候影响小、经济效益高等优点,已成为我国重要的农业生产模式[1]。然而,不合理的轮作和化肥的大量施用,易造成土壤酸化、次生盐渍化、养分失衡以及土传病害频发等问题[2]。王广印等[3]对河南省设施栽培状况调查统计发现,连作障碍发生率在种植蔬菜5年以上的地块高达80%,是造成作物产量下降的主要原因。尖孢镰刀菌()是一种世界性的土传病原真菌,对作物的致病能力强且致死率极高[4],且该病原菌侵染的作物已达100多种,严重制约了设施农业的可持续发展[5-6]。
目前农业生产中对于连作障碍的防治措施主要包括物理、化学及生物防治,虽然均有一定的成效,但都是针对退化土壤某一特定因素,采取相应的措施,无法从根本上消除连作障碍[7-9]。强还原土壤灭菌(reductive soil disinfestation,RSD)处理是一种向土壤中添加大量易分解有机碳源、灌溉至田间最大持水量并覆盖薄膜,以创造土壤强还原环境杀灭病原菌的作物种植前处理方法[10]。诸多研究表明,RSD处理创造的强还原环境、产生的杀菌物质以及重建的土壤微生物区系能够有效杀灭尖孢镰刀菌、立枯丝核菌()及青枯菌()等多种土传病原微生物[11-12]。RSD处理已成功应用于花卉、蔬果及药材等多种作物的连作障碍防控[13-15]。因此,RSD处理是一种广谱、环保且高效的连作障碍消减措施。
RSD处理杀菌效果主要受处理时的温度、周期、土壤含水量以及添加物料类型与用量等因素的影响[11],虽然前期已有大量文献对其进行报道,但研究结果不一致。例如,刘亮亮等[16]研究发现,RSD处理在低温条件下进行4个月可有效地杀灭土传病原菌,表明温度并非RSD处理杀灭病原菌的决定性因子;Shennan等[17]研究发现,RSD处理温度由16 ~ 21.1℃升高至21.1 ~ 26.6 ℃时,减少一半的物料施用量仍取得了显著的杀菌效果,表明温度而非物料添加量对于RSD处理效果影响显著;Wen等[18]研究发现,RSD处理杀菌效果随物料施用量的增加而显著增加,且杀菌效果在添加相同物料的淹水和饱和水处理中无显著差异,表明物料施用量并非淹水条件对于RSD处理效果具有重要影响。此外,先前的研究均是针对单一土壤开展了单一因素的比较研究,尚缺乏RSD处理影响因素的系统研究。基于此,本试验以西瓜和草莓连作病土为研究对象,分析RSD处理在不同温度、周期、土壤含水量以及物料类型影响下,对土壤理化性质修复效果和病原菌杀灭效果的影响,并通过冗余分析和随机森林分析探究影响RSD处理效果的主要因素,以期为RSD处理的实践提供一定的理论依据。
1 材料与方法
1.1 试验材料
供试土壤分别采自安徽省蚌埠市(117.38°E,32.95°N)连作3年的西瓜和草莓地块。采样前,作物枯萎病发生严重,减产达20% ~ 40%。西瓜和草莓栽培土壤pH分别为6.73和6.75,电导率(EC)分别为0.63 mS/cm和0.46 mS/cm,有机碳含量分别为10.67 g/kg和11.29 g/kg,硝态氮含量分别为94.7 mg/kg和151.3 mg/kg,以及尖孢镰刀菌数量分别为4.16×105copies/g和5.69×106copies/g。RSD处理所需稻草(C/N比46.19)和牛粪(C/N比24.46)采自当地,均研磨成2 mm粉末;铁粉购于安徽省蚌埠市华昌化工站。
1.2 试验方法
两种土壤均按表1所示条件进行处理。RSD处理具体操作流程如下:分别将土样装入密封袋内,按相应方案添加不同材料混匀后,加水至特定条件后密封,并置于相应温度的恒温培养箱中培养。每个处理3个重复,每个重复500 g土,处理结束后采集土样,测定其理化性质和微生物学性质。
1.3 测定项目与方法
1.3.1 土壤理化性质的测定 土壤pH和EC值分别采用S220K pH计(Mettler, Switzerland)和DDS-320电导率仪(Dapu Instrument Co.,Ltd)测定, 水土比分别为2.5∶1(/)和5∶1(/);土壤有机碳含量采用H2SO4-K2Cr2O7湿烧法进行测定;土壤NO3–-N含量采用2 mol/L KCl溶液按液土比5∶1(/)比例进行浸提,浸提液过滤后采用流动分析仪(Skalar San++,Breda,The Netherlands)测定。
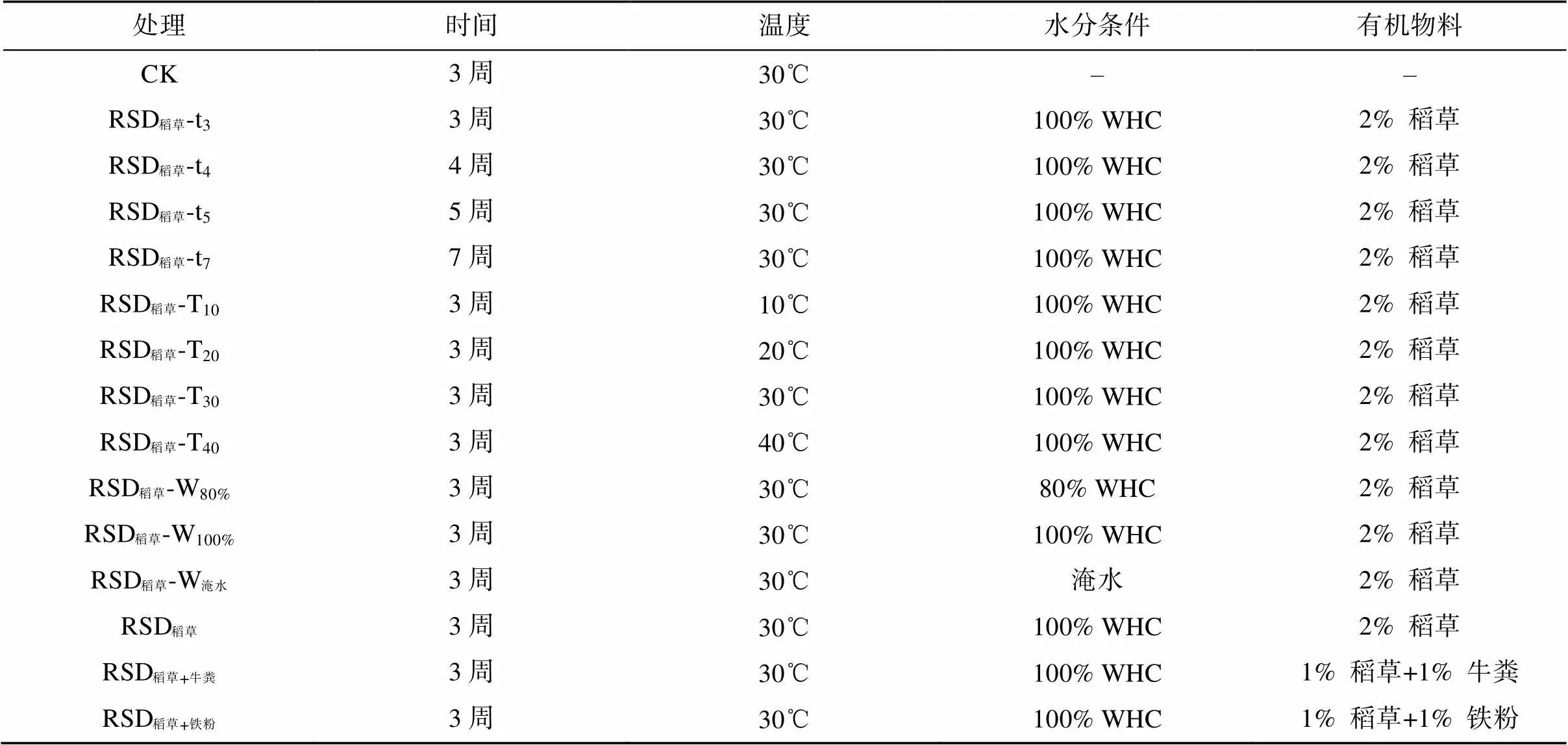
表1 草莓和西瓜栽培土壤处理信息
注:“–”表示不进行灌溉和添加物料处理;WHC,田间最大持水量。
1.3.2 土壤DNA提取和荧光定量PCR分析 称取0.5 g鲜土,采用试剂盒FastDNA®SPIN Kit(MP Biomedicals,USA)提取土壤总DNA。所有DNA样品的浓度和纯度经DS-11超微量分光光度计(DeNovix,USA)检测后置于–80℃冰箱保存待用。采用QuanStudio 3 Real-Time PCR system(Applied Biosystems,USA)对土壤细菌、真菌以及尖孢镰刀菌进行定量分析,反应体系(20 μl)包括SYBR®Premix Ex Taq™(2×,Takara,中国大连)10 μl、参比荧光染料 ROX II(50×)0.4 μl、正、反引物(10 μmol/L)各1 μl(表2)、DNA模板2 μl以及无菌水5.6 μl。细菌和真菌的定量反应条件:95℃ 2 min预变性,95℃ 10 s解链,53℃ 20 s退火,72℃ 30 s延伸,40个循环;尖孢镰刀菌的定量反应条件:95℃ 2 min预变性,95℃ 10 s解链,58℃ 15 s退火,72℃ 20 s延伸,40个循环。在每个循环的延伸阶段采集荧光信号,反应结束后绘制溶解曲线。扩增条件和标准曲线参照Huang等[12]的方法构建,斜率分别为–3.342、–3.381和–3.476。
1.4 数据处理
采用SPSS 25.0中的最小显著差数法(LSD),对单一影响因素下不同处理的土壤理化性质和微生物学性质(微生物定量数据采用对数lg转化)进行统计分析;采用Canoco 5.0对各因素与RSD处理后的土壤理化性质和微生物学性质进行冗余分析;采用随机森林法分析各因素RSD处理在两种土壤中杀菌效果的贡献度。

表2 微生物定量引物
2 结果
2.1 土壤pH和电导率
与CK相比,RSD处理均能有效提高西瓜和草莓栽培土壤的pH(图1A ~1D),且草莓栽培土壤pH经RSD处理后上升幅度(12% ~ 24%)整体高于西瓜栽培土壤(12% ~ 17%)。在不同时间和温度影响下,RSD处理后,两种土壤pH均随处理时间和温度的增加而显著升高(<0.05),且RSD稻草-T40处理的土壤pH显著高于其他温度下的RSD处理(<0.05图1A和1B)。在不同水分条件下(图1C),除西瓜栽培土壤的RSD稻草-W80%处理外,两种土壤pH经RSD处理后均显著高于CK(<0.05)。此外,西瓜栽培土壤的pH 在添加不同物料的RSD处理中无显著差异(>0.05);而在草莓栽培土壤中,RSD稻草+牛粪处理的土壤pH显著高于RSD稻草处理(<0.05)。
与CK相比,RSD处理均能显著降低两种土壤的电导率(<0.05图,1E~1H),且RSD处理在相同土壤和影响因素(时间、含水量和物料类型)下,土壤EC值存在差异性。在不同时间条件下,西瓜栽培土壤的EC值经RSD稻草-t4和RSD稻草-t5处理后显著低于RSD稻草-t3处理(<0.05),草莓栽培土壤的EC值经RSD稻草-t5和RSD稻草-t7处理后显著低于RSD稻草-t3和RSD稻草-t4处理(<0.05,图1E);在不同水分条件下,两种土壤的EC值经RSD稻草-W淹水处理后均显著低于RSD稻草-W80%和RSD稻草-W100%处理(<0.05,图1G)。

(图中误差线表示标准误,图柱上方不同小写字母表示同一土壤不同处理间差异显著(P<0.05),下同)
2.2 土壤细菌和真菌数量
与CK相比,RSD处理均能增加西瓜和草莓栽培土壤中的细菌数量,减少土壤真菌数量和真菌/细菌比,且同一影响因素下的各RSD处理,真菌、细菌数量及其二者比例呈现显著差异性(图2)。在不同时间条件下,草莓栽培土壤的细菌数量经RSD稻草-t7处理后显著高于RSD稻草-t4和RSD稻草-t5处理(<0.05),且RSD稻草-t7处理的细菌数量(2.4×1010copies/g)较CK (2.0×109copies/g)显著增加了11.0倍(<0.05)。在不同温度条件下,西瓜和草莓栽培土壤的真菌数量经RSD稻草-T40处理后均显著低于其他RSD处理(<0.05),且西瓜和草莓栽培土壤的真菌数量在RSD稻草-T40处理中较CK(1.58×108copies/g和9.33× 107copies/g)分别显著降低了89.5% 和72.5%(<0.05),此外,西瓜和草莓栽培土壤中的真菌数量分别在RSD稻草-T20和RSD稻草-T10处理中显著增加(<0.05)。RSD处理温度越高,两种土壤的真菌/细菌比越低,且西瓜栽培土壤的真菌/细菌比经RSD稻草-T40处理后显著低于RSD稻草-T10、RSD稻草-T20及RSD稻草-T30处理(<0.05)。

(图中颜色代表土壤中细菌数量、真菌数量及真菌/细菌比的相对值,不同大(小)写字母表示西瓜(草莓)土壤不同处理间差异显著(P<0.05))
2.3 土壤尖孢镰刀菌数量及其比例
在不同温度条件下,与CK相比,RSD稻草-T10处理对两种土壤的尖孢镰刀菌数量无显著影响(>0.05),RSD稻草-T40处理的尖孢镰刀菌数量最低,其杀菌效果均达到99.7% 以上(图3B)。两种土壤的尖孢镰刀菌数量在不同时间、水分状况以及物料类型条件下的RSD处理中均呈显著降低趋势(<0.05)。不同时间、水分状况和物料类型条件下的RSD处理在西瓜栽培土壤中的杀菌率分别达81.0% ~ 90.2%、67.8% ~ 85.6% 和81.0% ~ 90.9%,在草莓栽培土壤中的杀菌率分别达91.6% ~ 99.6%、90.4% ~ 92.8% 和82.9% ~ 93.6%。除水分因素外,两种土壤的尖孢镰刀菌数量在其他因素下的RSD处理中呈显著差异(<0.05)(图3A、3B和3D)。草莓栽培土壤的尖孢镰刀菌数量经RSD稻草-t4和RSD稻草-t5处理后显著低于RSD稻草-t3和RSD稻草-t7处理(<0.05)(图3A);两种土壤的尖孢镰刀菌数量经RSD稻草+牛粪处理后低于RSD稻草和RSD稻草+铁粉处理。
在不同温度条件下,与CK相比,RSD稻草-T10处理显著增加了西瓜栽培土壤的尖孢镰刀菌/真菌比(<0.05),而RSD稻草-T30和RSD稻草-T40处理呈相反趋势,尖孢镰刀菌/真菌比分别显著降低了79.3% 和97.6% (<0.05,图3F)。与CK相比,两种土壤的尖孢镰刀菌/真菌比在不同时间、水分状况以及物料类型条件下的RSD处理中均显著降低(<0.05),且在同一因素下的RSD处理中无显著差异(>0.05,图3E、3G和3H)。
2.4 各因素对RSD处理效果影响的冗余分析和随机森林分析
冗余分析结果表明,不同温度条件下的RSD处理(图4A和4B)与两种土壤的尖孢镰刀菌数量、尖孢镰刀菌/真菌比及杀菌效果的相关性最大(<0.05),而其他因素下的RSD处理对其影响不显著(>0.05)。不同时间条件下的RSD处理与西瓜栽培土壤的电导率相关性最大(图4A),不同温度和水分条件下的RSD处理与草莓栽培土壤的pH和电导率相关性最大(图4B)。此外,对两种土壤综合分析均发现,RSD处理温度与土壤pH和杀菌效率呈正相关关系,与土壤的真菌/细菌比和尖孢镰刀菌数量呈负相关关系(图4C);且通过随机森林分析发现,各因素对RSD处理杀菌效率的贡献程度排序为:温度、时间、物料类型和含水量(图4D)。
3 讨论
因集约化种植品种单一、复种指数高以及化肥的大量施用,土壤酸化、盐渍化以及土传病原菌累积引发的连作障碍问题日益突出,给农业生产带来了巨大的经济损失[23]。诸多文献报道[24-25],RSD处理可以显著提高土壤pH,本研究结果与之一致。但是,不同土壤经RSD处理后pH上升幅度呈现差异性,这可能与土壤初始理化性质和微生物性质的差异导致RSD处理过程中还原程度不同有关[26]。本研究发现,两种土壤的pH均随RSD处理时间和温度的增加呈上升趋势,这可能是因为长时间和高温的RSD处理易建立更强的还原环境,从而消耗更多的H+[27]。两种土壤的pH变化幅度在水分含量为80% 田间最大持水量的RSD处理中呈现差异,表明水分含量和土壤类型对RSD处理提升土壤pH的效果具有交互影响。两种土壤经不同参数的RSD处理后,土壤EC值均显著下降,与前人研究结果一致[28]。集约化设施栽培过程中土壤次生盐渍化时长发生,且盐分以硝酸盐和硫酸盐为主,RSD处理所形成的土壤强还原环境,可促进硝酸盐和硫酸盐分别还原为N2O和H2S,从而减轻或消除发生次生盐渍化土壤上所栽培植物的盐分胁迫[1]。
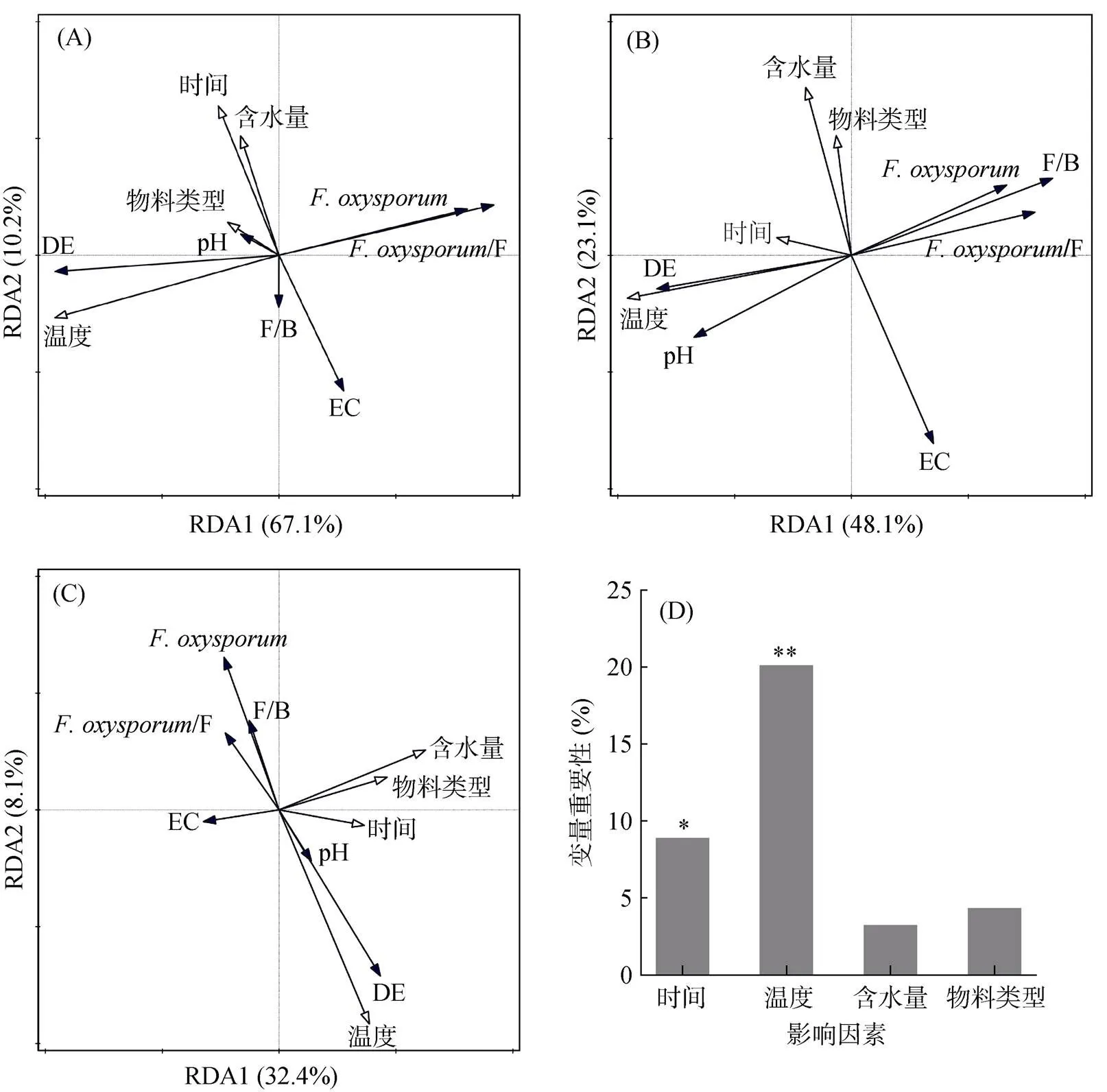
(图A为西瓜栽培土壤,图B为草莓栽培土壤,图C和图D均为西瓜和草莓栽培土壤。图中实心箭头代表RSD处理因素,空心箭头代表土壤理化性质和微生物学性质。“DE”表示对尖孢镰刀菌的杀菌效率,“F/B”表示真菌/细菌比,*、**表示在P<0.05、P<0.01水平影响显著)
土壤真菌/细菌比是衡量土壤健康的重要指标之一。已有研究表明,土壤连作后微生物区系由“细菌主导型”向“真菌主导型”转化,使病原菌更容易侵染植物而引发土传病害[6]。本研究中,RSD处理后土壤真菌/细菌比较CK显著降低,最低仅为CK的4.75%,这与Strauss等[29]的研究结果一致,即RSD处理能够重建健康的土壤微生物区系。此外,RSD处理温度越高,两种土壤中的细菌数量越多,真菌数量及真菌/细菌比越低,这可能是因为温度升高提高了土壤酶活性,加快了有机物的分解,从而进一步刺激细菌的繁殖[12]。西瓜栽培土壤的细菌数量在添加稻草+牛粪的RSD处理中高于仅添加稻草的处理,一方面可能是因为牛粪的C/N比更低,有利于刺激细菌的繁殖和提高它们的活性[30],另一方面可能与牛粪本身含有一定的微生物有关。此外,两种土壤中真菌/细菌比在时间和水分因素下的变化具有差异性,即最低真菌/细菌比的处理条件在两种土壤中并不一致,表明时间和水分条件与土壤类型对RSD处理后真菌/细菌比具有交互影响。
土壤病原菌的累积被认为是对作物可持续栽培的主要威胁,而RSD处理对病原菌的杀菌效率被认为是该方法取得有效性的关键指标[31]。在本试验中,两种土壤的尖孢镰刀菌数量经RSD处理4周后低于更长周期的处理,这可能与RSD处理前期碳源分解者能够快速分解物料中的易氧化有机碳和产生有机酸有关[16]。RSD处理对两种土壤的杀菌效率均随温度的上升而增加。在10℃条件下,土壤的尖孢镰刀菌数量经RSD处理后与CK相比差异不显著,这与Shennan等[32]研究结果一致,即温度低于15℃的RSD处理无法对病原菌进行有效的控制;而Yonemoto等[33]研究表明,在30℃条件下的RSD处理能够有效抑制土壤的尖孢镰刀菌。以上结果均表明温度对RSD杀菌效果具有重要作用。不同水分状况的RSD处理对两种土壤中尖孢镰刀菌的杀菌效果差异不显著,这与Wen等[18]的研究结果一致,即灌溉土壤至田间最大持水量,足以建立强烈的厌氧还原环境以减少土壤中病原菌数量。两种土壤的尖孢镰刀菌/真菌比在添加不同物料类型的RSD处理后均无显著性差异,表明物料类型对其影响较小。添加稻草+牛粪的RSD处理杀菌效果高于添加稻草的RSD处理,一方面是因为牛粪增加了梭菌科、瘤胃菌科和毛罗菌科等功能微生物的丰度[26];另一方面与添加牛粪的RSD处理过程中产生更多的氨气有关[29]。本研究还发现,添加稻草+铁粉的RSD处理对尖孢镰刀菌数量的影响与仅添加稻草的RSD处理无显著差异,这与Momma等[34]研究发现还原性Fe2+溶液中可以显著抑制土传病原菌不一致,仍有待进一步的研究。本研究冗余分析表明,仅温度与RSD处理的尖孢镰刀菌数量及其在真菌中的占比呈显著负相关关系,可能是因为高温降低了土壤中氧气的溶解度和增加了好氧微生物的耗氧量,进而增强了土壤的还原程度[35]。通过随机森林分析进一步发现,温度是RSD处理在不同土壤中有效杀灭病原菌最为主要的影响因子。然而,对于一些低温地区,如何通过调整各因子的结合获得有效的处理效果,有待进一步的研究。
4 结论
RSD处理能显著降低不同作物连作病土的EC和提高pH,同时有效降低真菌/细菌比、尖孢镰刀菌数量及其在真菌中的占比。相比于时间、物料类型以及土壤含水量,温度是影响不同土壤中RSD处理杀菌效果的主要共性因子。在40℃条件下持续3周的RSD处理,对两种土壤的尖孢镰刀菌杀灭效果最好;在高于10 ℃ 条件下持续3周的RSD处理可显著提高土壤pH;在淹水条件下土壤盐渍化的去除效果最佳。
[1] 蔡祖聪. 我国设施栽培养分管理中待解的科学和技术问题[J]. 土壤学报, 2019, 56(1): 36–43.
[2] Zhao J, Zhou X, Jiang A Q, et al. Distinct impacts of reductive soil disinfestation and chemical soil disinfestation on soil fungal communities and memberships[J]. Applied Microbiology and Biotechnology, 2018, 102(17): 7623–7634.
[3] 王广印, 郭卫丽, 陈碧华, 等. 河南省设施蔬菜连作障碍现状调查与分析[J]. 中国农学通报, 2016, 32(25): 27–33.
[4] McGovern R J. Management of tomato diseases caused by[J]. Crop Protection, 2015, 73: 78–92.
[5] 黄新琦, 温腾, 孟磊, 等. 土壤快速强烈还原对于尖孢镰刀菌的抑制作用[J]. 生态学报, 2014, 34(16): 4526–4534.
[6] 王宝英, 李金泽, 黄新琦, 等. 土壤强还原处理对连作芥蓝产量、微生物数量及活性的影响[J]. 土壤, 2019, 51(2): 316–323.
[7] 黄新琦, 蔡祖聪. 土壤微生物与作物土传病害控制[J]. 中国科学院院刊, 2017, 32(6): 593–600.
[8] Zhao J, Mei Z, Zhang X, et al. Suppression ofwilt of cucumber by ammonia gas fumigation via reduction ofpopulation in the field[J]. Scientific Reports, 2017, 7: 43103.
[9] Ouhaibi-Ben Abdeljalil N, Vallance J, Gerbore J, et al. Combining potential oomycete and bacterial biocontrol agents as a tool to fight tomatoroot rot[J]. Biological Control, 2021, 155: 104521.
[10] Blok W J, Lamers J G, Termorshuizen A J, et al. Control of soilborne plant pathogens by incorporating fresh organic amendments followed by tarping[J]. Phytopathology, 2000, 90(3): 253–259.
[11] 蔡祖聪, 张金波, 黄新琦, 等. 强还原土壤灭菌防控作物土传病的应用研究[J]. 土壤学报, 2015, 52(3): 469–476.
[12] Huang X Q, Wen T, Zhang J B, et al. Toxic organic acids produced in biological soil disinfestation mainly caused the suppression off.sp. cubense[J]. BioControl, 2015, 60(1): 113–124.
[13] Huang X Q, Wen T, Zhang J B, et al. Control of soil-borne pathogenby biological soil disinfestation with incorporation of various organic matters[J]. European Journal of Plant Pathology, 2015, 143(2): 223–235.
[14] Huang X Q, Liu L L, Wen T, et al. Changes in the soil microbial community after reductive soil disinfestation and cucumber seedling cultivation[J]. Applied Microbiology and Biotechnology, 2016, 100(12): 5581–5593.
[15] 李云龙, 王宝英, 常亚锋, 等. 土壤强还原处理对三七连作障碍因子及再植三七生长的影响[J]. 土壤学报, 2019, 56(3): 703–715.
[16] 刘亮亮, 周开胜, 黄新琦, 等. 低温茬口空闲期土壤强还原消毒对西瓜枯萎病的影响[J]. 应用生态学报, 2021, 32(8): 2967–2974.
[17] Shennan C, Muramoto J, Koike S, et al. Optimizing anaerobic soil disinfestation for non-fumigated strawberry production in California[J]. HortScience, 2010, 45: S270.
[18] Wen T, Huang X Q, Zhang J B, et al. Effects of biological soil disinfestation and water regime on suppressingroot rot pathogens[J]. Journal of Soils and Sediments, 2016, 16(1): 215–225.
[19] Dorsch M, Lane D, Stackebrandt E. Towards a phylogeny of the genusbased on 16S rRNA sequences[J]. International Journal of Systematic Bacteriology, 1992, 42(1): 58–63.
[20] Muyzer G, de Waal E C, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology, 1993, 59(3): 695–700.
[21] Durán P, Thiergart T, Garrido-Oter R, et al. Microbial interkingdom interactions in roots promotesurvival[J]. Cell, 2018, 175(4): 973–983.e14.
[22] Lievens B, Brouwer M, Vanachter A C R C, et al. Quantitative assessment of phytopathogenic fungi in various substrates using a DNA macroarray[J]. Environmental Microbiology, 2005, 7(11): 1698–1710.
[23] Zhang J, Wang P C, Tian H M, et al. Pyrosequencing-based assessment of soil microbial community structure and analysis of soil properties with vegetable planted at different years under greenhouse conditions[J]. Soil and Tillage Research, 2019, 187: 1–10.
[24] 朱同彬, 孙盼盼, 党琦, 等. 淹水添加有机物料改良退化设施蔬菜地土壤[J]. 土壤学报, 2014, 51(2): 335–341.
[25] 周开胜. 强还原处理改良西瓜连作土壤[J]. 浙江农业学报, 2017, 29(6): 982–987.
[26] Huang X Q, Liu L L, Zhao J, et al. The families Ruminococcaceae, Lachnospiraceae, and Clostridiaceae are the dominant bacterial groups during reductive soil disinfestation with incorporated plant residues[J]. Applied Soil Ecology, 2019, 135: 65–72.
[27] Momma N, Momma M, Kobara Y. Biological soil disinfestation using ethanol: Effect onf.sp. lycopersici and soil microorganisms[J]. Journal of General Plant Pathology, 2010, 76(5): 336–344.
[28] 朱文娟, 王小国. 强还原土壤灭菌研究进展[J]. 土壤, 2020, 52(2): 223–233.
[29] Strauss S L, Greenhut R F, McClean A E, et al. Effect of anaerobic soil disinfestation on the bacterial community and key soilborne phytopathogenic agents under walnut tree-crop nursery conditions[J]. Plant and Soil, 2017, 415(1/2): 493–506.
[30] Liu L L, Kong J J, Cui H L, et al. Relationships of decomposability and C/N ratio in different types of organic matter with suppression ofand microbial communities during reductive soil disinfestation[J]. Biological Control, 2016, 101: 103–113.
[31] 薛超, 黄启为, 凌宁, 等. 连作土壤微生物区系分析、调控及高通量研究方法[J]. 土壤学报, 2011, 48(3): 612–618.
[32] Shennan C, Muramoto J, Koike S, et al. Anaerobic soil disinfestation is an alternative to soil fumigation for control of some soilborne pathogens in strawberry production[J]. Plant Pathology, 2018, 67(1): 51–66.
[33] Yonemoto K, Hirota K, Mizuguchi et al. Utilization of sterilization by soil reduction in an open air field and its efficacy againstwilt of strawberry[J]. Proceedings of the Association for Plant Protection Shikoku, 2006(41): 15–24.
[34] Momma N, Kobara Y, Momma M. Fe2+and Mn2+, potential agents to induce suppression offor biological soil disinfestation[J]. Journal of General Plant Pathology, 2011, 77(6): 331–335.
[35] Stover R H. Flood-fallowing for eradication ofoxysporum f. cubense[J]. Soil Science, 1954, 77(5): 401–414.
Influencing Factors to Improvement Effect of Reductive Soil Disinfestation on Continuous Cropping Diseased Soil
YAN Yuanyuan1, ZHOU Kaisheng1,5,6, ZHANG Jinbo1,3,4, CAI Zucong1,3,4, HUANG Xinqi1,3,4, LIU Liangliang1,2*
(1 School of Geography Science, Nanjing Normal University, Nanjing 210023, China; 2 College of Life Science and Environmental Resources, Yichun University, Yichun, Jiangxi 336000, China; 3 Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, China; 4 Jiangsu Engineering Research Center for Soil Utilization & Sustainable Agriculture, Nanjing 210023, China; 5 School of Civil and Hydraulic Engineering, Bengbu University, Bengbu, Anhui 233030, China; 6 Anhui Province Key Lab of Farmland Ecological Conservation and Pollution Prevention, Bengbu, Anhui 233030, China)
In this study, the watermelon and strawberry continuous cropping soils were used to conduct various reductive soil disinfestation (RSD) treatments, involving different incubation time (3, 4, 5 and 7 weeks), temperature (10, 20, 30 and 40℃), irrigating conditions (80%, 100% of the maximum field capacity and flooding) and organic material types (straw, straw+crow dung and straw+iron powder). The common factors influencing the improvement effect of RSD on different soils were analyzed through redundancy analysis and random forest analysis. Results showed that the electrical conductivity,abundance, proportion of fungi/bacteria and/fungi in both soils could be effectively reduced by RSD treatments, and pH in both soils were significantly increased after all of RSD treatments. However, these values of above-mentioned soil properties after different RSD treatments showed significant differences. The overall ranges of soil pH, electrical conductivity, and disinfestation effect were 6.48–8.64, 0.15–0.22 mS/cm, and 0.6%–99.9%, respectively. RSD treatments significantly increased soil pH when the temperature was higher than 10 ℃ for 3 weeks. The best removal effect of RSD on soil salinization was found in the soil flooding condition, and the disinfestation effect ofwas more than 99.7% in both RSD-treated soils at 40 ℃. Correlation analyses further revealed that the temperature was significantly correlated with pH and microbial properties in both soils after RSD treatments. Moreover, the contributions of the factors to the RSD disinfestation effects in both soils were ranked as follows: temperature > time > organic material > water content. In conclusion, our study shows that temperature is the most important factor affecting the RSD effects in different soil types.
Reductive soil disinfestation;; Disinfestation effect; Common factor; Facility cultivation
S154.3
A
10.13758/j.cnki.tr.2022.03.010
闫元元, 周开胜, 张金波, 等. 强还原土壤灭菌处理对连作病土改良效果的影响因素. 土壤, 2022, 54(3): 508–516.
国家自然科学基金项目(32160748,42090065)、中国博士后科学基金面上项目(2021M691625)和农田生态保育与污染防控安徽省重点实验室开放基金项目(FECPP201901)资助。
(190030@jxycu.edu.cn)
闫元元(1996—),男,河南新蔡人,硕士研究生,主要从事土壤微生物及土传病害生物防控等方面的研究。E-mail: yyy18336222721@163.com

