降解多菌灵和啶虫脒残留的复合菌剂研发及初步应用①
李锦涛,杨 涵,陈 洋,焦 宸,汤浩宇,何 健,黄 星
降解多菌灵和啶虫脒残留的复合菌剂研发及初步应用①
李锦涛,杨 涵,陈 洋,焦 宸,汤浩宇,何 健,黄 星*
(南京农业大学生命科学学院,南京 210095)
针对菜田土壤中多菌灵和啶虫脒的残留问题,以多菌灵降解菌株djl-6和啶虫脒降解菌株D-2作为材料,进行降解菌剂的复配,研究了使用复合降解菌剂对复合农药残留土壤的修复效果及微生态效应。研究结果表明:①复配降解菌株djl-6与D-2的最适体积比为5∶3,复合降解菌剂在3 d内对无机盐培养基中50 μg/ml的多菌灵降解率为87.14%,对50 μg/ml的啶虫脒降解率为96.10%。②初始接种量为7% 时,复合降解菌剂可在6 d内将复合农药污染土壤中5 mg/kg多菌灵降解74.40%,将5 mg/kg啶虫脒降解95.87%。土壤含水率为25% 时,复合降解菌剂对复合农药污染土壤中5 mg/kg多菌灵的降解率为80.80%,对5 mg/kg啶虫脒的降解率为97.87%。③复合农药污染土壤中10 mg/kg多菌灵和10 mg/kg啶虫脒即可对小青菜的生长产生明显的药害,小青菜生长24 d时根长仅为空白对照的66.56%、茎叶长为58.35%、鲜重为45.13%。在7% 的接种量条件下,复合降解菌剂可解除药害,使小青菜的生长指标恢复至对照水平。④多菌灵和啶虫脒残留造成土壤细菌群落的Observed species指数、Shannon指数、Chao1指数和ACE指数降低,均与浓度呈正相关,接入复合降解菌剂后各指数均提高。可见,该复合降解菌剂具有较好的应用前景。
多菌灵降解菌djl-6;啶虫脒降解菌D-2;复合降解菌剂
设施栽培是提高蔬菜产量的有效途径,可以解决我国蔬菜淡季的短缺问题,但因其种植密度高、湿度大、温度高等特点,致使病虫害多发,导致农药的使用频次高,施用量大[1-2]。大量农药残留沉积在土壤中会破坏微生物的生存环境,降低土壤中微生物的总量,折损土壤的肥力[3-4]。杀菌剂多菌灵和啶虫脒因其高效低毒的特点,被广泛应用于设施农业中,但同样也面临着严重的残留问题亟待解决,土壤中多菌灵和啶虫脒残留主要的降解途径是微生物代谢[5-7]。
以高效降解菌株为材料,开发微生物菌剂用于修复农药残留污染是一种公认安全有效的方法[8-10]。菜地土壤农药残留量大、残留种类多,针对该问题组合不同功能的菌株,功能互补,优化得到比单一菌株降解效果更好、更稳定的微生物复合菌剂成为目前主要的研究和应用方向[11-13]。研究表明,微生物菌剂施用得当可以改善土壤的理化性质,增加细菌群落丰富度和多样性[14]。
本研究以实验室保藏的多菌灵降解菌株djl-6和啶虫脒降解菌株D-2为材料[15],进行降解菌剂的复配,确定复合降解菌剂的最适配比,并在此基础上分别探究接种量及土壤含水率对复合降解菌剂降解效果的影响,以及复合降解菌剂对复合农药残留土壤的修复效果及其微生态效应,以期为菜地多菌灵和啶虫脒土壤污染修复提供修复制剂及理论依据。
1 材料与方法
1.1 试验试剂及培养基
啶虫脒(纯度98.3%)原药购自绿源制药,多菌灵(纯度99.8%)原药购自江苏新沂农药厂。无机盐培养基:硝酸铵 1.0 g/L,磷酸二氢钾0.5 g/L,磷酸氢二钾 1.5 g/L,氯化钠1.0 g/L,七水硫酸镁 0.2 g/L,pH 7.0。LB培养基:酵母浸出物5.0 g/L,蛋白胨10.0 g/L,NaCl 5.0 g/L,pH 7.0。D-2发酵培养基:葡萄糖9 g/L,硫酸铵0.9 g/L,酵母膏0.3 g/L,氯化钠0.1 g/L,碳酸钙1 g/L,磷酸氢二钾1 g/L,七水硫酸镁0.5 g/L,pH 7.0 ~ 7.2。djl-6发酵培养基:葡萄糖8 g/L,硫酸铵0.8 g/L,酵母膏0.2 g/L,氯化钠0.1 g/L,碳酸钙0.5 g/L,磷酸氢二钾1.5 g/L,七水硫酸镁0.1 g/L,pH 7.0 ~ 7.2。
1.2 供试菌株、作物与土壤
供试多菌灵降解菌株djl-6和啶虫脒降解菌株D-2,由本实验室分离并保藏;供试作物选用上海青,购自南阳青青种业;供试土壤为黄棕壤,采集于南京农业大学牌楼实验基地。供试土壤基本理化性质:pH 6.91,全氮 0.85 g/kg,全磷 0.32 g/kg,全钾 1.41 g/kg,有机质15.12 g/kg。
1.3 培养基中降解菌的最适接种量及复配比例确定
分别挑取菌株djl-6和菌株D-2的单菌落于液体LB培养基试管中,置于30℃摇床以160 r/min培养至菌株对数生长期。按照1% 的接种量将菌株分别接入装有1 000 ml各自发酵培养基的三角瓶中,培养至菌株对数生长期,使用无菌水进行重悬至OD600约0.8左右(活菌数大约108cfu/ml)。将菌株djl-6的发酵液以0.5%、1%、3%、5%、7% 的接种量分别加入到多菌灵浓度为50 mg/L的100 ml无机盐培养基中,30℃、160 r/min培养,于72 h时取样,通过高效液相色谱(HPLC)测定样品中多菌灵的浓度,并计算降解率。同时,将菌株D-2的发酵液以0.5%、1%、3%、5%、7% 的接种量分别加入到啶虫脒浓度为50 mg/L的100 ml无机盐培养基中,30℃、160 r/min培养,于72 h时取样,通过高效液相色谱法测定样品中啶虫脒的浓度,并计算降解率。由上述试验分别确定菌剂djl-6和菌剂D-2的最适接种量,以接种量比例(体积比)将菌株djl-6的发酵液和菌株D-2的发酵液混合接种到多菌灵和啶虫脒浓度均为50 mg/L的100 ml无机盐培养基中,30℃、160 r/min培养,于72 h时取样,通过HPLC测定样品中多菌灵和啶虫脒的浓度,并计算降解率。
1.4 多菌灵和啶虫脒的提取及HPLC检测条件
多菌灵和啶虫脒的提取:在待测样品中加入等体积的二氯甲烷充分振荡萃取,去除上层废液,下层有机相加入适量无水硫酸钠后,取1.5 ml于离心管中置于通风橱中吹干,待挥发完全后加入300 μl甲醇(色谱纯)溶解,经有机相滤器(孔径为0.22 μm)过滤后,用HPLC测定样品中多菌灵和啶虫脒的含量。
HPLC检测条件:仪器型号为Dionex UltiMate 3000,色谱柱为C18反相色谱柱,规格为250 mm× 4.6 mm×5 μm,流动相为甲醇∶水(60∶40,/),柱温为40℃,流速1.0 ml/min,进样量为20 μl,多菌灵检测波长为240 nm和280 nm,啶虫脒检测波长为235 nm和260 nm。
1.5 接种量对土壤中复合降解菌剂降解效果的影响
向供试土壤中同时加入多菌灵和啶虫脒的水溶液,充分搅拌均匀,使土壤中多菌灵和啶虫脒最终浓度为5 mg/kg。按1%、3%、5%、7% 和9% 的接种量将复合降解菌剂接入含100 g土壤的避光塑料杯中,调节土壤含水率为20%,以不加菌剂的土壤为对照组,每个处理设3个重复,并置于光照培养箱(26 ℃、16 h光照和20℃、8 h黑暗为一个周期)中培养。培养过程中,每天进行称重,通过补水来保持土壤的含水率,并且每3 d取一次土样,使用HPLC检测多菌灵和啶虫脒的浓度,并计算其降解率。
1.6 土壤含水率对复合降解菌剂降解效果的影响
将复合降解菌剂以1.5节中确定的最适接种量接种至含土壤100 g的避光塑料杯中,调节土壤含水率为10%、15%、20%、25% 和30%,每个处理3个重复,置于光照培养箱(26℃、16 h光照和20℃、8 h黑暗为一个周期)中培养。培养过程中,每天进行称重,通过补水来保持土壤的含水率,并且每3 d取一次土样,使用HPLC检测多菌灵和啶虫脒的浓度,并计算其降解率。
1.7 复合降解菌剂对小青菜生长的修复与促进作用
设置土壤中复合农药残留浓度分别为10 mg/kg (多菌灵和啶虫脒浓度均为10 mg/kg)和50 mg/kg(多菌灵和啶虫脒浓度均为50 mg/kg),复合降解菌剂的接种量为7%,进行以下6组处理:空白对照组(CK)、添加复合降解菌剂(J)、添加复合农药残留10 mg/kg (Y)、添加复合农药残留10 mg/kg和复合降解菌剂(JY)、添加复合农药残留50 mg/kg(Y5)、添加复合农药残留50 mg/kg和复合降解菌剂(JY5),每个处理3个重复。供试小青菜种子消毒、萌发后,播种在盆钵中,在南京农业大学温室中进行试验。在24 d时取样,对各处理盆钵中的小青菜随机取样,对茎叶长度、根系长度和鲜重等指标进行测量。
1.8 复合降解菌剂对复合农药残留污染土壤修复的微生态效应
作物根际微生物对植物的生长和群落演替起重要的作用,根际土壤中微生物的群落结构对于了解添加农药残留和添加外源微生物对环境的影响具有重要意义。本试验分别对1.7节中6组处理的小青菜根际土(24 d时)进行测序分析(北京诺禾致源科技股份有限公司)。包括对有效数据进行OTU(operational taxonomic units)物种分类分析,根据OTU分析结果,对每个OTU做物种注释,得到对应的物种信息和基于物种的丰度分布情况;对OTUs进行丰度、Alpha多样性分析,得到样品均匀度、物种丰富度、组内和组间样品多样性差异等信息。
1.9 数据处理与分析
利用Microsoft Excel™软件进行数据处理,采用IBM SPSS statistical Ver. 25.0 software进行方差分析。将IonS5TMXL下机数据根据barcode序列区分为各个样本的数据,然后进行嵌合体过滤,得到可用于后续分析的有效数据。对所有样本的Effective Tags以97% 的一致性(Identity)进行OTU聚类,用Mothur方法与SILVA132的SSUrRNA数据库进行物种注释分析,获得物种分类学信息并分别在门水平和属水平统计各样本的群落组成。使用Qiime软件(Version 1.9.1)计算Alpha多样性指数,包括Observed species指数、Chao1 指数、Shannon指数和ACE指数。
2 结果与分析
2.1 培养基中降解菌的最适接种量及复配比例
由图1可知,接种量为5% 时,菌剂djl-6能够在72 h内降解88.00% 无机盐培养基中浓度为50 mg/L的多菌灵。接种量为3% 时,菌剂D-2能够在72 h内降解96.89% 无机盐培养基中浓度为50 mg/L的啶虫脒。将菌剂djl-6的发酵液和菌剂D-2的发酵液以体积比为5∶3混合制成复合降解菌剂,以7% 的接种量接入啶虫脒与多菌灵的浓度均为50 mg/L的无机盐液体培养基中,在72 h内多菌灵的降解率达到87.14%,啶虫脒的降解率达到96.10%。
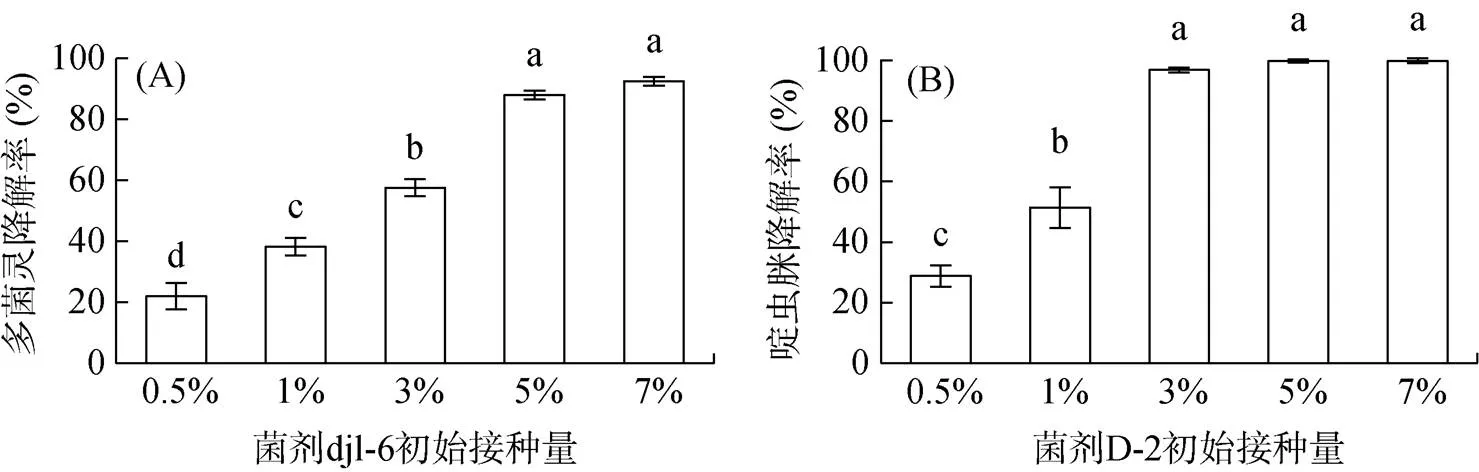
(图中小写字母不同表示处理间差异显著(P<0.05))
2.2 接种量对土壤中复合降解菌剂降解效果的影响
由图2可知,较高的接种量更有利于复合降解菌剂对多菌灵和啶虫脒的降解。多菌灵和啶虫脒的降解率和复合降解菌剂的起始接种量呈正相关。在光照培养箱中连续培养时,接种量越大,起始降解率越高;当接种量大于7% 时,受底物浓度的限制,降解效果基本一致。在培养6 d时,以7%、9% 的接种量接入复合降解菌剂的试验组对5 mg/kg啶虫脒的降解率已经接近最高值;在培养9 d时,除了接种量为1% 的试验组,其余试验组对5 mg/kg多菌灵的降解率均已达到最高值。

图2 复合菌剂不同接种量对复合农药降解的影响
2.3 土壤含水率对复合降解菌剂降解效果的影响
图3的结果表明,较高的土壤含水率更有利于复合降解菌剂对多菌灵和啶虫脒的降解。多菌灵和啶虫脒的降解率与土壤含水率呈正相关。在光照培养箱中连续培养时,土壤含水率越大,起始降解率越高。在培养12 d时,土壤含水率大于25% 时,多菌灵的降解率达94.71%,同时趋于稳定;土壤含水率为20% 时,啶虫脒的降解率基本达到最高;土壤含水率低于25% 时,复合降解菌剂对啶虫脒的降解效果优于对多菌灵的降解效果。
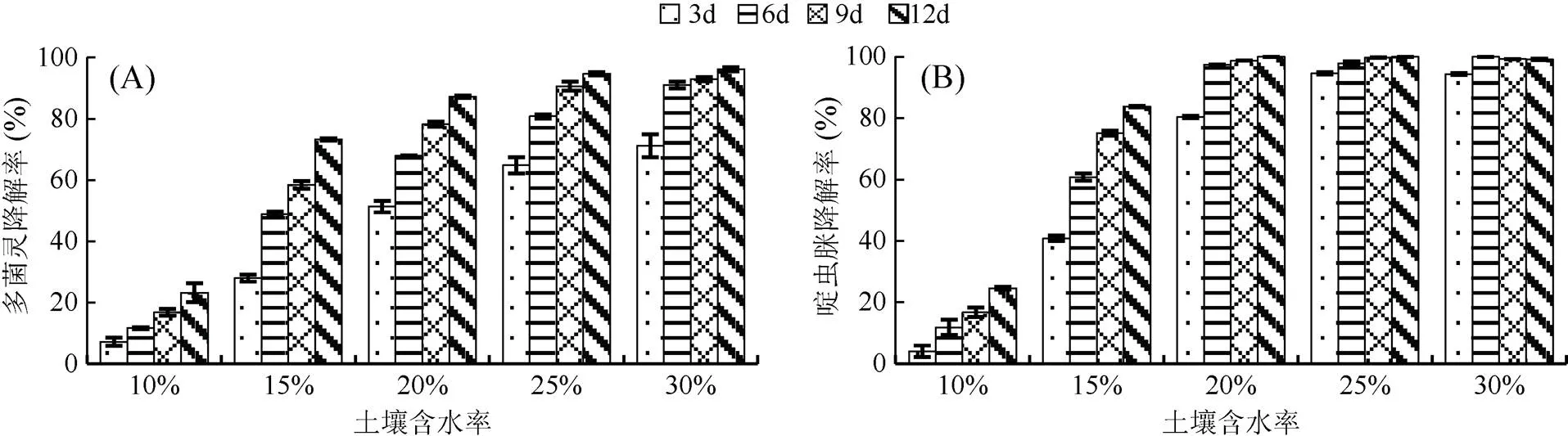
图3 土壤含水率对复合降解菌剂降解复合农药的影响
2.4 不同处理条件下小青菜的生长情况
由表1可知,多菌灵和啶虫脒的复合农药残留对小青菜的生长产生明显的药害且与浓度呈正相关,导致小青菜的根系长度、茎叶长度和鲜物质量的生理指标都远低于CK,添加50 mg/kg复合农药残留处理(Y5)的小青菜根长仅为CK的30.10%、茎叶长仅为CK的43.30%,鲜物质量仅为CK的31.94%。复合降解菌剂可以有效降解多菌灵和啶虫脒复合农药残留,修复复合农药残留对小青菜产生的药害,添加10 mg/kg复合农药残留和复合降解菌剂处理(JY)的小青菜生长指标基本达到CK水平,添加50 mg/kg复合农药残留和复合降解菌剂处理(JY5)的小青菜各生长指标相较于Y5处理提高1倍以上。
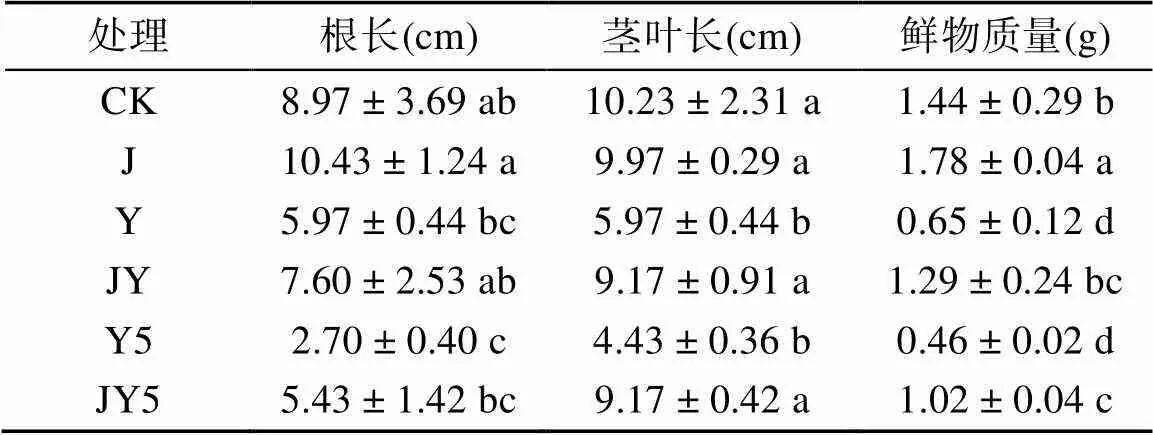
表1 不同处理条件下小青菜的生长指标
注:表中数据后小写字母不同表示处理间差异显著(<0.05)。
2.5 复合降解菌剂对复合农药残留污染土壤修复的微生态效应
本试验通过IonS5TMXL 平台对各处理样本中的16S V3 ~ V4 区域进行PCR 扩增和测序,下机数据根据barcode 序列对各个样本数据进行区分、过滤,获得有效数据。对不同样本在97% 一致性阈值下的Alpha 多样性进行统计(均一化时选取的数据量:cutoff=28 239)。
Alpha多样性主要关注的是单个样本下物种的多样性,也被称为生境内的多样性,是反映丰富度和多样性的综合指标。Chao1指数和ACE指数用来反映群落的丰富度,即样本中所含OUT数目,指数越大,群落丰富度越高。Shannon指数用来反映群落的多样性,即群落中个体分配上的均匀性,其中Shannon值越大,说明群落多样性越高。Observed species指数代表OTU的直观数量统计,表示该样品中含有的物种数目。Good coverage指数是反映测序深度的指标,其值越接近于1,说明测序深度越合理,即该深度已经基本覆盖到样品中所有的物种;反之,测序深度不高,许多物种仅被测到了一次,暗示着很多低丰度物种可能尚未被测序测到。由表2可知,各处理样品Good coverage指数均大于0.95,本试验测序深度合理,基本覆盖到样品中所有的物种。相较于CK,不同处理的Observed species指数、Shannon指数、Chao1指数和ACE指数的变化具有一致性。在添加复合降解菌剂处理中,各指数均显著高于CK。添加复合农药的各处理相比于CK均降低,且复合农药的浓度越高抑制作用越明显。JY处理与CK基本持平,而JY5处理则低于CK,但也高于Y5处理。综上,复合农药残留对土壤群落的物种数目、丰富度和多样性具有抑制作用且与浓度呈正相关,而接入复合降解菌剂能够在很大程度上减轻抑制作用,使其恢复至正常状态。

表2 不同处理条件下根际土壤中细菌的Alpha多样性指数
各处理土壤中细菌在门水平物种相对丰度如图4所示,由高到低分别是Proteobacteria(变形菌门)、Actinobacteria(放线菌门)、Acidobacteria(酸杆菌门)、Bacteroidetes(拟杆菌门)、Gemmatimonadetes(芽单胞菌门)、Firmicutes(厚壁菌门)。相较CK,Proteobacteria相对丰度在其他处理中均降低,但在添加复合农药残留的处理中尤为明显。Actinobacteria相对丰度在各个处理中基本保持稳定。Acidobacteria相对丰度在所有添加复合农药残留的处理中均表现为升高。Bacteroidetes相对丰度在添加10 mg/kg和50 mg/kg复合农药残留处理中呈现显著提高。CK处理中(红球菌属)相对丰度为0.085%、(嗜染料菌属)相对丰度为0.004%,接入复合降解菌剂处理中相对丰度为7.822%、相对丰度为1.286%。
3 讨论
微生物复合菌剂相较于单一菌剂有明显优势,竞争力较强,接种后可迅速成为优势菌群,提高对目标污染物的降解能力[16]。复合菌剂的制备需要充分了解菌株的生物学特性,将菌种进行科学、合理的复配,发挥复合菌剂菌群间的互惠、协同、共生等作用,以避免竞争或拮抗的发生[17]。本试验先分别确定培养基中菌剂djl-6和菌剂D-2的最适接种量,以接种量体积比配置复合菌剂再加以验证,最终确定复合菌剂的复配比例为体积比5∶3。复合降解菌剂可在3 d内将无机盐培养基中复合农药残留中的50 mg/kg的多菌灵降解87.14%,将50 mg/kg的啶虫脒降解96.10%。可见,复合降解菌剂对复合农药残留的降解效果达到了单一菌剂的水平,满足开展后续试验的条件。
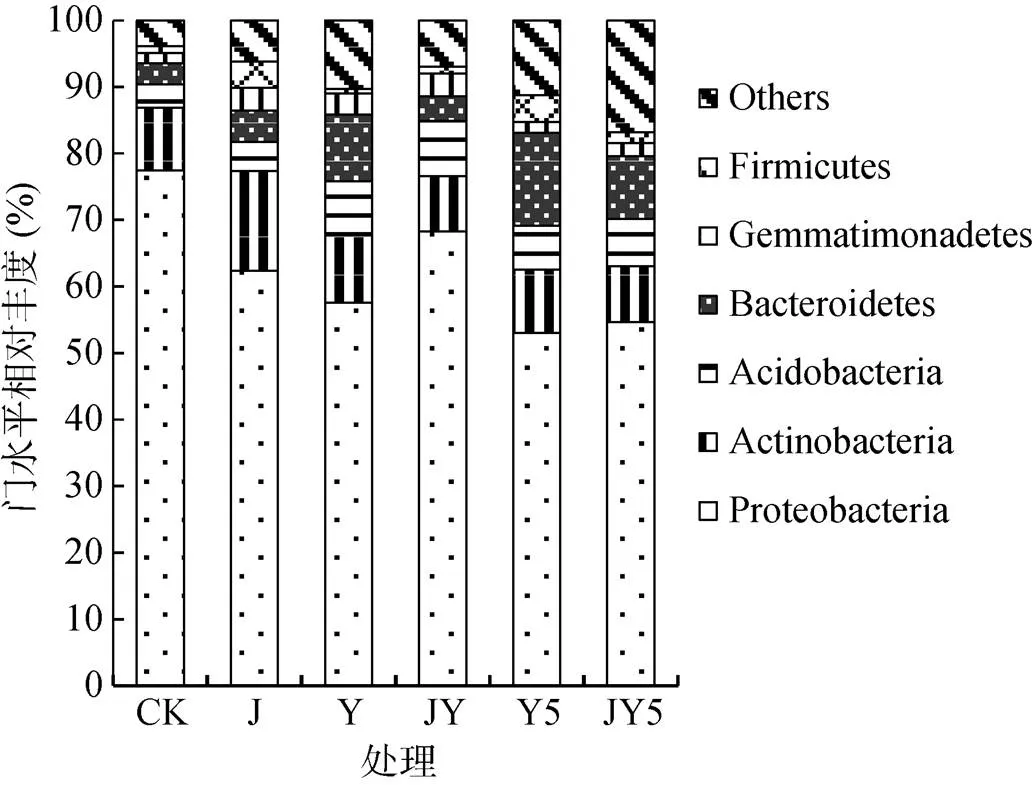
图4 不同处理条件下细菌门水平相对丰度
本试验结果表明,多菌灵和啶虫脒的降解率与复合降解菌剂的起始接种量和土壤含水率呈正相关,当接种量大于7% 或含水率高于25% 时,受底物浓度限制,降解效果基本一致。同时土壤含水率低于25% 时,复合降解菌剂对啶虫脒的降解效果优于对多菌灵的降解效果。研究表明,土壤含水率对多菌灵和啶虫脒的降解具有不同的影响,在一定的土壤含水率范围内,随着含水率升高,多菌灵在土壤中的降解速度加快,而土壤湿度为20% 和80% 时,啶虫脒降解速率无明显差异[18-19]。复合降解菌剂的接种量是田间施用时的重要指标,接种量过小会导致菌株生长延滞期延长,降解效果差。而接种量过大一方面增加生产成本造成浪费,另一方面可能影响土壤菌群群落结构,消耗营养物质而降低土壤肥力[20]。综合考量复合降解菌剂的降解效果、田间的环境条件以及在实际应用的经济效益,本研究认为7% 为复合降解菌剂的最佳接种量,同时在复合降解菌剂施用期间应保持土壤含水率不低于25%。
本试验结果表明,复合降解菌剂可以有效降解多菌灵和啶虫脒复合农药残留,修复复合农药残留对小青菜产生的药害,添加10 mg/kg复合农药残留和复合降解菌剂处理组小青菜的生长指标基本达到对照组水平,添加50 mg/kg复合农药残留和复合降解菌剂处理组的小青菜各生长指标相较于添加50 mg/kg复合农药残留处理均大幅提高。土壤的生物肥力指土壤中的微生物等有机体为作物生长发育所需的营养和理化条件做出的贡献,长期大量施用农药会对土壤肥力产生损害,施用微生物菌剂是维持和提高土壤肥力的有效手段[21]。
微生物种群的多样性和丰富度是其实现土壤物质循环和养分转化等功能的基础,也是维持土壤肥力的保障。研究表明,土壤微生物量与土壤的肥力状况存在显著相关性[22],土壤微生物群落丰富度和多样性对农业生产中作物的抗病性起到重要作用[23]。微生物菌剂的施用会在一定程度上提高土壤细菌种群多样性,丰富细菌群落结构[24]。本试验结果表明,复合农药残留对土壤群落的物种数目、丰富度和多样性具有显著的抑制作用且与农药残留的浓度呈正相关,而接入复合降解菌剂不仅能够使其恢复至正常状态,且有明显的促进作用。本试验结果表明,Proteobacteria(变形菌门)相对丰度在所有处理中均降低,但在添加复合农药残留的处理中尤为明显,推测可能的原因是复合降解菌剂接种后与其产生竞争作用,同时复合农药残留对Proteobacteria也有一定的抑制效果。Acidobacteria(酸杆菌门)和Bacteroidetes (拟杆菌门)相对丰度在添加10 mg/kg和50 mg/kg复合农药残留处理中呈现显著提高。
本研究提供了一种降解能力可靠、具备实际开发价值的复合农药残留降解菌剂,为复合农药残留的降解以及复合降解菌剂的应用提供了理论基础。但是也存在一定的局限性,如未开展田间试验,同时复合菌剂菌群与土壤菌群间的互作及其在根际土壤的定殖还有待进一步的研究。
4 结论
复合降解菌剂中菌株djl-6与D-2的最适体积比为5∶3,其在3 d内对无机盐培养基中50 μg/ml的多菌灵降解率为87.14%,对50 μg/ml的啶虫脒降解率为96.10%。复合降解菌剂的最佳接种量为7%,菌剂施用期间土壤含水率应保持在25% 以上。复合降解菌剂可有效修复多菌灵和啶虫脒残留对小青菜的药害,同时对小青菜有显著的促生作用。施加复合降解菌剂可有效提高土壤微生物种群的多样性和丰富度,进而提高土壤的肥力。
[1] 周建斌, 翟丙年, 陈竹君, 等. 设施栽培菜地土壤养分的空间累积及其潜在的环境效应[J]. 农业环境科学学报, 2004, 23(2): 332–335.
[2] 骆飞, 徐海斌, 左志宇, 等. 我国设施农业发展现状、存在不足及对策[J]. 江苏农业科学, 2020, 48(10): 57–62.
[3] 陆涛, 李燕, 傅正伟, 等. 农药对根际微生物群落的影响及潜在风险[J]. 农药学学报, 2019, 21(S1): 865–870.
[4] Ataikiru T L, Okpokwasili G S C, Okerentugba P O. Impact of pesticides on microbial diversity and enzymes in soil[J]. South Asian Journal of Research in Microbiology, 2019: 1–16.
[5] 周威. 多菌灵、百菌清、毒死蜱在大棚和露地蔬菜及其土壤中的残留特征[D]. 杭州: 浙江大学, 2013.
[6] 游子涵, 陈智东, 柳训才, 等. 油菜植株及其土壤中多菌灵残留检测及动态[J]. 农药, 2006, 45(8): 552–553.
[7] 丁悦, 孙星, 汪佳蕾, 等. 露地和大棚条件下啶虫脒在黄瓜和土壤中的残留及消解动态[J]. 农药学学报, 2014, 16(1): 110–114.
[8] 陈冬梅, 关俊杰, 张桂柯, 等. 农药的微生物降解研究现状[J]. 河南科技学院学报(自然科学版), 2020, 48(5): 39–46.
[9] Ye X L, Dong F, Lei X Y. Microbial resources and ecology- microbial degradation of pesticides[J]. Natural Resources Conservation and Research, 2018, 1(1): 22–28.
[10] 苑伟伟, 赵阳国, 井永苹, 等. 一种高效解磷复合菌剂的筛选与应用[J]. 山东农业科学, 2016, 48(12): 86–90.
[11] 邵波, 刘勇, 李鑫, 等. 长三角地区土壤中有机氯农药残留量及其分布特征[J]. 环境化学, 2018, 37(4): 824–835.
[12] Baez-Rogelio A, Morales-García Y E, Quintero-Hernández V, et al. Next generation of microbial inoculants for agriculture and bioremediation[J]. Microbial Biotechnology, 2017, 10(1): 19–21.
[13] Zhao K N, Xu R, Zhang Y, et al. Development of a novel compound microbial agent for degradation of kitchen waste[J]. Brazilian Journal of Microbiology, 2017, 48(3): 442–450.
[14] 桂莎, 刘芳, 张立丹, 等. 复合菌剂防控香蕉枯萎病的效果及其微生物学机制[J]. 土壤学报, 2020, 57(4): 995–1007.
[15] 徐铭阳, 卢家森, 孟献雨, 等. 多菌灵降解菌djl-6和啶虫脒降解菌D-2固体菌剂的研发[J]. 土壤, 2021, 53(2): 329–335.
[16] 唐志远, 王雪玲, 刘可星. 高效油脂降解的复合菌剂构建及降解性能优化[J]. 江苏农业科学, 2020, 48(7): 269–272.
[17] 李俊, 姜昕, 李力, 等. 微生物肥料的发展与土壤生物肥力的维持[J]. 中国土壤与肥料, 2006(4): 1–5.
[18] 赵思崎, 王敬敬, 杨宗政, 等. 微生物复合菌剂的制备[J]. 微生物学通报, 2020, 47(5): 1492–1502.
[19] 肖文丹, 杨肖娥, 李廷强. 多菌灵在农田土壤中的降解及其影响因子研究[J]. 环境科学, 2012, 33(11): 3983–3989.
[20] 母昌立, 余向阳, 刘贤进. 环境条件对土壤中啶虫脒降解的影响[J]. 农药, 2011, 50(5): 355–358, 364.
[21] 张安龙, 王晔, 王雪青, 等. 一株高效苯酚降解真菌的分离鉴定及其菌剂的制备[J]. 微生物学通报, 2018, 45(7): 1450–1461.
[22] 刘健, 李俊, 葛诚. 微生物肥料作用机理的研究新进展[J]. 微生物学杂志, 2001, 21(1): 33–36, 46.
[23] 徐阳春, 沈其荣, 冉炜. 长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响[J]. 土壤学报, 2002, 39(1): 83–90.
[24] van Elsas J D, Garbeva P, Salles J. Effects of agronomical measures on the microbial diversity of soils as related to the suppression of soil-borne plant pathogens[J]. Biodegradation, 2002, 13(1): 29–40.
[25] 王超, 李刚, 黄思杰, 等. 枯草芽胞杆菌菌肥对有机冬瓜根区土壤微生态的影响[J]. 微生物学通报, 2019, 46(3): 563–576.
Development and Preliminary Application of Compound Bacterial Agent for Degrading Carbendazim and Acetamiprid Residues
LI Jintao, YANG Han, CHEN Yang, JIAO Chen, TANG Haoyu, HE Jian, HUANG Xing*
(College of Life Science, Nanjing Agricultural University, Nanjing 210095, China)
In order to solve carbendazim and acetamiprid residues in vegetable soil, carbendazim degradation straindjl-6 and acetamiprid degradation strainD-2 were used as materials to study the remediation effect and microecological effect of compound degradation bacteria on compound pesticide residue soil. The results show that:1) The optimum volume ratio of compound degradation strain djl-6︰D-2 is 5︰3, and the degradation rates of carbendazim and acetamiprid are 85.46% and 94.36% for 50 μg/ml respectively within 3 days. 2) When the initial inoculation amount is 7%, the degradation rates of 5 mg/kg carbendazim and acetamiprid in compound pesticide contaminated soil are 74.40% and 95.87% respectively within 6 days. When soil water content is 25%, the degradation rates of 5 mg/kg carbendazim and 5 mg/kg acetamiprid in soil contaminated by compound pesticides are 80.80% and 97.87%, respectively. 3) Soil contaminated by 10 mg/kg carbendazim and 10 mg/kg acetamiprid (compound pesticides) cause obvious drug damage to the growth of green vegetables. After growing for 24 days, the root length, stem and leaf length and fresh weight of green vegetables are only 66.56%, 58.35% and 45.13% of those of the blank control. Under the condition of 7% inoculation, the compound degradation bacteria can relieve the drug damage, and the growth index of green vegetables is consistent with that of the control. 4) Carbendazim and acetamiprid residues have significant inhibitory effects on Observed species index, Shannon index, Chao1 index and ACE index of soil bacterial community, which are positively correlated with the concentrations of carbendazim and acetamiprid. In conclusion, the compound degradation bacterial agent has a broad application prospect.
Carbendazim-degrading strain djl-6; Acetamiprid-degrading strain D-2; Compound degradation agents
X172
A
10.13758/j.cnki.tr.2022.03.027
李锦涛, 杨涵, 陈洋, 等. 降解多菌灵和啶虫脒残留的复合菌剂研发及初步应用. 土壤, 2022, 54(3): 646–652.
中央高校基本科研业务费项目 (KYZZ2022001)和江苏省农业科技自主创新资金项目(CX(18)1005)资助。
(huangxing@njau.edu.cn)
李锦涛(1998—),男,安徽阜阳人,硕士研究生,主要从事环境微生物学研究。E-mail: 2020816122@stu.njau.edu.cn

