青藏高原三江源区不同恢复期高寒草甸土壤线虫群落演变①
吴雨薇,罗 珊,拉 琼,吴纪华, *
青藏高原三江源区不同恢复期高寒草甸土壤线虫群落演变①
吴雨薇1,罗 珊2,拉 琼3,吴纪华1,3 *
(1 复旦大学生物多样性科学研究所,生物多样性和生态工程教育部重点实验室,上海 200438;2 Lancaster Environment Centre, Lancaster University, Lancaster, United Kingdom, LA1 4YW;3 西藏大学理学院生态学研究中心,西藏大学和复旦大学生物多样性与全球变化联合实验室,拉萨 850000)
青藏高原三江源地区的高寒草甸面临着严峻的退化问题,人工建植是三江源地区退化草地的重要修复方式。为探究地下生物对草地人工恢复措施的响应,本研究比较了三江源地区高寒草甸不同恢复期人工草地(建植1、5和10 a)的土壤线虫群落变化。结果显示:与原生植被样地相比,所有恢复期样地的植物地下生物量降低,土壤容重、pH、全磷、全钾和硝态氮含量升高,表明人工草地系统的初级生产力和土壤特性尚未恢复到原生草地状态。不同恢复期样地中土壤线虫的均匀度和多样性指数均显著高于原生植被样地。此外,不同恢复期样地的线虫多度、代谢足迹以及成熟度指数均随恢复年限的增加而增加。相关性分析结果表明,土壤线虫多度与植物地下生物量、土壤有机质、全氮、全磷、矿质氮和速效氮含量显著正相关(<0.05),与土壤pH、全钾和容重显著负相关(<0.05)。尽管三江源区退化草地的人工恢复措施尚未完全恢复牧草生产力至原生植被状态,但土壤生物结构及功能具有改善的趋势,显示该地区退化草地生态系统具有较强的恢复潜力。
草地退化;草地恢复;高寒草甸;土壤线虫;人工建植
在中国,近40年来由于过度放牧导致天然草地的面积逐渐减少。全国近90% 的草地出现了不同程度的退化现象,其中严重退化草地占退化草地面积约60%[1]。青藏高原是我国生态环境最为脆弱敏感的地区,在人为干扰和全球变化的影响下,其草地退化严重,物种多样性锐减,生态系统功能丧失。人工建植草地是该地区重要的草地修复方式,其中灭鼠、翻耕、播种、施肥和围封等综合措施,已被广泛用于退化草地的修复[2]。三江源地区位于青藏高原腹地,拥有我国设立的第一个国家公园,在生态文明建设中占据着极其重要的地位[3]。人类活动导致三江源高寒草甸生态系统的不断退化,同时也正在开展人工生态修复。
大量研究表明,三江源区人工草地的建植措施会导致生态系统植物地上部特性的改变,如改变植被盖度、植物多样性及植物群落结构等[4]。近年来,随着关于植物地上部与土壤生物之间联系的研究增加,人们更多地认识到地下生态系统对于生态过程的重要性[5-6]。土壤生物与植物生长、有机质分解、碳存储、养分循环、土壤呼吸、团聚体形成等土壤生态系统过程具有密切联系[6],影响着生态系统修复的成效。此外,有研究表明,在不同的恢复时间梯度下,地上与地下多个组分的恢复进程可能是不同步的[7-8]。但是,以往关于地下部分的研究主要集中在人工恢复措施对土壤理化性质及土壤微生物群落的影响[9],很少涉及到土壤线虫等动物类群的群落结构及功能对高寒草甸不同恢复时间的响应[10-11]。
线虫是土壤生态系统中多样性最高和数量最大的后生动物门类,作为小型土壤动物的重要代表和组成部分,土壤线虫在凋落物分解、土壤养分矿化、食物网结构调控及植物生长等方面都发挥着重要作用,并且可以敏感地反映土壤食物网甚至生态系统功能的变化[12]。草地退化导致植被类型改变,土壤裸露增加,土壤环境和质量发生极大改变,因而可以直接影响线虫群落组成与结构[13-14]。刘安榕等[15]研究预测,恢复退化草地时采用的施肥措施可通过提供更多土壤基质的方式增加线虫群落多样性,围封措施可通过增加植物生产力、土壤养分含量、含水量及有机质等方式使线虫多样性增加。
因此,本研究主要以土壤线虫为研究对象,通过对比三江源区高寒草甸不同恢复期土壤线虫群落的变化,揭示土壤线虫群落对草地修复的响应,并探讨其可能的机制,旨在从土壤线虫的角度揭示三江源区在人为采取建植措施修复后土壤食物网结构和功能的变化情况,从而评估该地区高寒草甸土壤生态系统的健康状态、恢复效果和可持续发展潜力,为三江源区高寒草甸生态系统,尤其是其土壤生态系统后续的恢复、保护和管理政策提供依据。
1 材料与方法
1.1 样地概况
本研究的野外样地位于青海省果洛藏族自治州玛沁县(100°20′E,34°26′N)草甸,海拔约3 900 m。未受干扰的原生植被样地:植物盖度大于80%[2],植被类型为典型的高寒草甸,主要以中生、多年生牧草植物为主,多为莎草科嵩草属(),同时分布有毒杂草如甘肃马先蒿()、甘肃棘豆()和大戟()等。植被恢复样地:本研究选取了3种不同年限(1、5、10 a)的人工建植草地。该区域的草甸恢复措施是在极度退化(植物盖度<10%)的草地上,通过灭高原鼢鼠、翻耕松土、播种垂穗披碱草()、施肥等措施进行人工草地的建植[16],并在恢复期间采取围封措施禁止家畜进入。
1.2 研究方法
本研究于2018年8月进行4种类型草地(原生植被及恢复1、5、10 a草地)的野外样品采集。在每种类型草地各选取4个10 m×10 m的样区,同一类型草地的相邻样区间隔100 m以上,每个样区内随机布设3个1 m×1 m样方,共采集48个样方。每一样方内,使用内径为50 mm的取土钻取表层0 ~ 10 cm深度的土壤五钻混合成1个土样。采集的土样密封避光并尽快置于4°C冷藏保存。
1.3 测定指标
将样品带回实验室进行植物地下生物量、土壤理化性质和土壤线虫群落的测定。
植物地下生物量的测定是将所获得的每个混合样品分别置于孔径为0.5 mm的网筛内用水把泥土冲洗干净,所有植物地下生物量样品在50℃下烘至恒重后进行称重。
土壤理化性质测定包括土壤pH(电位测定法)、容重(环刀法)、有机质(重铬酸钾容量法)、速效氮(碱解扩散法)、全钾(NaOH熔融,火焰光度计法)、全氮(半微量凯氏定氮法)、全磷(NaOH熔融,钼锑抗比色法)、铵态氮(流动注射法FIA)、硝态氮(间隔流动分析法SFA)及含水率(重量分析法)。
土壤线虫采用LUDOX悬浮法提取,计数,制片并鉴定至属的水平。本研究主要根据线虫群落的不同食性分为5种营养类群:植食性线虫(plant feeders)、食细菌性线虫(bacterial feeders)、食真菌性线虫(fungal feeders)、捕食性线虫(omnivores)和杂食性线虫(carnivores)[17-18]。此外,根据线虫群落的不同生活史类型将其分为5种c-p类群:c-p1类群、c-p2类群、c-p3类群、c-p4类群和c-p5类群。其中,c-p值较低的线虫类群倾向于是r-对策者,而c-p值较高的线虫类群倾向于是k-对策者[19]。
本研究中选取的土壤线虫群落相关生态参数的计算公式如下[20-21]。
香农–维纳指数:

丰富度指数:
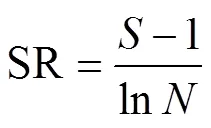
均匀度指数:
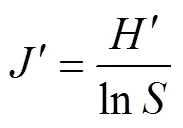
成熟度指数:
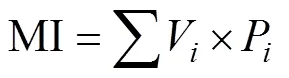
线虫代谢足迹指数:
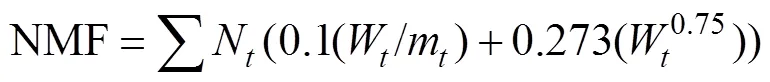
式中:为属丰富度;P为第属线虫多度与总体线虫多度的比例;为总体线虫多度;V为土壤线虫群落中第属线虫的c-p值;W为属线虫的鲜重即生物量(数据参考自http://nemaplex.ucdavis.edu/);m为属线虫的c-p值;N为属线虫的多度;0.273=12/44,即碳原子分子量比二氧化碳分子量;0.75为回归系数。
1.4 数据分析
本研究使用SPSS 22.0对不同样地中植物地下生物量、土壤理化性质和线虫群落特征进行单因素方差分析(One-way ANOVA),并评价其差异的显著性,平均值的多重比较采用LSD法;使用R studio进行皮尔森相关性分析;使用Sigmaplot 14.0、OmicShare tools和R语言进行绘图。为保证数据在进行方差分析时符合方差齐性检验,本文对不符合正态分布的指标进行了对数转换。
2 结果与分析
2.1 植物地下生物量及土壤理化性质
与原生植被样地相比,3种不同恢复期样地植物地下生物量均显著降低(图1),土壤容重、pH、全磷、全钾和硝态氮含量则均显著提高(表1)。随着恢复年限的增加,恢复样地的土壤全磷、有机质、矿质氮(铵态氮+硝态氮)及速效氮含量均显著升高,而土壤pH显著降低(表1)。

(图中误差线表示标准误差(N=4),不同小写字母表示样地间差异显著(P<0.05),下同)

表1 不同恢复期样地的土壤理化性质
注:表中数据表示为平均值±标准误差(=4),同列不同小写字母表示样地间具有显著性差异(<0.05)。
2.2 土壤线虫组成及生态参数
本研究共鉴定出三江源地区高寒草甸土壤线虫34科50属。不同恢复期样地的线虫群落平均多度均高于原生植被样地,且随恢复年限的增加而增加(图2A)。其中,原生植被样地线虫群落平均多度为102.44(± 11.10) 条/10g干土,人工建植恢复1、5和10 a样地线虫群落平均多度分别为149.49(± 15.82)、164.78 (± 11.04) 和221.19(± 19.87) 条/10 g干土。
与原生植被样地相比,所有恢复期样地的线虫均匀度指数(图2C)和香农–威纳指数(图2D)均显著提高。不同恢复期样地的线虫多度(图2A)、代谢足迹(图2E)以及成熟度指数(图2F)随恢复年限的增加而增加。此外,随着恢复年限的增加, 不同恢复期样地的线虫丰富度(图2B)、均匀度(图2C)和香农–威纳指数(图2D)呈现趋向原生植被状态演替的态势。
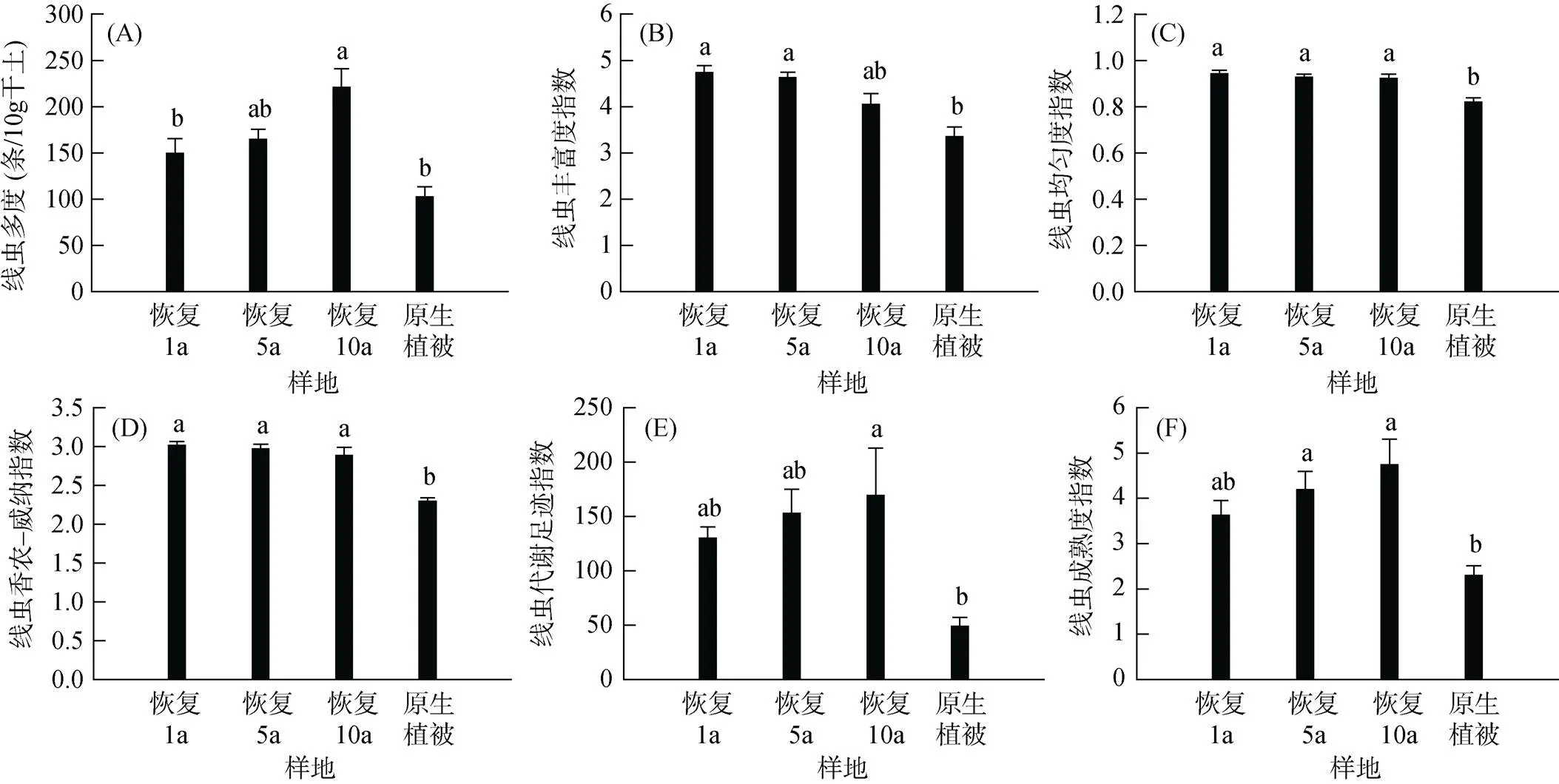
图2 不同恢复期样地的线虫群落生态参数
2.3 土壤线虫营养类群及群落组成
与原生植被样地相比,不同恢复期样地的杂食性和食细菌性线虫的多度更高(图3A),杂食性、植食性和食细菌性线虫的丰富度更高(图3B)。3种不同恢复期样地的杂食性、植食性和食细菌性线虫的香农–威纳指数均高于原生植被样地,而捕食性和食真菌性线虫的香农–威纳指数低于原生植被样地(图3C)。就线虫生活史类群而言,不同恢复期样地的c-p2和c-p4线虫类群的多度(图3D)、丰富度(图3E)和香农–威纳指数(图3F)均高于原生植被样地。非度量多维度分析(NMDS)结果显示,原生植被样地与不同恢复期样地间的线虫群落结构差异显著(图4)。此外,恢复10 a样地的线虫群落与恢复1 a与5 a样地中的线虫群落(图4)存在一定重叠。
相关性分析结果表明,线虫多度与植物地下生物量、土壤含水率及有机质、全磷、全氮、矿质氮和速效氮含量显著正相关(<0.05),与土壤pH、容重和全钾含量显著负相关(<0.05)。植食性线虫多度与土壤容重和有机质含量显著正相关(<0.01)。
3 讨论
本研究发现,在三江源地区高寒草甸沿着时间梯度的植被恢复演替过程中,植物地下生物量和土壤质量均有不同程度的提升,该地区所采用的围封措施行之有效,并且这些恢复措施可能对土壤生物群落产生直接的积极作用。其他草地恢复的相关研究也发现,随着恢复时间的延长,土壤有机碳和全氮含量显著增加,土壤容重降低[22-23],表明围封后放牧活动的减少导致动物啃食和踩踏减少,土壤营养状况趋于向原生植被样地状态恢复[24]。土壤质量的改善可能是由于植被恢复和植物生产力升高导致[25]。本研究中各恢复样地土壤全磷和全钾含量高于原生植被样地(表1),可能是恢复期间人为施肥的结果。虽然不同恢复期样地的植物地下生物量均低于原生植被样地(图1),但是值得注意的是地下生物量随着恢复时间的增加而增加,呈现出趋于向原生植被样地状态恢复的态势。
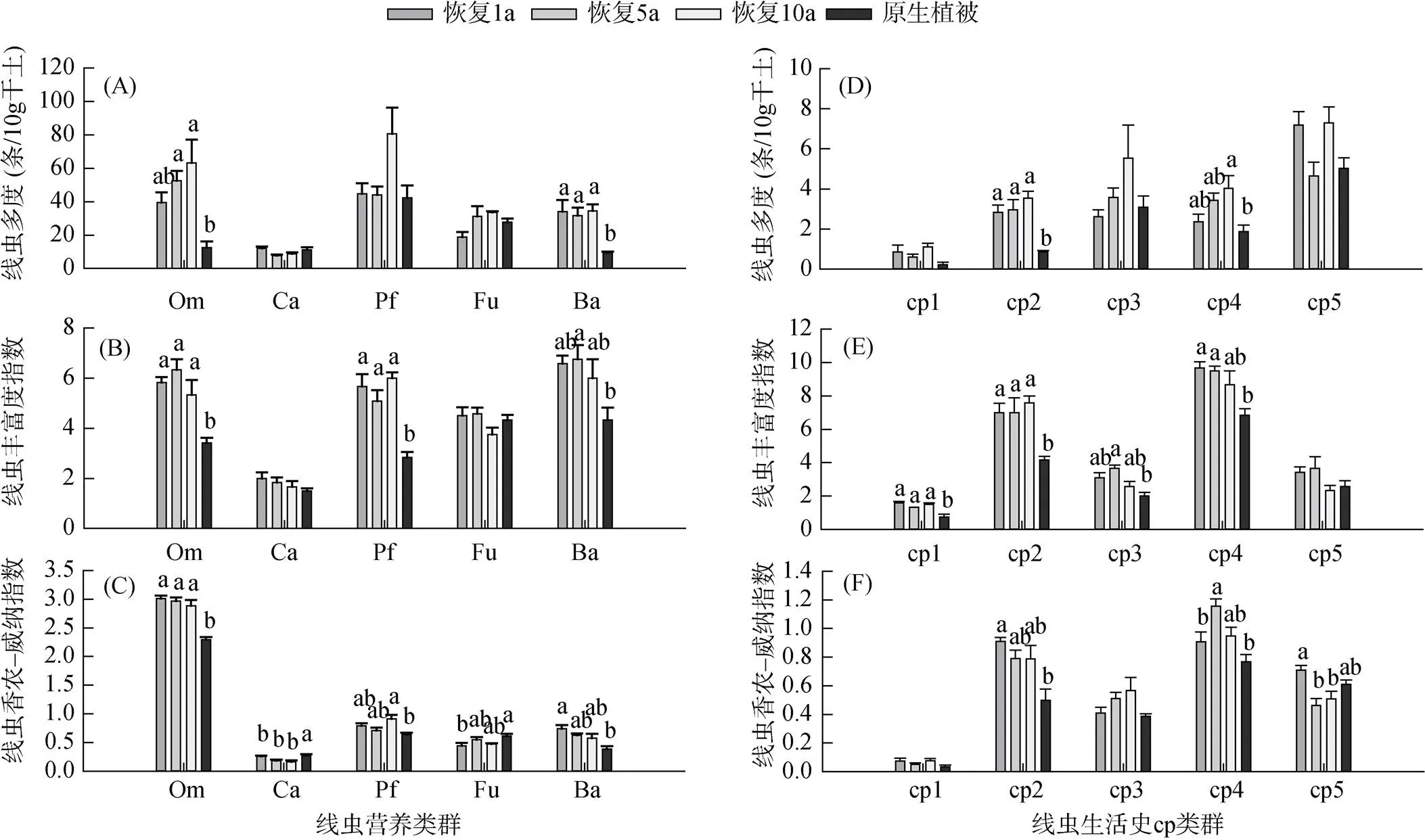
(Om:杂食性线虫;Ca:捕食性线虫;Pf:植食性线虫;Fu:食真菌性线虫;Ba:食细菌性线虫)

(R1:恢复1 a样地;R5:恢复5 a样地;R10:恢复10 a样地;NV:原生植被样地)
各恢复样地土壤线虫丰富度指数、均匀度指数和香农–威纳指数高于原生植被样地(图2B ~ 2D),这可能由于围封和施肥措施增加了土壤养分,进而改善了线虫生活环境[24, 26]。各恢复样地食细菌性线虫多度高于原生植被样地(图3A),表明土壤生物活性增强,土壤有机质分解等物质周转速率加快[19]。各恢复样地杂食性线虫香农–威纳指数(图3C)高于原生植被样地,表明高寒草甸恢复后土壤食物网更为复杂。这可能是由于围封措施使生态系统向更稳定的方向演替[26-27]的结果。
此外,以往研究表明,线虫c-p4类群体型较大、世代周期较长且对环境变化敏感,属于k-对策线虫;c-p2类群体型较小、世代短且繁殖率高,是r-对策线虫[19]。本研究发现,不同恢复期样地的c-p2和c-p4类群线虫的多度、丰富度和香农–威纳指数均高于原生植被样地(图3D ~ 3F),表明土壤生态系统正在趋向稳定的演替进程中。不同恢复期样地中c-p2线虫类群多度、丰富度和香农–威纳指数的增加可能与施肥措施有关[28],而c-p4线虫类群的增加可能与植被的恢复和土壤质量的改善有关[12]。
本研究发现,土壤线虫多度、代谢足迹指数及成熟度指数均随恢复时间的增加而升高(图2A, 2E, 2F),表征着高寒草甸生态系统向更加复杂、成熟、稳定的状态演替,恢复的年限越久,恢复成效越好。Guo等[29]在黄土高原30 a恢复时间序列的草地研究中发现,细菌和真菌物种丰富度都随着草地恢复年数的增加而升高,恢复后期呈现更大的微生物群落网络复杂性,本研究结果与之相似。
土壤的生物活力是生态系统恢复的基础。本研究表明,在种草、施肥、围封等恢复措施下,土壤生物表现出了积极的响应趋势。然而,由于三江源区退化高寒草甸的恢复措施实施仅十余年,目前尚无法明确这些措施在更长时间尺度上对土壤生物的影响,以及土壤生物群落的率先恢复对整个草地生态系统恢复的影响及意义。因此,未来需要在更大时间尺度上探究高寒草甸人工恢复措施对土壤生物的影响及其反馈,从地下系统的角度为生态系统整体的修复提供参考。
4 结论
三江源地区高寒草甸退化草地的人工恢复措施有效改善了该地区的土壤质量和生物活性。尽管植物生物量尚未恢复到原生植被状态,但随着恢复年限增加,土壤质量和以土壤线虫为代表的土壤生物结构指标均有提升。此外,土壤线虫代谢足迹和成熟度指数随恢复时间的增加而升高,表明恢复样地中土壤生物的功能也正在向更稳定的状态演替。
致谢:感谢西北高原研究所周华坤老师在样地采样过程中的帮助和指导。
[1] 白永飞, 赵玉金, 王扬, 等. 中国北方草地生态系统服务评估和功能区划助力生态安全屏障建设[J]. 中国科学院院刊, 2020, 35(6): 675–689.
[2] 赵新全, 周青平, 马玉寿, 等. 三江源区草地生态恢复及可持续管理技术创新和应用[J]. 青海科技, 2017, 24(1): 13–19, 2.
[3] 乔慧捷, 汪晓意, 王伟, 等. 从自然保护区到国家公园体制试点: 三江源国家公园环境覆盖的变化及其对两栖爬行类保护的启示[J]. 生物多样性, 2018, 26(2): 202–209.
[4] Garbowski M, Brown C S, Johnston D B. Soil amendment interacts with invasive grass and drought to uniquely influence aboveground versus belowground biomass in aridland restoration[J]. Restoration Ecology, 2019, 28: A13–A23.
[5] Wardle D A, Yeates G W, Williamson W, et al. The response of a three trophic level soil food web to the identity and diversity of plant species and functional groups[J]. Oikos, 2003, 102(1): 45–56.
[6] Farrell H L, Léger A, Breed M F, et al. Restoration, soil organisms, and soil processes: Emerging approaches[J]. Restoration Ecology, 2020, 28: S307–S310.
[7] Gao X X, Dong S K, Xu Y D, et al. Resilience of revegetated grassland for restoring severely degraded alpine meadows is driven by plant and soil quality along recovery time: A case study from the Three-river Headwater Area of Qinghai-Tibetan Plateau[J]. Agriculture, Ecosystems & Environment, 2019, 279: 169–177.
[8] Wei X Y, Mao X F, Wang W Y, et al. Measuring the effectiveness of four restoration technologies applied in a degraded alpine swamp meadow in the Qinghai-Tibet plateau, China[J]. Journal of Environmental Accounting and Management, 2021, 9(1): 59–74.
[9] Schmidt K T, Maltz M, Ta P, et al. Identifying mechanisms for successful ecological restoration with salvaged topsoil in coastal sage scrub communities[J]. Diversity, 2020, 12(4): 150.
[10] Duddigan S, Gil-Martínez M, Fraser T, et al. Evaluating heathland restoration belowground using different quality indices of soil chemical and biological properties[J]. Agronomy, 2020, 10(8): 1140.
[11] 邵元虎, 傅声雷. 试论土壤线虫多样性在生态系统中的作用[J]. 生物多样性, 2007, 15(2): 116–123.
[12] 李玉娟, 吴纪华, 陈慧丽, 等. 线虫作为土壤健康指示生物的方法及应用[J]. 应用生态学报, 2005, 16(8): 1541–1546.
[13] 刘艳方. 青藏高原高寒草地植物群落与土壤线虫相互关系研究[D]. 西宁: 青海师范大学, 2020.
[14] Wang B, Wu L J, Chen D M, et al. Grazing simplifies soil micro-food webs and decouples their relationships with ecosystem functions in grasslands[J]. Global Change Biology, 2020, 26(2): 960–970.
[15] 刘安榕, 杨腾, 徐炜, 等. 青藏高原高寒草地地下生物多样性: 进展、问题与展望[J]. 生物多样性, 2018, 26(9): 972–987.
[16] 马玉寿, 郎百宁, 李青云, 等. 江河源区高寒草甸退化草地恢复与重建技术研究[J]. 草业科学, 2002, 19(9): 1–5.
[17] Yeates G W, Bongers T, de Goede R G, et al. Feeding habits in soil nematode families and genera-an outline for soil ecologists[J]. Journal of Nematology, 1993, 25(3): 315–331.
[18] Bongers T. The maturity index: An ecological measure of environmental disturbance based on nematode species composition[J]. Oecologia, 1990, 83(1): 14–19.
[19] 陈云峰, 韩雪梅, 李钰飞, 等. 线虫区系分析指示土壤食物网结构和功能研究进展[J]. 生态学报, 2014, 34(5): 1072–1084.
[20] Ferris H. Form and function: Metabolic footprints ofin the soil food web[J]. European Journal of Soil Biology, 2010, 46(2): 97–104.
[21] de Deyn G B, Raaijmakers C E, van Ruijven J, et al. Plant species identity and diversity effects on different trophic levels ofin the soil food web[J]. Oikos, 2004, 106(3): 576–586.
[22] He H D, Li H Q, Zhu J B, et al. The asymptotic response of soil water holding capacity along restoration duration of artificial grasslands from degraded alpine meadows in the Three River Sources, Qinghai-Tibetan Plateau, China[J]. Ecological Research, 2018, 33(5): 1001–1010.
[23] Liu M, Zhang Z C, Sun J, et al. Restoration efficiency of short-term grazing exclusion is the highest at the stage shifting from light to moderate degradation at Zoige, Tibetan Plateau[J]. Ecological Indicators, 2020, 114: 106323.
[24] 杜清. 施肥对青藏高原高寒草甸土壤线虫群落结构影响的研究[D]. 兰州: 兰州大学, 2020.
[25] Raiesi F, Salek-Gilani S. Development of a soil quality index for characterizing effects of land-use changes on degradation and ecological restoration of rangeland soils in a semi-arid ecosystem[J]. Land Degradation & Development, 2020, 31(12): 1533–1544.
[26] Zhang Z W, Li Q, Zhang H Y, et al. The impacts of nutrient addition and livestock exclosure on the soil nematode community in a degraded grassland[J]. Land Degradation & Development, 2019, 30(13): 1574–1583.
[27] 薛会英, 罗大庆, 胡锋, 等. 短期围封对西藏北部高寒草甸土壤线虫群落的影响[J]. 生态学报, 2016, 36(19): 6139–6148.
[28] 耿德洲. 宁南山区人工植被恢复对土壤微生物和线虫群落的影响[D]. 杨凌: 西北农林科技大学, 2020.
[29] Guo Y Q, Hou L J, Zhang Z Y, et al. Soil microbial diversity during 30 years of grassland restoration on the Loess Plateau, China: Tight linkages with plant diversity[J]. Land Degradation & Development, 2019, 30(10): 1172–1182.
Response of Soil Nematode Communities to Restoration of Alpine Meadow Grassland in Three-river Headwater Region on Qinghai-Tibet Plateau in Different Restoration Periods
WU Yuwei1, LUO Shan2,Laqiong3,WU Jihua1,3*
(1 Key Laboratory for Biodiversity Science and Ecological Engineering, Ministry of Education, Institute of Biodiversity Science, Fudan University, Shanghai 200438, China; 2 Lancaster Environment Centre, Lancaster University, Lancaster LA14YW, United Kingdom; 3 Ecological Research Center, School of Science, Tibet University, Joint Laboratory of Biodiversity and Global Change, Tibet University and Fudan University, Lhasa 850000, China)
Alpine meadow in the Three-River Headwater Region on the Qinghai-Tibet Plateau is undergoing severe degradation. Artificial planting is an important way to restore degraded grasslands. This study compares the structure and function of soil nematode communities of alpine meadow grasslands at different restoration stages (artificial grassland planting for 1, 5 and 10 years) to test the effectiveness of grassland restoration from the view of belowground. Compared with the native vegetation plots, plant belowground biomass of the restored plots is significantly lower, and soil bulk density, pH, total phosphorus, total potassium and nitrate nitrogen are significantly higher. Nematode evenness index and Shannon Wiener index in the three restoration plots are significantly higher than those in native vegetation plots. In addition, with the increase of restoration years, nematode abundance index, metabolic footprint index and maturity index in restoration plots are increased. Correlation analysis results show that soil nematode abundance is significantly positively correlated with plant belowground biomass, soil organic matter, total nitrogen, total phosphorus, mineral nitrogen and available nitrogen (<0.05), and significantly negatively correlated with soil pH, total potassium and bulk density (<0.05). Although the artificial restoration measures of the degraded grassland in the Three-River Headwater Region have not fully restored the forage productivity to the state of native vegetation, soil biological structure and function have a trend of improvement, indicating the strong restoration potential for the degraded grassland ecosystem in this area.
Grassland degradation; Grassland restoration; Alpine meadow; Soil nematode; Artificial vegetation
Q14
A
10.13758/j.cnki.tr.2022.03.013
吴雨薇, 罗珊, 拉琼, 等. 青藏高原三江源区不同恢复期高寒草甸土壤线虫群落演变. 土壤, 2022, 54(3): 532–538.
西藏大学高层次引进人才科研资助经费和西藏大学和复旦大学生物多样性与全球变化联合实验室经费项目资助。
(jihuawu@fudan.edu.cn)
吴雨薇(1995—),女,山西太原人,硕士研究生,主要从事土壤生态学方面的研究。E-mail: 18210700093@fudan.edu.cn

