基于药物相互作用研究麦冬皂苷D对麦冬皂苷D′急性和亚急性毒性的影响
徐焕华,江珍红,姚泓,汤响林,王宁宁,孙宇婷,马增春,高月1,
(江西中医药大学 1.现代中药制剂教育部重点实验室,2.创新药物与高效节能降耗制药设备国家重点实验室,江西南昌 330004;3.军事科学院军事医学研究院辐射医学研究所,北京 100850;4.江西省分子中心医学重点实验室,江西南昌 330006)
本研究集体前期在对麦冬中的活性成分麦冬皂苷D(ophiopogonin D,OPD)与OPD'进行比较研究时发现,互为同分异构体的2 个分子在药理活性方面存在明显差异[1]。检索目前与OPD 和OPD'相关的文献,其中OPD 占87.7%,且药理研究均表明OPD 具有心血管保护作用[2-6]。与此相反,其同分异构体OPD' 2 μmol·L-1即对细胞产生明显的细胞毒性,细胞存活率仅为41%[7];动物实验结果亦表明其具有显著的心脏毒性。因此,应当重视OPD'存在的临床风险。
本研究集体已研究表明,OPD'在体内和体外均具有明显的溶血作用,而OPD 仅在体内发生溶血,且两者在体外溶血方面存在药物相互作用[8]。近来研究报道,OPD'具有促进肿瘤细胞凋亡的作用,或许可应用于治疗某些癌症[9-10]。但以实际情况看,OPD'抑制肿瘤细胞活性的作用有可能是其细胞毒性,其成药性值得商榷。为此,本研究基于药物相互作用观察OPD 对OPD'急性毒性和亚急性毒性的影响,为后续OPD'的药理研究提供参考,也为临床使用参脉注射液提供合理建议。
1 材料与方法
1.1 实验动物、试剂和仪器
SPF 级昆明小鼠150 只,雌雄各半,体重18~22 g;SPF级SD大鼠25只,雄性,体重180~220 g,购于北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2018-0011。动物饲养于军事医学研究院动物保障中心,环境许可证号为SCXK-(军)2002-003。室温控制在18~28℃,湿度40%~80%,12 h循环照明-黑暗。动物由获得资格认可的人员饲养并自由饮食饮水。伦理审查批号:IACUCDWZX-2020-684。
OPD 和OPD'(批号:F059758 和F581298),上海一飞生物科技有限公司;40%甲醛溶液(批号:1603062),西陇化工股份有限公司;甲醇,美国Thermo Fisher科技有限公司。BS110S型十万分之一天平,德国Sartorius 公司;XH-89 型旋涡振荡器,浙江乐成电器厂;ES-502HA型百分之一天平,中国湘平公司;DM3000型LEICA显微成像系统,德国莱卡公司;XT-2000i型血细胞分析仪,日本Sysmex公司;Cobas c 311型生化分析仪,瑞士Roche公司。
1.2 急性毒性试验
将昆明小鼠随机分为OPD'单用、OPD+OPD'(OPD 和OPD'提前混合)和OPD→OPD'(先注射OPD 间隔15 min 再注射OPD')组。OPD'单用组OPD'5 个剂量分别为3.127,6.460,9.979,10.245和13.098 mg·kg-1;OPD+OPD'组OPD 和OPD'1∶1 混合,5 个剂量分别为5.711,6.129,7.626,8.712 和10.262 mg·kg-1;OPD→OPD'组OPD 固定为1.0 mg·kg-1,OPD' 5 个剂量分别为11.351,15.551,22.732,26.568 和30.137 mg·kg-1;共15组,每组10只,单次尾静脉注射5 mL·kg-1。给药后即刻观察小鼠行为表征,并记录死亡数。14 d 后计算LD50。对死亡小鼠剖检,记录大体观察结果,部分有明显病变的组织进行组织病理分析。
1.3 亚急性毒性试验
据急性毒性试验结果,亚急性毒性试验主要考察OPD'和OPD 药物之间的相互作用,因此未设梯度剂量。据急性毒性试验OPD'的LD50值及体外溶血试验测得的临床允许溶血的限度值(5%)[8],OPD'和OPD 均设为0.25 mg·kg-1。将SD 大鼠分为正常对照、OPD、OPD'、OPD+OPD'和OPD→OPD'组,每组5只。尾静脉注射给药(1 mL·kg-1),每天1 次,持续给药30 d。每天观察并记录大鼠行为表征,间隔7 d 称量1 次体重。末次给药前12 h,禁食不禁水。待末次给药结束后,记录体重,二氧化碳麻醉处死,取材,记录各脏器重量,并计算脏器指数(脏器重量/体重×100)。将心、肝、脾、肺和肾等组织置4%甲醛溶液中固定,石蜡包埋,切片,进行HE 染色,观察组织病理变化。收集血液,EDTA抗凝,制备血浆,分析血浆成分。另取部分血液,离心制备血清,测定血清生化指标。
1.4 统计学分析
急性毒性试验采用Bliss 法计算不同给药组小鼠的LD50,将各组得到的数据录入GraphPad Prism 6软件,经计算得到LD50和95%可信限区间。小鼠体重以±s表示,采用SAS 8.2 统计软件先进行组间单因素方差分析,方差齐则采用非配对t检验进行组间比较。P<0.05为差异具有统计学意义。
2 结果
2.1 OPD′急性毒性
注射OPD'后,OPD'各剂量组小鼠死亡时间区间在4 min~1 h,多数小鼠在给药后约15 min 死亡,但6.460 和9.979 mg·kg-1组在给药后第7 天各只有1 只死亡。给药14 d 时小鼠死亡数见表1。小鼠注射给药后立即出现呼吸急促、运动不协调、痉挛、四肢和全身颤抖和震颤、心动过速、心率增加和尿失禁等,推测小鼠死亡原因可能与神经系统有关。死亡小鼠大体解剖均未发现肉眼可见的病理改变(图略)。据各剂量组小鼠死亡数,计算得OPD'单用时LD50值为7.785 mg·kg-1,95%可信限为6.814~8.893 mg·kg-1。
OPD+OPD'各剂量组给药后小鼠行为反应和死亡时间分布与OPD'单用组相似,其中6.192 和8.172 mg·kg-1组在给药后第4天分别有1只小鼠死亡。给药14 d 时小鼠死亡数见表1。为便于比较,最终剂量以OPD'计,根据各组小鼠死亡数,计算得LD50值为7.706 mg·kg-1,95%可信限为6.959~8.534 mg·kg-1。
OPD→OPD'各剂量组给药后小鼠行为反应和死亡时间分布与OPD'和OPD+OPD'组一致,其中26.568 和30.137 mg·kg-1组分别有1 只小鼠在第7 天死亡。给药14 d 时小鼠死亡数见表1。剂量以OPD'计,计算得LD50值为22.820 mg·kg-1,95%可信限为19.86 ~26.22 mg·kg-1。
2.2 OPD′亚急性毒性
2.2.1 对体重和脏器系数的影响
由表2 可见,与正常对照组相比,OPD',OPD,OPD+OPD'和OPD→OPD'组大鼠体重均下降(P<0.05,P<0.01),心、肝和肾指数无明显变化,脾指数增大(P<0.05,P<0.01);OPD',OPD+OPD'和OPD→OPD'组肺指数增大(P<0.05,P<0.01)。OPD+OPD'和OPD→OPD'组与OPD 或OPD'组比较,体重和以上脏器指数均无显著性差异。
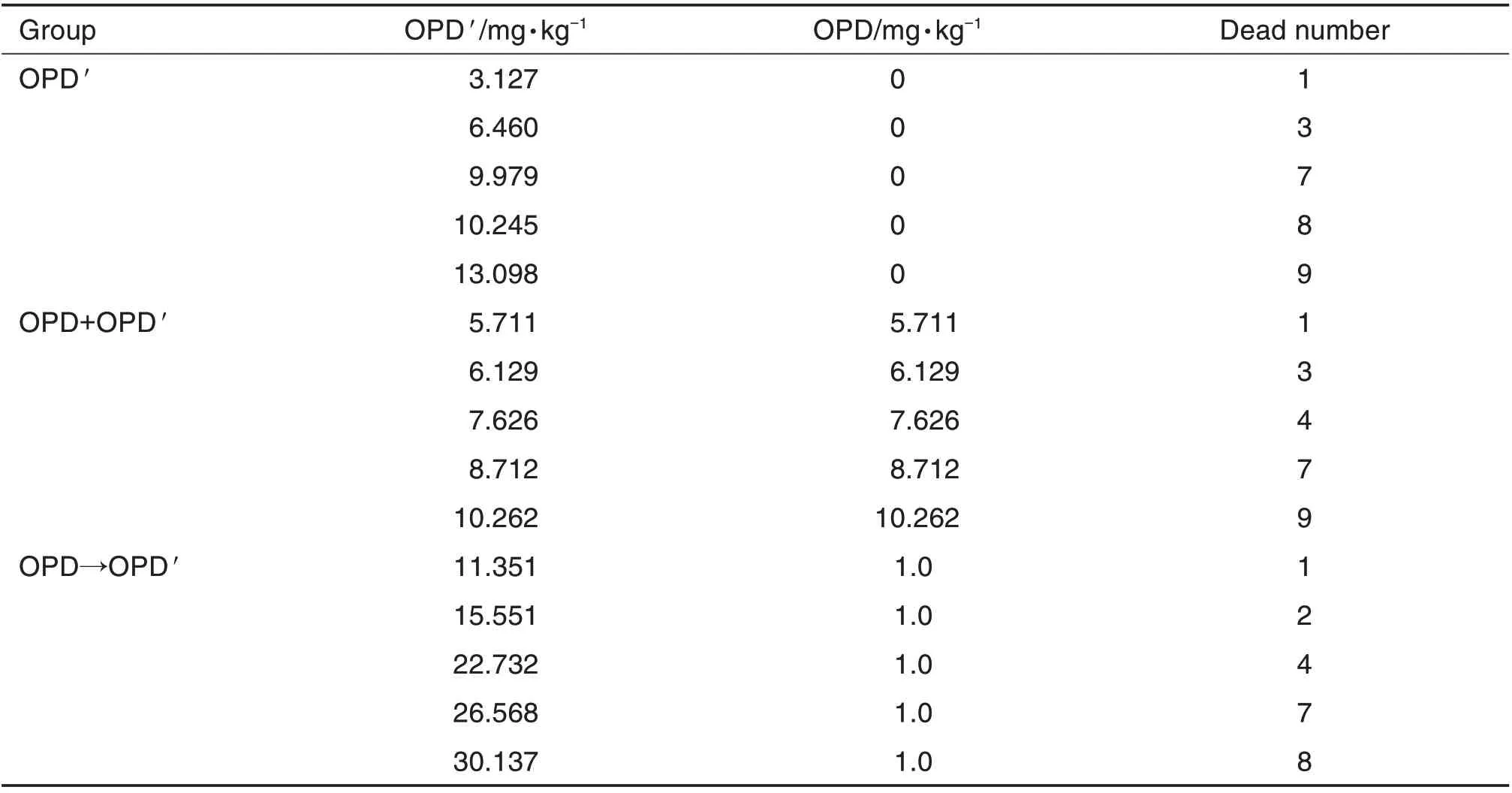
Tab.1 Acute toxicity of ophiopogonin D′(OPD′)in mice
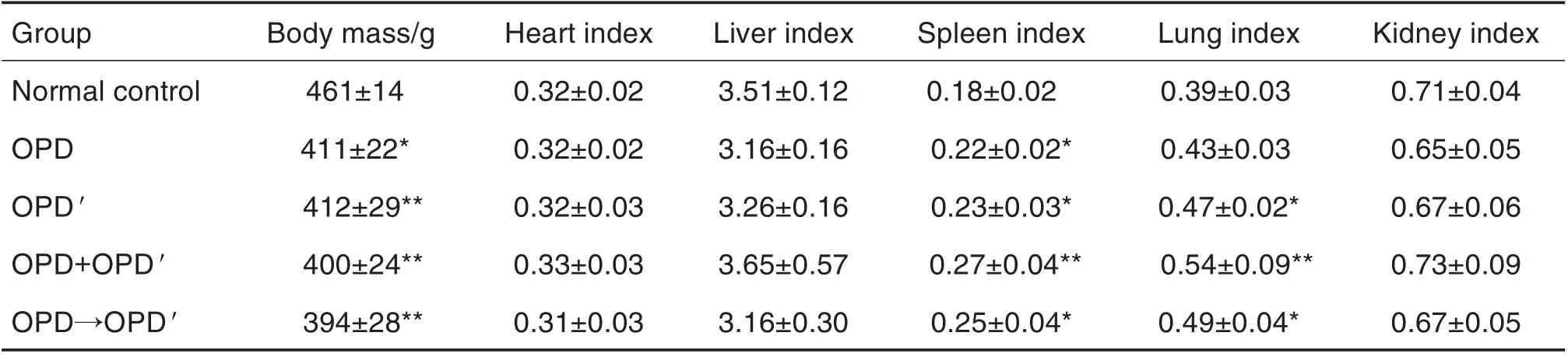
Tab.2 Effect of OPD and OPD′ on body mass and organ indices of rats in sub-acute toxicity test
2.2.2 对血常规指标的影响
如表3 所示,OPD 组大鼠白细胞数较正常对照组明显降低(P<0.05,P<0.01),但尚在正常生理范围;各组淋巴细胞百分比与正常对照组比较均降低(P<0.05)。OPD+OPD'和OPD→OPD'组与OPD或OPD'比较,以上指标均无显著性差异。红细胞及溶血相关指标另文发表[11]。
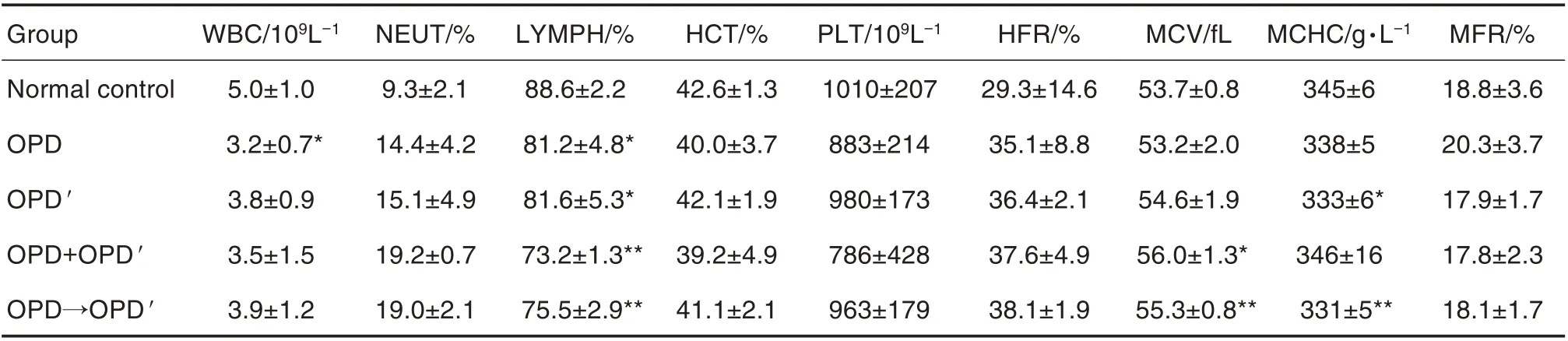
Tab.3 Effect of OPD and OPD′ on hematological parameters of rats in sub-acute toxicity test
2.2.3 对血生化指标的影响
共检测血生化指标18项,其中白蛋白、间接胆红素、碱性磷酸酶、总胆汁酸、肌酸肌酶、尿酸、高密度脂蛋白、低密度脂蛋白和血清胆碱酯酶等9项各给药组与正常对照组比较无显著改变(数据略)。如表4 所示,各给药组谷丙转氨酶、谷草转氨酶、总蛋白、总胆固醇、总胆红素、尿素氮和肌酐与正常对照组比较无明显变化,血清葡萄糖和甘油三酯水平均显著下降(P<0.05,P<0.01)。与OPD 或OPD'比较,OPD+OPD'和OPD→OPD'组以上指标均无显著性差异。
2.2.4 对主要脏器组织病理变化的影响
与正常对照组比较,各给药组肝和肾组织无明显病理改变(图略),心、肺和脾组织具有明显病理改变。
2.2.4.1 对心脏组织病理变化的影响
如图1所示,各组大鼠心肌中层结构正常,中层纤维排列整齐、横纹清楚,肌浆丰富,核圆形或卵圆形,染色质清晰。各给药组心内膜均出现部分心肌细胞轻度水肿、核周间隙轻度增宽,灶性或小片状心肌颗粒变性、肌浆凝聚、均质化,间质血管淤血。OPD+OPD'组病理改变程度最为明显,其中1 例出现灶状心肌细胞坏死、成纤维细胞增生和单核细胞浸润。
2.2.4.2 对脾组织病理变化的影响
如图2 所示,各组脾组织结构基本正常,红、白髓分界较清楚,脾小体及淋巴细胞等形态结构正常;各给药组红髓轻度淤血,其中OPD→OPD'组红髓明显淤血,较OPD,OPD'和OPD+OPD'组更为明显。各给药组均未见明显出血。
2.2.4.3 对肺组织病理变化的影响
如图3 所示,各组肺组织结构基本正常。各给药组部分肺泡上皮细胞轻度肿胀,核周间隙增宽,部分细胞核染色质浓缩深染,肺泡壁血管不同程度淤血,单核细胞稍增多,导致肺泡隔轻至中度增宽,其中OPD,OPD+OPD'和OPD→OPD'组病理改变较OPD'组较轻。
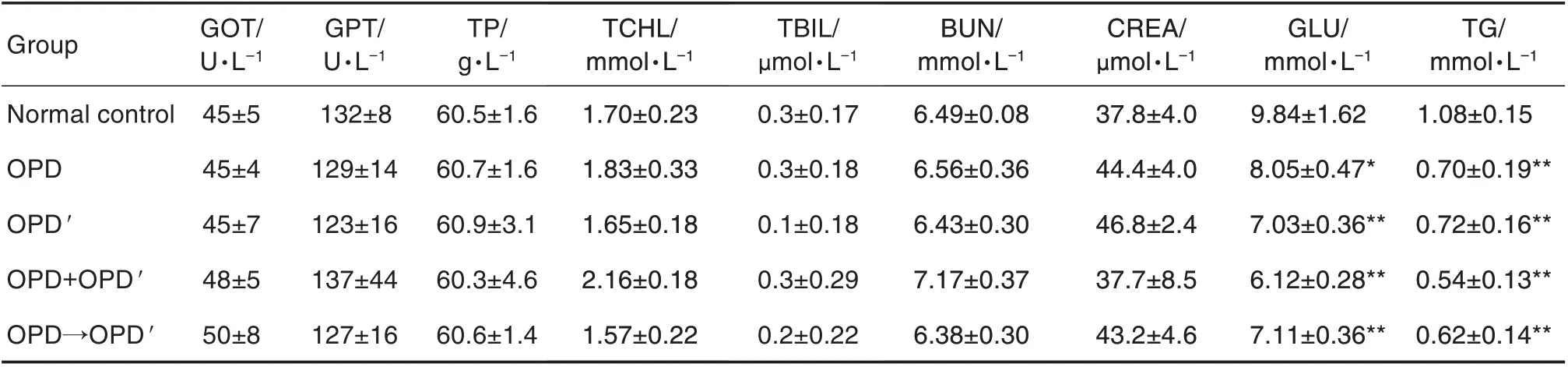
Tab.4 Effect of OPD and OPD′ on blood biochemical indexes of rats in sub-acute toxicity test
3 讨论
因OPD'和OPD 均存在水溶性差的问题,特别是OPD',因此在药液制备时加入不同比例的甲醇作为溶剂。急性毒性预试验结果表明,控制甲醇含量<20%不会引起小鼠死亡。在亚急性毒性试验中,因给药浓度小且持续时间长,药液制备时可适当添加乙醇促溶,但乙醇含量不得>15%。依据《保健食品检验与评价技术规范》(2003年版)的评价要求,该含量在用于毒理学试验中是一个可被接受的溶剂剂量。
关于OPD'和OPD 之间的药物相互作用,据本课题组研究结果,可从3 个方面互为印证。①本研究急性毒性试验结果表明,与OPD'单用相比,当OPD'和OPD 提前混合使用时LD50量效曲线无变化,而当先注射OPD、间隔15 min 再注射OPD'时LD50量效曲线明显右移。在亚急性毒性试验中未见该现象,可能与亚急性毒性的重复给药密切相关。②体外溶血实验结果[8]与急性毒性试验结果一致。与OPD'单用相比,当OPD'和OPD 提前混合使用时,其发生溶血的剂量更低,程度更高;然而当先注射OPD、间隔15 min 再注射OPD'时,溶血发生的剂量升高,程度降低,提示OPD 可减轻OPD'的溶血作用。③本课题组王佳等[12]实验结果表明,OPD干预内质网应激能减轻OPD'所致心肌细胞损伤。但不同的是,该研究中采取的是共处理模式,并未考察间隔给药,且结果也提示两者之间存在药物相互作用。
一般来说,药物相互作用可能与两者作用在同一个靶标有关[13-14]。因此,本课题组利用分子模拟技术,以OPD'寻靶,再辅以OPD验证,找到了10个两者共同的靶标[11],其中Q9NPD5可能与溶血存在一定的关联性[15-16]。本研究结果表明,在急性毒性试验中,小鼠死亡集中在给药后30 min 内,大体解剖观察未见脏器肉眼可见的变化。但在亚急性毒性试验中所呈现出来的异常结果,如体重降低、脾指数和肺指数增大、心肌细胞轻度水肿和间质血管淤血、脾红髓淤血、肺泡上皮细胞轻度肿胀及肺泡壁血管不同程度淤血等均与溶血相关。基于Q9NPD5 靶标的深入研究或许可揭示两者在溶血方面的相互作用机制[17-18]。但两者之间的药物相互作用应不止于此,还有待更深入研究。
关于亚急性毒性试验剂量的设置,本课题组任思嘉等[19]在研究OPD'的心脏毒性时使用的剂量为0.5,1.0 和2.0 mg·kg-1,本研究设置的剂量为0.25 mg·kg-1。该剂量设置的依据主要是急性毒性试验结果的LD50值;其次是体外溶血试验测得的临床允许溶血的限度值(5%),该限度值下,OPD'的浓度为5 mg·L-1[11]。根据动物体重换算,本研究亚急性毒性试验设置OPD'的剂量为0.25 mg·kg-1。
本研究亚急性毒性试验的血生化结果表明,各给药组血糖和血脂与正常对照组比较均显著降低,提示OPD'和OPD 均具有降低血糖和血脂的作用。OPD 用于代谢综合征的治疗已有报道[20],表明OPD 能通过调整肠道菌群结构进而改善高脂饮食诱导的代谢综合征,但关于OPD'的类似研究还未见报道。本课题组首次发现OPD'具有降低血糖和血脂的药理活性,为后续研究OPD'药理活性提供参考。
笔者前期对收集到的国内市场生产的每厂家各3 批次的参脉注射液进行溶血作用检测,结果均符合药典规定,未发生溶血。但对收集样品中OPD'含量的测定结果显示,不同企业中OPD'含量差异巨大[21],个别企业OPD'含量按临床使用最大剂量计算,已触及亚急性毒性试验中采用的临床允许的溶血限度值(5 mg·L-1)。因此,基于本研究结果,建议明示制剂中OPD'的含量并予以控制,以在保证安全剂量范围的前提下选择临床用药剂量。

