基于相转移亲核取代机理的原油脱除有机氯研究
潘小燕, 顾 晋, 宋 佳, 刘纪昌, 韩 鑫, 濮 鑫
(1.山东京博石油化工有限公司,山东 博兴 256500;2.华东理工大学 化学工程联合国家重点实验室,上海 200237)
在原油开采过程中需要加入含氯化学助剂以提高原油采出率,从而导致原油中氯含量升高[1-2]。含氯化合物在原油后续加工过程中会生成氯化氢腐蚀设备,氯化氢还会进一步反应生成氯化铵,在蒸馏塔和换热器等装置的低温部位沉积,造成结盐堵塞与垢下腐蚀,产生安全隐患[3-4]。此外,氯还会导致原油加工过程中催化剂(如催化重整装置的催化剂)中毒,这是因为氯化物增加了催化剂的酸性活性位点,使油品发生过渡裂解[5]。因此,脱除原油中氯化物对炼油厂的高效安全生产尤为重要。
原油中氯元素主要以无机氯化物和有机氯化物2种形式存在[6]。其中,NaCl、MgCl2、CaCl2等无机氯化物可在电脱盐过程中进入水相被脱除[7]。而氯代烃、氯代芳烃等有机氯化物相对稳定,如环氧氯丙烷,1,3-二氯丙烷,1-氯丁烷等中的氯元素通过共价键与碳原子连接,且不溶于水,无法直接脱除[8-9]。常用的有机氯脱除方法主要有催化法、吸附法、化学法、相转移亲核取代法等[10-13]。催化法脱氯成本较高,反应条件苛刻,并会将金属或金属离子引入原油中,从而导致原油金属含量过高等问题,影响后续的炼油过程[14]。电化学法脱氯尽管操作简单、反应速率快,但反应条件较严格,也会使原油体系中的金属含量升高,增加了后续原油脱金属的难度[15]。目前,吸附法脱氯效果一般,且对吸附剂具有较高的要求。李瑞丽等[16]采用的ZSM-5分子筛对石脑油脱氯率为39.7%。另外,吸附剂不仅需要具有较大的吸附容量,而且吸附剂需要具有再生性[17]。相转移亲核取代法具有成本较低、相转移剂加注方便、不会引入杂质且脱氯效果较好等特点,是原油工业脱氯中常用方法之一[18]。相转移亲核取代法研究中,开发高效相转移剂是提高脱氯效果的关键。例如,刘公召等[19]开发了以苄基三乙基氢氧化铵为相转移剂的原油有机氯脱除剂,使常减压蒸馏装置的常压塔顶和减压塔顶冷却水中的氯含量分别减少了69.7%和18.9%。姜铁辉等[20]报道了一种含有四正丁基溴化铵的原油脱氯剂,对模拟原油中的有机氯脱除率达到45.8%。采用相转移亲核取代法对原油中有机氯的脱除过程通常分为两步,首先是相转移剂将有机氯分子由油相转移到水相,然后与亲核试剂发生取代反应,生成可溶于水的无机氯离子,被脱除[21]。但是,脱氯剂在原油有机氯脱除过程中的作用机理以及不同氯化物分子的脱氯反应活性和反应动力学特性等目前还缺少深入研究。
选用3种原油添加剂中常见的有机氯化物作为模型化合物,采用相转移亲核取代法对原油中有机氯原子脱除过程进行了研究,分析了相转移亲核取代脱氯反应机理,并建立了脱氯反应动力学模型,计算获得了不同有机氯分子的脱氯反应速率和表观活化能,对脱氯剂在原油有机氯脱氯过程中的作用机理进行了研究。通过密度泛函理论对相转移反应的过渡态以及反应能量与能量势垒进行了计算分析,解释了不同氯代烷烃中的有机氯化物被脱除的难易程度。并在此基础上,研制了一种高效脱氯剂,并评价了其对实际原油的脱氯效果。
1 实验部分
1.1 原料和试剂
环氧氯丙烷(GC),1-氯丁烷(AR),环氧丙醇(GC),1,3-丙二醇(GC),均为阿拉丁试剂有限公司产品;1,3-二氯丙烷(质量分数99%),正丁醇(质量分数99%),氢氧化六甲铵(质量分数25%水溶液),均为萨恩化学技术有限公司产品;无水乙二胺(AR),上海凌峰化学试剂有限公司产品;无水乙醇(GC),二甲苯(AR),均为上海麦克林生化科技有限公司产品;甲苯(GC),四丁基氢氧化铵(质量分数40%水溶液),乙酸(AR),均为上海泰坦科技股份有限公司产品;浓硫酸(GC),国药集团化学试剂有限公司产品;氧气(体积分数99.9995%),氩气(体积分数99.9995%),氮气(体积分数99.9995%),均为法国液化空气集团有限公司产品;超纯水,华东理工大学自制。
1.2 脱氯剂的配制
配制了2种脱氯剂,均由相转移剂、亲核试剂和溶剂组成,其中亲核试剂为乙二胺,溶剂为乙醇;2种脱氯剂的相转移剂分别为四丁基氢氧化铵和氢氧化六甲铵,并将2种脱氯剂依次命名为T脱氯剂和H脱氯剂。
1.3 模型化合物的脱氯实验
3种含有机氯化物模拟油的配制过程:磁力搅拌下,分别在20 g甲苯中加入4 mg环氧氯丙烷、1,3-二氯丙烷、1-氯丁烷模型化合物,继续搅拌20 min 混合均匀。
模拟油的脱氯过程:先将上述25 mL的模拟油和 20 μL脱氯剂在锥形瓶中混合均匀,然后将此混合溶液的锥形瓶置于油浴锅中加热到一定的温度(70~110 ℃)反应90 min,使其脱氯过程进行完全。模拟油中的有机氯化物的含量变化和产物的组成采用安捷伦气相色谱(PY/GC-MS/7890A-5975C,美国安捷伦公司)进行分析得到,检测过程如下:气相色谱在分流模式下,加热器温度260 ℃,压力40 kPa,总流速83.8 mL/min,隔垫吹扫流量3 mL/min,体积分流比100∶1,分流体积流量80 mL/min,进样量为0.4 μL,升温程序为:初始温度40 ℃停留2 min,以10 ℃/min升温至150 ℃,以20 ℃/min升温至260 ℃并停留2 min;质谱的初始温度40 ℃,压力42 kPa,流动相平均速率0.8 mL/min,低质量数29.0,高质量数450.0,阈值150,离子源230 C,MS四极杆150 C。
1.4 原油脱氯实验
取25 mL原油和适量的脱氯剂在锥形瓶中充分混合,置于油浴锅中进行脱氯反应。反应结束后,取1 mL此混合溶液,用体积比为1∶1的甲苯稀释并混合均匀,取20 μL的稀释液,用自动进样器匀速进样,通过微库伦仪(JF-WK-2000型,江苏江分电分析仪器有限公司产品)分析测定原油样品中的氯含量。分析条件:Ar流量为130 mL/min、进口O2体积流量为40 mL/min、裂解O2体积流量为400 mL/min,设置石英管的裂解温度1000 ℃,采样电阻6.4 kΩ,增益微调为3。当裂解温度升至设定温度,将系统设置在平衡状态,测量电解池偏压,理想偏压为100~140 mV。
脱氯率通过式(1)计算:
(1)
式(1)中:D为脱氯率,%;w0、w1分别为脱氯前、后模拟油中有机氯质量分数,mg/kg。
1.5 模型化合物脱氯过程的理论计算
采用Materials Studio 8.0中的DMol3量子力学模块进行计算,泛函选用基于广义梯度近似泛函(GGA)的PBE,在DND基组下优化模型分子的空间结构、总能量及能量势垒,结构优化过程中收敛条件为:能量小于1×10-3Ha(1 Ha=2626.66 kJ/mol),受力小于0.04 Ha/nm,位移小于0.0005 nm。过渡态的搜索采用完全线性同步和二次同步交换(Complete LST/QST)方法,计算反应能量和能量势垒。
2 结果与讨论
2.1 相转移亲核取代反应机理
原油中的氯化物组成复杂,难以准确确定原油中有机氯化物的种类及含量。采用由甲苯与原油中较为常见的若干种氯代烷烃配制成模拟油,体系内的含氯化合物组成相对简单,易于通过气-质联用等方法对脱氯反应前后模拟油中各组分进行定性与定量分析,从而研究脱氯反应过程和反应机理。用于模拟油和实际原油脱氯的脱氯剂由相转移剂、亲核试剂和溶剂组成,亲核试剂为强碱性且原子核正电性较强的乙二胺,溶剂为具有较好有机物溶解性的乙醇。因季铵碱通常都具有较好的溶解性和碱性,且含有较多的氢氧根离子,适合作为亲核取代法原油脱氯的相转移剂,所以主要考察了四丁基氢氧化铵和氢氧化六甲铵这2种季铵碱作为相转移剂的脱氯效果。
分别以环氧氯丙烷、1-氯丁烷和1,3-二氯丙烷作为模型化合物与甲苯混合制备得到了3种含有不同有机氯原子类型的模拟油,并用T脱氯剂考察了3种模拟油中氯原子的脱除效果以及脱氯前后模拟油中的组分变化。
3种分别含有环氧氯丙烷、1-氯丁烷和1,3-二氯丙烷的模拟油在相转移亲核取代过程中的有机氯化物的含量变化及反应后的产物,如表1所示。由表1可以发现,在脱氯反应过程中,3种模拟油中的有机氯化物的含量均相应减少,T脱氯剂对3种有机氯化物都具有一定的脱除效果。其中,T脱氯剂对环氧氯丙烷为模型化合物的模拟油中的有机氯的脱除效果最好,其有机氯质量分数由200 mg/kg降低到1.18 mg/kg,脱氯率达到了99.4%;T脱氯剂对1,3-二氯丙烷的脱除效果次之;对1-氯丁烷的脱除效果最差,脱除率仅为22.0%。值得注意的是,在脱氯反应后,环氧氯丙烷、1-氯丁烷和1,3-二氯丙烷的模拟油中分别有环氧丙醇、正丁醇和1,3-丙二醇被检测到,并且有机氯含量明显降低。说明T脱氯剂在有机氯的脱氯过程中,作为相转移剂的四丁基氢氧化铵可以与氯代烷烃发生取代反应,相转移剂中的氢氧根离子被模型化合物中的Cl-取代生成相应的醇类化合物与四丁基氯化铵。由于四丁基氯化铵易溶于水,从而可进一步将有机氯原子从油相中转移到水相中,并在水相中与乙二胺发生取代反应。水相中的乙二胺以其较强的亲核取代能力,使得四丁基氯化铵中的C—Cl键断裂,从而生成Cl-,而OH-会与失去Cl-的季铵基团组合,重新生成四丁基氢氧化铵。由此可以推断,相转移亲核取代法对原油中有机氯的脱除过程可分为相转移和亲核取代两步进行,如图1所示。具体如下:首先,氯代烷烃与季铵碱相转移剂作用,生成氯代烷烃对应的醇类化合物和含有氯原子的季铵盐,在此过程中氯原子从油相转移至水相,实现了氯原子的相转移过程;随后亲核试剂会与含有氯原子的季铵盐发生取代反应,生成无机氯离子和季铵碱,最终实现有机氯原子的高效脱除[22]。
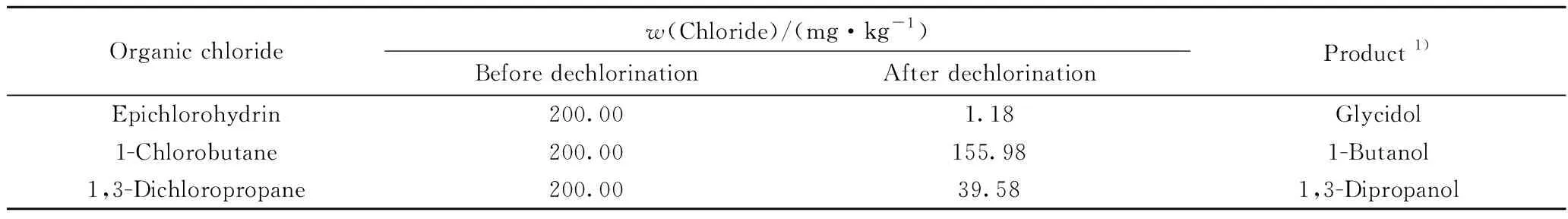
表1 模拟油中的有机氯含量与反应产物Table 1 Organochlorine content and reaction products in simulated oil
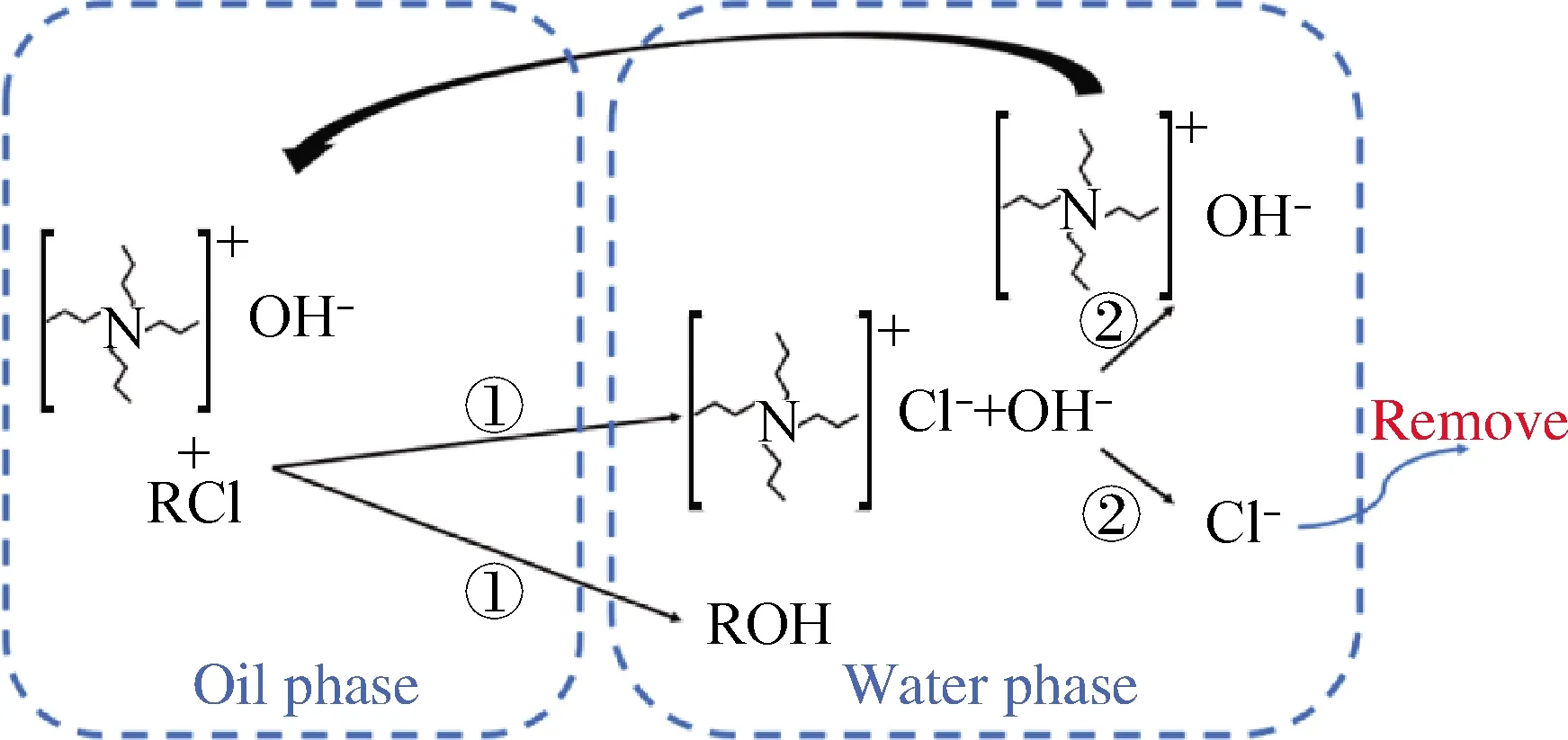
①Phase transfer reaction; ②Nucleophilic substitution reaction; R—Alkyl图1 氯代烷烃的相转移亲核取代脱氯反应机理Fig.1 Reaction mechanism for dechloridation of chloroalkanes by nucleophilic substitution under the action of phase transfer catalyst
2.2 模型化合物的脱氯反应动力学
从2.1节的机理分析可以看出,采用相转移亲核取代法脱除原油中的有机氯的效果与相转移剂的特性密切相关,相转移剂的性能直接影响了有机氯从油相到水相的转移过程。因此,进一步考察不同相转移剂及原油中不同有机氯的脱除难易程度,了解其反应过程具有重要意义。主要对比了T脱氯剂和H脱氯剂对不同有机氯模型化合物的脱除效果,并通过建立脱氯反应动力学模型,进而研究脱氯剂对有机氯化物脱氯的难易程度[23-24]。
通过反应速率方程式(1)进行拟合,计算得到2种脱氯剂对模拟油脱氯过程的反应级数n及反应速率常数k,并通过阿伦尼乌斯式(2)计算得到各有机氯化物的脱氯反应的表观活化能。
r=kwn
(1)
(2)
式中:r为反应速率,mol(1-n)·L(n-1)/s,其中n为反应级数;k为反应速率常数;w为氯化物质量分数,mg/kg;E为表观活化能,kJ/mol;R为摩尔气体常数,8.3145 J/(mol·K);T为反应热力学温度,K。
以脱氯效果最好的环氧氯丙烷的脱氯过程为动力学研究对象,用T和H脱氯剂分别在不同温度下对其浓度随反应时间的变化进行了考察,结果如图2 所示。将这些实验数据点通过反应速率方程式(1),分别以零级、一级与二级的反应级数进行拟合,得到图2中的拟合效果较好的二级反应速率拟合曲线,其拟合方差R2均大于0.997,说明以环氧氯丙烷为模型化合物的模拟油的脱氯过程为二级反应。脱氯的反应速率与反应物浓度密切相关,当反应物浓度较高时,模拟油中环氧氯丙烷的浓度快速下降,单位时间的脱氯反应速率较大;随着反应物的浓度下降,脱氯反应速率也逐渐下降。

图2 T和H脱氯剂对环氧氯丙烷的脱氯结果及其二级反应拟合曲线Fig.2 Dechlorination of epichlorohydrin using T and H dechlorination agents and the corresponding second-order reaction fitting curves(a) T dechlorination agent; (b) H dechlorination agent
为了比较2种脱氯剂对环氧氯丙烷的反应表观活化能,使用阿伦尼乌斯公式(2)考察反应速率常数k与反应热力学温度T之间的关系,计算T和H脱氯剂在脱氯过程中的lnk与1/T的线性拟合如图3所示,相应的反应速率常数与表观活化能的计算结果如表2所示。可以看出,随着反应温度的增加(343.15~373.15 K),T和H脱氯剂对环氧氯丙烷的脱氯反应速率常数kT、kH都不断增加。经过计算,T和H脱氯剂对环氧氯丙烷脱氯反应的表观活化能ET和EH分别为19.68、23.00 kJ/mol,含有四丁基氢氧化铵的T脱氯剂参与环氧氯丙烷的脱氯反应所需要的能量更低,该脱氯反应更容易进行。这是由于四丁基氢氧化铵的季铵基团与4个丁基相连,与氢氧化六甲铵相比,其空间中的分子卷曲程度较小,空间位阻较低,因而由四丁基氢氧化铵与乙二胺复配得到的T脱氯剂更容易与环氧氯丙烷发生反应,使其脱氯反应过程的活化能更低[25-26]。
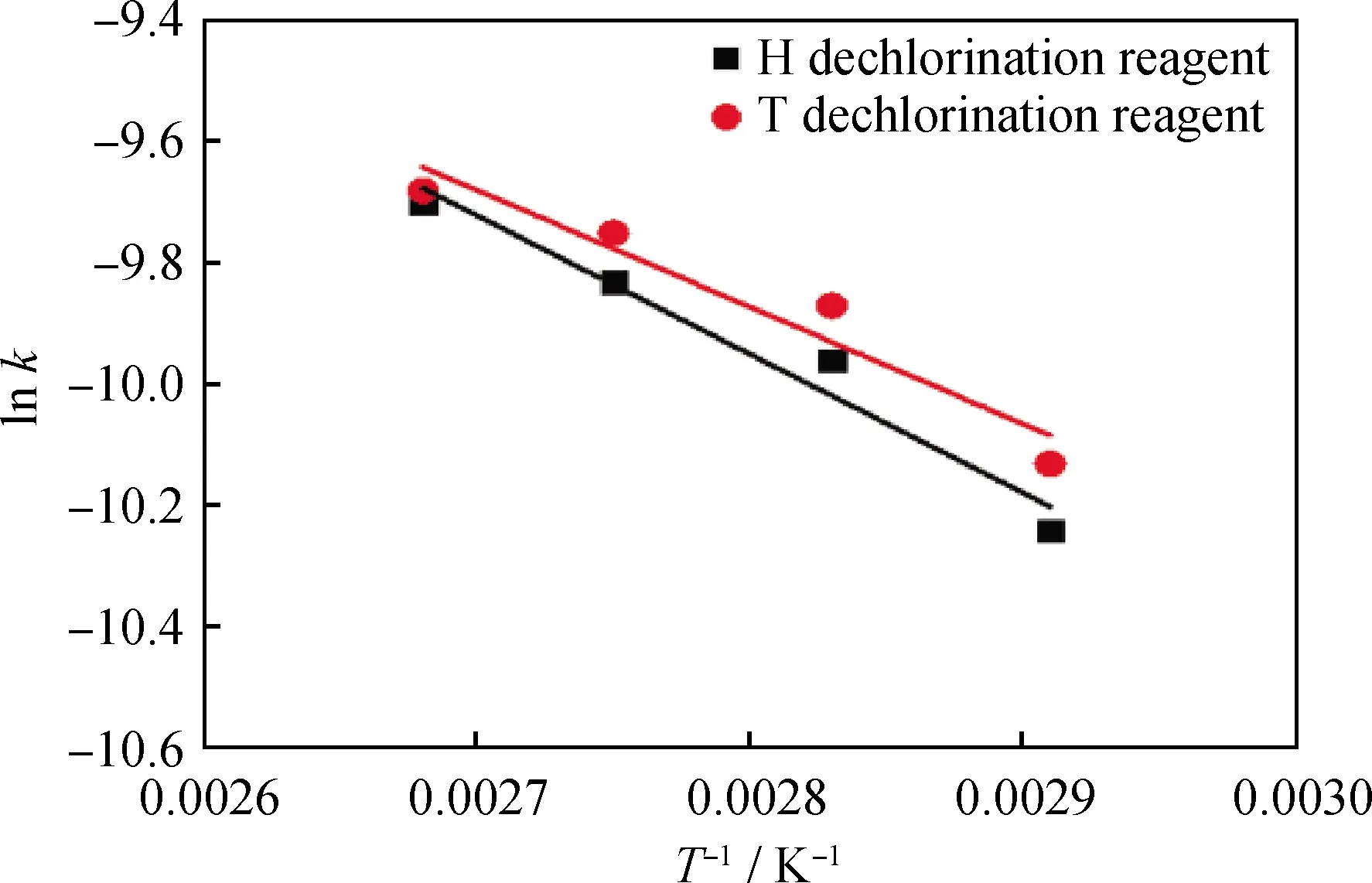
图3 T和H脱氯剂对环氧氯丙烷脱氯反应速率常数与 反应热力学温度的关系Fig.3 Relationship between the reaction rate constant for the dechlorination of epichlorohydrin by use of T and H dechlorination agents and the thermodynamic temperature

表2 脱氯剂在不同反应温度下对环氧氯丙烷的脱氯反应速率常数和表观活化能Table 2 Reaction rate constant and apparent activation energy for the dechlorination of epichlorohydrin by use of dechlorination agents at different reaction temperatures
为了进一步探究原油中不同有机氯模型化合物与2种脱氯剂的脱氯反应,考察了T和H脱氯剂对1-氯丁烷和1,3-二氯丙烷作为模型化合物的脱氯情况。不同温度下,T和H脱氯剂对1-氯丁烷和1,3-二氯丙烷组成的模拟油的脱氯率随时间变化的结果如图4所示,经拟合,脱氯剂对1-氯丁烷和1,3-二氯丙烷的脱氯反应的级数也是二级。当1-氯丁烷和1,3-二氯丙烷的质量分数较高时,其质量分数快速下降,单位时间的脱氯反应速率较大;随着反应物的质量分数下降,脱氯反应速率也逐渐下降。因此,采用与环氧氯丙烷相似的方法对1-氯丁烷和1,3-二氯丙烷表观活化能进行了计算,结果如表3所示。

图4 T和H脱氯剂对1,3-二氯丙烷、1-氯丁烷的脱氯结果及其二级反应拟合曲线Fig.4 Dechlorination of 1,3-dichloropropane and 1-chlorobutane by use of T and H dechlorination agents and the corresponding second-order reaction fitting curves(a) Dechlorinating performance of T dechlorination agent on 1,3-dichloropropane and its secondary reaction fitting curve; (b) Dechlorinating performance of H dechlorination agent on 1,3-dichloropropane and its secondary reaction fitting curve; (c) Dechlorinating performance of T dechlorination agent on 1-chlorobutane and its secondary reaction fitting curve; (d) Dechlorinating performance of H dechlorination agent on 1-chlorobutane and its secondary reaction fitting curve

表3 T和H脱氯剂对有机氯化物脱氯反应的表观活化能Table 3 Apparent activation energy of T and H dechlorination agents for the dechlorination reaction of organic chlorides
从表3可以看出, H和T脱氯剂的表观活化能都遵循如下由小到大顺序:E(环氧氯丙烷)、E(1,3-二氯丙烷)、E(1-氯丁烷),即这2种脱氯剂对环氧氯丙烷的脱氯反应表观活化能最低。可见,环氧氯丙烷在脱氯反应过程中所需要克服的能量势垒最小,因此其在2种脱氯剂下都表现出了最好的脱氯效果,相比于其他2种有机氯化物,其脱氯反应更容易进行。产生此现象的原因,是由于环氧氯丙烷中的环氧基团具有较强的吸电子诱导能力,使其氯取代基团附近的电子云密度降低,C—Cl键更容易被亲核试剂取代,而1,3-二氯丙烷是氯取代基在丙烷上的二氯取代化合物,2个氯取代基团之间存在共轭作用,使其氯取代基团附近的电子云密度下降,该C—Cl键相比于环氧氯丙烷的C—Cl键更不容易被取代,且1,3-二氯丙烷中2个氯取代基团的共轭作用小于环氧氯丙烷中环氧基团对氯取代基团的影响,因此1,3-二氯丙烷的反应活化能大于环氧氯丙烷的反应活化能。此外,1-氯丁烷中的氯取代基团没有受到其他基团的影响,其附近的电子云密度较高,并且其空间位阻较大,降低了相转移剂在两相之间的传递效率,使脱氯反应较难进行,导致脱氯剂对1-氯丁烷的脱氯过程更困难,反应活化能最大[27-28]。
比较表3中的计算结果发现,T脱氯剂对环氧氯丙烷、1-氯丁烷和1,3-二氯丙烷3种模型化合物的反应表观活化能均小于H脱氯剂,说明T脱氯剂对3种有机氯化物的相转移亲核取代脱氯反应更容易发生,这与T脱氯剂具有更好的脱氯效果相一致,也说明其对原油可能具有更好的脱氯效果。因此,进一步将T脱氯剂应用于实际原油的脱氯过程中进行验证,并优化脱氯剂对原油脱氯的工艺条件。
2.3 模型化合物脱氯过程的理论计算
上文采用2种脱氯剂对实际原油中的3种典型有机氯化物进行了反应动力学研究,为了进一步验证脱氯反应表观活化能大小,对模型化合物的脱氯过程进行理论计算。由反应机理可知,相转移剂在相转移亲核取代脱氯过程中对有机氯化物的脱除具有很大的影响。在相转移亲核取代脱氯反应过程中,有机氯化物需要先和相转移剂结合,生成季铵盐。以四丁基氢氧化铵、氢氧化六甲铵等季铵碱作为相转移剂,与有机氯化物结合生成季铵盐和醇类化合物,从而完成相转移过程。在该过程中,相转移剂中的季铵基团(R4N+OH-)起到相转移作用。因此,笔者在DFT理论计算中采用四甲基氢氧化铵((CH3)4N+OH-)作为相转移剂,分别与环氧氯丙烷、1,3-二氯丙烷和1-氯丁烷进行反应,并以这3种有机氯化物对应的醇类化合物(环氧丙醇、1,3-丙二醇和正丁醇)与四甲基氯化铵作为生成物。
首先,反应物与生成物采用Materials Studio 8.0中的DMol3量子力学模块进行计算,泛函选用基于广义梯度近似泛函(GGA)的PBE,在DND基组下优化模型分子的空间结构、总能量及能量势垒,进行几何构型优化,在反应预览模式下进行反应物原子与生成物原子配对,得到环氧氯丙烷的相转移反应的过渡态结构,如图5(a)所示。通过计算,得到环氧氯丙烷与四甲基氢氧化铵相转移过程的反应物、过渡态和生成物的能量信息,如图5(b)所示。由图5可知,以环氧氯丙烷和四甲基氢氧化铵作为反应物的基态能量为-942.20 Ha,以环氧丙醇和四甲基氯化铵作为生成物的基态能量为-942.25 Ha,反应后生成了能量更低、稳定性更好的物质。该反应为吸热反应,其反应能量为-88.61 kJ/mol,发生反应需要从外界吸收能量来激发分子活性,使其达到能量为-942.16 Ha的过渡态,并通过DFT理论计算,得到了该过程的能量势垒为171.33 kJ/mol。
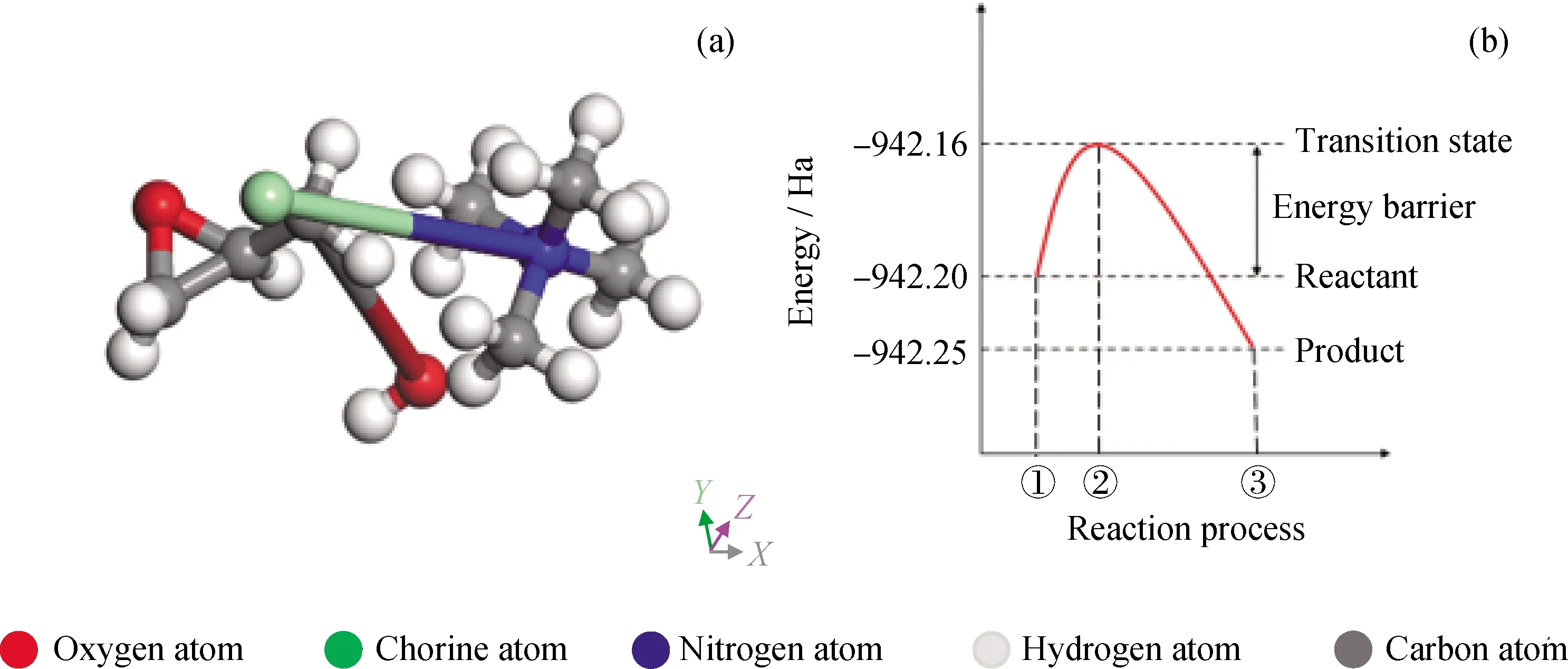
①C3H5ClO+NaOH; ②C3H5O++Cl-+Na++OH-; ③C3H6O2+NaCl图5 环氧氯丙烷的相转移反应过渡态信息Fig.5 The transition state for epichlorohydrin in phase transfer reaction(a) The structure of transition state in phase transfer reaction; (b) the energy of reactant, transition state and product
按照上述方法计算得到1-氯丁烷、1,3-二氯丙烷和环氧氯丙烷的相转移过程的反应能量如表4所示。由表4可见,这些有机氯化物发生相转移过程的反应能量约为-136.25~-67.43 kJ/mol,反应能量均小于零,说明发生反应需要外界提供能量来完成,有机氯化物的相转移过程为吸热反应,反应后生成了稳定的化合物,并且因有机氯化物之间存在结构的差异,从而导致了其发生相转移过程的反应能量不同。
另外,由表4发现,1-氯丁烷、1,3-二氯丙烷和环氧氯丙烷3种有机氯化物相转移反应中间体的能量势垒由大到小顺序为: 1-氯丁烷、1,3-二氯丙烷、环氧氯丙烷,环氧氯丙烷相转移反应中间体的能量势垒最低,为171.33 kJ/mol,说明在强吸电子能力的环氧基团影响下,环氧氯丙烷在活化过程中所需要克服的能量势垒最低,与上文反应动力学模型中得到的脱氯剂对有机氯化物的表观活化能大小顺序一致,验证了反应动力学结果的正确性。而上文2.1实验得到脱氯剂对这3种有机氯化物的脱除率由小到大顺序为:1-氯丁烷、1,3-二氯丙烷、环氧氯丙烷。可见,过渡态的能量势垒顺序与脱氯实验所得的脱氯率大小顺序呈负相关性,相转移反应中间体的能量势垒越低,相转移反应越容易发生,对应的有机氯化物脱除率越高。

表4 有机氯化物相转移过程的反应能量及能量势垒Table 4 Reaction energy and energy barrier in phase transfer process of organic chlorides
2.4 伊朗原油的脱氯工艺条件优化
伊朗原油氯含量高,在炼制过程中设备腐蚀严重,急需从源头脱除其中的氯化物。伊朗原油的理化性质如表5所示。由表5可知,伊朗原油总氯质量分数较高,达到了17.2 mg/kg,而且其中主要为有机氯(11.7 mg/kg),有机氯的占比高达68.0%。因此,此伊朗原油中的氯原子并不能通过简单的电脱除法去除。因此,采用T脱氯剂对伊朗原油进行脱氯实验,并考察了不同反应温度、时间和用量的条件下,脱氯剂对伊朗原油的脱氯率。
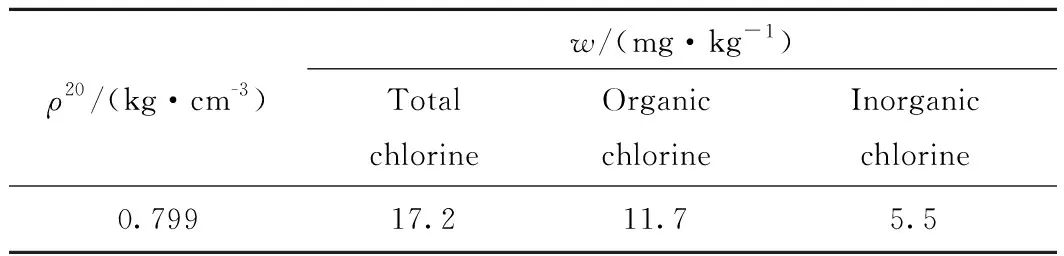
表5 伊朗原油理化性质Table 5 Physical and chemical properties of Iranian crude oil
不同反应温度下T脱氯剂对伊朗原油的脱氯效果,如图6(a)所示。由图6(a)可知:当脱氯反应温度由80 ℃升高至95 ℃时,T脱氯剂对伊朗原油的脱氯率逐渐增大,这是由于随着脱氯反应温度升高,脱氯反应速率加快,促进了油/水两相间相转移亲核取代反应进行。在95 ℃时,T脱氯剂对伊朗原油的脱氯率达到了最大值78.5%。然而,随着脱氯反应温度的进一步升高,脱氯效果反而下降,这是因为[29-30]当脱氯温度超过100 ℃后,四丁基氢氧化铵的热稳定性较差,并发生了一部分的分解,导致其相转移能力降低。由此得出,实际应用中,T脱氯剂最适宜的脱氯温度为95 ℃。另外,在适宜的脱氯反应温度区间内(80~95 ℃),四丁基氢氧化铵与乙二胺复配得到的脱氯剂对原油的脱氯率较高,这也进一步表明,所选用的模型化合物具有很好的代表性。
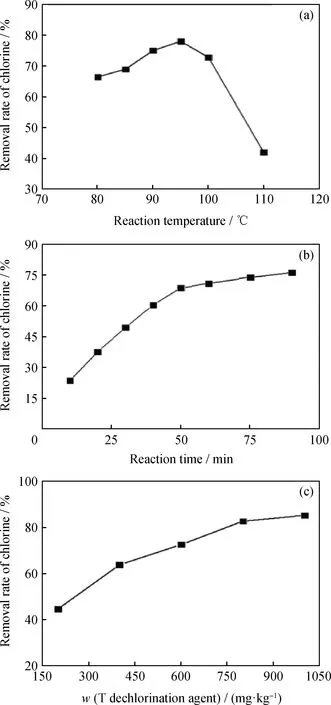
图6 脱氯条件对伊朗原油脱氯的影响Fig.6 The influence of different dechlorination conditions on the dechlorination of Iranian crude oil Dechlorination conditions: (a) Reaction time 60 min,w(T dechlorination agent)=600 mg/kg; (b) Reaction temperature 95 ℃,w(T dechlorination agent)=600 mg/kg; (c) Reaction temperature 95 ℃, Reaction time 90 min
在T脱氯剂作用下,伊朗原油的脱氯率随反应时间的变化曲线如图6(b)所示。由图6(b)可知,当反应时间超过80 min时脱氯过程基本结束。值得注意的是,在反应前50 min,由于伊朗原油中的有机氯含量较高,因此脱氯速率较大,而反应50 min以后,由于伊朗原油中的有机氯含量下降,使脱氯速率变小,有机氯含量随时间的变化的趋势符合二级反应规律,并与前文脱氯剂对模型化合物的脱氯反应是二级反应的结果一致。
T脱氯剂用量对伊朗原油脱氯效果的影响如图6(c)所示。由图6(c)可以看出,T脱氯剂对伊朗原油的脱氯率随其用量的增加而增大。当T脱氯剂质量分数为1000 mg/kg时,由图6(c)可知,T脱氯剂对伊朗原油的总氯脱除率为87.9%,对有机氯的脱除率为82.2%,T脱氯剂中四丁基氢氧化铵对伊朗原油中的有机氯化物相转移效果较好。为了进一步验证T脱氯剂对其他原油的脱氯效果,将其继续应用于青海、大庆和云南原油的脱氯过程中。
当反应温度为95 ℃、反应时间为80 min时,采用T脱氯剂,青海、大庆、云南原油脱氯反应前后的氯质量分数如图7所示。由图7可以看出,青海、大庆、云南原油中的初始氯质量分数均较高,在使用T脱氯剂脱氯后,其总氯的脱除率均达到76.0%以上,说明T脱氯剂对青海、大庆、云南原油都具有良好的脱氯效果。
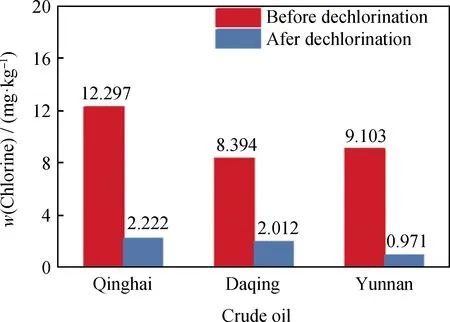
图7 T脱氯剂对青海、大庆、云南原油的脱氯效果Fig.7 Dechlorination effect of T dechlorination agent on Qinghai, Daqing and Yunnan crude oil
3 结 论
(1)通过反应机理研究发现相转移亲核取代法的脱氯反应过程可分为2步:①氯代烷烃与季铵碱作用,生成氯代烷烃对应的醇类化合物和含有氯原子的季铵盐,氯原子从油相转移至水相,实现了相转移;②含有氯原子的季铵盐与水相中氢氧根离子发生取代反应,生成无机氯离子,氯原子可被电脱盐法脱除。
(2)通过建立脱氯反应动力学模型,得出脱氯剂对氯代烷烃的相转移亲核取代脱氯反应为二级反应,并得到3种有机氯模型化合物脱氯反应的表观活化能由小到大顺序为:环氧氯丙烷、1,3-二氯丙烷、1-氯丁烷;而且以四丁基氢氧化铵为相转移剂,乙二胺为亲核试剂,乙醇为溶剂研制得到的T脱氯剂的脱氯反应表观活化能更低,具有较好的脱氯效果。
(3)通过DFT模拟计算,发现氯代烷烃发生的相转移过程是吸热反应,有机氯化物发生的相转移反应能垒由小到大顺序为:环氧氯丙烷、1,3-二氯丙烷、1-氯丁烷,与反应表观活化能的顺序一致,验证了反应动力学的结果。
(4)将脱氯剂应用于实际原油的脱氯过程中,得到由四丁基氢氧化铵与乙二胺复配得到的脱氯剂对伊朗原油的脱氯效果更好,在反应温度95 ℃、反应时间80 min的条件下,有机氯脱除率达到82.2%。

