环状RNA hsa_circ_0004771 基因干扰对骨肉瘤细胞增殖和凋亡的影响
李德珍,冯翎,余洛潇,常国栋
1.武汉大学人民医院肿瘤科,湖北 武汉 430060;2.湖北中医学院附属医院肿瘤科,湖北 武汉 430000
骨肉瘤是儿童和青少年最常见的原发性骨恶性肿瘤之一,占20 岁以下人群骨癌的56%[1]。化学疗法和手术治疗使骨肉瘤患者的5 年总生存率从10%提高至70%,但对于有转移或存在耐药性的病例,预后仍较差[2]。因此,迫切需要寻找骨肉瘤的新治疗策略。
环状RNA(circRNA)是一类内源性RNA,由无5'→3'极性的闭环结构结合在一起,通过充当microRNA 来调节转录或转录后基因的表达[3]。有报道表明,许多circRNA 可作为癌症诊断和治疗的标志物,包括肝癌、胃癌和肺腺癌等[4-6]。目前,尚无有关骨肉瘤与circRNAhsa_circ_0004771相关性的研究,本研究旨在探究circRNAhsa_circ_0004771基因干扰对骨肉瘤细胞生长及凋亡的影响,为骨肉瘤新治疗策略的研究提供实验依据。
1 材料与方法
1.1细胞及干扰序列 人成骨肉瘤MG63 细胞株购自中国典型培养物保藏中心;3 对hsa_circ_0004771基因干扰序列(shRNA1 ~3)及阴性对照序列(shRNANC)由生工生物工程(上海)股份有限公司提供。
1.2主要试剂 DMEM 培养基、胎牛血清(10082-147)、胰蛋白酶及青-链霉素均购自美国Gibco 公司;BCA 蛋白浓度测定试剂盒、线粒体膜电位检测试剂盒JC-1、EdU 细胞增殖检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒及HRP 标记的山羊抗兔IgG均购自上海碧云天生物技术研究所;Hoechst 双染试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)及丙二醛(malondialdehyde,MDA)测定试剂盒均购自南京建成生物工程研究所;兔抗Bax、Bcl-2、Caspase-3、cleaved Caspase-3、c-Myc、β-actin 单克隆抗体均购自英国Abcam 公司。
1.3细胞培养 将MG63 细胞用DMEM 培养基(含10%胎牛血清和1%青-链霉素)于37 ℃,5% CO2恒温培养箱中培养,每3 d 更换1 次培养液。
1.4shRNA 干扰效果的检测 取对数生长期的MG63 细胞,用LipoRNAiTM转染试剂将hsa_circ_000-4771shRNA1、shRNA2、shRNA3 及shRNA-NC 序列分别转染至MG63 细胞,同时设空白对照组(不转染)。转染后72 h,Trizol 试剂提取各组细胞总RNA,反转录合成cDNA,以其为模板进行PCR 扩增。PCR 反应条件为:95 ℃30 s,95 ℃10 s,60 ℃30 s,共35 个循环。以β-actin为内参基因,2-△△CT法计算各目的基因相对表达量。
1.5hsa_circ_0004771基因抑制对MG63 细胞EdU阳性细胞数影响的检测 按1.4 项方法将MG63细胞分为shRNA 组(选择干扰效果最佳的干扰序列)、shRNA-NC 组及空白对照组。取对数生长期的各组MG63 细胞,按每孔1×105个接种于96 孔板,37 ℃培养过夜;加入含50 μmol / L EdU 的DMEM 培养基,100 μL / 孔,37 ℃孵育2 h;PBS 洗涤2 次,每次5 min,加入4%多聚甲醛,室温孵育30 min;加入2 mg/mL 甘氨酸,继续孵育5 min;加入0.5%TritonX-100 渗透液,继续孵育10 min;加入Apollp 染液,避光30 min;加入Hoechst 33342,室温孵育2 min;PBS洗涤2 次,每次5 min。置荧光显微镜下观察。
1.6hsa_circ_0004771基因抑制对MG63 细胞凋亡率影响的检测
1.6.1流式细胞术 细胞分组同1.5 项,取对数生长期的各组MG63 细胞,0.25%胰酶消化,PBS 洗涤2 次,加入195 μL 的Annexin V-FITC 结合液重悬细胞;加入5 μL Annexin V-FITC 和10 μL 碘化丙啶染色液,混匀,室温避光孵育20 min,用流式细胞仪检测。
1.6.2Hoechst 染色 取对数生长期的各组MG63细胞,按每孔1 × 105个接种于6 孔板,加入0.5 mL Hoechst 染色试剂盒中的固定液,37 ℃固定10 min;PBS 洗涤2 次,加入0.5 mL Hoechst 33258 染色液,染色5 min;PBS 洗涤2 次,取一滴置玻片上,于荧光显微镜下观察。
1.7hsa_circ_0004771基因抑制对MG63 细胞线粒体膜电位影响的检测 细胞分组同1.5 项,取对数生长期的各组MG63 细胞,按3 × 105个/ 孔接种于6 孔板,PBS 洗涤3 次,37 ℃孵育24 h;加入5 μg/mL的JC-1,室温避光反应30 min;用流式分选仪检测,记录红色和绿色荧光强度。
1.8hsa_circ_0004771基因抑制对MG63细胞中MDA及LDH 含量影响的检测 细胞分组同1.5 项,取对数生长期的各组MG63 细胞,采用相应试剂盒测定LDH 和MDA 含量。
1.9hsa_circ_0004771基因抑制对MG63 细胞中Bax、Bcl-2、cleaved Caspase-3、Caspase-3、c-Myc 表达水平影响的检测 采用Western blot 法。细胞分组同1.5项,取对数生长期的各组MG63 细胞,加入含蛋白酶抑制剂的细胞裂解液提取总蛋白,BCA 试剂盒测定蛋白含量。取等量蛋白质样品,经12% SDS-PAGE分离后,转移至PVDF 膜,用TBST 稀释的5%脱脂牛奶于4 ℃封闭2 h;加入兔抗Bax、Bcl-2、cleaved Caspase-3、Caspase-3、c-Myc、Actin 单克隆抗体(均按1 ∶1 000 稀释),4 ℃孵育过夜;TBST 洗涤3 次,加入HRP标记的山羊抗兔IgG(1 ∶10 000 稀释),4 ℃孵育2 h;用双蒸水终止反应,ECL 显色。ImageJ 软件统计灰度值。目的条带相对表达量以目的蛋白与β-actin灰度值比值表示。
1.10统计学分析 应用GraphPad Prism 5 统计学软件进行统计分析,数据均以均值± 标准差(±s)表示,两组间比较采取t检验,多组间比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结 果
2.1shRNA 的干扰效果 shRNA1、shRNA2、shRNA3、shRNA-NC 及空白对照组MG63 细胞中hsa_circ_0004771基因相对表达量分别为0.15 ± 0.06、0.48±0.08、0.60±0.09、0.99±0.05、1.00±0.01。与空白对照组比较,shRNA-NC 组MG63 细胞中hsa_circ_0004771基因相对表达量差异无统计学意义(t=0.340,P> 0.05),shRNA1、shRNA2、shRNA3 组均显著降低(t分别为24.204、11.171、7.651,P均<0.05),其中shRNA1 的干扰效果最好,因此选择shRNA1 进行后续试验。
2.2hsa_circ_0004771基因抑制对MG63 细胞EdU阳性细胞数的影响 shRNA1、shRNA-NC 及空白对照组EdU 阳性细胞数分别为(18.79±9.68)、(92.32±7.12)、(88.62±8.59)个。与空白对照组比较,shRNA1组EdU 阳性细胞数明显降低(t= 9.346,P<0.05),shRNA-NC 组差异无统计学意义(t=0.574,P>0.05)。见图1。
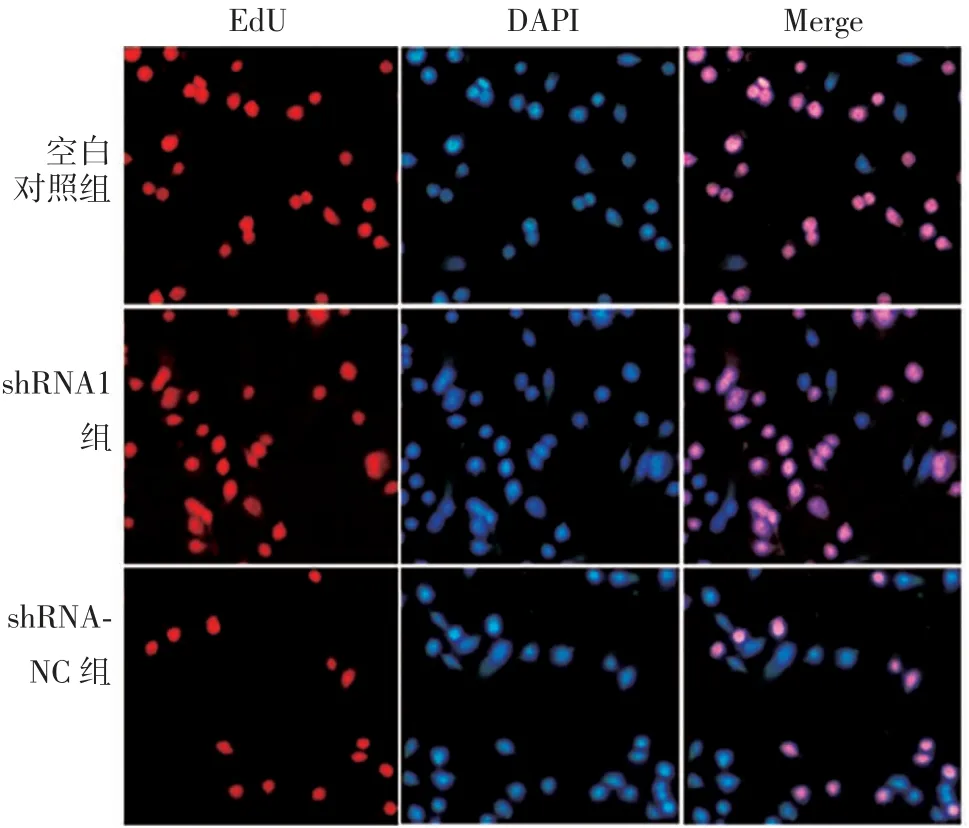
图1 各组MG63 细胞的EdU 阳性细胞数(EdU 染色,× 200)Fig.1 Counts of EdU positive cells in MG63 cells of various groups(EdU staining,× 200)
2.3hsa_circ_0004771基因抑制对MG63 细胞凋亡率的影响
2.3.1流式细胞术 shRNA1、shRNA-NC 及空白对照组MG63 细胞凋亡率分别为(28.93 ± 2.76)%、(5.38±1.21)%、(5.42±0.83)%。与空白对照组比较,shRNA1 组MG63 细胞凋亡率明显升高(t=14.129,P<0.05),shRNA-NC 组差异无统计学意义(t=0.047,P> 0.05)。见图2。
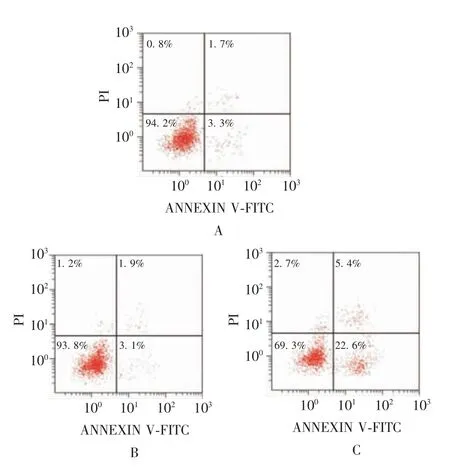
图2 流式细胞术检测各组MG63 细胞的凋亡情况Fig.2 Flow cytometry of apoptosis of MG63 cells in various groups
2.3.2Hoechst 染色 shRNA1、shRNA-NC 及空白对照组MG63 细胞凋亡率分别为(31.80 ± 2.12)%、(14.08 ± 1.06)%、(12.72 ± 1.06)%。与空白对照组比较,shRNA1 组MG63 细胞凋亡率明显升高(t=13.943,P<0.05),shRNA-NC 组差异无统计学意义(t= 1.571,P> 0.05)。见图3。

图3 Hoechst 染色法检测各组MG63 细胞的凋亡情况(Hoechst 染色,× 200)Fig.3 Hoechst staining of apoptosis of MG63 cells in various groups(Hoechst staining,×200)
2.4hsa_circ_0004771基因抑制对MG63 细胞线粒体膜电位的影响 shRNA1、shRNA-NC 及空白对照组MG63 细胞线粒体膜电位分别为(2.73 ± 0.85)%、(53.13 ± 1.03)%、(51.26 ± 1.18)%。与空白对照组比较,shRNA1 组MG63 细胞线粒体膜电位明显降低(t= 57.800,P<0.05),shRNA-NC 组差异无统计学意义(t= 2.068,P> 0.05)。见图4。

图4 各组MG63 细胞的线粒体膜电位Fig.4 Mitochondrial membrane potential of MG63 cells in various groups
2.5hsa_circ_0004771基因抑制对MG63细胞中MDA及LDH 含量的影响 shRNA1、shRNA-NC 及空白对照组MG63 细胞中MDA 含量分别为(4.10±0.50)、(2.36 ± 0.20)、(2.30 ± 0.30)mmol / L,LDH 含量分别为(1 776.62 ± 213.18)、(896.77 ± 198.61)、(878.94±245.08)U/L。与空白对照组比较,shRNA1组MG63 细胞中MDA 及LDH 含量显著升高(t分别为5.347 和4.787,P均<0.05),shRNA-NC 组差异无统计学意义(t分别为0.288 和0.098,P均>0.05)。
2.6hsa_circ_0004771基因抑制对MG63 细胞中Bax、Bcl-2、cleaved Caspase-3、Caspase-3、c-Myc 表达水平的影响 与空白对照组比较,shRNA1 组Bax / Bcl-2、cleaved Caspase-3/Caspase-3 比值明显升高(t分别为22.395 和7.593,P均<0.05),c-Myc 蛋白表达水平显著降低(t=4.201,P<0.05);shRNA-NC 组Bax/Bcl-2、cleaved Caspase-3/Caspase-3 比值及c-Myc 蛋白表达水平差异均无统计学意义(t分别为0.775、1.225、0.541,P均> 0.05)。见图5 和表1。
表1 各组MG63 细胞中Bax/Bcl-2、cleaved Caspase-3/Caspase-3及c-Myc 的表达水平( ± s,n = 3)Tab.1 Expression levels of Bax /Bcl-2,cleaved Caspase-3/Caspase-3 and c-Myc in MG63 cells of various groups(x±s,n=3)
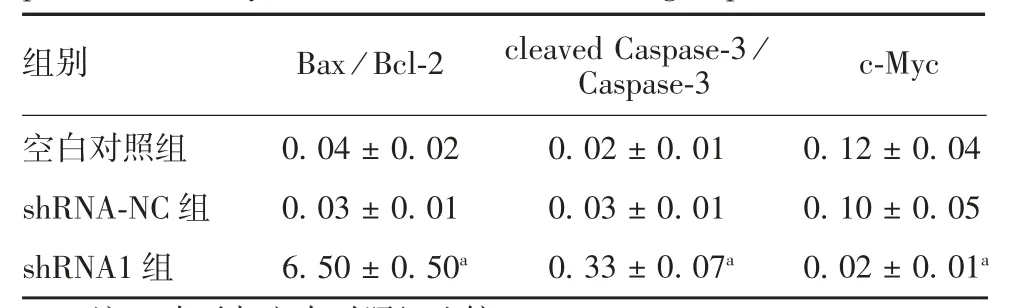
表1 各组MG63 细胞中Bax/Bcl-2、cleaved Caspase-3/Caspase-3及c-Myc 的表达水平( ± s,n = 3)Tab.1 Expression levels of Bax /Bcl-2,cleaved Caspase-3/Caspase-3 and c-Myc in MG63 cells of various groups(x±s,n=3)
注:a 表示与空白对照组比较,P <0.05。
?
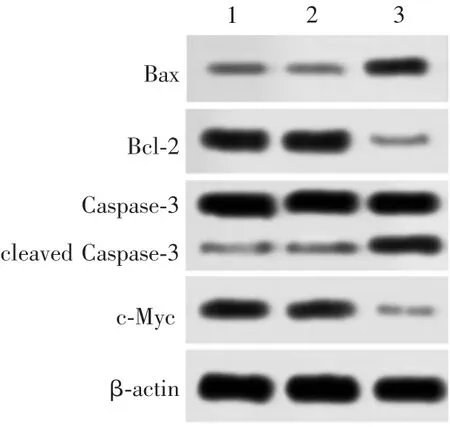
图5 Western blot 法检测MG63 细胞中Bax、Bcl-2、cleaved Caspase-3、Caspase-3、c-Myc 的表达水平Fig.5 Determination of expression levels of Bax,Bcl-2,Caspase-3,cleaved Caspase-3 and c-Myc proteins in MG63 cells by Western blot
3 讨 论
circRNA 在生物系统中广泛表达,在哺乳动物细胞中高度保守,且较稳定,这些特性使circRNA 可能成为诊断各种癌症的理想生物标志物[7]。相关研究表明,hsa_circ_0004771是一个功能性circRNA 基因,在大肠癌患者血清的外泌体中高表达,对大肠癌有一定诊断价值[8];hsa_circ_0004771在胃癌组织中的表达水平也上调,可作为胃癌的新型诊断和动态监测生物标志物[9]。
细胞增殖是恶性肿瘤的基本生物学特征,抑制肿瘤细胞增殖对临床治疗肿瘤有指导意义。HUANG等[10]研究发现,hsa_circ_0004771通过miR-339-5p /CDC25A 轴抑制食管鳞状细胞癌增殖。本研究发现,hsa_circ_0004771shRNA 可明显降低MG63 细胞EdU阳性细胞数,提示基因干扰hsa_circ_0004771可抑制MG63 细胞增殖。促凋亡蛋白Bax 和抗凋亡蛋白Bcl-2 可相互作用,形成的复合物比例的高低可判定细胞凋亡状态[11]。细胞质中的Caspase-3 一般无活性,以procaspase-3 形式存在,当细胞受到凋亡刺激时,被激活,进而诱导细胞发生凋亡,当Caspase-3 活化时意味着凋亡进入不可逆阶段[12]。c-Myc 为原癌基因,可介导肿瘤细胞无限增殖,促进肿瘤细胞凋亡,相关研究表明,c-Myc 高表达可促进骨肉瘤的发生[13]。XIE 等[14]研究发现,敲除hsa_circ_0004771可抑制乳腺癌细胞系中的细胞增殖并诱导其凋亡。本研究发现,hsa_circ_0004771shRNA 干扰后可明显升高MG63 细胞Bax / Bcl-2、cleaved Caspase-3 /Caspase-3 比值(P<0.05),显著降低c-Myc 蛋白表达水平(P<0.05)。提示干扰hsa_circ_0004771基因可诱导MG63 细胞凋亡。
氧化应激是一种复杂的动态过程,其特点是保持活性氧生成与抗氧化剂的活性及有效性之间的平衡。线粒体是真核生物进行能量代谢的主要场所,在自由基产生、细胞凋亡和衰老等生理病理活动中发挥着重要作用,是氧化应激的重要靶细胞器,当线粒体的正常生理功能受到破坏,导致线粒体膜电位下降,从而导致细胞发生凋亡[15]。MDA 是脂质过氧化的最终产物,MDA 的测定能反映脂质过氧化水平,间接反映出细胞损伤程度[16]。LDH 属于氧化还原类酶,参与机体的能量代谢,LDH 的含量高低反映了细胞的活力。本研究发现,hsa_circ_0004771shRNA可显著提高MG63 细胞MDA、LDH 含量(P<0.05),明显降低线粒体膜电位的作用(P<0.05),提示干扰hsa_circ_0004771基因可通过改善氧化应激调节MG63 细胞增殖和凋亡。
综上所述,hsa_circ_0004771基因干扰可抑制骨肉瘤细胞MG63 增殖,促进细胞凋亡,降低线粒体膜电位,改善氧化应激的作用。本研究为骨肉瘤新治疗策略的研究提供了实验依据。今后也将通过动物及临床水平验证hsa_circ_0004771基因干扰对骨肉瘤的作用及其作用机制。

