Ru/WO3纳米催化剂的制备、表征及催化氨硼烷水解性能研究
赵红鸽,张世豪,郑修成*
(1. 黄淮学院 化学与制药工程学院, 河南 驻马店 463000;2. 郑州大学 化学学院, 河南 郑州 450001)
0 引言
随着社会的快速发展,人类对能源的需求量与日俱增。因此,大力发展低碳能源已迫在眉睫。氢气具有燃烧性能好、发热值高(120 MJ/kg)、耗损少、利用率高、无污染、来源广泛等优点,被认为是一种最具发展前景的新型清洁能源[1]。尽管如此,当下氢能利用面临着存储和运输不便的困境,阻碍了其商业化进程。
研究表明,固态储氢材料释氢是一种行之有效的制氢方式。其中,氨硼烷(NH3BH3,简称AB)具有含氢量高(质量分数为19.6%)、在极性溶剂(如水、甲醇等)中溶解度大、室温下稳定性好等特点,得到学者们的普遍关注[2-5]。一般而言,AB可以通过热分解、水解和醇解三种途径释放氢气。热解工艺所需设备复杂、能耗高,同时伴随着氨气、乙硼烷、硼吖嗪及复杂低聚混合物的生成[6]。水解和醇解反应在室温甚至更低温度下即可发生,能耗低、操作便捷、可控性强且可制备出高纯氢气,因而更具发展前景。与醇解相比,水解工艺更环保、成本更低且反应速率快[7]。然而,室温下AB水解在动力学上几乎不可行,需要适当催化剂的参与。与其他贵金属(如Rh、Pt、Pd等)相比,Ru具有造价低廉、催化AB水解性能较突出的优势。而负载型金属催化剂在保证催化性能的前提下,可以大幅减少贵金属的使用量,降低催化剂成本。因此为AB水解制氢反应研发高效的负载型Ru基催化剂极有意义。
众所周知,WO3晶体易产生氧空位,作为载体时可以提供牺牲位点,吸附AB水解反应的副产物(如偏硼酸铵),从而抑制其占据催化剂的活性位点,提高催化剂的循环稳定性。鉴于此,本工作通过直接焙烧钨酸铵制备WO3载体,继而通过吸附-化学还原工艺负载Ru纳米粒子(nanoparticles, NPs),采用多种手段对其进行表征,探究不同Ru负载量对AB水解速率的影响。最后在最佳催化剂作用下,研究相应的反应动力学及循环稳定性,并验证不同NaOH用量对反应速率的影响,为固态储氢材料的液相释氢研究提供理论基础。
1 实验部分
1.1 试剂和分析仪器
氯化钌、氨硼烷,上海阿拉丁生化科技有限公司;硼氢化钠、氢氧化钠,天津市科密欧化学试剂有限公司;钨酸铵,上海麦克林生化科技有限公司;浓盐酸,郑州派尼化学试剂厂。
Panalytical XPert Pro X-射线衍射仪,Zeiss Ultra 55扫描电子显微镜,JEM-2100型透射电子显微镜Renishaw RM-1000显微共焦激光拉曼光谱仪,AXIS Supra X-射线光电子能谱仪。
1.2 催化剂的制备
将盛有2.0 g钨酸铵的坩埚移于马弗炉中,升温至550 ℃(升温速率:4 ℃/min)并保温2 h,得到WO3粉体。
以制备负载质量分数为2.0%的Ru/WO3催化剂为例。取20.0 mL去离子水于100 mL烧杯中,搅拌下滴加2.0 mol/L的稀盐酸,调节体系pH=2~3;用移液枪加入RuCl3溶液5.04 mL(CRu3+=0.794 mg/L),搅拌12 h后滴加适量的NaOH溶液(2.0 mol/L)调节pH值至6~7;将44.9 mg的NaBH4溶于8.0 mL去离子水中,并缓慢滴于上述RuCl3溶液中,持续搅拌12 h,用去离子水抽滤洗涤所得固体至滤液呈中性,将所收集的滤饼冷冻干燥。若没有特殊说明,下文中Ru/WO3均指该负载量的催化剂。
采用上述相同工艺,制备一系列其他Ru/WO3催化剂(即Ru负载质量分数分别为1.0% 、1.5%和2.5%)。
1.3 氨硼烷水解释氢实验
以配置有油浴的MR Hei-Tec磁力搅拌器控制反应温度和磁子搅拌速度,以配置有磁子和恒压滴液漏斗的50 mL两口圆底烧瓶为反应器。首先将油浴控制在设定温度,经由恒压滴液漏斗向装有20.0 mg所制催化剂的反应瓶中加入溶有10.0 mg AB的去离子水(15.0 mL),磁力搅拌下对催化剂进行预还原处理。随后将一定量的AB溶于10.0 mL去离子水中,并经由恒压滴液漏斗注入反应瓶中。在磁力搅拌下发生水解反应,所产生的气体先经由盛有稀盐酸溶液(1.0 mol/L、50 mL)的洗瓶处理去除可能生成的氨气等气态副产物,随后利用RTK-SBH系统在线记录生成的氢气体积,通过理想气体状态方程(PV=nRT)将所得氢气体积校准到标准状况下,将其对反应时间(t)作图即得到AB水解释氢曲线,具体实验条件列于正文相应部分。
(1)
lnν=lnk+αlnCRu+βlnCAB,
(2)
k=Ae-Ea/(RT),
(3)
lnν=-Ea/(RT)+C,
(4)
TOF=nhydrogen/(t·nRu)。
(5)
式(1)和(2)为AB水解释氢反应速率(ν)式,其中k代表反应速率常数,CRu和CAB分别代表反应体系中Ru和AB的初始浓度,α和β分别代表该水解反应对Ru和AB浓度的反应级数。根据Arrhenius公式,以lnν对1/T作图,拟合得到一条直线,由该直线的斜率即可获得此催化反应的表观活化能Ea,见式(3)和(4),其中A为指前因子,R为摩尔气体常量8.314 J/(mol·K),B=αlnCRu+βlnCAB,C=lnA+B。转化频率(turnover frequency,TOF)按照式(5)计算,其中nhydrogen为所释放的氢气量(mol)、t为相应的反应时间(min)、nRu为反应体系中Ru的量(mol)。
催化剂的循环性能是评价催化剂性能好坏的一个重要参数。本研究在AB用量为31.0 mg、催化剂用量为10.0 mg、反应温度为303 K的反应条件下,对Ru/WO3的循环性能进行了评价。每完成一次水解反应,立刻补充相同质量(31.0 mg)的AB以开始下一个循环。
为验证强碱对AB水解释氢速率的影响,在上述反应条件下,加入不同质量的NaOH,进行了一系列AB水解释氢实验。
2 结果与讨论
图1为所制WO3粉体及Ru/WO3催化剂的XRD图。WO3的各个衍射峰分别对应于单斜相WO3(M-WO3)的相应晶面(JCPDS No. 43-1035),且没有其他杂峰,说明焙烧钨酸铵成功制备出单一晶相的WO3[8]。与WO3相比,Ru/WO3呈现出相似的衍射特征,表明Ru的负载并未对WO3的晶相结构造成显著影响。另外,在该催化剂的XRD衍射图上并未出现Ru的特征峰,说明Ru NPs在该载体上未发生明显的团聚。这种较高分散态有利于暴露出更多的表面活性位,进而呈现出较高的催化活性。

图1 WO3和Ru/WO3的XRD图Fig. 1 XRD patterns of WO3 and Ru/WO3
为探索所制催化剂的结构信息,分别利用扫描电镜和透射电镜技术对Ru/WO3进行了表征。由图2(a)和(b)可知,WO3粉体表面比较粗糙,且存在大量的大孔和亚微米孔。这些孔是由于钨酸铵分解过程中所释放的气态产物(如氨气)外逸形成的,它们的存在将有利于反应底物及产物分子的扩散,继而对催化反应产生积极影响。据报道,作为载体,WO3自身的氧缺陷结构有望抑制金属粒子的团聚。从图2(c)可以看出,Ru NPs较均匀地分散在WO3表面或边沿处[6]。由图2(d)所示的高分辨透射电镜(HRTEM)图,可以观察到分别归属于WO3和Ru的晶格线,其中间距为0.206 nm的晶面对应于Ru的(101)面[9]。

图2 Ru/WO3的SEM(a、b)、TEM(c)及HRTEM图(d)Fig. 2 SEM images (a, b), TEM image (c) and HRTEM image (d) of Ru/WO3
图3所示的Ru/WO3的EDX图表明Ru、W和O元素的存在。而且Ru分散较均匀,进一步说明Ru较均匀地分散于WO3载体上。

图3 Ru/WO3的EDX图Fig. 3 EDX mapping of Ru/WO3
由图4可知,WO3和Ru/WO3均表现出单斜相WO3的拉曼吸收特征,其中131.1和182.9 cm-1处的峰分别对应于O—O键和W—O键的扭转振动,269.9和321.8 cm-1处的峰对应于O—W—O键的弯曲振动,710 cm-1代表W—O伸缩振动,而803.8 cm-1处的峰则代表O—W—O键的伸缩振动[10]。另外,与WO3相比,Ru/WO3的吸收峰略有偏移,这是源于氧缺陷程度的差异,随后的XPS谱将对此做进一步佐证。

图4 WO3和Ru/WO3的拉曼光谱Fig. 4 Raman spectra of WO3 and Ru/WO3
采用XPS技术探究了WO3和Ru/WO3表面化学信息,结果如图5所示。与WO3相比,Ru/WO3的XPS全谱表明除了W和O,还存在Ru元素(图5 (a)),证实了Ru在WO3载体上的成功负载。二者全谱中出现的C元素是源于制备XPS分析样所用的导电胶。图5 (b)为Ru 3p精细谱,其中462.6和464.9 eV处的峰分别对应于Ru03p3/2和Run+3p3/2[11]。Ru0的存在证明了Ru3+被NaBH4成功还原为单质态,Run+的出现是所制催化剂暴露于空气中或者制备XPS分析样过程中部分Ru NPs的氧化所致,这一现象在金属纳米催化剂中很常见。这也是需要在催化AB水解反应前对催化剂进行预还原处理的原因。图5(c)所示的W 4f精细谱证实了W6+和W5+的共存,即在WO3中存在氧缺位。图5(d)为两个样品的O 1s精细谱,其中位于530.1、530.5和530.9 eV处的峰分别对应于金属氧化物的晶格氧(OL)、氧空位(OV)和化学吸附氧(OC)。与单纯WO3相比(晶格氧、氧空位和化学吸附氧的含量分别为33.6%、17.9%和48.5%),Ru/WO3的晶格氧和氧空位分别降至31.5%和37.0%,而吸附氧的含量升至31.8%,说明Ru的负载增强了对氧物种的吸附能力[12]。
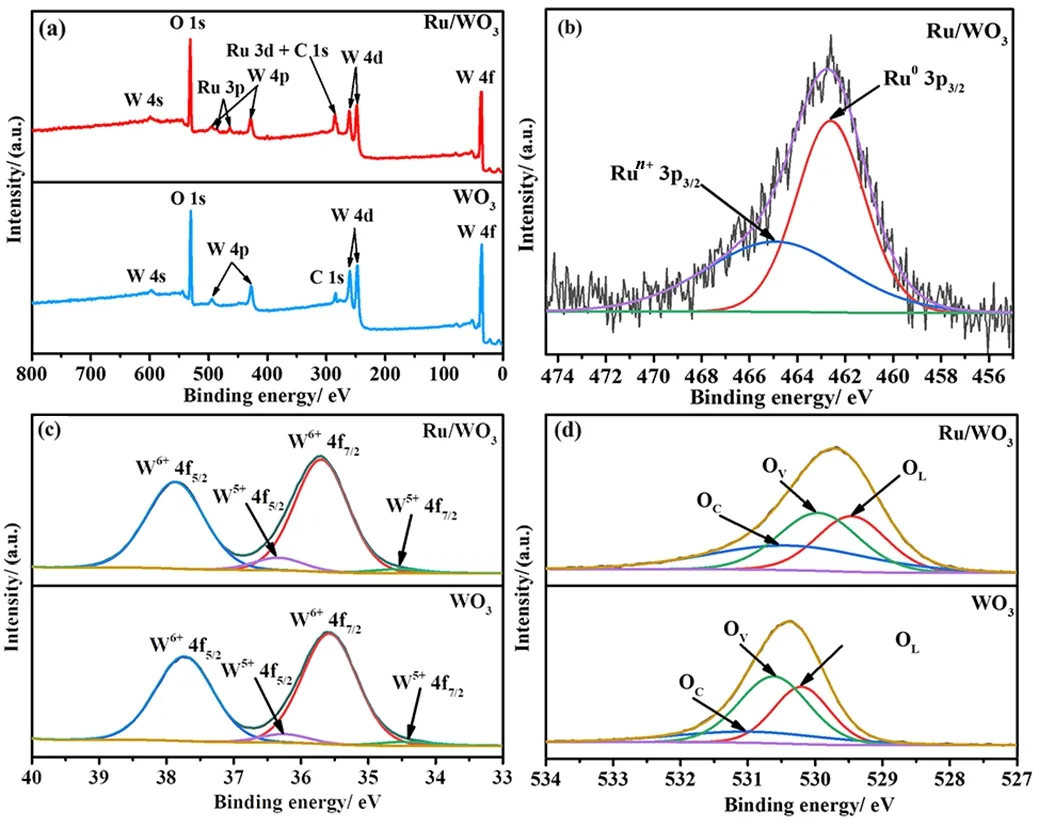
图5 WO3、Ru/WO3的XPS全谱(a)及 Ru 3p(b)、W 4f(c)、O 1s的精细谱(d)Fig. 5 XPS survey spectra of WO3 , Ru/WO3 (a) and the corresponding high resolution spectra of Ru 3p (b), W 4f (c) and O 1s (d)
图6显示了不同Ru负载量对AB水解速率的影响(反应条件:催化剂 20.0 mg、AB 31.0 mg、去离子水 25 mL,反应温度 303 K)。从图6可以看到,单纯WO3对该水解反应没有催化活性,而所制负载型Ru催化剂明显加快了反应速率,表明Ru NPs确为催化剂的活性组分。另一方面,随着Ru负载量增加,反应速率持续加快。但是负载质量分数为2.0%和2.5%的Ru/WO3催化活性基本相当,甚至后者略低。这可能与较高负载量时Ru颗粒长大有关。综合考虑催化剂的成本和催化活性,Ru的最佳负载质量分数为2.0%,相应的Ru/WO3催化剂被用于后续催化反应。
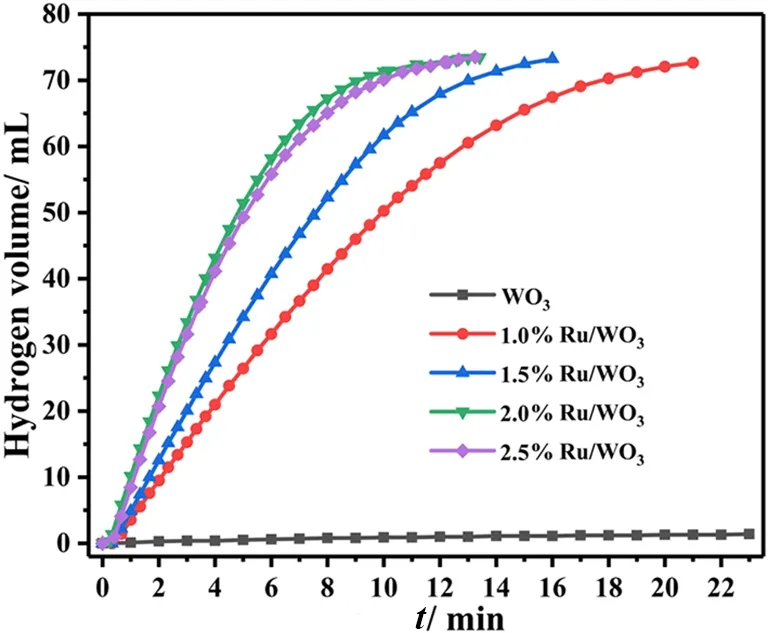
图6 不同Ru负载量对AB水解释氢速率的影响Fig. 6 Effect of different Ru loadings on the rate of AB hydrolysis

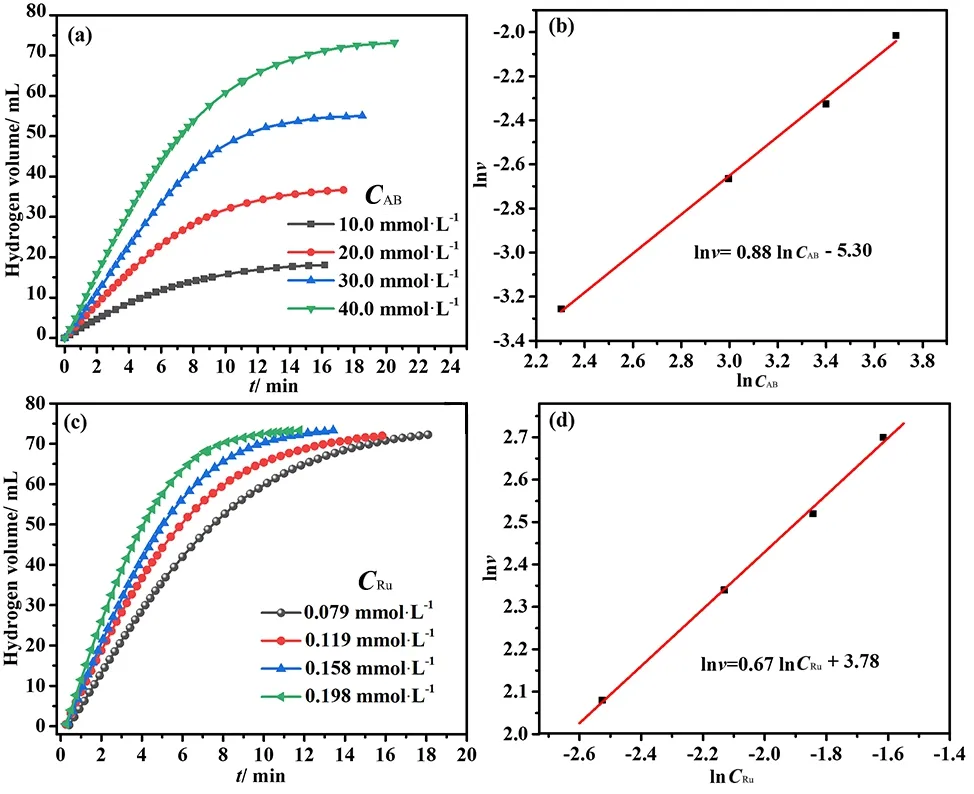
图7 不同反应底物浓度对AB水解释氢速率的影响(a)及相应ln ν~ln CAB关系曲线(b),不同催化剂用量对AB水解释氢速率的影响(c)及相应ln ν~ln CRu拟合直线(d)Fig. 7 Effect of different substrate concentrations on the rate of AB hydrolysis (a) and the corresponding curve of ln ν~ln CAB (b),effect of different Ru/WO3 dosages on the rate of AB hydrolysis (c) and the corresponding curve of ln ν~ln CRu (d)
图8(a)为不同反应温度下,Ru/WO3催化AB水解的释氢曲线(反应条件:Ru/WO310.0 mg、AB 31.0 mg、去离子水 25 mL)。 随着温度的升高,AB水解速率持续增大。即升高反应温度对AB水解速率起到积极作用。由图8(b)可知,Ru/WO3催化AB水解反应的Ea为34.93 kJ/mol,低于不少已报道Ru基催化剂的相应值,如Ru/CS(Ea=41.30 kJ/mol[9]、Ru/BC-hs(Ea=45.70 kJ/mol)[13]、Ru/ND(Ea=50.70 kJ/mol)[14]、Ru0/CeO2(Ea=51.00 kJ/mol)[15]等。

图8 不同反应温度对AB水解释氢速率的影响(a)及相应ln ν~1/T关系曲线(b)Fig. 8 Effect of different temperatures on the rate of AB hydrolysis (a) and the corresponding curve of ln ν~1/T (b)
图9(a)显示了Ru/WO3催化剂的循环性能(反应条件:Ru/WO310.0 mg、AB 31.0 mg、去离子水 25 mL,反应温度 303 K)。在前四次的循环实验中,Ru/WO3催化剂呈现出较稳定的催化活性,表明其具有较好的循环稳定性。随后其催化活性有所降低,对应的TOF由初始的147.2降至87.6 min-1。这是由于随着循环实验的进行,AB水解生成的副产物(偏硼酸铵)浓度不断增加,起初WO3载体中的氧缺陷可与BO2-结合,随着BO2-不断生成,由缺陷提供的牺牲位点逐渐饱和,因而活性位点逐渐被副产物分子占据。同时,这些副产物也增大了体系的黏度,降低了催化剂表面活性位的可及性和可利用率,导致催化剂活性下降。另外,催化剂活性降低还可能与Ru NPs粒度增大和部分团聚有关,这一点在本课题组前期工作中已得到验证[5, 7, 9, 11]。图9 (b)显示了不同NaOH用量对AB水解速率的影响。与未使用NaOH的体系相比,强碱的加入加快了AB水解速率。当其用量由0.3 g增至0.9 g时,相应的TOF值由297.3 min-1增至449.6 min-1。 这是因为引入适量OH-将提高Ru表面的电荷密度,有利于H2O中O—H的氧化,进而加速释氢速率。但是,当NaOH用量继续增大至1.2 g时,相应的TOF值略降至445.1 min-1。这可能与过多OH-占据Ru NPs表面活性位有关。因此,在本文实验条件下,最佳NaOH用量为0.9 g。
3 结论
通过直接焙烧钨酸铵制备出WO3载体,继而采用吸附-化学还原工艺制得一系列负载型Ru纳米催化剂。得益于较丰富的孔结构、较高的Ru分散度及WO3载体的氧缺陷,最佳催化剂Ru/WO3对AB水解呈现出优异的催化性能,表观活化能仅为34.93 kJ/mol。在适量NaOH存在下,TOF值达到449.6 min-1。本研究工作为固态储氢材料的液相释氢奠定了一定的理论基础,提供了一种较适用的催化剂材料。

