电针“足三里”等穴对糖尿病胃轻瘫大鼠胃窦Cajal间质细胞自噬与凋亡的影响❋
赵莎彤,肖小娟,魏 星,张天华,黎晓宇,彭 艳
(湖南中医药大学,长沙 410208)
糖尿病胃轻瘫(diabetic gastroparesis,DGP)是糖尿病的一种慢性胃肠道并发症,以胃动力障碍、胃电节律紊乱、排除机械性梗阻为特征,临床表现常伴有餐前过早饱腹感,餐后腹胀满、腹痛、厌食、恶心及食欲减退[1],因其反复导致血糖控制不佳,诱发糖尿病并发症风险增加并产生抑郁心理,造成严重的经济负担,降低患者的生活质量[2]。目前DGP的发病机制尚未完全明确,但众多研究表明,主要与胃肠平滑肌纤维化、自主神经病变、胃肠交感及副交感神经损伤、高血糖因素、胃窦Cajal间质细胞(interstitial cells of cajal,ICC)病变[3]等因素密切相关。从细胞分子水平分析,ICC结构、功能的异常及数量的改变,可能是DGP发病的重要病理基础[4]。近年来研究[5]及本课题组前期研究表明,DGP发病过程中ICC可能存在异常的细胞自噬与凋亡,且两者在机体不同生理病理状态下具有拮抗或协同作用[5-8]。电针改善DGP大鼠胃运动的过程中,细胞自噬与凋亡发生了何种变化,是否与电针的调控机制有关?这一问题尚不明确。基于前期研究基础,本实验建立DGP模型大鼠,通过检测自噬蛋白微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)、家蚕隔离体蛋白1(sequestosome-1,p62)及胃窦ICC凋亡率,结合血糖、胃排空率,初步探讨电针改善DGP胃动力与自噬、凋亡之间的关系,为临床针灸治疗DGP提供理论依据。本研究通过湖南斯莱克景达实验动物有限公司动物伦理委员会审查(批号IACUC-SJA18081)。
1 材料与方法
1.1 动物
SPF级SD大鼠雌雄各半共64只,体质量(200~250)g,购于湖南斯莱克景达实验动物有限公司,实验动物许可证号SCXK(湘)2016-0002。于湖南斯莱克景达实验技术服务部SPF级实验动物房分笼饲养,室温(20~26 ℃),相对湿度40 %~70 %,昼夜循环,保持12 h光照,自由饮食饮水。
1.2 分组与模型制备
适应性喂养7 d后,从64只大鼠中随机抽取13只设为对照组,其余51只腹腔注射链脲佐菌素(streptozocin,STZ)配合高脂高糖饲料不规则喂养8周制备DGP模型[9]。期间造模大鼠死亡2只,8周后在造模组和对照组大鼠中各随机抽取3只进行胃排空率测定,并验证DGP模型是否成功,造模成功率64.7 %。将造模成功的30只大鼠随机分为模型组、电针组、胃复安组每组各10只。实验过程中对动物的处置严格遵照中华人民共和国科学技术部2006年发布的《关于善待实验动物的指导性意见》[10]。
1.3 主要试剂与仪器
链脲佐菌素(streptozocin,STZ)(批号S0130-1 g),美国Sigma公司;胃复安(国药准字H41021141),开封制药有限公司;水合氯醛(批号20151217),国药集团化学试剂有限公司;LC3、P62、β-肌动蛋白(β-actin)抗体(货号分别为GB11124、GB11531、GB12001,Servicebio);RIPA裂解液、蛋白酶抑制剂、BCA蛋白定量检测试剂盒、ECL、SDS-PAGE凝胶制备试剂盒、脱脂奶粉(货号分别为G2002、G2007、G2026、G2014、G2003、G5002,Servicebio);Annexin V-FITC/PI 细胞凋亡检测试剂盒(货号AC12L033),李记生物。
血糖仪及血糖试纸(型号安稳+,三诺);尿糖试纸(型号YY/T0478),高尔宝生物技术有限公司;电针仪及针灸针(型号分别为SDZ-Ⅱ型、0.3 mm×13 mm,华佗牌);紫外分光光度计(型号UV1800),日本岛津公司;荧光倒置显微镜(型号CKX53),日本Olympus公司;AIRTECH 型无菌操作台(型号HVS-1600-U),苏净安泰公司;酶标检测仪(型号Rt2100c),Rayto;冷冻离心机(型号neofuge 13R),heal force;转印电泳仪(型号DYCZ-40 D),北京六一公司;脱色摇床及匀浆仪(型号分别为TSY-B、KZ-Ⅱ,Servicebio)、PVDF膜(型号IPVH00010),美国millipore公司; Bio-rad Trans-Blot小型转印槽转膜仪(型号170-4156),美国BIO-RAD公司;流式细胞仪(型号Accuri C6),BD公司。
1.4 造模方法及评定
所有大鼠适应性喂养7 d后禁食12 h,将STZ临用前用0.1 mmol/L柠檬酸-柠檬酸钠缓冲液(pH 4.5,4°)配成2 %浓度,按55 mg/kg剂量于左下腹快速注射(对照组单次注射等剂量0.1 mmol/L,pH4.5柠檬酸-柠檬酸钠缓冲液)。72 h后尾静脉采血测血糖、尿糖,血糖值≥16.7 mmol/L,尿糖阳性者视为糖尿病大鼠,之后给予高脂高糖饲料(普通饲料、蔗糖、熟猪油、奶粉、鸡蛋之比为 58∶20∶15∶5∶2)不规则喂养(即采用单日上午和双日下午进食法)[11]持续8周(对照组则采用普通饲料喂养8周),期间于每周一下午测定全部大鼠血糖、尿糖值1次。DGP模型成功标准[9]:监测大鼠血糖、尿糖,血糖≥16.7 mmol/L、尿糖阳性者;观察大鼠粪便量和性状、皮毛色泽、精神状态、行为活动与对照组有明显差异者;大鼠胃排空率与对照组有显著差异。
1.5 干预方法
于8周造模结束后开始电针及药物治疗,将大鼠仰卧位固定于鼠板上,定位后局部剪毛、络合碘消毒,采用0.3 mm×13 mm一次性针灸针进行针刺,穴位定位参照《实验针灸学》[12],选取“梁门”(ST21)“足三里”(ST36)“三阴交”(SP6)及三穴直下2 mm取一非穴点作为电针连接的附点进行电针治疗。电针组0.9 %氯化钠溶液灌胃(1 mL/100 g),电针 “足三里”“梁门”“三阴交”三穴及三穴附点直刺进针,针刺深度约2~4 mm,穴位接负极,附点接正极,疏密波(疏波20 Hz,密波100 Hz,疏波时间10 s,密波时间15 s),强度2 mA,时间15 min,每日单侧穴位针刺,次日左右交替取穴。模型组、对照组0.9 %氯化钠溶液灌胃(1 mL/100 g),捆绑对照15 min。胃复安组1.7%浓度胃复安药液灌胃(1 mL/100 g),捆绑对照15 min。治疗期间均普通饲料喂养,自由摄食饮水,每日1次,持续治疗5 d为1个疗程,期间休息2 d共3个疗程。
1.6 指标检测及取材
1.6.1 血糖测定 取大鼠尾静脉血用血糖仪及血糖试纸测血糖并记录造模前、造模后及治疗后血糖值。
1.6.2 组织取材 于实验第19天治疗结束后,所有大鼠禁食24 h、禁水2 h,第20天给予50 mg/dL酚红溶液2 mL灌胃,20 min后给予10 %水合氯醛按3.5 mL/kg剂量腹腔注射麻醉,仰卧位固定于鼠板,大鼠腹部酒精消毒后剖腹,分离干净胃旁系膜后结扎贲门、幽门取胃,沿胃大弯剪开后用0.9 %氯化钠溶液冲洗并收集胃内容物,定容20 mL测定胃排空率。迅速剪取胃窦组织置于含有PBS无菌培养皿内,4 ℃条件下迅速送至生物公司提取ICC原代细胞进行培养并鉴定[13]。采用Western blot法检测LC3、P62蛋白表达,采用流式细胞仪检测并分析细胞凋亡。
1.6.3 胃排空测定 将收集的20 mL胃内容物加入0.5 mmol/L NaOH溶液20 mL搅拌均匀,静置1 h后取5 mL上清液,加0.5 mL 20 %三氯乙酸去蛋白,混匀后3500 r/min离心(离心半径0.1 m)10 min,取上清液用分光光度计在560 nm波长处测吸光度(OD)值。另取2 mL酚红溶液,依次加入蒸馏水18 mL、0.5 mmol/L NaOH溶液20 mL、20 %三氯乙酸4 mL,混匀后测定OD 值为标准酚红OD值。胃排空率=(1-实测标本OD值/标准酚红OD值)×100 %。
1.6.4 Western blot法检测胃窦Cajal间质细胞LC3、P62蛋白表达 培养ICC原代细胞,用PBS清洗ICC细胞2次,使用移液器彻底吸干残留液,将PIPA裂解液与蛋白酶抑制剂混匀并使其充分接触,用细胞刮刀把细胞和试剂刮下,以BCA进行蛋白质定量。经SDS-PAGE凝胶电泳后转到PVDF膜上;5%的脱脂牛奶密封1 h,TBST洗膜3次,加入LC3(1∶1000)、p62(1∶500)和β-actin(1∶1000)抗体,并在4 ℃过夜孵育一抗。将二抗用TBST稀释3000倍,室温下孵育30 min,TBST洗涤后滴加ECL化学发光液,暗室曝光、显影和定影。将胶片进行扫描存档,Alpha软件处理系统分析目标条带的光密度值,最后进行统计分析。
1.6.5 流式细胞仪检测胃窦Cajal间质细胞凋亡 将ICC原代细胞接种至6孔板,37 ℃ 5%CO2饱和湿度下继续培养。待细胞生长至60 %~70 %时开始处理,把细胞培养基吸至15 mL离心管内,离心5 min弃上清,收集细胞PBS缓冲液洗涤细胞,胰酶消化细胞,先用0.5 mL预冷的 1×结合缓冲液重悬细胞, 依次加入5 μL Annexin V-FITC和Propidium Todide(PI)10 μL混匀, 室温下避光孵育15 min后,于1 h内进行流式细胞术检测Cajal间质细胞凋亡。
1.7 统计学方法
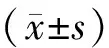
2 结果
2.1 各组大鼠血糖值比较
图1示,造模后与对照组比较,造模组(模型组、电针组、胃复安组)血糖值均显著升高(P<0.01);除对照组外,模型组、电针组、胃复安组造模前后自身比较血糖值均呈明显升高(P<0.01)。治疗后与模型组比较,电针组血糖水平降低(P<0.05),胃复安组血糖值有所下降,但差异无统计学意义(P>0.05);电针组、胃复安组治疗前后比较血糖值均显著下降(P<0.01);电针组、胃复安组比较差异无统计学意义(P>0.05)。
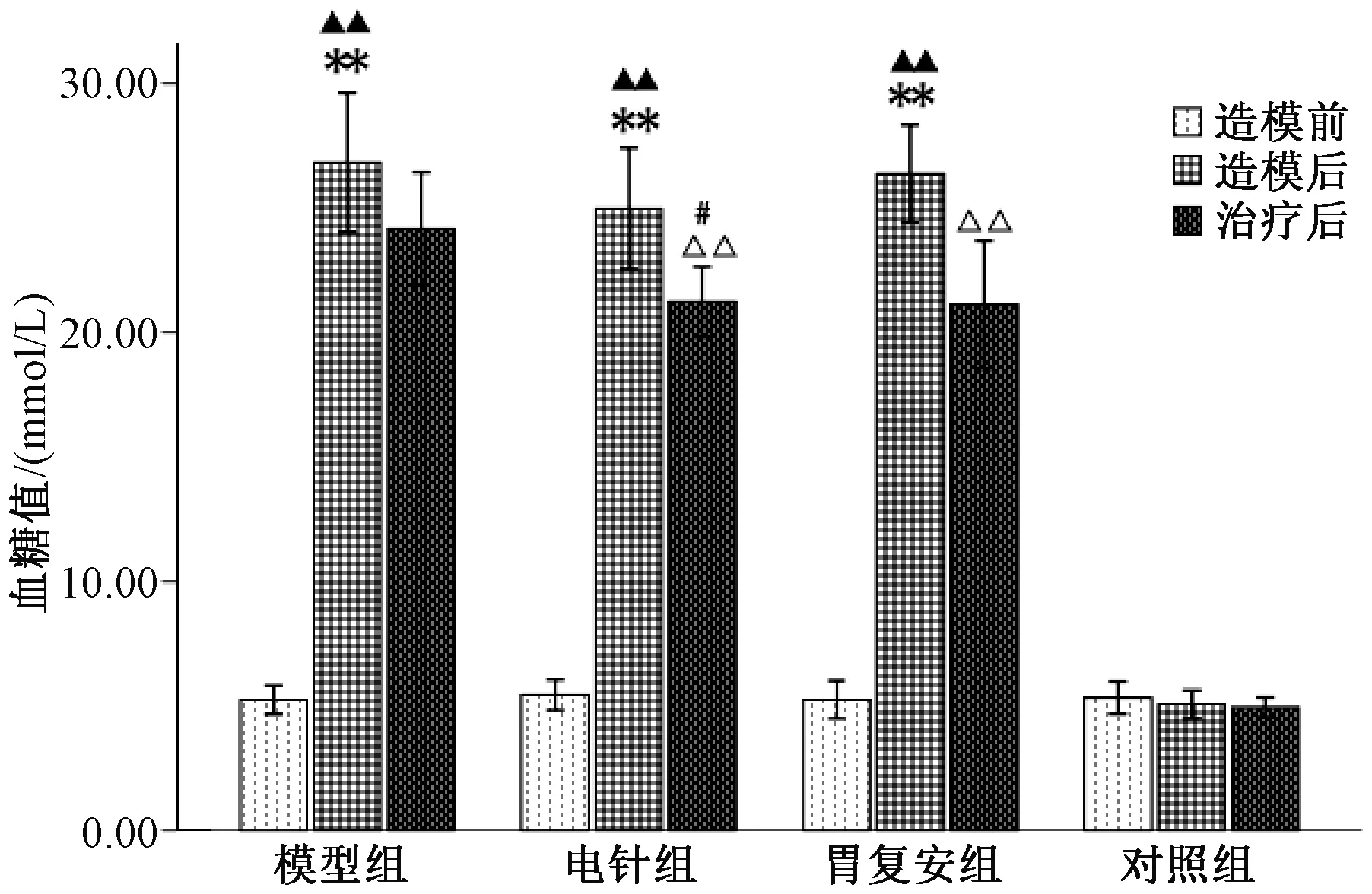
注:造模前后自身比较:▲▲P< 0.01;治疗前后自身比较:△△P< 0.01;与对照组比较:**P< 0.01;与模型组比较:#P< 0.05
2.2 各组大鼠胃排空率比较
与对照组比较,模型组胃排空率显著降低(P<0.01);与模型组比较,电针组、胃复安组胃排空率均显著上升(P<0.01);电针组和胃复安组组间比较差异无统计学意义(详见图2)。

注:与对照组比较:**P< 0.01;与模型组比较:##P< 0.01
2.3 各组大鼠胃窦Cajal间质细胞LC3Ⅱ/Ⅰ、P62蛋白表达比较
与对照组比较,模型组大鼠 LC3-Ⅱ/Ⅰ比值及P62相对表达量均显著上升(P<0.01);与模型组比较,电针组、胃复安组LC3-Ⅱ/Ⅰ比值及P62相对表达量均显著降低(P<0.01)。电针组、胃复安组组间比较LC3-Ⅱ/Ⅰ比值、P62相对表达差异无统计学意义(P>0.05)(详见图3)。

注:与对照组比较:**P< 0.01;与模型组比较:##P< 0.01;A.为模型组;B.为电针组;C.为胃复安组;D.为对照组
2.4 各组大鼠胃窦Cajal间质细胞凋亡率比较
与对照组比较,模型组细胞凋亡率显著升高(P<0.01);与模型组比较,电针组和胃复安组细胞凋亡率明显下降(P<0.01或P<0.05)。与电针组比较,胃复安组细胞凋亡率升高(P<0.05)(详见图4)。
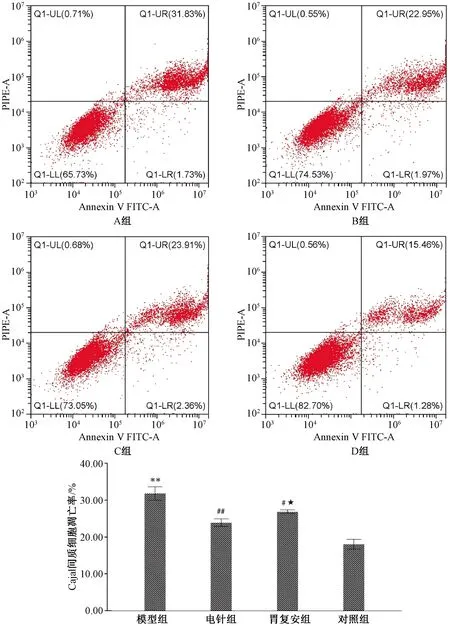
注:与对照组比较:**P< 0.01;与模型组比较:##P< 0.01,#P< 0.05;与电针组比较:★P< 0.05;A.模型组;B电针组;C.胃复安组;D对照组
3 讨论
根据DGP典型临床表现其属于中医学“消渴”兼“痞满”“腹痛”“呕吐”等病证范畴[14]。明·孙一奎《赤水玄珠》记载:“一日夜小便二十馀度……味且甜……饮食减半,神色大瘁……不能食者必传中满鼓胀”,所言“中满”与本病密切相关。其病机变化复杂,因消渴病日久气阴亏虚,或致气滞、痰湿、食积、瘀血等病理产物阻滞,导致中焦气机升降失常,总属本虚标实之证[15,16]。研究表明,针灸治疗胃肠疾病具有良好的双向调节作用,可将趋于亢进或减弱的胃肠功能恢复平衡[17,18]。本实验选用“足三里”“梁门”“三阴交”穴位旨在健脾和胃,疏肝理气,是临床常用调节胃运动的腧穴。本实验研究结果显示,电针“足三里”等穴位后可有效降低DGP模型大鼠的血糖值,促进胃排空,这与我们前期研究结果一致[19]。胃复安组治疗前后自身比较时血糖值显著下降,但与模型组比较血糖虽呈下降趋势,但差异无统计学意义。胃排空率显著上升,提示胃复安作为促胃动力药,可阻断胃肠多巴胺受体,引起食管及近端小肠平滑肌运动,加速胃肠蠕动,促进胃排空[20]。糖尿病患者存在胃运动障碍,多与高血糖或胃排空延迟有关,两者可互为因果[21],推测胃复安促进胃运动、胃内潴留减少使得血糖得到控制[22]。
近年来,ICC损伤被认为是DGP发病的主要因素。ICC主要存在于胃肠道的肌肉层,是自主神经系统与平滑肌细胞之间的双向通信中介[23],在胃肠运动的起搏和调控中扮演着重要角色。研究显示,糖尿病患者ICC超微结构损伤、数量减少,是导致DGP胃肠功能下降的罪魁祸首[24,25]。上调ICC的数量[26]和改善受损的超微结构[27],可能是针灸治疗DGP改善胃肠动力的关键机制之一。自噬是细胞通过溶酶体对受损细胞器进行自我消化的过程,生理状态下细胞处于低自噬水平,当缺氧、营养不良或应激状态时则会诱导细胞自噬进行自我更新为机体提供营养,倘若自噬行为发生异常,则会引发细胞凋亡或自噬性死亡[28]。LC3是自噬体形成的标志蛋白,自噬启动时定位于胞浆的LC3-I与磷脂酰乙醇胺结合形成LC3-Ⅱ,定位于自噬体内外膜上,在晚期自噬小体、溶酶体融合之前,从自噬体膜去除[29],因此检测LC3-Ⅱ/I的比值可反映自噬启动水平,两者比值增加说明自噬体被诱导,但当自噬体与溶酶体发生融合障碍时,亦可出现LC3-Ⅱ/I比值增加[30],因此尚需结合其他自噬因子综合分析。目前认为P62是一种选择性自噬效应器,在溶酶体中被降解[31],其含量与自噬水平呈负相关。当后期自噬小体与溶酶体融合发生障碍时,LC3Ⅱ升高,同时P62也因在溶酶体中无法降解同时升高[32]。本研究结果显示,模型组LC3-Ⅱ/I比值与P62蛋白表达较对照组均明显升高,提示自噬流受到抑制,经电针处理后,LC3-Ⅱ/I比值与P62蛋白表达均明显下降,说明电针“足三里”等穴位可有效改善自噬小体与溶酶体融合障碍,促进自噬通量。
研究证实,P62表达增加可能表明其自噬降解不足,同时也导致对凋亡的抵抗[31]。细胞凋亡是一种主动式程序性细胞死亡,凋亡与自噬之间可能存在某种相互作用的关系。贾亚萌[33]发现,巴西苏木素能抑制舌癌细胞增殖并促进其凋亡,同时调控AMP激活蛋白激酶/哺乳动物雷帕霉素靶蛋白(amp-activated protein kinase/mammalian target of rapamycin,AMPK/mTOR)通路诱导细胞自噬,提示诱导细胞自噬使细胞进行代谢,同时导致癌细胞凋亡,抑制癌细胞增殖,两者具有协同作用。王卓怡[34]发现,二甲双胍可能通过促进细胞自噬而减少血管内皮细胞凋亡,进而改善糖尿病大鼠血管内皮损伤,提示自噬拮抗凋亡。宋峰[35]表示白介素-1β可诱导大鼠INS-1胰岛β细胞自噬,促进INS-1胰岛β细胞凋亡,证明诱导自噬可促进细胞凋亡。因此,自噬与凋亡可能具有如下3种关系[8]:一是自噬与凋亡呈协同作用,两者均在对方不足时补足缺陷共同促进细胞死亡;二是自噬抗凋亡,自噬能调节凋亡蛋白而使正常细胞存活;自噬促凋亡,自噬能调节正常细胞使有害细胞发生凋亡。前期研究已经证明,糖尿病胃动力障碍大鼠模型ICC数量减少并呈凋亡改变[6,36],在其他病变模型中电针治疗可促进细胞自噬[37],亦可抑制细胞自噬[38],同时抑制细胞发生凋亡改变[39],提示电针具有良性的双向调节效应,可适度调整异常的自噬行为并相应改变凋亡状态。本研究结果显示,模型组凋亡率显著升高,电针和胃复安分别处理后凋亡率均明显下降,而电针组凋亡率下降更为显著。结合LC3、P62结果提示,电针和胃复安均可有效改善自噬通量,同时降低ICC细胞凋亡,但电针效果优于胃复安。从整体观察,凋亡趋势与自噬趋势相反,提示电针可能通过调节ICC自噬抑制ICC凋亡,推测在本研究中自噬与凋亡属于上述第2种关系。
综上所述,本实验初步证实DGP的发生与胃窦ICC自噬抑制、ICC凋亡率升高有关,其自噬小体与溶酶体融合障碍是其主要的病理基础,电针处理能使DGP模型大鼠胃窦ICC凋亡率下降,促进胃窦ICC自噬,其机制可能与调节自噬蛋白LC3、P62的表达及细胞凋亡有关。然而这一过程涉及到的机制十分复杂,电针是通过何种途径调控自噬与凋亡,保护胃窦ICC,改善胃动力,尚有待后续进一步研究。

