基于扩散加权成像的全域子宫内膜纹理分析对早期子宫内膜恶性病变的诊断价值
刘海涛,宋天彬,马杰,王颖,陈瑞
1.中国中医科学院广安门医院南区放射科,北京 102618;2.首都医科大学宣武医院放射与核医学科,北京 100053;3.磁共振成像脑信息学北京市重点实验室,北京 100053;*通信作者 宋天彬 songtb_1984@163.com
子宫体肿瘤根据病理分型分为恶性上皮肿瘤和间叶细胞肿瘤[1],其发病率与致死率居女性生殖系统肿瘤第2位[2]。子宫内膜癌中70%为临床早期,病灶仅局限于子宫体,临床表现较为隐匿[3];MRI具有较高的软组织分辨率,是评估子宫体病变局部肌层浸润和子宫内膜癌术前分期的常规影像学检查[4]。常规MRI对子宫内膜癌分期的总体准确度为92%,但对早期肿瘤检测无特异性[5]。此外,由于子宫内膜病变具有多灶性,宫腔镜下活检作为术前确诊的“金标准”,仍可能存在约10%的假阴性[3]。
扩散加权成像(DWI)能够评估子宫内膜组织水分子扩散特征,其表观扩散系数(ADC)与肿瘤分级成反比,且ADC值有助于区分正常子宫内膜和子宫内膜癌[6]。MR纹理分析通过提取感兴趣区(ROI)内定量的纹理特征评价病灶内部异质性,已广泛应用于预测妇科肿瘤的病理分型、分期等术前风险因素以及术后预后[7-9]。本研究基于DWI多序列图像提取全体素子宫内膜组织纹理参数,构建机器学习模型,从而精准诊断子宫内膜恶性病变,为临床病理诊断提供新的参考。
1 资料与方法
1.1 研究对象 回顾性分析2017年1月—2021年1月首都医科大学宣武医院65例早期子宫内膜病变患者的临床、生化及DWI资料。纳入标准:①子宫内膜病变患者,3.0T DWI检查提示子宫内膜增厚>1.0 cm,且T2脂肪抑制加权图像显示子宫联合带完整,病变仅局限于子宫体,未达宫颈;②无其他恶性肿瘤疾病史;③所有患者行MRI检查后1周内均于本院妇产科行子宫内膜分段诊刮或子宫、双附件切除术以明确病理诊断。最终纳入51例,按照7∶3随机分为训练集37例与测试集14例。本研究经本院医学伦理委员会审查,免除患者知情同意。
1.2 病理检查 内膜组织经石蜡切片、HE染色后,由2位具有5年以上诊断经验的病理科医师采用盲法间隔1周独立分析,结果存在争议时由第3位高年资病理科医师诊断。
1.3 MR图像采集 采用GE Signa 750w 3.0T MR扫描仪(Signa,GE)对盆腔进行局部MR扫描,使用24通道体线圈采集(30±10)min,扫描范围从髂前上棘到阴道外口,各序列扫描参数见表1。
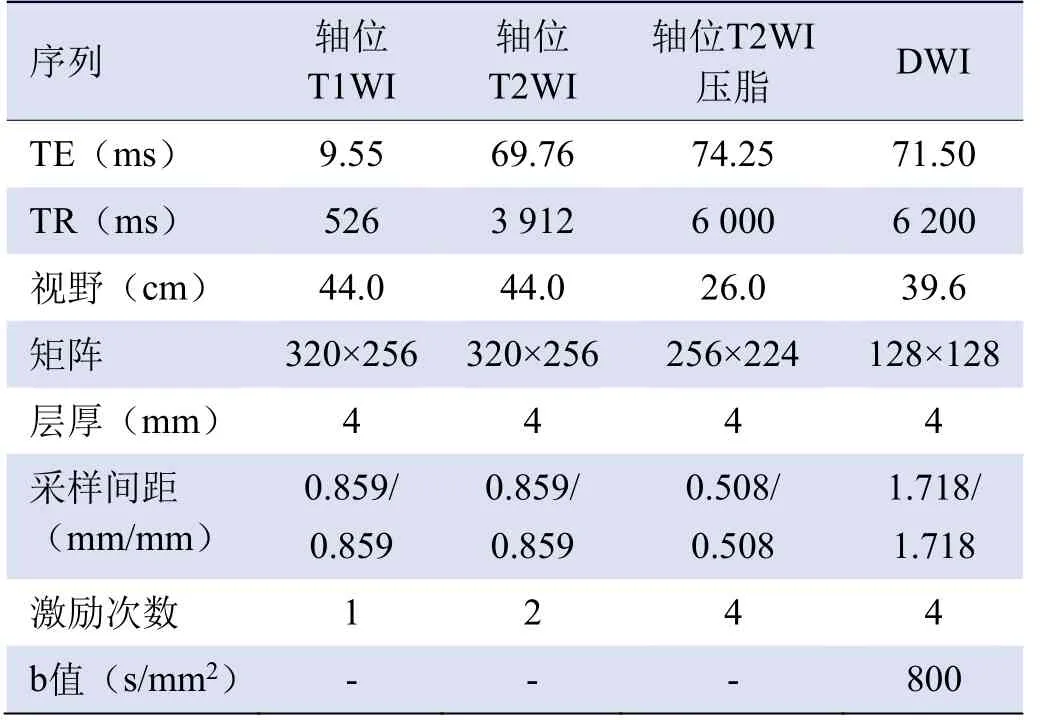
表1 3.0T DWI图像采集序列及扫描参数
1.4 图像预处理及ROI分割 将所有患者的DWI原始图像导入AW 4.6(GE Medical System)工作站生成ADC图像。使用线性插值算法对T1WI、T2WI、T2脂肪抑制序列、b=800 s/mm2DWI及ADC图像进行重采样,采样间隔设置为1 mm×1 mm×1 mm以保证体素各向同性进行后续纹理参数提取。使用开源的3D slicer(https://www.slicer.org)软件[10],由2名具有5年以上经验的放射科医师采用手动分割方式,对b值= 800 s/mm2DWI序列原始图像中的子宫内膜逐层勾画进行全体素分割,最终形成3D ROI(图1)。
1.5 图像纹理参数提取 使用Python 3.6语言开发框架下(https://www.python.org)的PyRadiomics 3.0.1[11]开源插件包对MR的T1WI、T2WI、T2脂肪抑制序列、DWI原始图像、ADC图的3D ROI内的纹理参数进行提取。首先对每个序列图像进行一级小波滤过转换,在3个维度的每个维度应用高通或低通滤波器进行分解,生成8幅小波滤过分解图像,其中包括HHH、LLL、HHL、HLL、LHH、LHL、LLH、HLH图像。然后对5个MR序列的原始图像及小波变换后的衍生图像提取ROI的纹理特征共4 185个(93×9×5),其中每种图像包括一阶统计特征(first order statistics,19 features)、灰度共生矩阵特征(gray level cooccurence matrix,GLCM,24 features)、灰度级长矩阵(gray level run length matrix,GLRM,16 features)、灰度及带矩阵特征(gray level size zone matrix,GLSZM,16 features)、邻域灰度差分矩阵(neighbouring gray tone difference matrix,NGTDM,5 features)、灰度依赖性矩阵(gray level dependence matrix,GLDM,14 features)。测量ADC图像的3D ROI内最小ADC(ADCmin)和平均ADC(ADCmean)。
1.6 特征筛选及影像组学评分 首先对所有特征采用Z-score法进行中心化、归一化处理。在训练集中采用基于快速相关的特征算法(fast based-correlation feature,FCBF)[11]、基于互信息的最大相关-最小冗余算法(minimum redundancy maximum correlation,mRMR)[12]对标准化后的纹理参数进行初步滤过筛选出有意义的特征。采用10折的最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)[13]进行特征筛选,以保留预测恶性子宫内膜病变最有意义且对于逻辑回归机器学习模型拟合最好的特征。再根据LASSO算法保留的特征偏回归系数对纹理参数特征进行线性整合成影像组学评分 (Rad-score)[14-15]。最后在训练集中对患者临床、生化特征进行单因素及多因素统计分析,筛选出有意义的临床特征。
1.7 机器学习模型构建及测试评价 在训练集中对纹理参数整合后的影像组学评分使用逻辑回归算法构建影像组学模型,使用影像组学评分结合筛选后的临床特征构建联合模型,以及单独使用临床特征构建临床模型预测子宫内膜病变的良恶性。在测试集中对3种机器学习模型进行测试。采用受试者工作特征(ROC)曲线下面积(AUC)以及校准曲线评价训练集和测试集下的3种模型预测效能。
1.8 统计学方法 采用R 4.0.3和SPSS 28.0软件,不符合正态分布的计量资料采用M(Q1,Q3)表示,两组比较采用Mann-WhitneyU检验;计数资料以例(%)表示,组间比较采用χ2检验。纹理参数筛选算法、机器学习模型构建及评价采用R语言完成,采用Logistic回归模型筛选构建临床机器学习模型的参数。P<0.05为差异有统计学意义。
2 结果
2.1 患者病理结果及基本资料 51例患者中,恶性病变35例(腺癌33例,肉瘤2例),良性病变16例(单纯内膜增生6例,息肉样增生10例)。训练集和测试集患者年龄、身高、体重、术前生化指标(CA199、CA125、癌胚抗原)及病理类型差异均无统计学意义(P均>0.05),见表2。

表2 早期子宫内膜病变患者基本资料及病理结果
2.2 临床、纹理特征筛选及整合结果 基于DWI的子宫内膜组织全体素纹理参数经过FCBF、mRMR滤过以及LASSO筛选后,共6个纹理参数被保留下来进行机器学习预测子宫内膜病变的病理类型。在LASSO交叉验证下当惩罚系数lambda=0.091时保留的纹理参数最少,且模型预测结果的二项式分布偏差最小,此时逻辑回归机器学习模型在训练集中的模型拟合效果最优(图2)。
6个纹理参数中,4个来自b=800 s/mm2下的DWI原始图像或小波滤过图像(original_glcm_ Idmn_DWI_b=800;wavelet_HLH_glrlm_Low Gray Level Run Emphasis_DWI_b=800;wavelet_HHH_glrlm_Run Variance_DWI_b=800;original_gldm_Large Dependence High Gray Level Emphasis_DWI b=800);1个来自小波滤过的ADC图像(wavelet_LHL_gldm_Large Dependence High Gray Level Emphasis_ADC);1个来自小波滤过的T1图像(wavelet_HHL_first order_Median_T1)。
根据逻辑回归方程机器学习模型的偏回归系数对保留下的纹理参数进行线性整合成影像组学评分。公式为Rad-score=-0.249* original_ glcm_ Idmn _DWI_b=800-0.194*wavelet_HLH_glrlm_Low Gray Level Run Emphasis_DWI_b=800-0.283* wavelet_ LHL_gldm_Large Dependence High Gray Level Emphasis_ADC+0.191* wavelet_HHL_first order_ Median_T1-0.336*wavelet_HHH_glrlm_RunVariance_ DWI_b=800-0.005*original_gldm_Large Dependence High Gray Level Emphasis_DWI_b=800+0.813。
训练集中患者临床特征经过单因素、多因素分析后仅ADCmean被保留用来构建临床机器学习模型,由于采用步进法进行逻辑回归分析,当P<0.05时特征被纳入,当P>0.1时被排除,最后ADCmean的OR值为1.002,P=0.168(表3),被用于构建临床模型。

表3 训练集临床特征多因素逻辑回归筛选结果
2.3 3种模型在训练集和测试集的预测效能 训练集中联合模型、影像组学模型预测子宫内膜病变病理类型效果均表现良好(AUC=0.88,准确度为83.78%),AUC值高于临床模型(AUC=0.69,准确度为72.97%),见图3、表4。
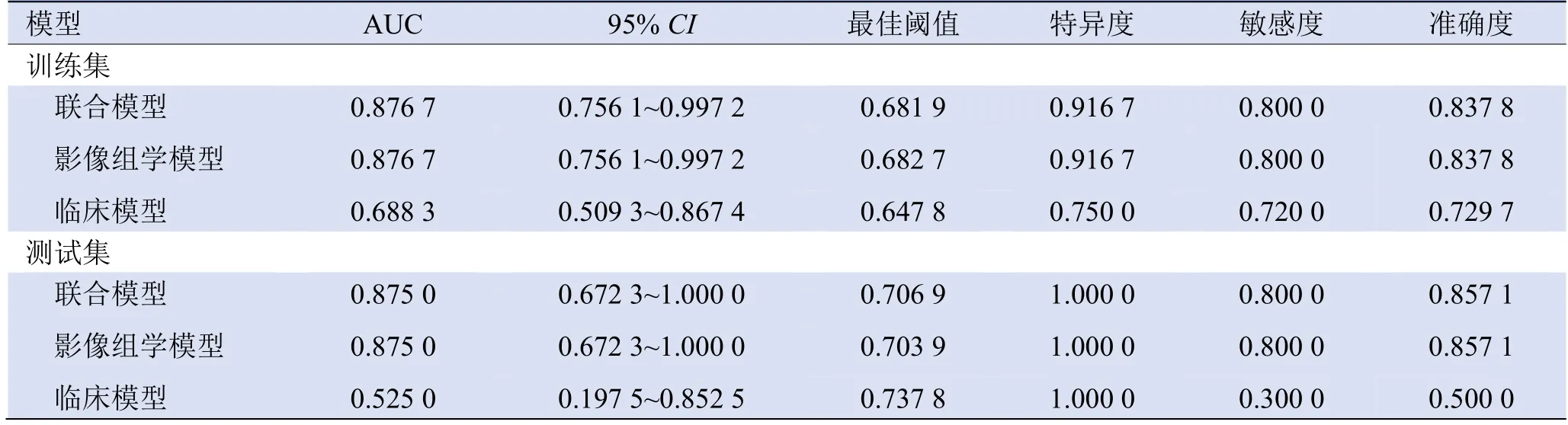
表4 3种预测模型ROC曲线分析及最佳阈值分析
测试集中联合模型、影像组学模型预测子宫内膜病变病理类型的ROC曲线表现一致(AUC=0.88,准确度为85.71%),且预测效能高于临床模型(AUC=0.53,准确度为50%),见表5。
联合模型、影像组学模型在训练集和测试集中预测子宫内膜恶性病变的敏感度均为80%,但在训练集中特异度为92%,在测试集中的特异度为100%。
2.4 影像组学评分、临床特征在子宫内膜病变良性组与恶性组分布情况 影像组学评分在良性组和恶性组间差异有统计学意义(P<0.001),恶性组影像组学评分在训练集和测试集中均大于良性组(P<0.05),两组间其他临床特征及传统ADC参数差异均无统计学意义(P>0.05),见表5、图4。

表5 子宫内膜良性与恶性病变的特征分布
3 讨论
3.1 构建机器学习模型鉴别子宫内膜早期良、恶性病变 本研究通过基于DWI图像的子宫内膜组织全体素纹理分析评价子宫内膜组织异质性,构建机器学习模型鉴别子宫内膜早期良、恶性病变,对于临床工作中明确子宫内膜病变性质、进行早期精准诊断具有实际意义,对于国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)指南提出的完善术前诊断、对于有生育要求的患者尽量实现保宫治疗的理念具有重要意义。
本研究发现,影像组学模型和联合模型预测子宫内膜恶性病变的准确度最高,证实子宫内膜全体素纹理分析能够预测子宫内膜病变的病理类型;而增加临床特征的联合模型对比影像组学模型,诊断效能并未提升,可能由于临床模型在训练集和测试集中均不能良好地鉴别子宫内膜早期病变的良恶性。
3.2 ADC值对子宫内膜良、恶性病变的诊断价值 DWI能够评估内膜病变水分子扩散受限情况,已经应用于评估内膜癌的术前危险因素。DWI证实肿瘤组织ADC值低于正常组织,可以作为癌症成像生物标志物使用[16-18]。研究发现对于子宫内膜良、恶性病变,归一化的ADC值(×10-3mm2/s)比绝对ADC值的鉴别诊断价值更强,恶性病变的归一化ADC值为0.52±0.09,而良性病变的归一化ADC值为0.91±0.19[19]。本研究中子宫内膜恶性病变的ADCmean、ADCmin与良性病变无显著差异,可能因为本研究纳入的子宫内膜病变均为超早期,MR图像上联合带尚完整,无明显肌层浸润征象,而其他研究纳入了明显联合带欠完整的IB期病例。
3.3 子宫内膜纹理分析对子宫内膜良、恶性病变的诊断价值 基于MR纹理分析参数能够预测内膜癌病变的病理类型、分化程度等。Fasmer等[8]基于全体积子宫内膜癌MR影像组学预测肌层浸润的AUCT/AUCV为0.84/0.76,预测淋巴结转移为0.73/0.72,预测FIGO Ⅲ+Ⅳ期为0.71/0.68,预测非子宫内膜样癌为0.68/0.74,预测高级别(G3)肿瘤为0.79/0.63。而本研究发现通过小波变换后的图像预测子宫内膜病理类型更具有意义,其中被筛选建模的wavelet_ HHH_ glrlm_ Run Variance_DWI_b=800特征反映了DWI原始图像在glrlm矩阵的运行方差,由于其偏回归系数为0.336,数值越大,反映图像异质性越强,则影像组学评分数值越大,更倾向于恶性病变。Ueno等[7]采用MR纹理分析参数构建随机森林算法模型预测高级别内膜癌的AUC值为0.83,敏感度为81%。田士峰等[20]研究也发现内膜癌ADC图像灰度共生矩阵的逆差距预估Ki-67高表达的AUC为0.847。
3.4 本研究的局限性 ①纳入病例数较少,尽管采用FCBF、mRMR多重滤过特征算法结合LASSO减少了特征的多重共线性,但机器学习模型仍然会存在过拟合的可能,未来需要多中心验证。②基于DWI图像ROI配准到结构图像中存在一定的范围差异;未来需要更优异的图像重采样及配准算法弥补ROI匹配问题。
总之,基于DWI的子宫内膜全域纹理分析能够实现子宫内膜组织异质性分析,基于纹理分析构建的机器学习模型能够准确诊断子宫内膜早期恶性病变,辅助临床制订治疗决策。

