木质纤维素基生物炭对葡萄糖厌氧消化性能的影响及机理研究
孙子滟 李叶青* 潘君廷
(1.中国石油大学(北京)新能源与材料学院 生物燃气高值利用北京市重点实验室,北京 102249;2.中国农业科学院 农业资源与农业区划研究所,北京 100081)
引 言
厌氧消化技术作为一种可以实现有机废物资源化利用的有效方法,被广泛用于城市生活垃圾及污泥、污水处理等领域[1-3]。近年来,通过添加导电碳材料来提高厌氧消化性能的研究逐渐受到人们的关注[4]。其中,生物炭由于具有原料来源广泛、生产成本低、表面官能团丰富等优点,成为目前研究的热点[5-7]。
通过改变生物炭的制备原料、热解温度、制备方法等因素可以得到不同性质的生物炭,其在厌氧消化体系中呈现的效果也各不相同。制备生物炭的主要原料有木本植物、草本植物、畜禽粪便和污泥等。Qin等[8]分别以木本植物和草本植物为原料,在500℃下热解制备了生物炭用于厌氧消化体系,结果发现:添加木本生物炭的实验组与对照组相比能提高产甲烷量,而添加草本生物炭的实验组与对照组之间无显著性差异。Indren等[9]使用木屑颗粒、小麦秸杆和羊粪为原料制备了生物炭用于厌氧消化体系,与对照组相比,添加木屑生物炭可使甲烷产率提高32%,而添加小麦秸秆或羊粪生物炭对厌氧消化产生不利影响。以上研究结果表明以木本植物为原料制备的生物炭的促进厌氧消化性能较好。目前,对生物炭制备原料的研究主要集中在宏观物质方面,缺乏对其内在组分的研究。
除原料外,生物炭的制备方法(如热解法、水热法等)也会影响厌氧消化性能。Wu等[10]分别使用水热法和热解法制备了生物炭,比较了它们对厌氧体系产甲烷性能的影响,结果表明采用水热法制备的生物炭促进产甲烷的效果比热解法好。Quintana-Najera等[11]分别以橡木、藻类和水葫芦为原料,使用水热法制备了生物炭,发现它们对厌氧消化体系均产生了抑制作用。由于水热炭和热解炭的性质相差较大,目前关于它们对厌氧消化体系作用的影响没有明确的认识,因此有必要对生物炭的制备方法在厌氧消化中的作用效果进行进一步研究。
为了深入阐明生物炭的制备原料和方法对厌氧消化过程的作用机理,本文以木质纤维素生物质纯组分——纤维素、半纤维素和木质素为原料,分别采用水热法和热解法制备了生物炭;以简单有机物——葡萄糖为底物,考察了所制备的生物炭对厌氧消化产甲烷性能的影响,并从微生物群落、官能团组成和电导率等方面探究了其作用机理,以期为相关研究提供参考。
1 实验部分
1.1 实验材料
纤维素采用微晶纤维素,100目(筛孔尺寸为0.150 mm),萨恩化学技术(上海)有限公司;半纤维素采用木聚糖,纯度95%,梯希爱(上海)化成工业发展有限公司;木质素采用碱木质素,化学纯,萨恩化学技术(上海)有限公司;葡萄糖,分析纯,上海阿拉丁生化科技股份有限公司;用于厌氧消化试验的接种液取自长期稳定运行的餐厨处理厂的沼液,其总固体含量(TS)为(2.52±0.01)%、挥发性固体含量(VS)为(1.02±0.03)%;FastDNA®Spin Kit for Soil试剂盒,美国MP Biomedicals公司。
1.2 生物炭的制备
1.2.1 水热炭
水热炭的制备在微型高压反应釜(TGYF-B型,巩义市予华仪器有限责任公司)内进行。分别准确称取10 g纤维素、半纤维素和木质素,与30 mL去离子水混合,置于反应釜的内胆中,放入转子,盖好釜盖,拧紧螺母,放置在带有磁力搅拌器的加热套中。设置磁力搅拌器的转速为100 r/min,以10℃/min的升温速率加热至265℃,并维持10 h。加热完成后,待水热合成釜冷却至室温后拧开螺母,将釜内的固液混合物倒入漏斗中,用去离子水和乙醇分别清洗至溶液澄清。将清洗过滤得到的水热炭置于蒸发皿中,放入烘箱内,于80℃下干燥12 h,研磨,过80目筛(筛孔尺寸为0.180 mm),置于离心管中密封保存,分别命名为纤HTC、半HTC和木HTC。
1.2.2 热解炭
使用管式炉(OTF-1200X型,合肥科晶材料技术有限公司)制备热解炭。在磁舟中分别称取适量的纤维素、半纤维素和木质素,置于管式炉中,关闭炉门,拧紧法兰,打开管式炉的气体进出口阀门,连接真空泵,抽至压力表显示负压,表示炉内处于真空状态。然后连接氮气瓶,缓慢通入氮气,使炉内充满氮气。设置管式炉加热程序,以10℃/min的升温速率加热至600℃,并维持1 h。待加热程序结束后,炉温降至80℃以下,取出磁舟,将得到的生物炭分别用去离子水、乙醇抽滤清洗,直至滤液澄清。将清洗的热解炭置于烘箱内,于80℃下干燥12 h,研磨,过80目筛,置于离心管中密封保存,分别命名为纤PC、半PC和木PC。
1.3 厌氧消化试验
使用全自动甲烷潜力检测系统(AMPTSII,中国海宁碧普仪器(海宁)有限公司)进行厌氧消化试验。该系统由厌氧消化单元、二氧化碳吸收单元和产气计量单元3部分组成。发酵瓶体积为100 mL,工作体积为80 mL,以葡萄糖为底物,添加量为10 g/L,接种液的接种量为10 g/L(基于VS),生物炭的添加量为10 g/L。设置空白组(只添加接种液),用于扣除接种液内源有机物的产气潜力;对照组(添加葡萄糖和接种液);试验组(添加葡萄糖、接种液和生物炭)。每组均做3个平行,分两次试验(使用同一批沼液,剩余沼液置于37℃恒温箱中,接种0.5 g/L葡萄糖驯化,用于下次试验)。另外,设计了只添加生物炭和接种液的空白组,以验证生物炭本身是否产气,试验证明6种生物炭均不产气。待物料添加完成,拧紧瓶盖,连接通气管,通入氮气3~5 min以排尽体系内空气。发酵瓶的温度维持在37℃,转速为80 r/min,启动程序,记录产气数据。采用IBM SPSSStatistics 21软件对试验结果进行统计学分析,采用单因素方差分析进行显著性检验,P<0.05表示差异具有显著性。
1.4 分析与测试
通过高通量测序分析微生物群落组成。使用FastDNA®Spin Kit for Soil试剂盒提取沼液样品中的基因组DNA,并进行PCR扩增和纯化等步骤,高通量测序和统计分析由上海美吉生物医药科技有限公司完成。
使用全自动元素分析仪(EA3000型,EuroVector,意大利)测定样品的碳、氢、氮含量,氧含量通过差值法确定;使用电导率仪(FE30K型,Mettler-Toledo公司)测定生物炭悬浮液的电导率;使用傅里叶变换红外光谱仪(FT-IR)(VERTEX70型,德国Bruker公司)测试生物炭的化学结构。
2 结果与讨论
2.1 水热炭对葡萄糖厌氧消化产甲烷性能的影响
图1为水热炭介导的葡萄糖厌氧消化产甲烷的特性曲线。由图1(a)可以看出,随着反应时间的延长,累积产甲烷量逐渐增加并达到最大值,且添加水热炭的试验组的总产气量均略高于对照组,但没有显著性差异(P>0.05)。T80或T90为达到最大累积产气量80%或90%所需要的时间,通常代表产气效率[12-13],其值越小表示产气效率越高。整个试验运行35 d,对照组、纤HTC、半HTC和木HTC组的T80分别为28、22、20 d和19 d,T90分别为31、24、22 d和21 d,其中木HTC组的T90最小。与对照组相比,纤HTC、半HTC和木HTC组的T90分别缩短了22.58%、29.03%和32.26%。由图1(b)可以看出,在整个厌氧消化过程中,有两个产甲烷的高峰期,分别在第1天和第18~26天。所有组均在第1天出现了第一个产甲烷高峰,且各组的峰值相差不大。所有添加水热炭的试验组均先于对照组达到第二个产气高峰,其中添加木HTC的试验组在第18天最先到达,此时日产甲烷量为22.38 mL。对照组在第26天达到第二个产气高峰,日产甲烷量为18.00 mL。纤HTC、半HTC和木HTC组作用效果的差异可能与水热炭残留的腐殖酸等不良副产物有关。例如,糠醛被发现是半纤维素水热碳化过程中水相的主要产物,该产物对厌氧消化会产生抑制作用[14]。以上结果表明:添加水热炭可以加快厌氧消化产甲烷的速率,提高厌氧消化效率,这与Ren等[15]的研究结果相似;以木质素为原料制备的水热炭的促厌氧消化效果更好。

图1 水热炭对葡萄糖厌氧消化产甲烷的影响Fig.1 Effect of hydrothermal carbon on methane production by anaerobic digestion of glucose
2.2 热解炭对葡萄糖厌氧消化产甲烷性能的影响
图2为热解炭介导的葡萄糖厌氧消化产甲烷的特性曲线。由图2(a)可以看出,添加热解炭的试验组的总产气量与对照组之间没有显著性差异(P>0.05),这与添加水热炭的试验组结果一致。整个试验运行32 d,对照组、纤PC、半PC和木PC组的T80分别为4、3、3 d和5 d,T90分别为13、5、7 d和6 d。与对照组相比,纤PC、半PC和木PC组的T90分别缩短了61.54%、46.15%和53.85%。从T80到T90,木PC组仅用了1 d,而对照组需要9 d。并且木PC组在第7天的累积产甲烷量就已经超过了对照组的总产气量,第6天的累积产甲烷量就已经超过了纤PC组和半PC组的总产气量。添加木PC的试验组在厌氧消化前期启动较慢,但在后期反应加快。木质素热解炭主要在厌氧消化后期发挥作用,这可能是由于木质素热解炭的比表面积较小,微生物附着慢。有研究表明,在相同热解温度下,纤维素热解炭的比表面积和碘吸附值分别为木质素热解炭的42倍和1.8倍[16]。由图2(b)可以看出,在整个厌氧消化过程中,有两个产甲烷高峰期,分别在第1天和第6~14天。所有组都在第1天出现了第一个产甲烷高峰,添加热解炭的试验组的日产甲烷量均小于对照组,原因可能是在试验启动初期,热解炭与厌氧体系没有充分接触。所有添加热解炭的试验组均先于对照组达到第二个产气高峰,其中添加木PC的试验组在第6天最先到达,日产甲烷量也最大,为21.79 mL。纤PC和半PC的作用效果小于木PC,原因可能是纤维素在热解过程中会产生羟甲基糠醛,半纤维素热解生物油的主要成分为酸类,这些成分的残留可能会对厌氧消化产生不利的影响。对照组在第14天达到第二个产气高峰,日产甲烷量为5.71 mL。以上结果表明:添加热解炭可以加快产甲烷速率,提高厌氧消化效率;以木质素为原料制备的热解炭的促厌氧消化效果更好,这与Li等[17]及本课题组[18]的研究结果相似。
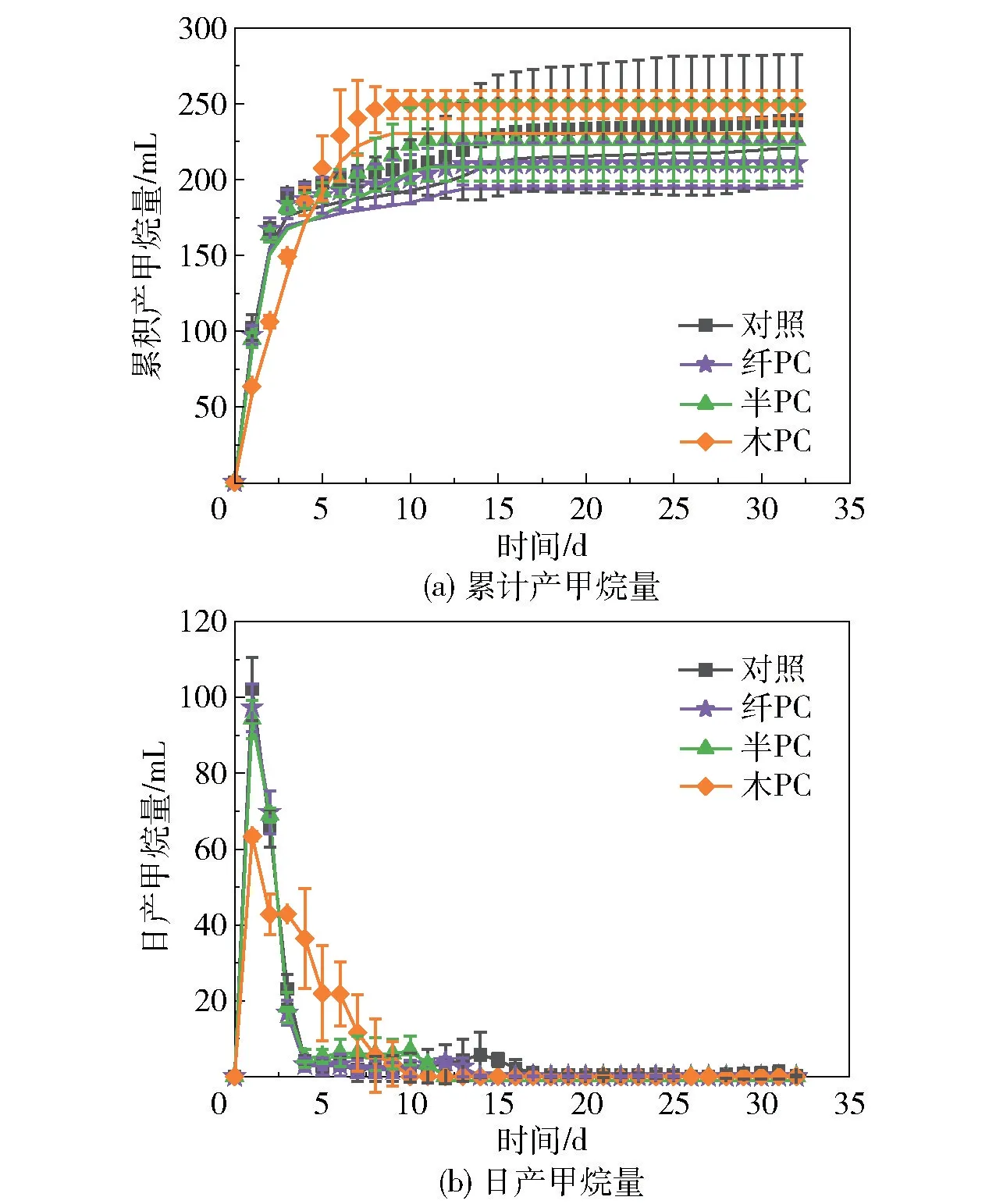
图2 热解炭对葡萄糖厌氧消化产甲烷的影响Fig.2 Effect of pyrolytic carbon on methane production by anaerobic digestion of glucose
2.3 微生物群落分析
2.3.1 细菌群落分布
图3为基于纲水平的细菌群落分布。可以看出,在木HTC试验组及其对照组中以梭状芽胞杆菌(Clostridia)、互养菌(Synergistia)、拟杆菌纲(Bacteroidia)和Cloacimonadia、γ-变形菌(Gammaproteobacteria)为主。相较于对照组,木HTC试验组提高了Synergistia、Cloacimonadia和Gammaproteobacteria的相对丰度。Synergistia是典型的互养型发酵细菌,它通常与氢营养型产甲烷菌共生,克服热力学能量障碍,促进挥发性脂肪酸的降解代谢而产生甲烷[19];Cloacimonadia属于Cloacimonetes门,某些属可将氨基酸、糖或醇转化为挥发性脂肪酸[20-21];Gammaproteobacteria在厌氧系统中负责发酵[22],它和Bacteroidia、Clostridia一样含有大量糖酵解酶[23]。
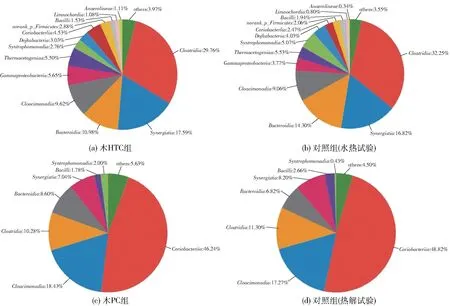
图3 基于纲水平的细菌群落分布Fig.3 Bacterial community distribution based on class level
在木PC试验组及其对照组中以Coriobacteriia、Cloacimonadia、Clostridia、Bacteroidia、Synergistia、芽胞杆菌(Bacilli)、Syntrophomonadia为主。Chao指数和Shannon指数分别反映群落丰度和多样性[24]。水热炭对照组的Chao指数和Shannon指数分别为309.43和3.85,热解炭对照组的Chao指数和Shannon指数分别为295.12和2.55。显然,无论是物种丰度还是多样性,后者均低于前者,这可能与接种液长时间放置有关。与对照组相比,添加木PC可以促进Cloacimonadia、Bacteroidia、Syntrophomonadia的富集。大多数属于Bacteroidia的细菌对多糖、蛋白质等大分子有机物具有良好的水解能力,并能产生乙酸等短链脂肪酸[19];属于Syntrophomonadia纲的细菌是互养型发酵细菌[25]。综上所述,木HTC或木PC的添加可以富集互养型发酵细菌,并且在一定程度上促进挥发性脂肪酸的降解,从而为直接种间电子转移(DIET)机制的建立提供了可能。
2.3.2 古菌群落分布
图4为基于属水平的古菌群落分布图。从图中可以看出古菌群落的组成比较单一:在木HTC试验组及其对照组中以甲烷丝菌(Methanosaeta)和甲烷杆菌(Methanobacterium)为主,两种古菌的相对丰度之和超过99%;在木PC试验组及其对照组中以Methanosaeta为主,含量约为99%。与对照组相比,木HTC和木PC的添加对古菌的相对丰度影响不大。Methanosaeta是一种专性乙酸型营养产甲烷古菌,有研究表明Methanosaeta可通过DIET机制将CO2转化为甲烷[26]。结合2.3.1节的结果可知,添加木HTC和木PC在一定程度上富集了互养菌型发酵细菌,同时还有丰富的Methanosaeta的存在,这可能有助于促进DIET机制的建立,从而提高产甲烷速率。
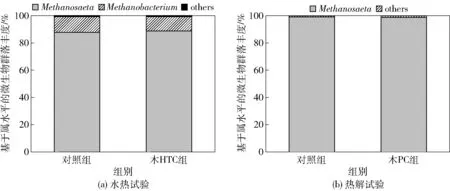
图4 基于属水平的古菌群落分布Fig.4 Archaeal community distribution based on genus level
2.4 生物炭的表征结果
2.4.1 元素组成和电导率
通过元素分析,得到本文制备的6种生物炭的元素组成,结果如表1所示。可以看出,3种水热炭的元素组成相差不大,3种热解炭的C、O含量相差较大;随着热解温度的升高,木质素C含量的升高和O含量的降低幅度低于纤维素和半纤维素,这与彭何欢等[27]的研究结果一致。生物炭元素的原子质量比可以表征多种理化性质,例如H与C的质量比(m(H)∶m(C))代表生物炭的炭化程度和芳香性,O和C的质量比(m(O)∶m(C))代表生物炭的稳定性和氧化性[28-29]。根据元素含量计算出6种生物炭的原子质量比,热解炭的m(H)∶m(C)和m(O)∶m(C)明显低于水热炭,这是因为热解炭的热解温度高,碳化程度大,氧含量低。以木质素为原料制备的生物炭的m(O)∶m(C)高于其他生物炭,并且3种热解炭的m(O)∶m(C)相差较大。这可能是因为热解炭的热解温度高,其表面含氧官能团较少,脱氧效果因原料不同而差异显著[30-31]。
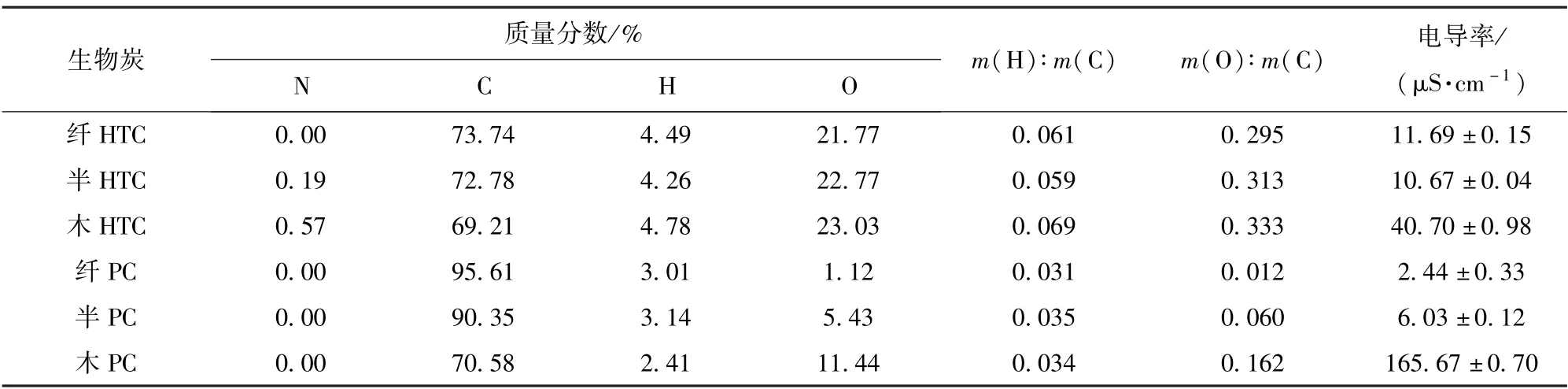
表1 生物炭的元素组成和电导率Table 1 Elemental composition and electrical conductivity of the biochars
从表1中可以看出,无论是水热法还是热解法,以木质素为原料制备的生物炭的电导率都远高于其他两种生物炭。当热解温度较高时,生物炭能形成结晶度和芳香性增加的类石墨片状结构。这些共轭π电子系统的积累逐渐增大了起始材料的电导率,使生物炭能够直接将电子从电子供体转移到电子受体而不存储它们[32],这种电子转移的速度比通过氧化还原官能团的得失电子能力传递电子快3倍以上[33]。这可能是以木质素为原料制备的生物炭促进产甲烷效果优于其他两种原料的原因。
2.4.2 官能团
图5是6种生物炭的FT-IR谱图。相同方法制备的生物炭的FT-IR谱图基本相同,只是某些峰的强度不同,说明在同一热解温度下,官能团组成没有变化。3 600~3 200 cm-1处的吸收峰是醇、酚、羧酸等的羟基伸缩振动引起的;1 730 cm-1左右处的吸收峰是由羰基、醌基、酯基和羧基的C═O伸缩振动引起的;1 650~1 450 cm-1处的吸收峰是由芳香族或苯环结构中的C═C键伸缩振动引起的[34-36]。与热解炭相比,水热炭明显含有更多的吸收峰,官能团更加丰富。热解炭中只有木PC在3 600~3 200 cm-1存在明显的特征峰,说明高温热解下生物质发生了脱羧、脱羰基等反应,脱除了大部分含氧官能团。结合元素组成结果可以看出,以木质素为原料制备的生物炭的氧含量更高、含氧官能团更加丰富,这可能是其促进产甲烷效果优于其他两种原料的另一原因。

图5 生物炭的FT-IR谱图Fig.5 FT-IR spectra of the biochars
2.5 变异性分析
为了评价生物炭的原料和制备方法对葡萄糖厌氧消化的影响,对6种生物炭进行了变异性分析。利用统计方法中的变异系数(CV)计算生物炭的原料依赖性(HF)和方法依赖性(HM),如式(1)所示。HF或HM越大,生物炭的特性受原料或制备方法的影响越大[37]。

式中:cv为变异系数,σ为标准偏差,μ为平均值。
通过变异性分析研究了生物炭的原料和制备方法引起的异质性,以确定生物炭特性与各因素之间的关系,结果如图6所示。当某一特性受原料影响较大时,它会靠近Y轴,反之亦然。可以看出,电导率和累积产甲烷量对生物炭原料的依赖性更大,元素组成对生物炭制备方法的依赖性更大,pH值对生物炭的原料和制备方法的依赖性相近。
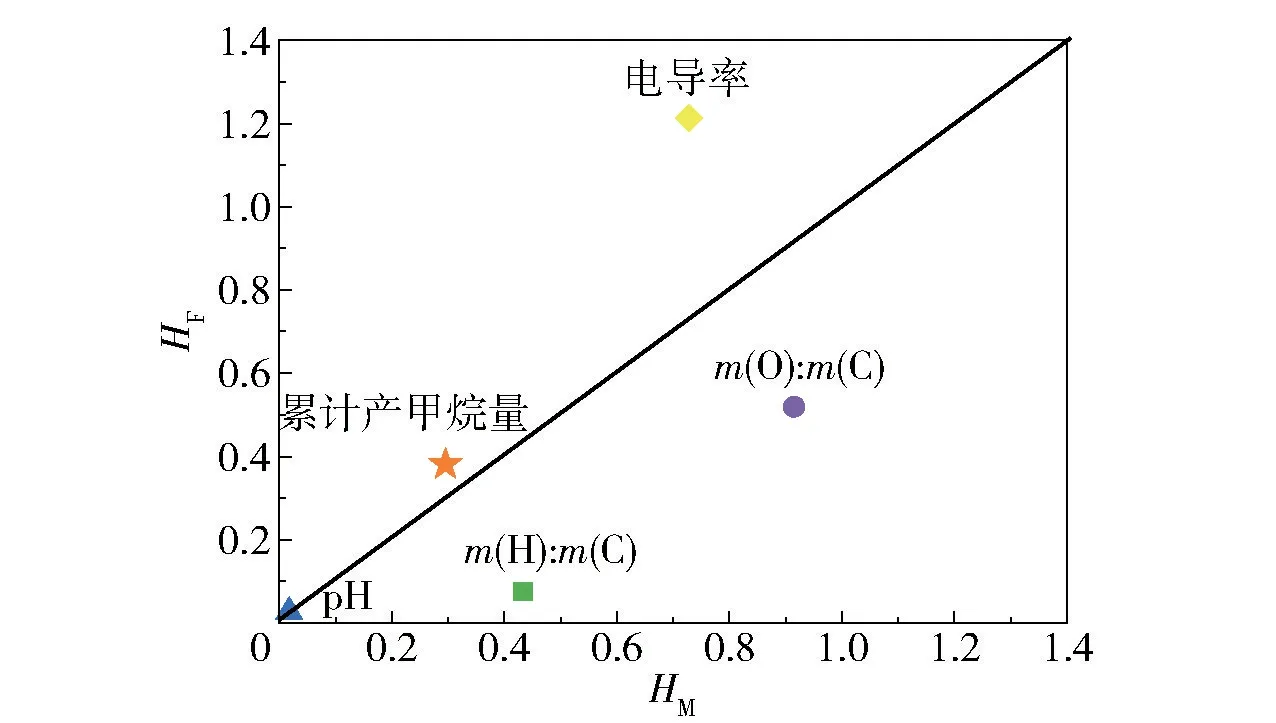
图6 生物炭的原料依赖性(HF)和方法依赖性(HM)的比较Fig.6 Comparison of raw material dependence(HF)and method dependence(HM)of the biochars
3 结论
本文以生物质纯组分——纤维素、半纤维素和木质素为原料,分别在265℃和600℃下制备了水热炭和热解炭,研究了生物炭的原料和制备方法对葡萄糖厌氧消化的影响,并探究了其作用机理,得到如下结论:
(1)与对照组相比,生物炭的添加不能提高葡萄糖的总产气量,但能加快厌氧消化速率,提高消化效率;相较于纤维素和半纤维素,以木质素为原料制备的生物炭的促厌氧消化效果更好。
(2)与对照组相比,添加木HTC和木PC均能在一定程度上富集互养型发酵细菌,这可能有助于促进DIET机制的建立,从而提高产甲烷速率。
(3)制备方法相同时,相较于纤维素和半纤维素,以木质素为原料制备的生物炭的表面含氧官能团更加丰富且电导率更高,这可能是其强化厌氧消化效果的关键特性。
(4)变异性分析结果表明,相较于生物炭的制备方法,电导率和累积产甲烷量对生物炭原料的依赖性更大。
木质素中3种单体的甲氧基含量的差异和提取方法的不同都会对木质素的结构产生影响,导致热裂解特性与机理非常复杂。生物质中纤维素、半纤维素和木质素这3种组分通过非共价键连接,形成了复杂而紧凑的纤维细胞壁结构,它们的不同连接方式、组合方式制备的生物炭对厌氧消化的影响尚不明确,这些都是今后研究需要重点关注的方面。

