7种营养筛查工具对癌症患者营养筛查准确性的网状Meta分析
林丽玉,许丽春,张鑫,庄盼盼,黄雨欣
营养不良是癌症患者最常见的伴随性疾病,其比例高达81.4%[1]。营养不良会降低患者对放化疗的耐受性,使其无法如期完成治疗计划,从而影响治疗效果,最终导致住院时间延长,死亡率增加[2]。研究显示,超过20%的癌症患者死于营养不良而非终末期肿瘤[3]。营养筛查是营养管理的关键环节。根据筛查结果进行针对性的营养支持,可改善患者营养状况,降低并发症发生率,提高生活质量[4]。目前,国内外已有多种工具用于筛查癌症患者的营养状况,如营养风险筛查2002(Nutritional Risk Screening 2002,NRS2002)、患者主观整体营养状况评估表(Patient-Generated Subjective Global Assessment,PG-SGA)、主观全面评定法(Subjective Global Assessment,SGA)等,可快速提高护理人员对患者营养筛查的效率及准确性。但目前尚无公认的营养筛查方法“金标准”,且不同研究纳入的营养筛查工具、癌症类型、样本量等不尽一致,何种筛查工具的诊断效能更好尚无定论[5-6]。因此,本研究采用网状Meta分析方法,探讨不同工具的筛查准确性,为临床准确评价癌症患者的营养状况提供循证依据。
1 资料与方法
1.1文献纳入与排除标准 纳入标准:①研究对象。癌症患者,癌症类型不限,无论患者是否接受过手术、化疗或放疗,是否住院。②待评估的诊断性试验。同时采用2种及以上的营养筛查工具,营养筛查工具:NRS2002、PG-SGA、SGA、营养不良通用筛查工具(Malnutrition Universal Screening Tool,MUST)、营养不良筛查工具(Malnutrition Screening Tool,MST)、微型营养评定法(Mini-nutritional Assessment,MNA)、微型营养评定简法(Mini Nutritional Assessment-Short Form,MNA-SF)。③参考标准。欧洲临床营养与代谢学会(European Society for Clinical Nutrition and Metabolism,ESPEN)制定的营养不良诊断标准、全球(营养)领导层倡议营养不良诊断(Global Leadership Initiative on Malnutrition,GLIM)标准、BMI、白蛋白(Albumin,ALB)或前白蛋白(Prealbumin,PA)[7-9]。④待诊断的疾病或症状。营养不良或营养风险。⑤发表语言为中文或英文。⑥原始研究可直接或间接获得真阳性、假阳性、假阴性、真阴性等数据。排除标准:①研究对象为新生儿、婴儿或小儿患者的研究;②数据不完整或前后数据矛盾的文献;③重复发表或无法获取全文的文献。
1.2文献检索策略 计算机检索中国知网、万方数据、维普、中国生物医学文献数据库、Cochrane Library、PubMed、Web of Science和Embase数据库。并对纳入文献及相关综述的参考文献进行追溯检索。检索时间从每个数据库建库开始至2021年10月。采用主题词与自由词结合的方式进行检索,中文检索词为:癌症,癌,肿瘤,恶性肿瘤、营养、NRS2002,营养风险筛查2002,PG-SGA,患者主观整体营养状况评估表,SGA,主观全面评定法,MUST,营养不良通用筛查工具,MST,营养不良筛查工具,MNA,微型营养评定法,MNA-SF,微型营养评定简法等;英文检索词为neoplasms,tumors,cancer,malignancy;malnutrition,nutrition*;NRS2002,NRS 2002,nutritional risk screening,PG-SGA,patient generated subjective global assessment,SGA,subjective global assessment,MUST,malnutrition universal screening tool,MST,malnutrition screening tool,MNA,mini-nutritional assessment,MNA-SF,mini nutritional assessment-short form等。
1.3文献筛选与资料提取 根据纳入排除标准进行文献初筛和复筛,并对纳入的文献进行数据提取。提取内容包括:①基本信息。题目、作者、发表时间等。②研究特征。研究对象、样本量、营养筛查工具、参考标准等。③诊断参数信息。真阳性、假阳性、假阴性、真阴性、灵敏度、特异度等。该过程由2名研究员(通过循证护理知识培训)独立进行,并核对结果,若2人意见不同,则交由第3名研究员解决。
1.4文献质量评价 由2名研究员采用诊断性研究质量评价工具(Quality Assessment of Diagnostic Accuracy Studies-2,QUADAS-2)[10]进行独立质量评价,并核对评价结果,意见不同则交由第3名研究员解决。该量表评价内容包括偏倚风险和临床适用性评价。偏倚风险由病例的选择、待评价试验、金标准、病例流程和进展情况4个部分组成。临床适用性由病例的选择、待评价试验和金标准3个部分组成。
1.5统计学方法 采用Stata15.0软件绘制证据网络图、做一致性检验、绘制比较-校正漏斗图、做聚类分析。应用WinBUGS 1.4.3软件进行贝叶斯网状Meta分析,链条数设置为4条,迭代次数为50 000次,步长设置为10。计算比值比(OR)及其95%置信区间(95%CI),当OR值的95%CI不含1,组间差异有统计学意义。
2 结果
2.1文献检索结果 共检索到文献10 805篇,其中中文文献4 708篇,英文文献6 097篇,根据流程进行层层筛选,最终纳入22篇文献[6,11-31]。
2.2纳入文献的基本特征 纳入的22项研究中有15项是双臂试验,6项研究是三臂试验,1项研究是五臂试验。NRS2002是使用最广泛的营养筛查工具。纳入的22项研究基本特征见表1。

表1 纳入文献的基本特征
2.3文献质量评价结果 在偏倚风险方面,有1项研究的病例选择偏倚风险为高风险,2项研究为不清楚,其余19项研究均为低风险;仅有1项研究的待评价试验偏倚风险为低风险,其余均为不清楚;有1项[6]研究金标准偏倚风险为高风险,6项研究为不清楚,其余15项研究均为低风险;有3项研究的病例流程和进展情况偏倚风险为高风险,4项为不清楚,其余均为低风险。在临床适用性方面,仅有1项[30]研究的病例的选择为不清楚,其余均为低风险。
2.4贝叶斯网状Meta分析结果
2.4.1证据网络图 纳入的研究中NRS2002的样本量最多,其次为PG-SGA,MNA和MST最少,证据网络图见图1。
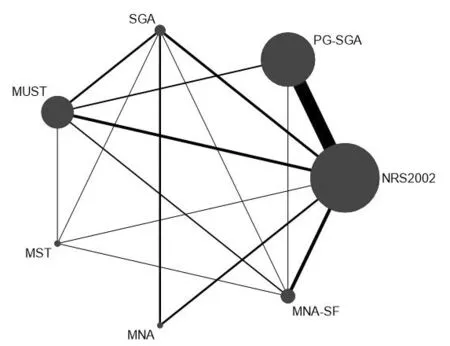
图1 证据网络图
2.4.2一致性检验 对各个结局指标做一致性检验,结果显示本研究共包含13个闭合环,都为3环。灵敏度和阴性预测值所有环的95%CI均包含0,说明纳入的研究一致性较好。特异度和阳性预测值各有5个闭合环存在不一致性,准确度有4个闭合环存在不一致性。综上所述,虽然个别营养筛查工具间的比较存在不一致性,但整体的一致性较好。
2.4.3网状Meta分析结果 灵敏度结果显示,与PG-SGA相比,NRS2002的灵敏度较差[OR=0.39,95%CI=(0.22,0.70)];PG-SGA的灵敏度高于SGA[OR=3.55,95%CI=(1.05,11.93)],组间差异有统计学意义。特异度结果显示,PG-SGA的特异度与MUST[OR=0.27,95%CI=(0.08,0.86)]和NRS2002[OR=0.46,95%CI=(0.21,0.97)]相比较差,组间差异有统计学意义。阳性预测值结果显示,MUST的阳性预测值高于PG-SGA[OR=2.31,95%CI=(1.01,5.16)],组间差异有统计学意义。阴性预测值结果显示,PG-SGA的阴性预测值高于NRS2002[OR=1.69,95%CI=(1.14,2.56)],组间差异有统计学意义。准确度结果显示,所有营养筛查工具组间差异均为无统计学意义,见表2、表3、表4。

表2 不同营养筛查工具的灵敏度(左下)和特异度(右上)网状Meta分析联赛表 OR(95%CI)
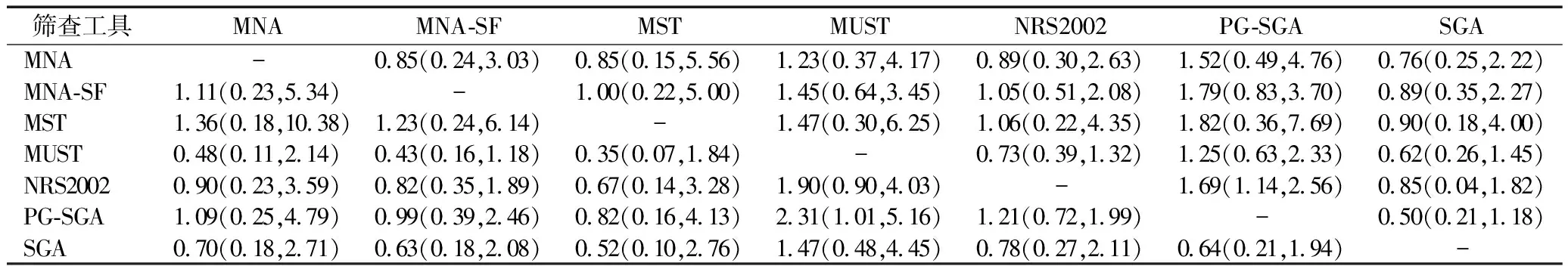
表3 不同营养筛查工具的阳性预测值(左下)和阴性预测值(右上)网状Meta分析联赛表 OR(95%CI)
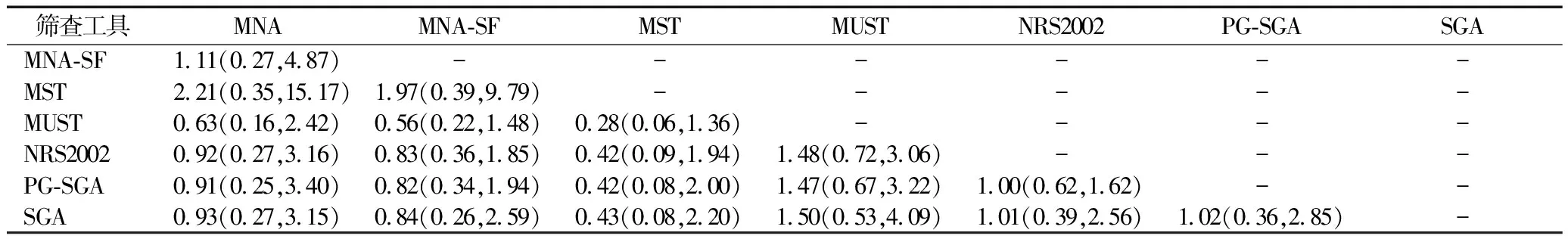
表4 不同营养筛查工具的准确度网状Meta分析联赛表 OR(95%CI)
2.4.4结果排序 不同营养筛查工具的累积排名概率曲线下面积(Surface Under the Cumulative, SUCRA)显示,PG-SGA灵敏度和阴性预测值的SUCRA值最高,MUST特异度、阳性预测值和准确度的SUCRA值最高。不同营养筛查工具的SUCRA值见表5。

表5 不同营养筛查工具的SUCRA值 %
2.4.5发表偏倚 分别绘制灵敏度、特异度、阳性预测值等指标的比较-校正漏斗图,进行发表偏倚检验。结果表明,漏斗图大致对称,但仍有部分研究散落在漏斗图两侧,提示本研究可能存在小样本效应或发表偏倚。
2.4.6聚类分析 分别对灵敏度和特异度、阳性预测值和阴性预测值进行聚类分析。相同颜色的点表示一类,营养筛查工具距离原点越远,成为最佳工具的可能性越大。结果显示MUST的灵敏度、特异度、阳性预测值和阴性预测值均较好,可作为癌症患者营养筛查的最佳工具,见图2、图3。

图2 灵敏度和特异度的聚类分析图
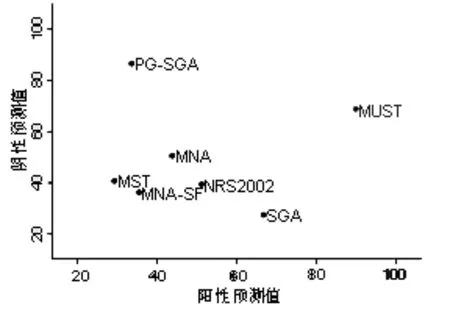
图3 阳性预测值和阴性预测值的聚类分析图
3 讨论
3.1MUST的特异度、阳性预测值和准确度较好 本次排序结果显示,MUST的特异度、阳性预测值和准确度均较好,同时聚类分析也提示MUST是最适合癌症患者的营养筛查工具。特异度是反映诊断性试验确定非营养不良或营养风险患者的能力,MUST的特异度较高,说明其误诊率较低。阳性预测值是检验结果为阳性(营养不良或营养风险)的患者真正营养不良或营养风险的概率,阳性预测值越高,正确识别营养不良或风险的能力越强,可为癌症患者早期营养干预提供基础。准确度是反映诊断性试验正确诊断营养不良或风险患者与非营养不良或风险患者的能力。准确度越高,真实性越好,理想的诊断准确度为100%。因此,本研究认为MUST可作为癌症患者营养筛查的首选工具。MUST表现出良好的诊断效能原因可能是该量表仅涉及3个条目,内容较为简单,且均为客观题目,避免了因操作者主观因素引起的诊断误差,可供医疗团队中的任何成员进行快速操作。但该量表也有不足,其涉及体质量,当患者存在卧床、腹腔积液等情况时,该工具的使用受到限制。
3.2PG-SGA的灵敏度和阴性预测值较好 网状Meta分析结果表明,PG-SGA的灵敏度高于NRS2002和SGA,阴性预测值高于NRS2002;排序结果也显示,PG-SGA的灵敏度和阴性预测值在7种营养筛查工具中最好,与Mendes等[32]研究结果相似。灵敏度是诊断试验的一个重要指标。灵敏度越高,识别营养不良或营养风险能力越强,相应的漏诊概率越小。阴性预测值是筛查结果为阴性(营养正常)的患者中真正营养正常的概率,高阴性预测值有助于医生识别可能无营养不良的患者。对于首次确诊的癌症患者,应追求高灵敏度和阴性预测值,以降低漏诊率,确保尽可能发现营养不良或营养风险患者。因此,本研究认为PG-SGA可作为首次确诊癌症患者的营养筛查工具。PG-SGA的灵敏度和阴性预测值较高,可能是因为PG-SGA是专门为癌症患者修订的工具[33]。PG-SGA除了可进行营养分级外,还可用连续计分表评估患者营养状态,以便在短时间内检测到微小变化,并可通过定期重复评估以动态监测患者营养状况[34]。虽然PG-SGA表现出良好的灵敏度和阴性预测值,但其条目较多、评估费时较长,且涉及患者和护士评估的主观内容,筛查结果可能会受多种主观因素的影响。因此,医院应加强对医护人员培训,制定相应评价标准,进一步规范PG-SGA的使用方法,提高筛查准确性。
3.3应将营养筛查工具的应用作为重点培训内容 护理评估是护理程序的核心,护理评估的关键在于评估工具的选择和使用。护理人员尤其是肿瘤科护士应熟练掌握营养筛查工具的正确使用方法,明确癌症患者营养评估重点,并根据评估结果制订针对性的护理措施。我国护士绝大多数不能主动进行营养风险筛查,护士营养筛查能力及主动性有待提高,未来医院应将营养筛查工具的运用作为重点培训内容,以指导护士正确选择和使用工具,提高筛查准确性。
4 小结
本研究基于贝叶斯网状Meta分析,比较7种常见营养筛查工具在癌症患者营养筛查中的诊断效能,结果显示MUST的特异度、阳性预测值和准确度较好,可作为癌症患者营养筛查的首选工具。PG-SGA的灵敏度和阴性预测值较好,可作为首次确诊的癌症患者营养筛查工具。但本研究也存在一定的局限性:①部分筛查工具纳入的文献较少,如MST的文献仅有1篇,存在一定程度偏倚;②本研究纳入的文献质量较低,在一定程度上影响了结果的可靠性。今后应开展更多设计严谨、样本量大、多中心的研究,以进一步补充证据,更深层次地探讨不同工具在癌症患者营养筛查中的应用价值。

