急性脑梗死中血小板反应蛋白1表达与血管生成因子的相关关系
李静娜, 张斯淼, 程 丹, 姚玉兰, 王运良,2
急性脑梗死是我国目前神经内科常见疾病,由于该疾病具有高发病率、致残率和死亡率的特点使得人类的生存质量大幅度降低。目前各种治疗方法的主要目的在于及时开通闭塞血管,挽救缺血半暗带,防止神经功能进一步受损。研究表明,脑卒中的长期预后与血管生成的数量有关[1],血管生成有助于侧枝循环的开放,因此血管生成因子对于脑梗死患者的生存预后显得尤为重要。而TSP1作为血管生成的抑制剂作用与此恰好相反,为了进一步研究TSP1与血管生成因子之间关系,我们通过以下实验来进一步分析。
1 材料与方法
1.1 一般资料 选取2021年4月-2021年8月郑州大学第二附属医院神经内科107例急性脑梗死患者作为病例组,男性52例,女性35例,年龄在(45~80)岁;同期入院体检的90例健康者作为对照组,男性36例,女性24例,年龄在(53~76)岁。排除标准:(1)合并全身炎症或全身重大身心疾病;(2)严重脑萎缩或脑积水;(3)近期有脑外伤史;(4)脑实质明显软化病变、陈旧性脑梗死、出血或肿瘤;(5)近期服用抗血小板、抗凝等药物。收集受试对象的基本资料,包括既往史、吸烟、饮酒史等。本实验均已告知上述研究对象并获得知情同意,同时获得我院伦理委员会批准。
1.2 方法 采集研究对象入院第二天空腹外周静脉血约2 ml,采用酶联免疫方法(ELISA)检测TSP1、转化生长因子(TGFα)、成纤维细胞生长因子2(FGF2)。试剂盒购自上海生工生物有限公司。
1.3 统计学方法 采用SPSS 26.0软件进行统计学分析,符合正态分布的计量资料采用t检验或单因素方差分析,不符合正态分布采用非参数检验;计数资料采用卡方检验;采用Spearman相关分析方法分析TSP1与血管生长因子、各临床生化指标间的相关性;采用多因素回归法分析脑梗死的危险因素;ROC曲线分析TSP1与TGFα、FGF2对脑梗死的预后关系。以P<0.05表示统计学有意义。
2 结 果
2.1 两组一般资料比较 两组一般资料仅高血压史有统计学差异(P<0.05),余指标未见明显差异(P>0.05)(见表1)。
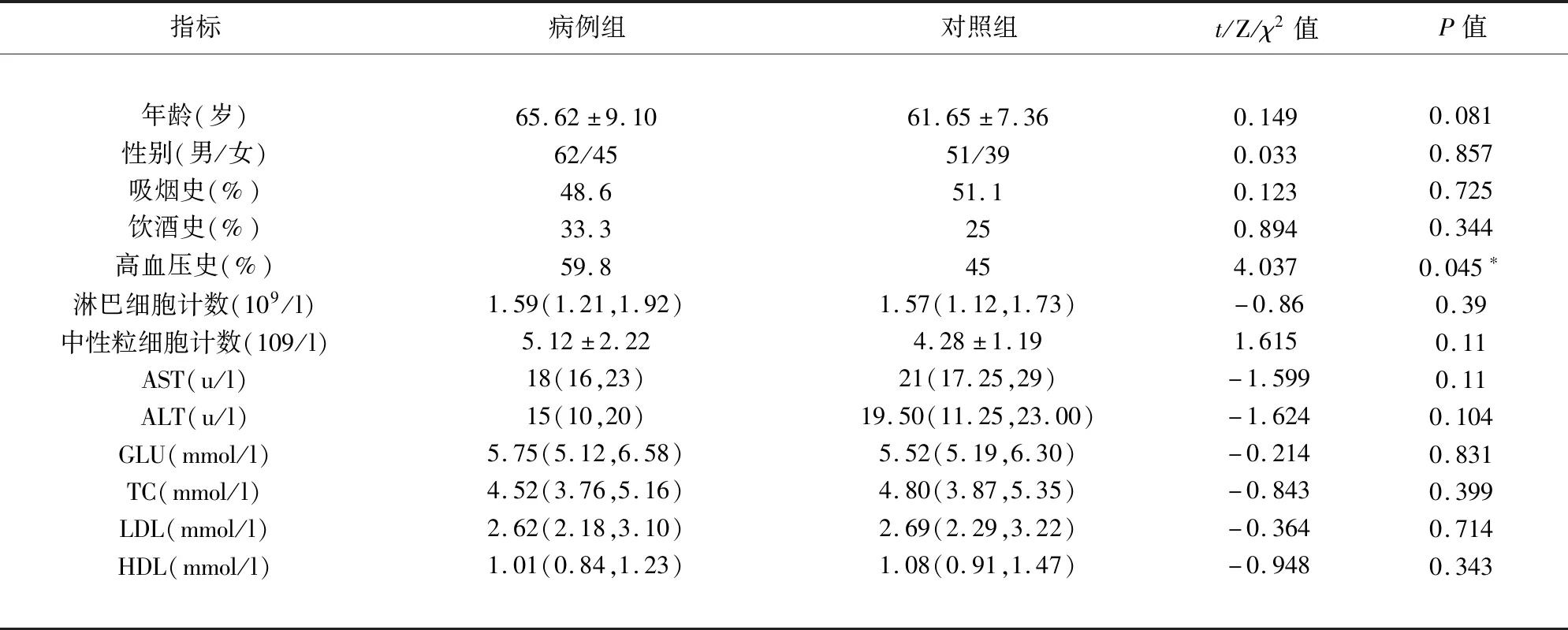
表1 两组一般资料比较
2.2 两组TSP1、TGFα、FGF2的水平比较 病例组TSP1、TGFα、FGF2均高于对照组,差异有统计学意义(P<0.05)(见表2)。

表2 两组TSP1、TGFα、FGF2的水平比较
2.3 NIHSS评分下病例组TSP1、TGFα、FGF2的水平比较 根据NIHSS评分标准[2]将病例组分为三组:轻度组(6分)、中度组(7~15分)、重度组(≥16分),三组间TSP1水平可见统计学差异(P<0.05),TGFα、FGF2均未见明显差异(P>0.05)(见表3)。
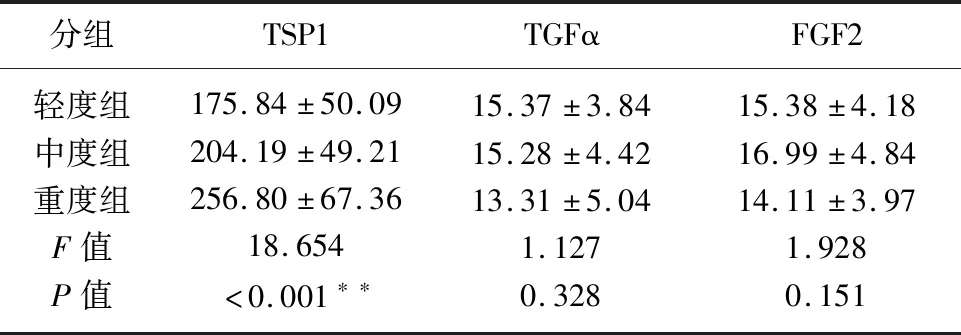
表3 NIHSS评分下病例组TSP1、TGFα、FGF2的水平比较
2.4 两组TSP1与TGFα、FGF2的相关性分析 病例组TSP1与TGFα成正相关(r=0.304,P<0.001),也与FGF2成正相关(r=0.446,P<0.001);对照组TSP1与TGFα、FGF2均未见明显相关性(TGFα:r=-0.005,P=0.962;FGF2:r=0.191,P=0.071)(见图1)。

图1 病例组TSP1与TGFα、FGF2的相关性
2.5 脑梗死危险因素的回归分析 我们以TSP1、TGFα、FGF2为自变量,以是否发生脑梗死为因变量,结果发现TSP1是脑梗死发生的危险因素(P<0.05)(见表4)。

表4 脑梗死危险因素的回归分析
2.6 病例组TSP1的ROC曲线分析 病例组TSP1的ROC曲线为:AUC=0.947,95%CI为0.920~0.974,截断值为132.3,敏感度为88.8%,特异性为85.6%。TGFα的ROC曲线为:AUC=0.677,95%CI为0.602~0.751,截断值为11.505,敏感度为86.9%,特异性为40.0%。FGF2的ROC曲线为:AUC=0.713,95%CI为0.640~0.786,截断值为13.82,敏感度为69.2%,特异性为66.7%(见图2)。

图2 TSP1 ROC曲线
3 讨 论
急性脑梗死一旦发生则会造成相应血管缺血缺氧,在此环境下,机体会做出适当的防御反应,防止损伤进一步加重。如在缺血缺氧时,梗死周围的巨噬细胞或宿主细胞会产生血管生成因子,直接或间接促进血管生成[3]。已证明神经元存活较长的区域主要存在于新生血管丰富的区域,且与患者长期预后有关,因此进一步表明血管生成因子在脑卒中的重要性。
本实验通过对两组TSP1、TGFα、FGF2的水平比较,发现病例组均高于对照组。我们推测造成此现象的原因可能与急性脑梗死发生时大脑组织恢复再灌注有关,而再灌注又与梗死周围血管生成有关。TGFα、FGF2作为血管生成因子与此作用正好一致,然而TSP1却抑制血管生成。在脑损伤发生后FGF2主要由胶质细胞合成并大量释放,它可通过多种途径发挥神经元保护作用,如干扰N-甲基-D-天冬氨酸(NMDA)受体的表达和门控[4]、维持Ca2+稳态[5]和调节活性氧(ROS)解毒酶[6];此外还可通过加强抗凋亡途径防止细胞凋亡,并促进损伤后成年海马的神经发生。在脑损伤的小鼠模型中注入FGF2可以减少梗死面积[7]。这些途径充分证明FGF2神经保护作用。TGFα可诱导脑卒中后新生神经元和胶质细胞数量显著增加,起血管生成和神经保护功能,减少缺血损伤所致的梗死面积。其中部分促血管生成作用可能是继发于骨髓来源的内皮细胞进入脑梗死边缘区的血管形成的[8]。此外Tang等研究表明,dl-3-正丁基苯酞治疗急性脑梗死时可以明显提高FGF2、血管内皮生长因子(VEGF)的表达,进一步提示了血管生成因子在脑卒中的重要性[9]。当然机体也存在一些抗血管生成因子,如血小板反应蛋白-1(TSP1),它主要由由内皮细胞、单核细胞等多种细胞合成,与体内多种蛋白结合,参与细胞生长凋亡、血管反应、氧化应激等多种活动[10]。它通过I型重复序列与CD36、整合素或者细胞外基质等结合发挥该作用[11],同时发现TSP1也可与血小板生长因子(PDGF-B)、FGF2、VEGF等结合[12],抑制新生血管形成,他们之间可能存在剂量饱和现象[13]。TSP1除可作为血管生成的抑制剂,还可与β1整合素结合,其N端蛋白水解和重组部分具有明显的促血管生成活性[14,15],然而在何时发挥何作用需要我们进一步研究。
通过相关性分析发现TSP1与TGFα、FGF2成正相关,我们考虑此原因可能与血管生成平衡有关。TSP1的III型重复结构域可以和FGF2结合[12],从而阻止FGF2与内皮细胞外基质的结合,并阻止内皮细胞的有丝分裂、平滑肌的增殖与迁移,达到抑制血管生成的功能[16]。目前研究表明TSP1可激活TGFβ来抑制血管生成,但是关于TGFα的研究较少。由于二者存在一定的相似性,因此我们考虑是否在激活途径上存在共同途径,需要进一步探讨。研究表明,在热休克、缺氧、PDGF、TGFβ1和FGF2的作用下TSP1 mRNA的表达会增加[17,18],进一步证实了上述研究。本实验按照NIHSS评分进行分组,仅TSP1有统计学有意义,且轻度组<中度组<重度组,提示神经功能损伤越重,则TSP1表达越高,这与李敏等研究一致[19]。回归分析结果也表明TSP1、TGFα与FGF2对脑梗死而言是一种危险因素,可能是脑组织损伤严重,血管开通、再灌注的时间延长,则需要更多的血管生成因子来促进血管生成,但是同时伴随着TSP1表达增加来抑制血管生成,此矛盾机制反而促进了机体的平衡,我们可以利用此机制来实现对脑梗死的诊治。通过ROC曲线分析,进一步证实了提示TSP1、TGFα与FGF2可作为疾病诊断的潜在指标。
综上所述,本实验通过对TSP1与TGFα、FGF2的研究,进一步证实了三者的关系;然而仍存在一些不足,如样本量仍需进一步扩大,或者通过构建体外模型分析不同损伤情况下TSP1与血管生成因子作用机制、影响因素等,这对我们研究急性脑梗死而言将是一种很好的思路。

