血清BDNF、Val66Met基因多态性和早期帕金森病临床症状的相关性
吴 擎, 俞 鸣, 刘红艳
帕金森病(Parkinson’s disease,PD)作为一种常见的神经系统退行性疾病,严重影响患者的生活质量;而脑源性神经营养因子(Brain-derived neurotrophic factor,BDNF)在 PD的发病和病程中起着重要作用[1],BDNF介导的神经营养不良可能是PD病因之一[2]。目前研究表明,在慢性帕金森病患者中,BDNF水平明显低于正常人群[3,4],和认知功能、抑郁程度也存在显著相关性,并且随着相关症状的改善,BDNF水平也可能得到明显的提升[5~7]。但是现有研究对象均为慢性服药患者,尚未有对于早期未服药的PD患者的相关研究。
BDNF Val66Met是BDNF的中一种单核苷酸基因多态性(G到A),是由前结构域66位处的缬氨酸(Val)取代蛋氨酸(Met),使BDNF树突分布和转运减少,从而损害BDNF活性依赖的分泌途径,而其可能在帕金森病中发挥重要作用[8,9]。目前已有BDNF Val66Met基因多态性在PD中的分布、与正常人群的差异以及和临床症状相关性的研究,但是由于纳入人群的病情严重度、评定方法和种族差异等原因,结果不一致甚至相矛盾[9~13],因此有必要进一步探究在中国早期PD人群中的情况。
目前鲜有早期未服药的中国PD人群中BDNF、Val66Met基因多态性的研究报道,而抗帕金森病药物的干扰以及副作用可能会影响临床症状的判断;此外,对于PD患者临床分型(震颤为主型、强直少动型和混合型),以及自主神经功能障碍(如直立性低血压的发生率)在早期PD中涉及较少。因此本研究着重探讨:(1)早期未服药PD患者和健康人群BDNF、Val66Met基因多态性的差异;(2)早期PD患者BDNF、Val66Met基因多态性是否与临床症状相关。
1 资料与方法
1.1 研究对象
收集就诊于宁波市第一医院的早期PD患者62例,这些患者从未接受帕金森病药物治疗,同时符合2015年运动障碍协会的诊断标准[14]。排除标准:(1)合并严重的周围神经病;(2)严重认知障碍或精神异常无法配合者;(3)严重吞咽或进食困难者。此外,收集年龄、性别相匹配的46例健康者作为对照组。本研究方案通过宁波市第一医院伦理委员会批准。
1.2 研究方法
1.2.1 人口资料学和临床资料 对早期PD患者进行症状分型(震颤为主型,强直少动型以及混合性),Hoehn-Yahr (HY分级),统一帕金森病评定量表UPDRS-Ⅲ测评,同时对所有受试者进行一般人口学资料收集,汉密尔顿焦虑量表(HAMA)[15]、汉密尔顿抑郁量表(HAMD)[16]评估以及卧位、3 min内站立位血压测定判断是否存在直立性低血压(OH),OH定义为与卧位血压相比收缩压降低至少20 mmHg和(或)舒张压降低至少10 mmHg[17,18]。
1.2.2 BNDF和BDNF Val66Met基因型检测 收集患者静脉血5 ml(两管),其中一管在3000 转/min离心5 min后取上层血清,两管置于-70 ℃冰箱备用。BDNF水平检测取血清标本,采用双抗体夹心酶联免疫吸附试验(ELISA)法,操作严格按照杭州联科生物技术有限公司提供的试剂盒说明书进行。Val66Met基因型检测取全血标本,采用聚合酶链式反应(PCR)法,对所有样本进行基因分型,确定BDNF基因(rs6265,c. 196G>A,Val66Met)中单核苷酸多态性。
1.3 统计学方法
所有数据应用SPSS 21.0进行分析。两组连续变量比较采用t检验或U检验,分类变量比较采用卡方检验,多组间资料比较应用单因素方差分析或卡方检验。临床资料之间的关联采用Pearson 或Spearman相关性分析,并进一步用多元线性回归印证相关性。以P<0.05表示为差异具有统计学意义。
2 结 果
2.1 早期PD组和健康对照组人口资料学和临床特点比较
本研究共纳入PD患者62例(其中男性37例,女性25例),健康对照者46例(其中男性27例,女性19例),表1显示两组的年龄、性别、教育程度和BDNF Val66Met基因多态性均无显著差异(P>0.05),早期PD组HAMA、HAMD分值和OH发生率均显著高于对照组(P<0.05),而BDNF水平明显低于对照组(P<0.001)。
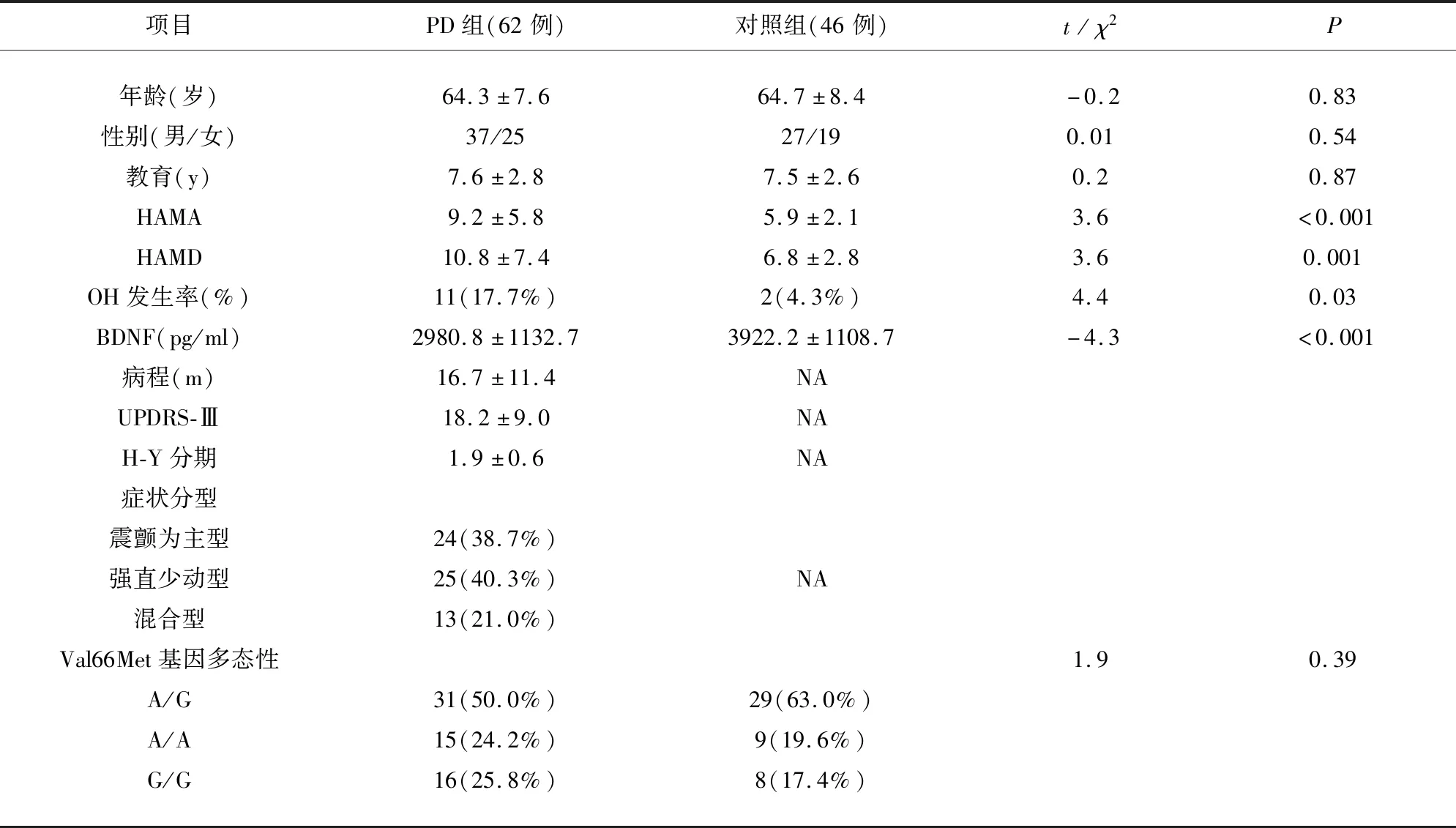
表1 早期PD组和对照组一般资料和临床症状学比较
2.2 不同BDNF Val66Met基因多态性在早期PD和对照组中各指标比较
在表2中可以看到,在PD人群中,Val66Met三种基因型(A/G、A/A和G/G)所对应的年龄、性别、教育、病程、UPDRS-Ⅲ、HAMA、HAMD分值、H-Y分期、OH发生率、BDNF水平以及症状分型无明显组间差异(P均>0.05);在对照组中,各基因型亚组间中的各项指标也无显著统计学差异(P均>0.05)。
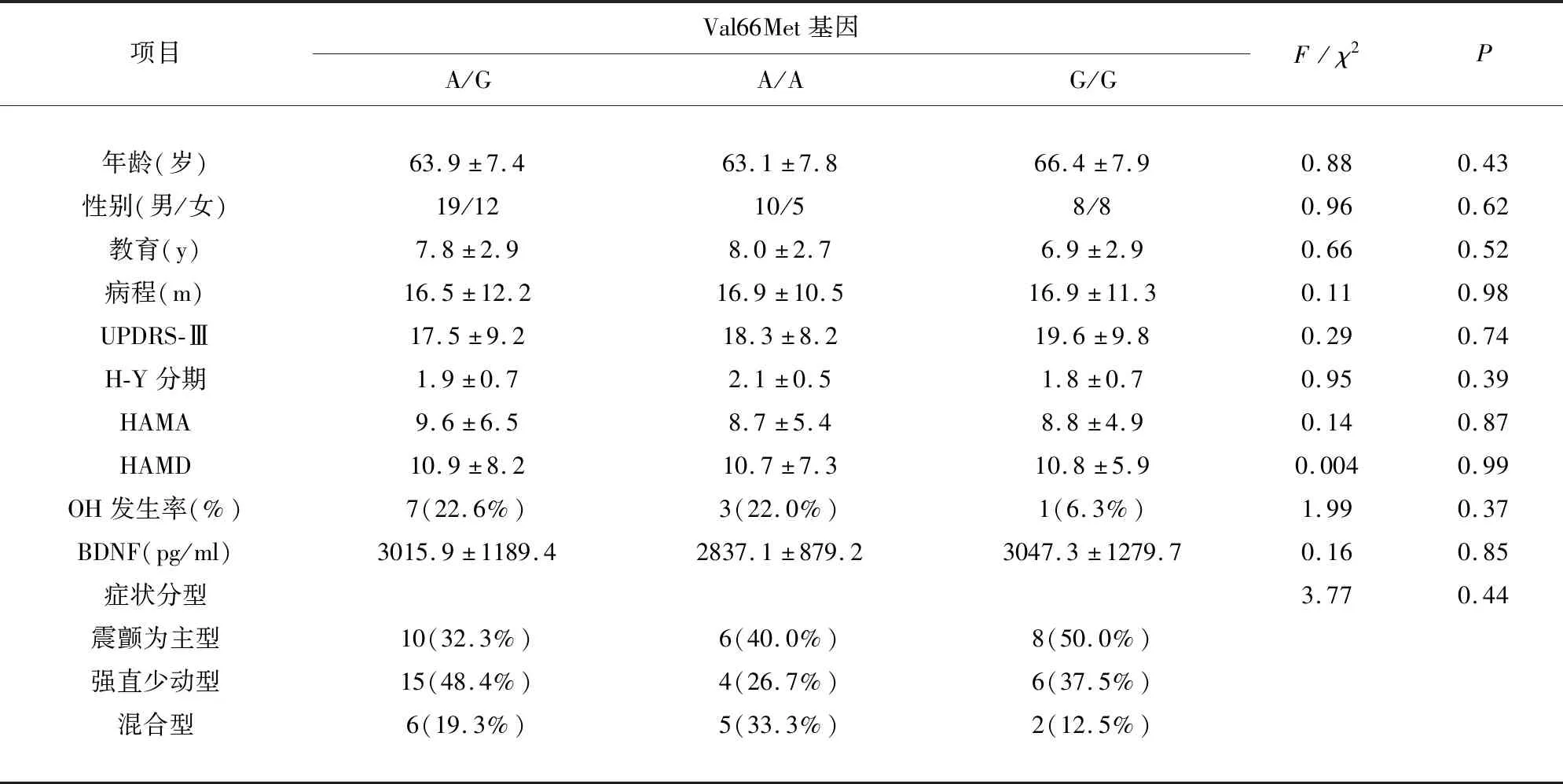
表2 早期PD患者BDNF Val66Met基因多态性的临床特征
2.3 早期PD组和对照组中BDNF水平、Val66Met基因型与各临床指标的相关性
Pearson 和 Spearman 相关分析显示在PD患者中,BDNF水平和UPDRS-Ⅲ、HAMA、HAMD分值、H-Y分期以及病程均存在显著相关性(P<0.01);而以BDNF为因变量,临床指标为自变量的多元线性回归显示仅HAMA(t=-2.556,P=0.014)和HAMD(t=-2.583,P=0.013)分值与BDNF水平有独立负相关性(见表3)。在正常组中BDNF和各临床指标均未发现显著相关性(P均>0.05)。而在PD组和对照组中,均未发现Val66Met基因型与各临床指标之间的相关性(P>0.05)。

表3 多元线性回归分析早期PD患者BDNF水平和临床症状的相关性
3 讨 论
目前尚无对于中国早期未服药PD患者血清BDNF、Val66Met基因多态性和临床症状相关性的研究报道。本研究发现早期未用药的PD患者BDNF、焦虑抑郁程度、直立性低血压的发生率和健康人群存在明显差异,BDNF水平和焦虑、抑郁程度呈独立负相关,而Val66Met基因型分布与健康人群无异,且与临床特点无显著相关性。
有研究报道,PD患者的非运动症状可以贯穿疾病全程,同时表现为如焦虑、自主神经功能障碍等多种形式[19,20],而本研究显示在疾病早期即可出现较为明显的焦虑抑郁和直立性低血压,和文献报道一致。
我们发现,早期PD患者的BDNF水平明显低于正常人群,这和先前的报道一致[21,22],这一现象可能与病理生理机制相关。有PD动物模型显示黑质纹状体通路中BNDF表达减少[23],而PD尸检报告提示患者脑组织中黑质、尾状核以及壳核部位的BDNF mRNA水平减少[24];此外,由于PD的发病机制是多巴胺能神经元缺失,BDNF可以与多巴胺系统相互作用,从而促进和诱导多巴胺能行为[25]。
有关PD中BDNF和焦虑程度的关系研究较少,Lucian等[26]研究发现在大鼠中注射脂多糖模拟帕金森样表现,可以降低BDNF mRNA的表达水平,同时增加大鼠的焦虑样行为;而在灵长类动物焦虑模型中显示纹状体多巴胺结合能力下降,继而可能影响BDNF表达,因此,结合我们的研究结果,有理由相信PD患者中BDNF水平和焦虑症状的密切联系。
我们也发现了早期PD患者中BNDF和抑郁程度存在负相关性,这与Wang等[5]在慢性PD人群中的研究结论相似,此外,一项国外的研究提示重度抑郁症患者在服用抗抑郁药物后降低的血清BDNF水平可以恢复到正常水平[27],而国内学者[28]在电针联合药物治疗PD伴抑郁患者后BDNF也有明显的升高,进一步证实了BNDF和抑郁的联系。动物模型中也有相似结果,抑郁模型的大鼠中与抑郁情绪变化密切相关的海马、前额叶和杏仁核等部位BDNF水平较其他部位下降更明显[29,30]。虽然BDNF在PD抑郁症状中的机制仍不明确,但是BDNF作为一种神经营养因子和重要的突触效能传导器,对轴突生长和突触的可塑性调节有重要的神经保护作用,而低水平的BDNF可能影响海马、杏仁体等部位的突触成熟性和可塑性进而导致抑郁。本研究中没有提示BDNF和运动症状的关联,但是有报道显示BDNF和PD的病程时间相关[21],作者推测BDNF的上升是PD晚期的一种代偿机制,因我们的研究对象为早期PD,需要更长时间的随访来证实这一结论。
在本研究中,我们没有发现BDNF Val66Met基因型在PD和健康人群中的差异,同时基因型与临床特点也无显著相关性。目前已有相关报道,但是结果并不一致,例如,Hong等[9]发现在中国PD和健康人群BDNF Val66Met基因型无显著差异,PD的发病年龄也和该基因型无关,同时在两组中都是A/G基因型为主,约50%左右,这与我们的结论非常接近;瑞典一项类似的研究也没有发现两组之间基因型的差异[13];在日本PD人群中A/A基因型比率显著高于健康人群[11],一项巴西的研究则提示PD患者G/G基因型占绝大多数,且明显高于对照人群,而G/G基因型和焦虑、抑郁的程度以及病程的发展密切相关[10],可能由于G等位基因影响BDNF前体的细胞外加工从而增加PD的易感性。在运动症状方面,一项纳入217例早期PD的研究显示A/A基因型的患者运动症状更轻微,病情进展更慢[31],而在本研究中未发现这种趋势。上述不同的研究结论可能和以下因素相关,首先,种族差异性可能是较为重要的原因,例如Momose[11]中对照组A/A基因型为12.7%,低于我们的对照组19.6%,而巴西人群仅为2.1%[10],瑞典人群为3.9%,Håkansson等也指出了亚洲人群和白人之间的种族差异[13]。第二,我们收集的为早期PD患者,运动症状以及焦虑抑郁等非运动症状相对慢性PD程度较轻,可能随着病情的进展,BDNF Val66Met基因型和PD症状的关联性会出现变化,需要长期随访来证实。第三,我们的研究对象未使用抗帕金森病药物,而药物本身也会出现相关副作用进而影响临床症状。此外病程时长、焦虑抑郁评定量表选用的差异等因素都会对研究结果产生影响,因此,目前Val66Met基因型在PD中所发挥的作用以及具体机制仍不明确,值得进一步探究。
本研究也存在一定的局限性。首先,样本量较小,单中心研究可能会造成统计结果的偏差;其次,研究指标相对较少,未来需要增加认知、睡眠、嗅觉、营养状况等PD其它非运动症状指标以达到更全面的评估。
综上所述,本研究提示了早期未服药PD患者即可出现显著的BDNF水平下降,焦虑抑郁表现和自主神经功能障碍,并且BDNF和焦虑抑郁程度密切相关,因此早期的BDNF补充治疗可能是改善PD症状和提高患者生活质量的一种方法。而BDNF Val66Met基因型在中国PD的发生和病情进展中未发挥显著作用,需要进一步多中心、大样本和长期随访来证实。

