血清β淀粉样蛋白对急性脑梗死后出血转化预测价值及相关因素分析
牛 壮, 胡全忠
急性脑梗死是造成不可逆脑损伤和严重残疾后遗症的常见原因,其中急性脑梗死后出血转化(HT)是急性缺血性脑卒中的常见并发症,是脑梗死后的一种特殊形式和自然预后的一个阶段。患者出血转化后使得病情进展并导致神经功能受损程度加重,更加大了其他并发症的风险,大大增加了病死率及致残率;本文就血清β淀粉样蛋白水平及其他相关危险因素来探讨非溶栓急性脑梗死后出血转化的预测价值及相关分析。
1 资料与方法
1.1 临床资料
1.1.1 一般资料
选取2021年3月至2021年10月以来青海省人民医院神经内科入院急性脑梗死患者共114例并收集其一般资料,观察组41例(发生出血转化),对照组73例(未发生出血转化),其中大动脉粥样硬化性58例,小动脉闭塞型43例,心源性栓塞型6例,不明原因及其他未明确原因型7例。
1.1.2 诊断标准
根据《中国急性缺血性脑卒中诊治指南2018》[1]为诊断标准纳入急性脑梗死患者。HT诊断标准根据中国急性脑梗死后出血转化诊治共识2019,发病入院后24 h之内出现神经系统症状加重,美国国立卫生院神经功能缺损评分(NHISS)增高≥4分者,复查CT或MRI后发现颅内出血灶[2],根据HT是否伴有症状及体征的加重程度可分为症状性出血转化和无症状性出血转化,根据欧洲合作急性卒中研究II(ECASS II)标准及结合核磁共振检查等来明确出血分级[3]。
1.1.3 排除标准
病情危重不能耐受 MRI从而没有MRI检查或有心脏起搏器及其他MRI禁忌证的没有检查MRI者;因颅脑外伤、颅内肿瘤、动脉瘤破裂、烟雾病,动静脉畸形及各种造成凝血功能异常导致的脑内出血;合并恶性肿瘤、严重心脏疾病、免疫系统疾病、精神障碍、传染病等病史。
1.2 方法
1.2.1 一般资料收集
患者入院后ACI患者当天采集空腹静脉血,经低速离心机离心后将血清移入冻存管内,放置于-80 ℃超低温冰箱内保存,择期行血清β淀粉样蛋白测定。测定血清Aβ水平使用人β淀粉样蛋白试剂盒(ELISA)产自上海酶联,试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。实验方法:向预先包被人β淀粉样蛋白(Aβ)捕获抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的人β淀粉样蛋白(Aβ)呈正相关。用酶标仪在450 nm波长下测定吸光度(OD值),计算样品浓度,得出样本血清Aβ含量并记录。
1.2.2 相关影响因素分析
记录入组ACI患者资料:年龄、性别、既往病史、入院前是否使用抗凝药物等,入院后记录血Hyc、血尿酸、低密度脂蛋白、血清Aβ、入院时美国国立卫生研究院卒中量表(NHISS)评分等。
1.2.3 统计方法
2 结 果
2.1 一般资料统计分析
HT组与未出现HT组之间年龄、性别、高血压病史、房颤病史、Hyc、LDL差异均无统计学意义(P>0.05),糖尿病病史、尿酸、入院NHISS评分、Aβ差异均有统计学意义(P<0.05)(见表1)。
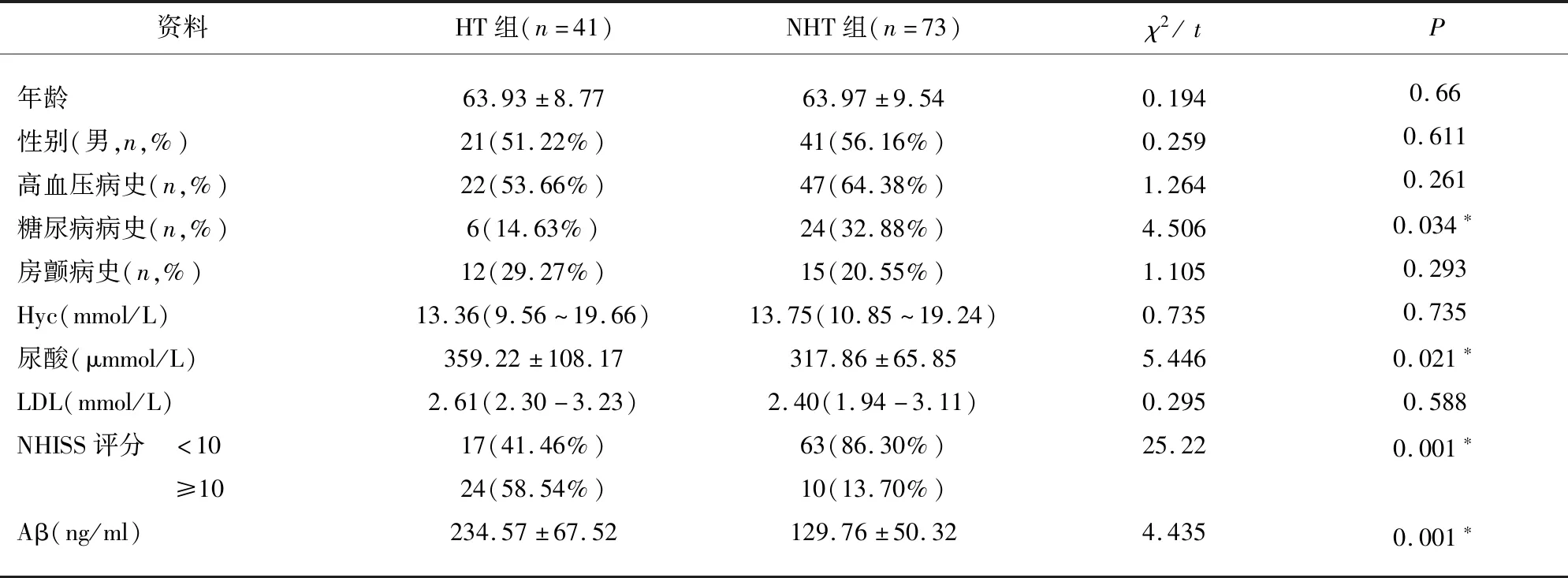
表1 HT组与nHT组单因素分析
2.2 HT相关危险因素二元Logistic回归分析
经二元Logistic回归分析后,高血压病史、尿酸、NHISS评分(≥10分)、Aβ为中老年急性脑梗死后出血转化的危险因素(OR>1,P<0.05)(见表2)。

表2 二元Logistic回归分析HT发生的危险因素
2.3 HT组中症状组于未出现症状组间Aβ水平相关性分析
ACI患者中发生出血转化的病例根据NHISS评分是否≥10分表示神经功能缺失严重程度,分为症状组和未出现症状组,两组之间差异具有统计学意义(P<0.05)(见图1)。
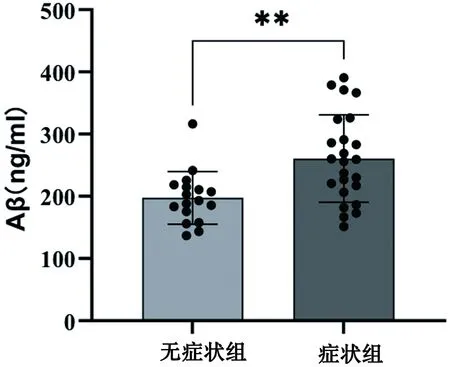
图1 HT组中症状组与无症状组血清Aβ水平
2.4 ACI组患者血清Aβ与其他危险因素变量Person及spearman秩相关检验
分析ACI患者血清Aβ与其他出血转化相关危险因素关系,血清Aβ与入院NHISS评分存在中正相关关系,血清Aβ与尿酸水平、LDL水平存在低正相关关系(见表3、图2~图4)。

表3 血清Aβ与其他危险因素相关性分析
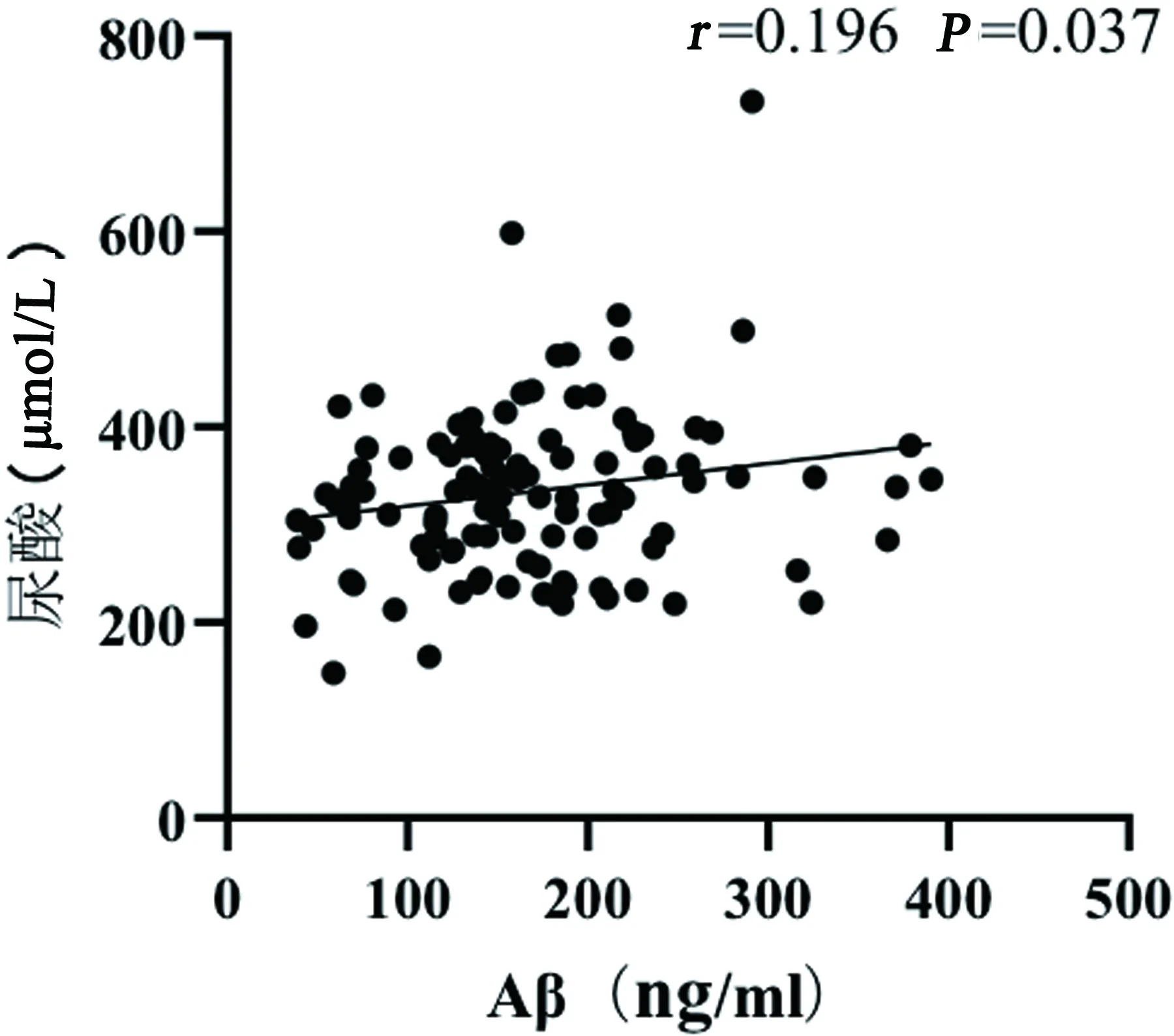
图2 血清Aβ与尿酸相关性
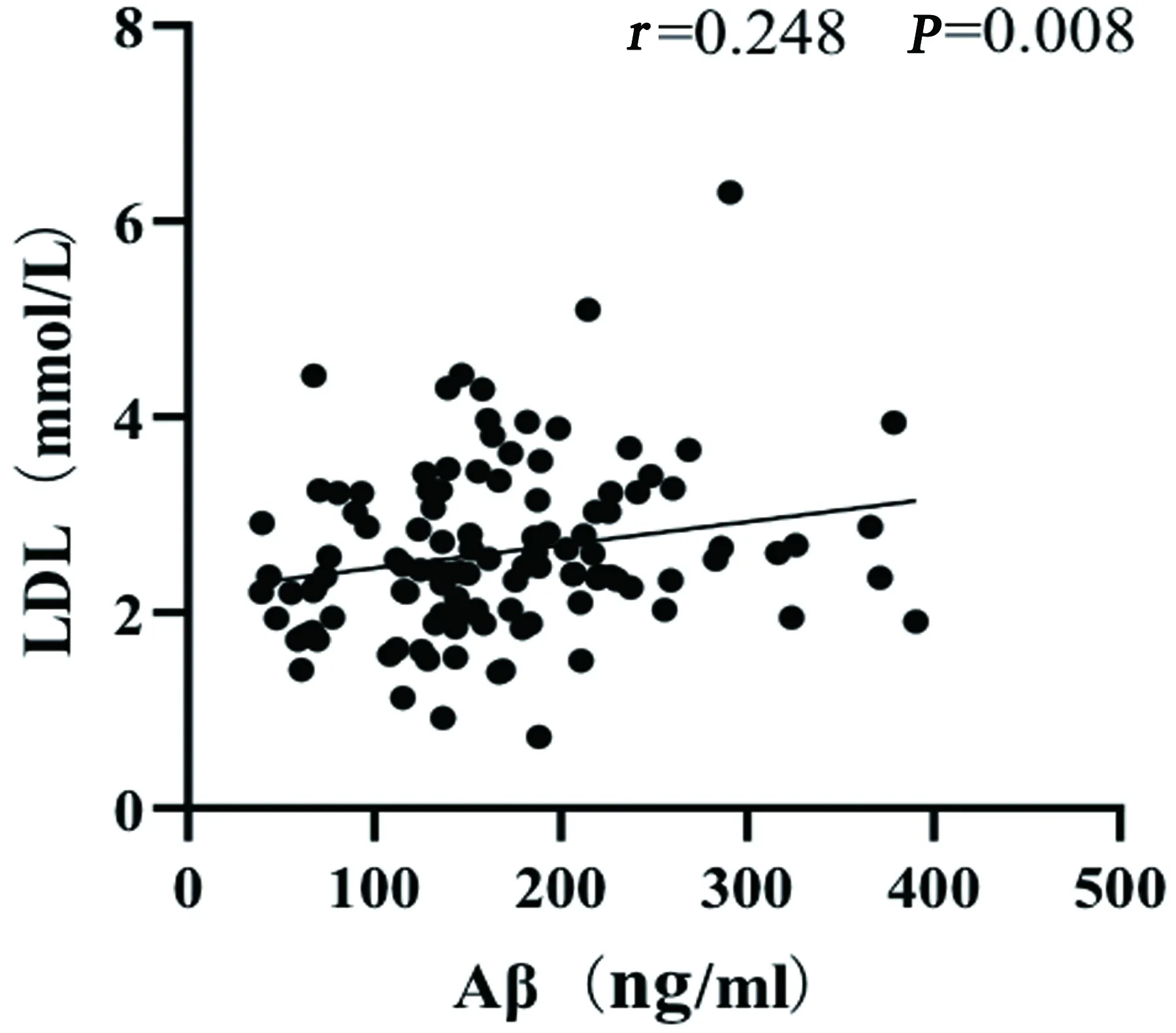
图3 血清Aβ与LDL相关性
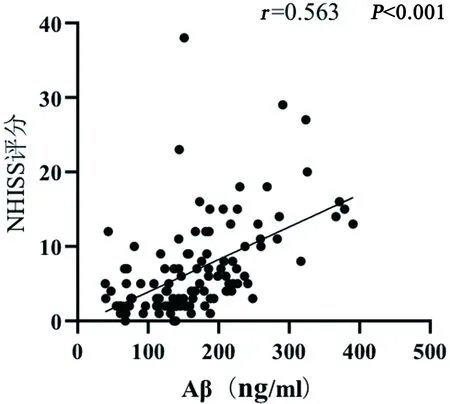
图4 血清Aβ与入院NHISS评分相关性
2.5 血清Aβ对急性脑梗死后出血转化的ROC曲线分析
ROC曲线分析结果:血清Aβ预测急性脑梗死后出血转化风险的曲线下面积为:0.909,最佳截断值为166.84,灵敏度为:87.8%,特异性为:79.5%,阳性预测值为:70.59%,阴性预测值为:92.06%(见图5)。
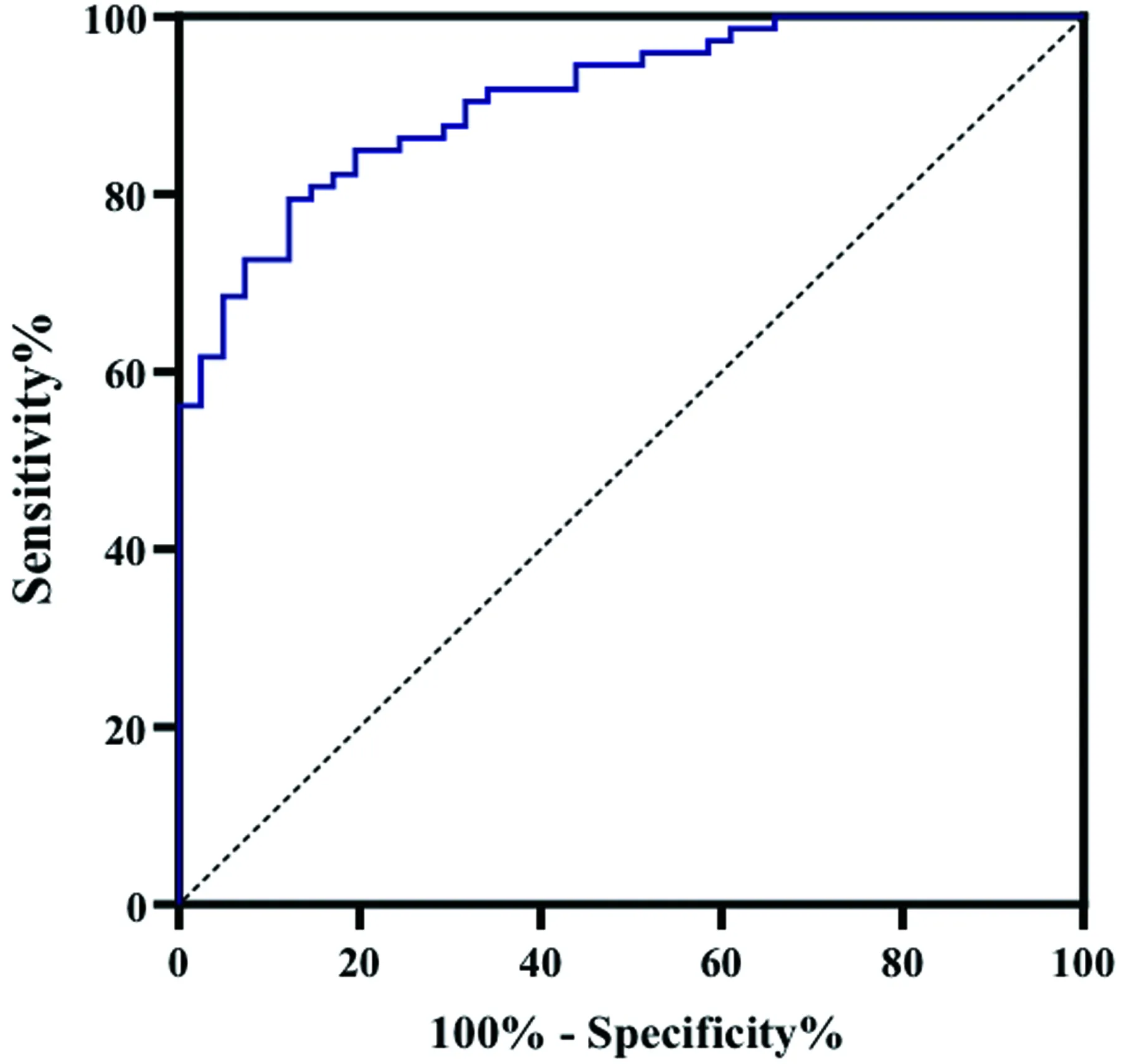
图5 血清Aβ对于急性脑梗死后出血转化ROC曲线
3 讨 论
急性脑卒中是我国病死率第一的疾病,特别是急性缺血性脑卒中其具有极高的致残率,一旦发生给患者及家属带来严重的身体上及心理上的负担。急性脑梗死患者出现出血转化后加重神经功能受损程度影响预后,并导致各种并发症出现,大大增加了病死率及住院时的治疗费用[4],因而注重分析急性脑梗死后出血转化的危险因素就显得尤为重要,以往研究表明静脉溶栓后脑梗死出血转化风险更会加大,因而对于这类患者的出血转化风险及预测研究也是迫在眉睫。
本文就急性脑梗死后出血转化的相关因素进行分析,得出Aβ、高血压病史、尿酸及入院时NHISS评分(≥10分)为出血转化的危险因素,本文病例于青海省人民医院收集,因青海地处中高海拔地区,其独特的地理及环境饮食因素脑卒中及脑白质病变发生率较高,这与高原缺氧高寒的环境,高脂、高盐、高嘌呤的饮食结构等也有关[5],高嘌呤饮食导致高尿酸血症的发病率居高不下,汤也等研究表示尿酸与促炎性细胞因子相关,并使用别嘌呤醇、碳酸氢钠等降尿酸药物后,促炎性细胞因子水平明显下降[6],这就解释了血清Aβ与入院后尿酸水平存在低度正相关。脑梗死后出血转化也经研究证实与炎性因子相关[7],因其它促炎性因子水平无法直观便捷的控制,所以控制血尿酸水平可以更加良好的阻止出血转化的发生。吉维忠等研究表明高原所有脑血管病的类型均存在,但缺血性脑血管病最常见,大面积脑梗死也较常见[8],入院时的NHISS评分反应了患者神经功能缺损程度,并有一定预测大面积脑梗死的作用,有研究表明急性大面积脑梗死大面积的梗死易发生出血转化[9],这也解释了入院NHISS评分与血清Aβ存在中度相关性,可能与梗死灶周围出现明显脑水肿进而压迫外周静脉,以引起血液的瘀滞和血管的缺血性损伤有关[10],刘利君等研究表明急性大面积脑梗死并且未溶栓患者更易发生HT[11],所以入院时NHISS评分越高提示神经功能缺损越严重,出血转化的风险可能更高。
β淀粉样蛋白(Aβ)是主要由脑组织产生的氨基酸片段,Aβ40、Aβ42含量最多[12],Aβ具有神经毒性,通过诱导自由基损伤、炎症反应以及氧化应激等减少突触而损伤神经元,破坏神经网络,导致脑损伤[13]。另外HT出血部位多发生于脑叶梗死部位,提示急性脑叶梗死的患者更容易发生HT,这是由脑叶发生血管透明变性的机制所致,并有研究表明脑叶部位和β淀粉样蛋白沉积有关,β淀粉样蛋白沉积易引发淀粉样脑血管病,导致脑出血[4]。HT的发生一个复杂且多因素的过程,目前国内外并未对其具体机制有统一阐述。根据目前研究表明,HT的发生与血脑屏障和基底板基质的完整性的过程有关[4],在血管缺血超急性期,突发性缺氧损害血脑屏障,导致细胞毒性水肿和通透性增加;在急性期,神经炎性反应加重血脑屏障损伤,导致通透性增加[15],缺血影响下沉积Aβ的血管出现通透性增加,更加大了发生HT的概率。中老年急性脑梗死患者中脑白质病变发生率较高,脑白质病变指脑室周围及皮质下因缺血及低灌注出现的白质病变,也是脑小血管疾病的常见表现之一,ACI患者多合并脑白质病变,有研究证实脑白质病变病理生理改变与血脑屏障的通透性有关,且其与HT的发生具有一定的相关性[16],刘春苗等研究中表明血清中Aβ指标对于预测脑梗死有一定的临床价值[17]。此次纳入的ACI患者中发生出血转化组与未出血转化组之间,HT组血清Aβ水平高于NHT组水平(P<0.05),提示血清Aβ的水平是急性脑梗死后出血转化的独立危险因素并具有一定预测HT的价值。并且我们将HT组中根据入院时NHISS评分是否≥10分分为症状组和未出现症状组,症状组Aβ水平高于无症状组(P<0.05),提示Aβ水平也有一定预测出血转化严重程度的作用。
本研究通过测定急性脑梗死后出血转化患者血清中Aβ的水平及其他相关因素来探究出血转化的发生,为急性脑梗死后出血转化的预测及预后提供判断价值。但本研究存在一定的局限性,其中样本量少,为单中心性研究,可能存在选择上的偏倚,因此需要更进一步的多中心、大样本的前瞻性队列研究来完善探索。

