双氢青蒿素对放射性肺损伤小鼠肺部炎症和氧化应激的作用*
蒙湾湾,赵伟东,李丽清,王瑜丹,梁世雄
(1.广西医科大学,南宁 530021;2.广西医科大学附属肿瘤医院放疗科,南宁 530021)
放射性肺损伤(radiation-induced lung injury,RILI)是临床上最常见的胸部肿瘤放射治疗的并发症之一,总体发生率约为20%~36%[1],有研究显示,RILI发病率最高的是肺癌(5%~25%),其次是纵隔淋巴瘤(5%~10%)和乳腺癌(1%~5%)[2]。RILI限制了放射治疗的剂量并影响患者的治疗效果和预后,是发生非原发病因死亡的主要原因之一。细胞因子学说是RILI发病机制的研究热点,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、转化生长因子-β(transforming growth factor-β,TGF-β)是RILI发生、发展过程中非常重要的细胞因子,在RILI生成的活性氧自由基(reactiveoxygen species,ROS)刺激下,TGF-β、TNF-α大量产生[3-4]。同时,在照射过程中ROS本身也是RILI产生的重要原因[5]。这使抗氧化成为防治放射性肺损伤的重要研究方向。
双氢青蒿素(dihydroartemisinin,DHA)是青蒿素的衍生物,是高效、速效、低毒的抗疟药[6-7]。有研究发现,DHA能通过作用于TLR4/NF-κB通路,抑制NF-κB的激活,调控TGF-β、TNF-α等多种炎症因子的表达从而实现抗炎效果[8]。为此,本研究通过复制小鼠RILI模型,观察DHA对肺组织TNF-α、TGF-β、超氧化物歧化酶(superoxide dismutase,SOD)及ROS表达的影响,以探讨DHA对RILI的干预作用,为RILI的治疗提供实验依据。
1 材料与方法
1.1 动物、主要试剂及仪器
健康SPF级C57BL/6小鼠54只,雄性,6~8周龄,体重20~25 g,购自广西医科大学实验动物中心(许可证号:SCXK桂2020-0003),采用标准饲料喂养,自由饮水和饮食,适应性饲养1周后进行实验。DHA购自Selleck公司,批号为S 229009;常规苏木精—伊红(HE)染色、免疫组化及TGF-β、TNF-α检测所需试剂盒购自武汉塞维尔生物,货号分别为:G1003、GB13028及GB11188;SOD检测试剂盒均购自南京建成生物,货号为A001;酶联免疫吸附试验(ELISA)及TGF-β、TNF-α检测所需试剂盒购自江苏酶免。Precise1120直线加速器购自瑞典医科达公司,酶标仪购自BIO-RAD公司。
1.2 动物分组与造模
将54只健康C57BL/6小鼠随机分为空白组、DHA组、单纯照射模型(IR)组,每组18只。对IR组小鼠进行RILI造模,小鼠RILI的造模于广西医科大学附属肿瘤医院的放疗中心进行,照射方法为单次全肺20 Gy剂量照射,此为课题组前期实验已证实可以造模成功的方法[9]:使用1%戊巴比妥钠(剂量为45 mg/kg)将小鼠麻醉,注射方式为腹腔注射,摆位后进行CT模拟定位,勾画照射野为全肺,照射面积约为1 cm×12 cm,每次照射6只小鼠,并排放置在照射台上,间隔为2 cm,用直线加速器进行单次双肺照射,照射剂量20 Gy,放射参数6 MV光子,皮源距100 cm,照射野30 cm×0.6 cm。空白组麻醉后佯装照射。照射结束后将小鼠送回动物实验中心饲养,并分别于照射后7 d、14 d处死小鼠。
1.3 给药方式与剂量
DHA溶于羧甲基纤维素钠(CMCNA)溶液中,各组均于照射前1 d开始给药,每日1次灌胃给药,连续7 d,DHA组按照前期预实验结果确定的25 mg/kg·d-1的剂量给药;空白组和IR组给予等量生理盐水。
1.4 小鼠肺标本的收集及处理
分别于照射后7 d、14 d两个时间点,每组各随机取9只小鼠,颈椎脱臼法处死小鼠后,打开胸腔,取出双侧新鲜肺组织,将左、右两侧肺均分为2份,左肺置于4%多聚甲醛溶液中固定,用于观察病理改变,取右肺置于冻存管中,放入-80℃冰箱中保存待检测。
1.5 方法
1.5.1 HE染色观察肺组织病理改变 取处理好的左侧小鼠肺组织标本,石蜡包埋,5μm连续切片,HE染色,光镜下观察肺组织炎性病理变化,并采用Szapiel半定量法[10]对其进行评分,1分:无肺泡炎表现;2分:轻度肺泡炎表现,即受累面积<20%肺叶;3分:中度肺泡炎,即受累面积为20%~50%肺叶;4分:重度肺泡炎,即受累面积>50%肺叶。
1.5.2 免疫组化染色观察TNF-α和TGF-β表达 取处理好的左侧小鼠肺组织标本,石蜡包埋,5μm连续切片,根据试剂盒说明书步骤,采用免疫组化法对肺组织中TNF-α和TGF-β蛋白相对表达量进行检测,免疫组化染色评分(IRS)=染色强度(SI)×阳性细胞百分比(PP)[11]。SI不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。PP评分为:视野中未见阳性细胞为0分,阳性细胞占总细胞数<10%为1分,11%~50%为2分,51%~80%为3分,>80%为4分。
1.5.3 冰冻切片DHE染色观察ROS阳性细胞 取处理好的左侧小鼠肺组织标本,在自制的锡箔纸小杯中以OCT包埋,液氮速冻15 s后存于-80℃冰箱,行厚度为8μm的冰冻切片。每张切片滴加50μL的10μmol/L DHE工作液,37℃孵育30 min。PBS冲洗后,滴加抗荧光猝灭剂封片,于荧光显微镜下观察并拍照。
1.5.4 电镜观察线粒体超微结构 将肺组织制成约1 mm×1 mm×1 mm的组织小块,经电镜固定液迅速固定30 min,使用醋酸铀和枸橼酸铅双染色法染色,应用透射电镜观察肺组织细胞线粒体超微结构的变化。
1.5.5 ELISA检测TNF-α和TGF-β的浓度 取各组小鼠相同部位肺组织,制作肺匀浆,3 000 r/min离心15 min,取其上清液用于检测,实验过程严格按照试剂盒说明书操作。
1.5.6 BCA法检测总蛋白含量 制作各组小鼠肺匀浆,取其上清液用于检测,其余按试剂盒说明书操作。
1.5.7 羟胺法检测肺组织SOD含量 制作各组小鼠肺匀浆,取其上清液用于检测,按SOD试剂盒说明书,采用多功能酶标仪检测肺组织SOD活性(波长550 nm)。
1.6 统计学方法
采用SPSS 16.0统计学软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组小鼠肺组织HE染色及肺组织总蛋白含量比较
小鼠肺组织HE染色结果显示:空白组小鼠肺组织肺泡壁薄、结构清晰。照射7 d和14 d后,IR组与DHA组小鼠均出现不同程度局灶性肺泡壁水肿、肺泡间隔增厚(图1白色箭头所示),巨噬细胞、中性粒细胞浸润、局部肺泡内充血(图1黑色箭头所示),其中IR组肺组织炎症明显加重,而DHA组则反应较轻;照射7 d和14 d后各组小鼠肺组织病理评分结果中,IR组评分较空白组升高,DHA组较IR组降低(均P<0.05);肺匀浆BCA法总蛋白含量检测结果显示,照射后7 d,各组小鼠肺组织总蛋白含量比较,未呈现明显差异(P>0.05);照射后14 d,IR组总蛋白含量较空白组升高,DHA组较IR组降低(均P<0.05),见表1。
表1 各组小鼠肺组织病理评分及总蛋白含量比较 ,n=9

表1 各组小鼠肺组织病理评分及总蛋白含量比较 ,n=9
与空白组比较,a P<0.05;与IR组比较,b P<0.05。
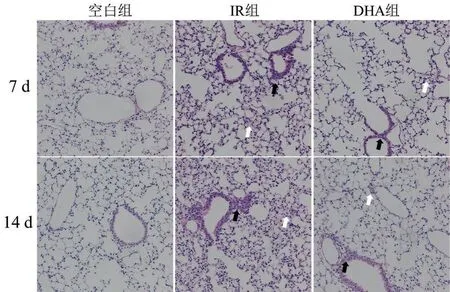
图1 各组小鼠肺组织HE染色图(×200)
2.2 各组小鼠肺组织TNF-α和TGF-β蛋白表达比较
免疫组化染色结果显示:空白组和DHA组小鼠肺组织支气管上皮中可见TNF-α和TGF-β呈散在表达,在肺实质中有少量炎症细胞及肺泡上皮细胞呈弱阳性(淡黄色)表达;照射后7 d和14 d,IR组肺组织TNF-α和TGF-β表达均增加,主要在支气管上皮中表达,呈片状、强阳性(棕褐色)表达,见图2、图3(TNF-α和TGF-β阳性表达如白色箭头所示)。

图2 各组小鼠肺组织病理TGF-β免疫组化染色结果比较(×400)
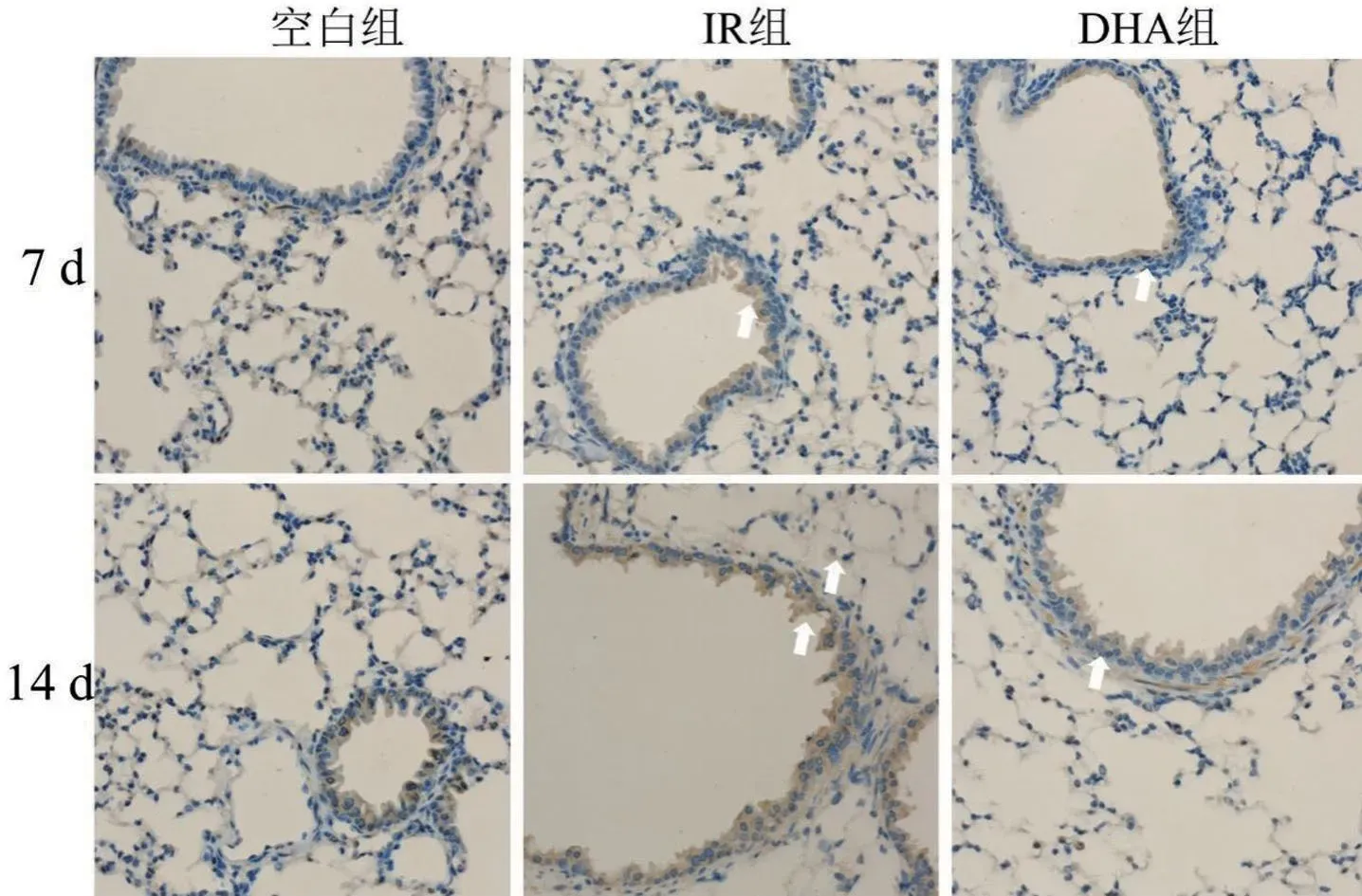
图3 各组小鼠肺组织病理TNF-α免疫组化染色结果比较(×400)
照射后7 d、14 d,与空白组比较,IR组肺组织TGF-β和TNF-α的IRS评分升高(P<0.05),与IR组比较,DHA组肺组织TGF-β和TNF-α的IRS评分降低(P<0.05),见表2。
表2 各组小鼠肺组织TGF-β和TNF-α的IRS评分比较 ,n=9

表2 各组小鼠肺组织TGF-β和TNF-α的IRS评分比较 ,n=9
与空白组比较,a P<0.05;与IR组比较,b P<0.05。
2.3 各组小鼠肺组织TGF-β、TNF-α含量及SOD活性比较
照射后7 d、14 d,与空白组比较,IR组肺组织中TGF-β和TNF-α含量均明显增高(P<0.05),与IR组比较,DHA组肺组织中TGF-β和TNF-α含量明显降低(P<0.05);照射后7 d,各组SOD活性比较,差异无统计学意义(P>0.05);照射后14 d,与空白组比较,IR组SOD活性降低(P<0.05),DHA组SOD活性高于IR组(P<0.05),见表3。
表3 各组小鼠肺组织TGF-β、TNF-α含量及SOD活性比较 ,n=9

表3 各组小鼠肺组织TGF-β、TNF-α含量及SOD活性比较 ,n=9
与空白组比较,a P<0.05;与IR组比较,b P<0.05。
2.4 各组小鼠肺组织细胞线粒体形态比较
照射后14 d,各组小鼠肺组织细胞线粒体形态学透射电镜下观察显示:空白组小鼠肺组织细胞线粒体结构基本正常;与空白组比较,IR组小鼠肺细胞超微结构明显受损,线粒体明显肿胀、嵴数量明显减少或消失,嗜锇性板层小体的板层结构出现明显融合或消失;与IR组比较,DHA组小鼠肺组织细胞超微结构损伤程度有所减轻,见图4(线粒体结构改变见图中白色箭头所示)。

图4 各组小鼠肺组织细胞线粒体形态
2.5 各组小鼠肺组织ROS水平比较
照射后14 d,各组肺组织冰冻切片DHE-ROS染色结果显示:肺组织细胞中ROS呈现红染,IR组小鼠肺组织切片中ROS阳性表达细胞较空白组增多;与IR组相比,DHA组小鼠肺组织切片中ROS阳性表达细胞减少,见图5。

图5 各组小鼠肺组织DHE-ROS染色图(×400)
3 讨论
RILI是一种由机体免疫系统介导的局部放射反应,其病理过程并不是单一靶细胞损伤的结果,而是具有多种细胞因子调控和多种细胞参与的复杂过程。有研究显示,TGF-β、TNF-α能趋化巨噬细胞和相关炎症细胞,诱导其合成IL-1、IL-6等细胞因子逐层放大“炎症瀑布”效应,进一步加剧肺部炎症反应及氧化应激[12-13]。有研究显示,青蒿素可明显抑制CpG DNA诱导的TNF-α和TGF-β释放,并且青蒿素可显著减少脓毒症大鼠炎症介质TNF-α和TGF-β的释放[14]。同时,DHA能够明显改善RILI小鼠肺组织的炎性渗出,抑制胶原纤维的产生,对RILI有保护作用[15]。本实验对TGF-β和TNF-α两种细胞炎性因子进行测定,进一步研究DHA对小鼠RILI的干预作用。组织病理学实验结果显示,IR组小鼠肺泡炎评分和免疫组化评分明显升高,肺组织TNF-α和TGF-β含量明显增加,DHA组小鼠肺泡炎评分和免疫组化评分降低,肺组织TNF-α和TGF-β含量有所减少,同时,ELISA实验结果同样呈现以上趋势,揭示DHA可以抑制小鼠肺部TGF-β和TNF-α的表达,DHA可能通过减少细胞炎性因子来减轻RILI。
近年来大量研究表明,氧化应激也是造成RILI的重要机制之一[16]。较高剂量射线进入肺组织时,将通过与机体水分子发生离子化反应产生大量ROS,ROS可对DNA、蛋白质及脂膜造成破坏,从而诱导氧化应激,上调TGF-β,并能使线粒体等细胞器功能损坏[7,17],进一步引发RILI进展。SOD是机体最主要的自由基清除剂,其可通过催化超氧阴离子和过氧化氢发生歧化反应而减少活性氧含量[18-19]。本实验中,IR组小鼠肺组织照射后14 d SOD活性降低,肺细胞线粒体超微结构损伤明显,肺组织ROS阳性细胞表达增加,而DHA组小鼠肺组织SOD活性明显升高,肺细胞线粒体超微结构损伤减轻,肺组织ROS阳性细胞表达减少。提示DHA可保护肺组织中SOD活性,减轻线粒体超微结构损伤,减少肺组织ROS的产生,缓解氧化应激反应,且其作用于该模型的时间为用药后7 d。
本文初步探讨了DHA对放疗诱导的肺损伤的作用及其机制,旨在为临床治疗RILI提供新的可能,DHA有望成为临床治疗RILI的候选药物,但DHA对RILI的保护作用机制还有待进一步研究。

