抗生素暴露对小鼠肠道菌群的改变及结肠黏膜屏障功能的影响*
杨 夏,吕自力,肖 娟,王永才,陈秀奇,黄 婷,单庆文Δ
(广西医科大学第一附属医院 1.儿科;2.病理科,南宁 530021;3.广西壮族自治区水产科学研究院,南宁 530021)
抗生素自发现以来被广泛应用于多种致命的细菌感染性疾病中,如霍乱、伤寒、流行性脑脊髓膜炎和结核病等。但临床上不规范使用抗生素现象日趋普遍,抗生素滥用的弊端随之产生。越来越多的研究发现,抗生素的不规范使用与许多肠道相关疾病或肠道外疾病存在关联,如抗生素相关性肠黏膜损伤、炎症性肠病、结直肠癌、哮喘和糖尿病等[1-3]。
抗生素相关性肠黏膜损伤是指临床上不规范应用抗生素后出现的一种常见不良反应。患者临床表现大多较轻,表现为腹痛、呕吐或腹泻,暂停使用抗生素后症状可有不同程度的恢复。部分患者临床表现较重,可有脱水、电解质紊乱等表现,严重者出现伪膜性结肠炎或中毒性巨结肠,短期内较难自行恢复或无法恢复,甚至出现肠穿孔或死亡[4]。健康人群拥有完整的肠道黏膜屏障系统,防止微生物入侵后造成的肠黏膜损伤。肠黏膜屏障系统主要由黏液屏障、肠上皮屏障、免疫屏障和微生物屏障组成。使用抗生素后,肠道内细菌群落稳态失衡,肠道黏膜屏障可能会受到损伤,细菌有可能侵入黏膜层,引发免疫效应[5]。因此,本研究通过抗生素连续灌胃诱导小鼠菌群紊乱,探讨抗生素的使用对小鼠肠道黏膜屏障和微生物群落的影响。
1 材料与方法
1.1 实验动物 选取32只雄性C57BL/J小鼠,5周龄,体重16~20 g。在22~25℃、12 h的光暗周期下,小鼠自由获取水和食物,适应性喂养1周后进行实验。所有动物实验程序均获得广西医科大学伦理委员会批准。
1.2 实验分组及处理 所有小鼠适应性饲养1周后,随机分为2组(n=16),分别为:(1)对照组(N组),生理盐水200μL/只/d,1次/d,灌胃7 d;(2)抗生素组(M组),抗生素混合液200μL/只/d,1次/d,连续灌胃7 d。抗生素混合液配制方案参照既往文献[6],具体如下:甲硝唑(1 mg/mL)、氨苄青霉素(1 mg/mL)、新霉素(1 mg/mL)、庆大霉素(1 mg/mL)和万古霉素(0.5 mg/mL)。
1.3 组织取材和处理 实验期间每天记录小鼠的精神状态、体重和粪便性状,计算粪便含水量,含水量计算公式如下:粪便含水量(%)=(粪便湿重-粪便干重)/粪便湿重×100%。实验结束时,麻醉小鼠,眼球取血后处死,采集小鼠结肠、盲肠组织,按盲肠数=盲肠重量(mg)/小鼠体重(mg)公式计算盲肠指数并统计结肠长度。取部分结肠组织为PCR实验做准备,剩余结肠组织放入4%组织固定液中,制作石蜡切片。
1.4 小鼠结肠组织苏木精—伊红(HE)染色 结肠组织收集于4%组织固定液中,石蜡包埋,切片为4μmol/L,二甲苯脱蜡、不同浓度酒精溶液中水化(无水酒精→90%→80%→70%),进行HE染色,在光学显微镜下观察结肠组织病理学改变并拍片。
1.5 小鼠结肠组织黏蛋白2(MUC2)蛋白免疫组织化学染色 制作好的石蜡切片脱蜡,水化,高压抗原热修复,内源性过氧化物酶失活,封闭非特异性抗原,之后加入MUC2一抗(按1∶2 000稀释,购于美国Proteintech公司),4℃过夜。次日加入生物素二抗工作液(1∶200),DAB显色后,用苏木精染液复染,脱水后封片,显微镜下观察拍照。用Image-Pro Plus 6.0图像软件计算MUC2的平均光密度值。
1.6 RT-qPCR检测小鼠结肠组织MUC2、白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)mRNA的表达 将各组小鼠结肠组织,加入500μL Nuclezol试剂,用研磨仪研磨,提取各组小鼠结肠组织总RNA。测定浓度后,将RNA逆转录为cDNA。后续以cDNA为模板对IL-10、MUC2、TNFα和IL-1β进行扩增,PCR反应条件:95℃预变性30 s;95℃变性10 s,60℃退火、延伸30 s,共 40个循环;添加熔解曲线:95℃15 s,60℃60 s,95℃15 s,以GAPDH为内参,引物序列见表1。
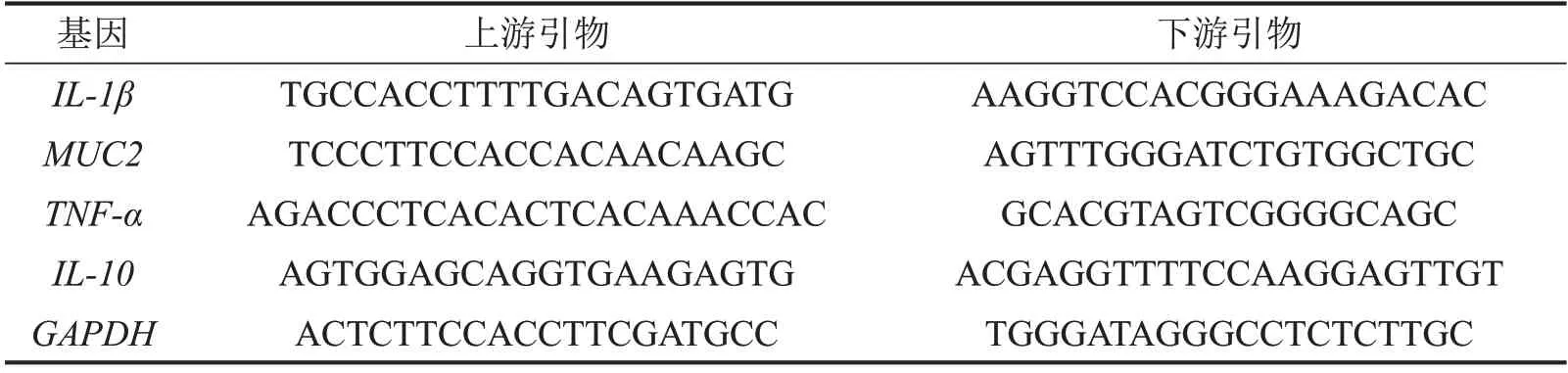
表1 PCR引物序列5’~3’
1.7 ELISA检测血浆二胺氧化酶(DAO)和D-乳酸(D-LA)表达水平 实验结束后,收集外周血,离心,收集上清,严格按ELISA试剂盒(购自武汉华美生物工程有限公司)说明书方法进行DAO和D-LA含量的检测。
1.8 16SrRNA肠道菌群测序分析 按照文献的方法[7],提取小鼠粪便总微生物基因组DNA样品后针对细菌的V3+V4可变区序列设计引物进行PCR扩增,扩增后使用Illumina公司建库试剂盒构建文库并质检,对该文库使用NovaSeq 6000 PE250平台上进行测序及分析(深圳微科盟科技集团有限公司)。
1.9 统计学方法 采用Graphpad 7.0统计分析软件处理数据。计量资料数据以均数±标准差()表示,组间比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 小鼠一般情况观察 N组小鼠精神活动、摄食、饮水正常,粪便呈棕褐色干燥成形大便。M组小鼠精神状态欠佳,粪便呈棕黄色,颗粒湿润。两组小鼠体重变化趋势一致(P>0.05)。与N组相比,M组小鼠粪便含水量升高(P<0.05),见图1。
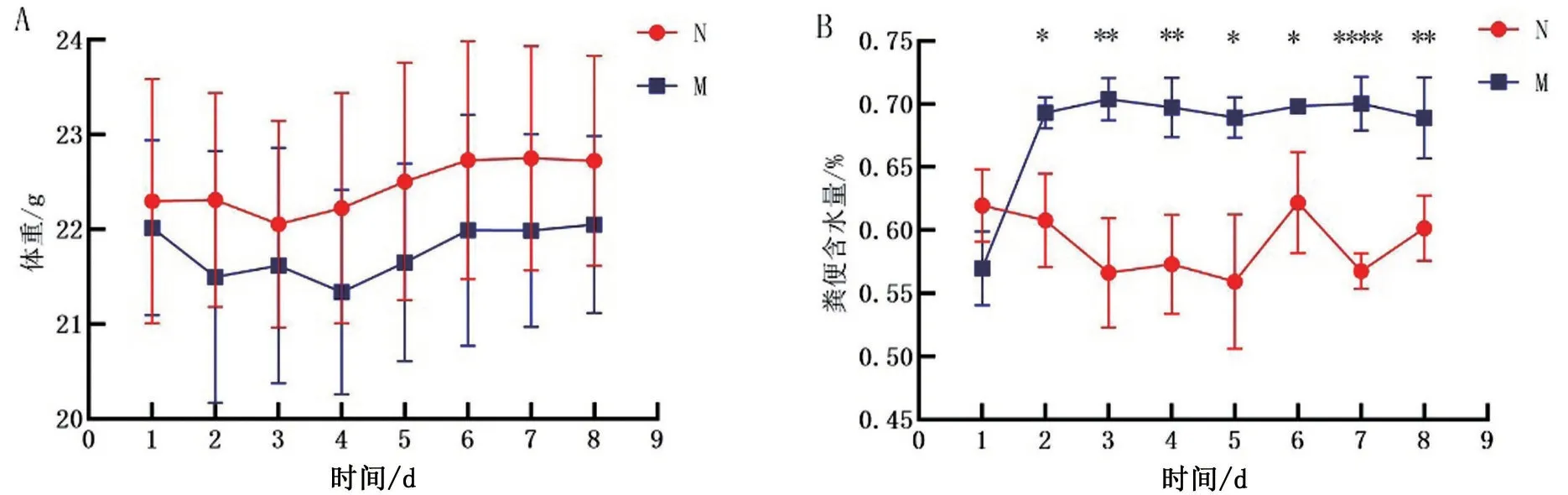
图1 小鼠体重和粪便含水量的对比
2.2 两组小鼠结肠和盲肠的变化比较 与N组相比,M组小鼠的结肠缩短(P<0.05)。与N组相比,M组小鼠离体前和清洗内容物后均可看见盲肠明显胀大,盲肠指数增大(P<0.05),见图2。
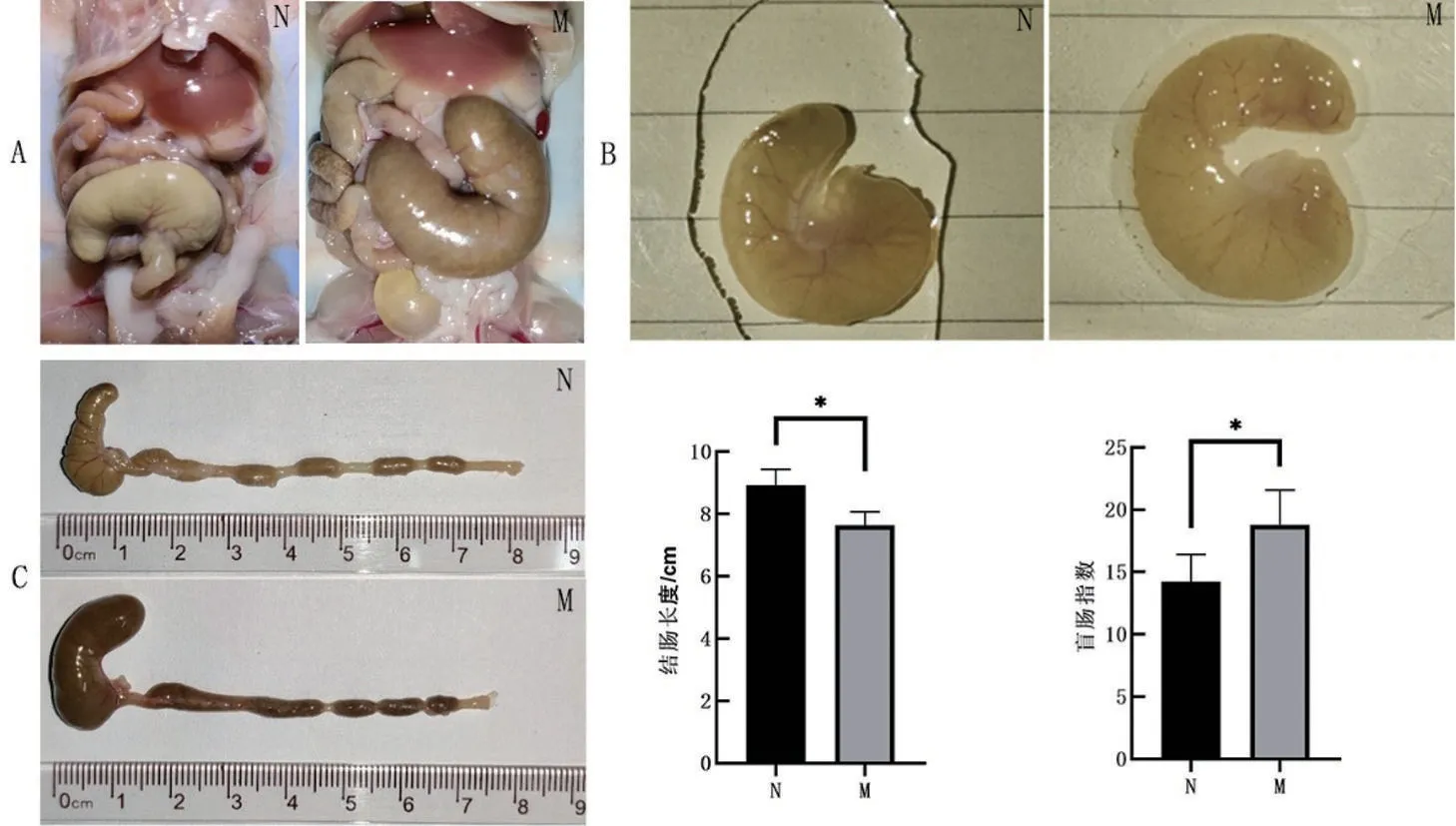
图2 小鼠结肠长度和盲肠大小的对比
2.3 两组小鼠的结肠组织病理学形态比较 N组小鼠结肠组织结构完整均匀,肠腺丰富排列规则,隐窝结构形态正常,未见明显炎症现象。与N组相比,M组小鼠有明显肠黏膜受损,表现为上皮完整性破坏,结肠腺体结构紊乱,部分腺体高度、密度下降,隐窝结构萎缩,黏膜下层可见明显水肿,黏膜及黏膜下层较多炎性细胞浸润,见图3。
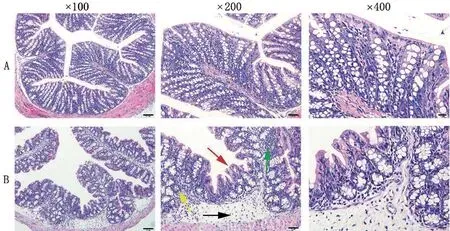
图3 小鼠结肠组织病理学形态对比(HE)
2.4 小鼠结肠组织中MUC2 mRNA和蛋白表达情况 M组小鼠结肠组织中MUC2蛋白的阳性细胞数较N组小鼠结肠中MUC2的阳性细胞数少,M组小鼠MUC2mRNA表达降低,MOD值较N组小鼠降低(P<0.01),见图4。
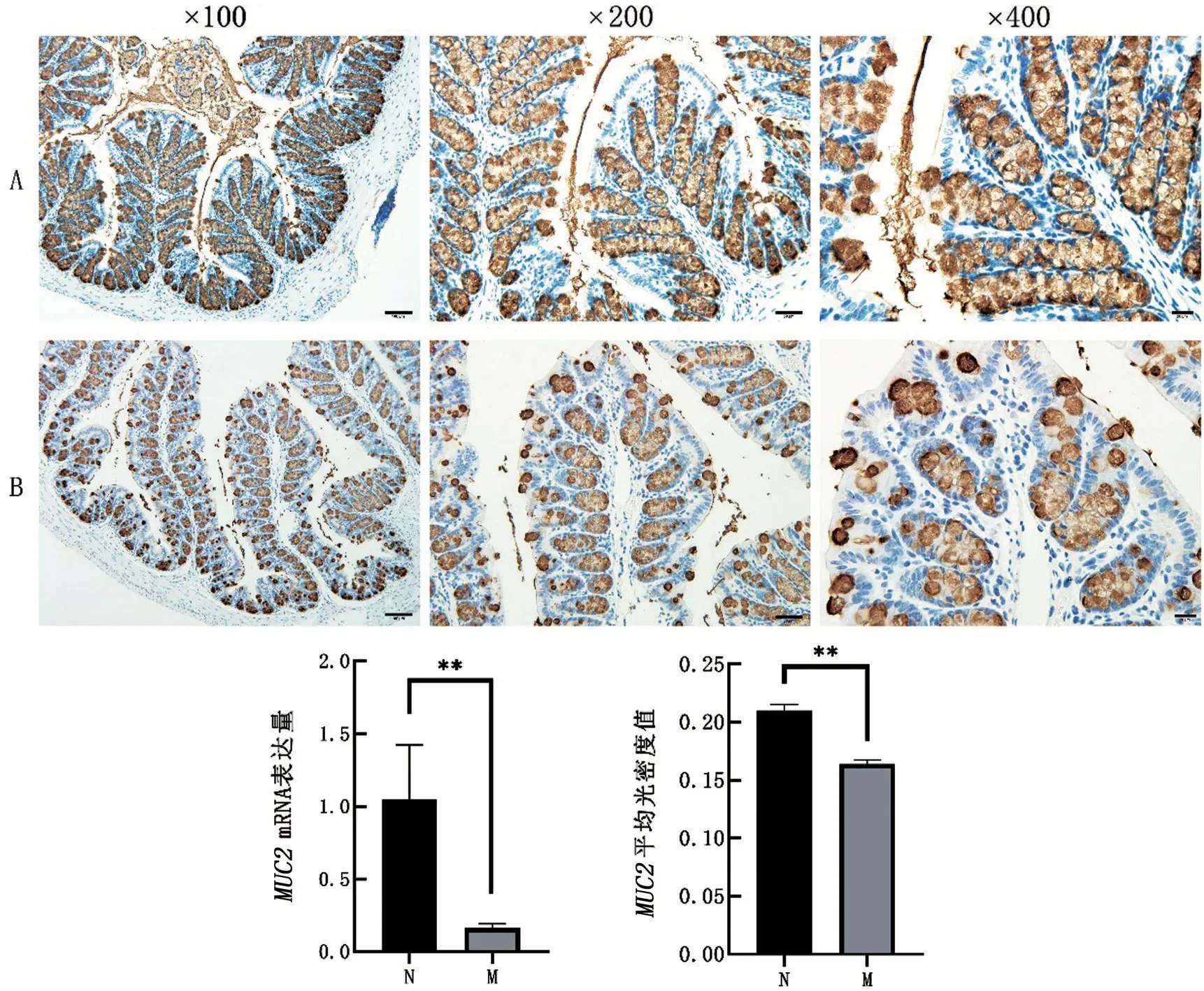
图4 抗生素给药对小鼠结肠组织中MUC2 mRNA和蛋白表达的影响
2.5 两组小鼠结肠组织中IL-1β、TNF-α和IL-10的表达情况 与N组相比,M组小鼠结肠组织中促炎因子IL-1β和TNF-αmRNA表达水平升高(P<0.01)。与N组相比,M组小鼠结肠组织中免疫调节因子IL-10mRNA表达水平降低(P<0.05),见图5。
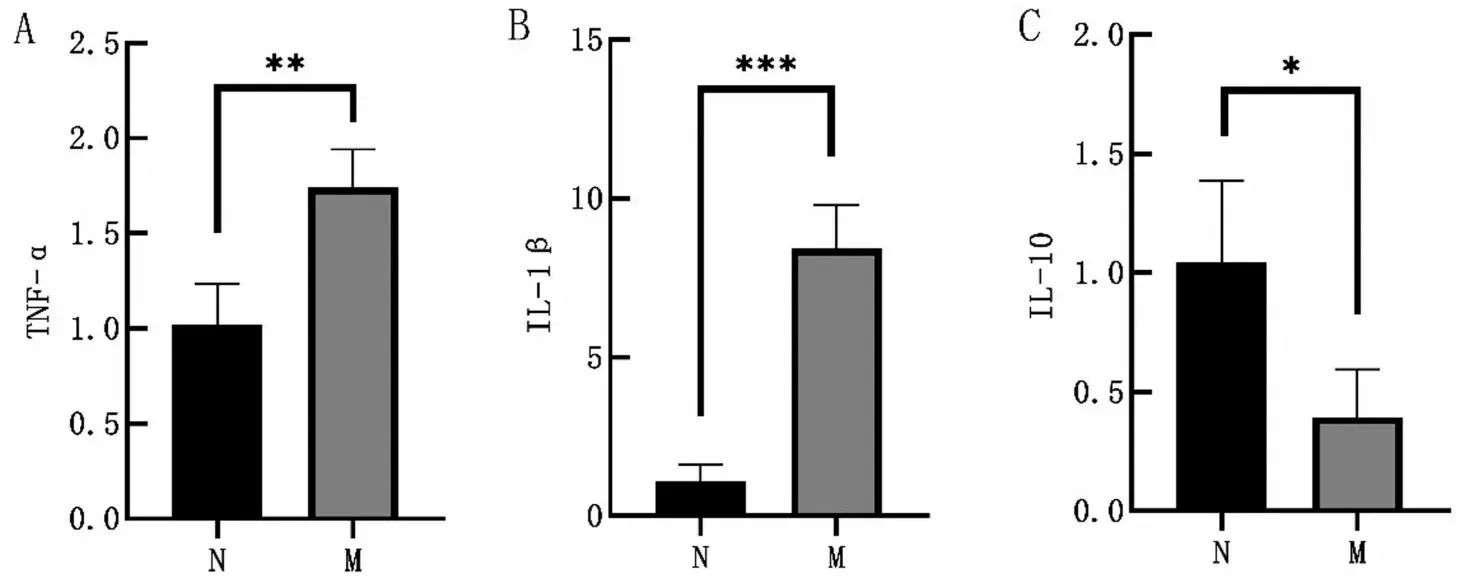
图5 小鼠结肠组织中TNF-α、IL-1β和IL-10 mRNA表达对比
2.6 各组小鼠外周血中二胺氧化酶(DAO)和D-乳酸(D-LA)含量对比 M组小鼠的外周血中DAO含量较N组升高(P<0.05),M组小鼠外周血中D-LA含量与N组比较,差异无统计学意义(P>0.05),见图6。

图6 小鼠外周血中DAO和D-LA含量对比
2.7 各组小鼠肠道菌群分析 由图7A可知,各样本的曲线趋向平缓,说明测序深度足以反应菌群结构真实状况,可进行后续的数据分析。图7B可以看出,M组小鼠的Shannon指数、Chao1指数和Observed OTU指数均小于N组(P<0.05)。说明M组小鼠菌群Alpha多样性低于N组。门和属水平肠道菌群丰度柱状分别见图7C和7D,可以看出两组小鼠菌群组成存在较大的差异,门水平上,M组小鼠中拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)的相对丰度较N组降低,而疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)的相对丰度明显高于N组。图7D的DESeq2火山图分析可以发现M组和N组小鼠中差异的菌属,其中M组中S24_7、普雷沃氏菌属(Prevotella)、拟杆菌属(Bacteroides)和异杆菌属(Allobaculum)等肠道菌属的相对比例较N组下降(P<0.05),副拟杆菌属(Parabacteroides)、克雷伯氏肺炎菌属(Klebsiella)、肠杆菌属(Enterobacter)、阿克曼氏菌属(Akkermansia)、变形杆菌属(Proteus)和埃希式菌属(Escherichia)等肠道菌属的相对比例高于N组(P<0.05)。为了研究抗生素暴露后肠道微生物组的功能,本研究使用PICRUSt软件预测抗生素暴露后的功能改变,图7E的KEGG L2水平功能预测柱状图表明,两组小鼠代谢功能组成不同,PCA分析图同样说明两组菌群的代谢功能预测存在明显差异。Dunn test检验后发现,在KEGG通路中的代谢(Metabolism),生物系统(Organismal Systems)和人类疾病(Human Diseases)在两组间比较差异有统计学意义(P<0.05)。

图7 各组小鼠肠道菌群16SrRNA测序分析结果对比
3 讨论
本研究发现,M组小鼠的精神状态较N组差,粪便含水量较N组增多,提示M组小鼠肠道出现损伤。研究证明,变大的盲肠是肠道菌群紊乱小鼠和无菌小鼠的典型表现[8],本研究亦观察到M组小鼠的盲肠增大,与既往研究结果相一致。此后进行的肠道菌群测序分析结果说明抗生素暴露可致小鼠的肠道生物屏障破坏,即菌群稳态失调,其主要表现为菌群多样性降低,与活动性结肠炎的鉴别性微生物谱系的升高(变形杆菌、肠杆菌、肺炎克雷伯菌、肠杆菌和阿克曼氏菌等菌属)和与结肠炎缓解有关支系的减少(S24-7和拟杆菌等菌属)[9]。有研究报道,变形杆菌属(Proteus)和克雷伯氏肺炎菌属(Klebsiella)的存在与小鼠的溃疡性结肠炎(UC)发展有关,UC小鼠与野生鼠共饲养时,野生鼠也会发展为结肠炎[10]。也有研究报道,结肠炎治疗后小鼠中S24-7丰度则会恢复至更高的水平,且S24-7的丰度与盲肠的丁酸盐的水平呈正相关关系[11]。说明肠道内菌群的结构组成变化和结肠炎症损伤密切相关,此后的功能预测显示两组小鼠KEGG代谢通路中代谢、生物系统和人类疾病存在显著性差异,也间接说明小鼠菌群的紊乱使得某些代谢通路发生改变,可能与生物代谢过程和人类疾病相关。
小鼠结肠表面有一层厚的黏液层,覆盖在结肠上皮层表面,防止微生物的入侵。MUC2是肠道黏液屏障的最主要蛋白。研究证实,MUC2基因敲除小鼠可出现腹泻、结直肠脱垂、肠道炎症、自发性结肠炎和结肠癌风险增加等表现[12]。当小鼠肠道菌群发生紊乱,某些嗜黏蛋白菌过度增殖,可能会造成黏膜屏障变薄,从而结肠上皮屏障受损[13]。本研究菌群分析显示,M组中导致黏液蛋白降解菌阿克曼氏菌(Akkermansia)较N组增多;且前者M组小鼠结肠组织MUC2表达明显下降,表明抗生素导致小鼠结肠黏液屏障的破坏。
结肠上皮屏障的完整性对于防止菌群侵袭入血具有重要的作用[14]。有研究发现,炎症性肠病小鼠结肠上皮屏障受损,其小鼠的结肠长度有明显缩短[15]。本研究结果提示M组小鼠的结肠长度较N组缩短,从形态学上说明M组小鼠造成了结肠上皮屏障的损伤。后续分析的结肠病理组织学同样证实M组小鼠上皮屏障明显受损,说明抗生素暴露可破坏结肠上皮屏障完整性。
当肠道黏膜屏障功能遭到破坏时常表现为肠道通透性升高。本研究选择肠道通透性相关的指标DAO和D-LA进行分析[16-17],结果提示M组小鼠DAO水平较N组升高,而D-LA变化虽无统计学差异但呈升高的趋势,这表明抗生素给药可致小鼠结肠通透性升高。
此外,结肠黏膜内的免疫细胞可通过分泌促炎因子和抑炎因子平衡肠道免疫稳态以维持正常的肠道免疫屏障功能。研究发现,炎性相关因子TNFα和IL-1β在炎症性肠病患者或临床前期患者中表达水平较高,说明TNF-α和IL-1β可能是导致肠道炎症的重要因子[18-19]。在缺乏IL-10受体小鼠中发现严重的肠道炎症,表明IL-10对于抑制炎症反应可能起到重要的作用[20]。本研究分析炎症细胞因子在结肠组织中的表达水平,发现M组小鼠的促炎因子IL-1β和TNF-α的表达水平较N组升高,抑炎因子IL-10较N组降低,表明抗生素可导致小鼠结肠黏膜的促炎和抗炎反应紊乱。
综上,抗生素破坏小鼠肠道菌群的平衡,可能是黏液屏障破坏的始发因素,黏液屏障的破坏使得结肠上皮屏障失去物理阻隔,导致结肠上皮受损,从而破坏黏膜屏障功能,导致小鼠结肠处于促炎反应阶段,最终导致抗生素相关性肠黏膜损伤。本研究初步说明抗生素对肠黏膜屏障的不利影响,为认识抗生素相关性肠黏膜损伤提供一定的理论依据。

