OsLOX10正调控水稻对稻瘟病和白叶枯病的抗性
周永林 申小磊 周立帅 林巧霞 王朝露 陈静 冯慧捷 张振文 陈晓婷, 3, * 鲁国东
正调控水稻对稻瘟病和白叶枯病的抗性
周永林1, 2申小磊1, 2周立帅1, 2林巧霞1, 2王朝露1, 2陈静1, 2冯慧捷1张振文1陈晓婷1, 2, 3, *鲁国东2
(1福建农林大学 生命科学学院,福州 350002;2福建农林大学 生物农药与化学生物学教育部重点实验室,福州 350002;3福建省作物有害生物监测与治理重点实验室,福州 350013;*通信联系人,E-mail:xiaotingchen@fafu.edu.cn)
【目的】由稻瘟病菌()引起的稻瘟病和由水稻黄单胞菌(pv,)引起的白叶枯病严重影响水稻的产量和品质。创制转基因水稻材料,进行稻瘟菌和白叶枯菌的抗病性分析,有助于揭示其调控水稻对稻瘟病和白叶枯病的抗性机制。【方法】采用CRISPR/Cas9系统构建的敲除载体,利用限制性内切酶Ⅰ线性化pCXUN-HA,TA连接构建的过表达载体,遗传转化获得转基因水稻,筛选过表达株系和纯合敲除株系进行真菌和细菌的抗病性分析。在稻瘟菌(Guy11)侵染水稻后,对水杨酸(salicylic acid,SA)、茉莉酸(jasmonic acid,JA)途径的标志基因进行qRT-PCR分析;在几丁质(chitin)和flg22诱导下,观测水稻活性氧(reactive oxygen species,ROS)的暴发情况。【结果】 qRT-PCR分析表明,接种稻瘟菌和白叶枯菌24 h后,表达量上调;的纯合敲除和过表达水稻转基因株系接种稻瘟病菌Guy11孢子悬浮液,与野生型(日本晴)相比,敲除株系更易感病,过表达株系则无典型的病斑症状;接种 6、12、24和36 h时,3个病程相关蛋白基因、、和SA通路基因,以及JA合成通路上的2个基因、的转录水平在敲除转基因株系中显著下调,而在过表达转基因株系中显著上调。对转基因水稻接种白叶枯菌(),发现敲除的转基因水稻对白叶枯菌更易感病。qRT-PCR分析和以及JA合成通路上的3个基因、和在过表达基因水稻中表达量明显上调,而在敲除的转基因水稻中却保持在较低水平,在接种7 d后表现出显著性差异。在几丁质和flg22诱导下,敲除株系的ROS水平显著性降低,而且在几丁质诱导下,ROS的起峰时间推迟。【结论】稻瘟病菌和白叶枯病菌能够诱导的表达,通过病原菌分子模式触发的免疫途径(PTI)参与抗病反应,其在水稻抵御稻瘟病和白叶枯病中起着正调控作用。同时,可能通过调节SA和JA介导的信号通路来正调控水稻对稻瘟病和白叶枯病的抗性。
;CRISPR/Cas9基因编辑技术;抗病性;稻瘟病;白叶枯病;信号途径
由稻瘟病菌()引起的稻瘟病和由白叶枯菌(pv,)引起的白叶枯病,是水稻生产上遭遇的两种严重而普遍的病害,影响水稻的产量和品质[1]。当前,化学防治仍是稻瘟病防治的主要手段,但防治效果依赖于对田间稻瘟病的准确预报和及时发现,而且长期大量的施用农药会使病原菌产生耐药性,降低防治效果,还会对水源、土壤、空气造成污染。白叶枯病是水稻生产中最严重的细菌性病害,水稻整个生育期都会感病,孕穗期最为严重。该病是一种维管束病害,化学防治效果差,导致水稻叶片干枯,从而使籽粒灌浆不饱满、秕谷率增加[2]。植物在与病原菌的长期互作过程中,形成两个层次的防卫机制,第一层次的基础防卫反应是基于病原关联分子模式(pathogen-associated molecular patterns,PAMPs)或损伤相关分子模式,(damage-associated molecular patterns,DAMPs)被植物模式受体蛋白(pattern recognition receptors,PRRs)所识别产生的,称为PAMP触发性免疫(Pattern-triggered immunity,PTI);面对病原菌的入侵,植物进化出细胞内受体蛋白(nucleotide-bind site and leucine-rich repeat domain receptors,NLRs),通过识别效应子激活更强烈的效应蛋白触发性免疫(effector-triggered immunity,ETI)。近期研究表明,PTI和ETI并不是两条平行的免疫通路。PRRs和NLRs会协同激活植物免疫;ETI会通过诱导PTI信号成分的转录来促进PTI,而PTI会通过丝裂原活化蛋白激酶(mitogen-activated protein kinases)和烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶信号来保证ETI的完整抗性功能的正常发挥[3-5]。植物免疫系统的激活不仅包括病原体识别、信号转导、下游防御相关基因激活以及不同信号通路之间的联络,还涉及一些激素信号传导途径,例如水杨酸(salicylic acid, SA)、茉莉酸(jasmonic acid, JA)和乙烯(ethylene, ET)等信号通路。脂氧合酶(lipoxygenase,LOX)是植物十八碳酸代谢途径中的一个关键酶,其功能是催化多不饱和脂肪酸(酯)的加氧反应,产生的氢过氧化物和自由基等物质,能参与信号转导,在植物生长发育和抵抗逆境胁迫过程中发挥着重要的作用。
水稻基因组中鉴定出14个LOX家族成员。每个LOX在水稻生长发育的不同阶段及应对外界的各种逆境胁迫中发挥各自不同的功能[6-7],Mizuno等[8]从成熟的水稻种子中克隆了,发现其与同源性高;Shirasawa等[9]克隆了水稻(),并发现其与水稻种子贮存过程中质量的下降有关。随后,陆续有科学家利用RNA干扰或TALEN技术抑制水稻种子LOX1和LOX3的活性,延长贮藏期[10-13]。而LOX2在种子萌发和贮藏过程中起相反的作用,适当降低的表达量,既可以使种子的萌发不受影响又能使种子储藏的时间得到延长,为培育种子耐储藏的新品种提供了参考[14];Ohta等[15]发现水稻受稻瘟菌侵染后,第5叶的LOX和脂质过氧化分解酶活性(LHDA)显著升高,这种诱导效应在非亲和菌株中表现更为明显,LOX3受非亲和菌株诱导最为显著。但(LOC_Os11g36719)在水稻抗病中的作用及机制尚未报道。本研究通过构建转基因水稻,研究在水稻-稻瘟病菌和水稻-白叶枯病菌互作过程中的功能,为水稻抗病育种提供理论依据。
1 材料与方法
1.1 试验材料
试验所用植物材料为日本晴及相应的(LOC_Os11g36719)转基因材料。
供试菌株为稻瘟菌菌株Guy11、白叶枯菌株大肠杆菌DH5α为福建农林大学功能基因组研究中心保存,根瘤农杆菌购自天根生化科技(北京)有限公司,过表达载体pCXUN-HA由福建省农业科学院惠赠,敲除载体pYLCRISPR/ Cas9-MTmono和pYL-U3/U6a-gRNA由华南农业大学惠赠。研究所用引物见表1。
1.2 敲除载体的构建及转基因植株靶点测序分析
参照文献[16]构建的CRISPR/Cas9载体,送武汉伯远生物科技有限公司进行遗传转化,标记转基因苗,用DNA提取试剂盒提取各株转基因苗DNA。以靶点切点为中心,在两侧100~150 bp处合成引物(PCR产物200~300 bp)。以各转基因株系DNA为模板进行扩增,用琼脂糖凝胶电泳检测,选取条带大小符合的产物进行测序。然后在DSDecodeM网站(http://skl.scau.edu.cn/dsdecode/)进行比对,获得基因编辑结果,选取编辑类型不同的纯合突变株系进行繁种,验证表型。
1.3 过表达载体的构建及转基因植株表达量分析
利用限制性内切酶Ⅰ对pCXUN-HA载体进行酶切,TA连接构建载体[17]。利用菌液PCR进行扩增检测(上游引物UbiP-seq和下游引物-R),扩增片段大小2 716 bp。利用测序引物UbiP和NosR进行测序确认,送武汉伯远生物科技有限公司遗传转化获得转基因苗,用qRT-PCR方法分析各转基因株系的表达量,选用表达量适宜的株系进行后续试验。
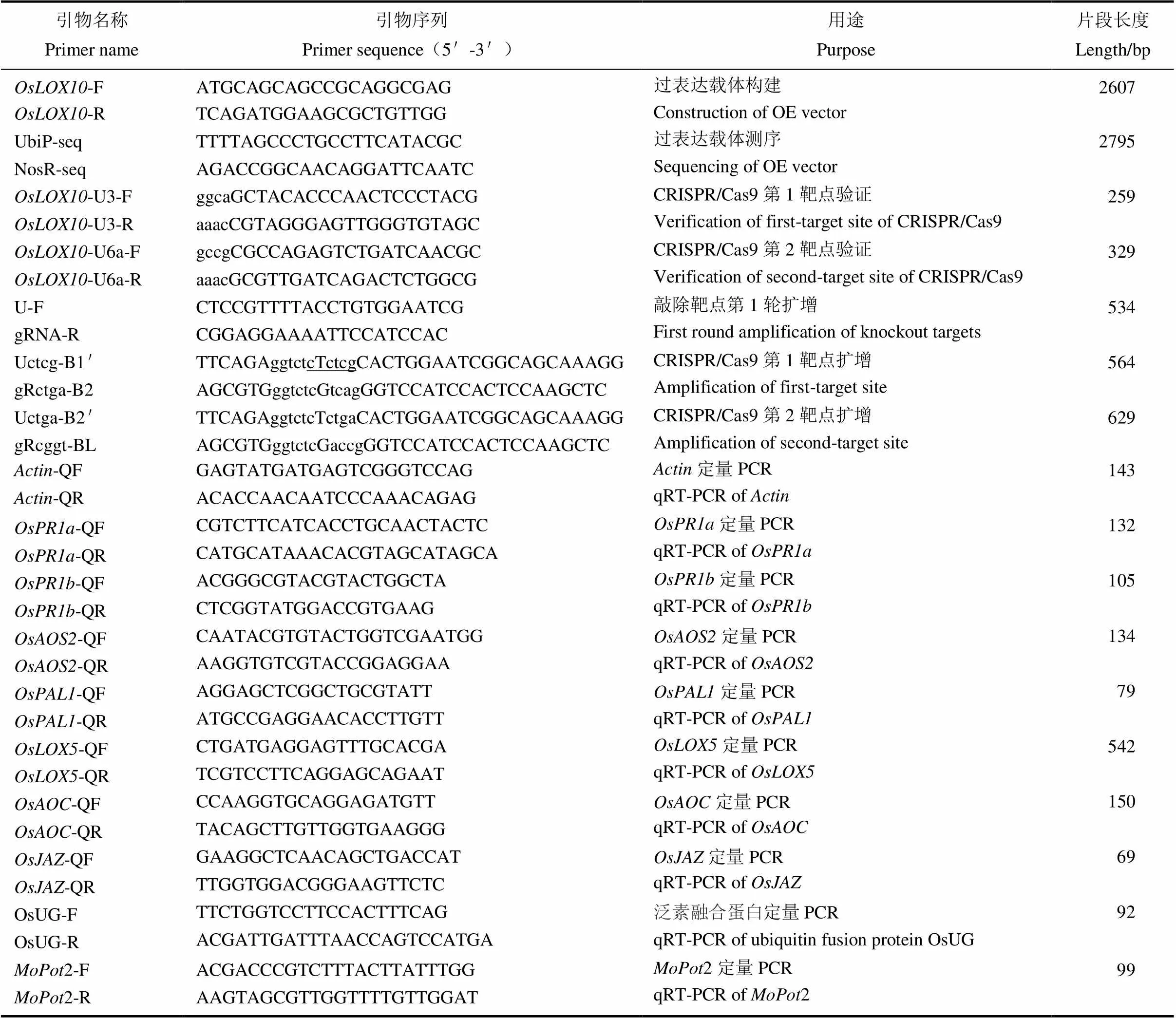
表1 本研究所使用引物
1.4 水稻喷雾接种稻瘟菌
以日本晴为对照,对的敲除和过表达转基因植株进行接菌试验。将稻瘟菌Guy11转接至完全培养基(酵母提取物6 g/L,酸水解酪蛋白6 g/L,蔗糖10 g/L,琼脂20 g/L)上进行活化,置于28℃培养箱中培养3~4 d。然后转至米糠培养基,继续培养3 d,刮掉菌丝,在光照下进行产孢培养,至孢子铺满培养皿后,用适量无菌水(含0.02%吐温)悬浮孢子,显微镜下观察,并统计孢子数。调至孢子浓度为1×105cfu/mL,用小喷壶对生长至3叶1心的水稻进行喷雾接种,然后移至暗箱中保湿培养24 h,次日转至接种室(25℃±1℃,相对湿度90%),1周后调查发病情况[18]。
1.5 水稻创伤接种稻瘟病菌
用鼠耳打孔器将6周龄稻叶轻微创伤,然后在创伤处接种7 μL孢子悬浮液(5×105cfu/mL)。用透明胶带密封接种区域,并将接种的植物放回人工智能培养室培养7 d,然后调查发病情况,使用ImageJ软件测量病斑面积。同时,对侵染稻叶组织中的真菌生物量进行定量分析:从叶子上切下一部分(3.0 cm×1.0 cm)含病斑的叶片,提取DNA,进行定量PCR分析,用e(Ct-Ct)计算相对真菌生长量(:循环数,和代表水稻泛素融合蛋白基因和稻瘟菌转座子基因),结合病斑面积分析突变体的发病情况[18]。
1.6 水稻接种白叶枯菌
将−80℃保存的白叶枯菌在培养基(酵母提取物5 g/L,蛋白胨10 g/L,蔗糖10 g/L,琼脂15 g/L,调pH至6.8)上划线,置于28℃培养箱中活化。培养3 d,待细菌长成亮黄色,进行转接,转接2次,用10 mmol/L无菌MgCl2溶液悬浮白叶枯菌,稀释至600值为0.6。
对5周龄的水稻苗接种,接种时用剪刀蘸取菌液,剪掉距离叶尖2 cm左右的叶片。每个单株至少接种5片叶子,剪刀每次蘸入菌液时需短暂停留片刻,每剪2片叶片需重新蘸取菌液。14 d后调查病斑长度(从接种部位到枯萎叶中间静脉边缘的长度),每个单株至少调查5片水稻叶片[18]。
1.7 水稻抗病相关基因转录丰度分析
利用稻瘟菌孢子悬浮液(浓度为1×105cfu/mL)对转基因水稻及其野生型进行喷雾接种,并在不同时间点(0、6、12、24和36 h)取样,提取RNA,并反转录成cDNA,利用qRT-PCR分析相关基因(如、、和等)在转基因水稻中的表达情况;白叶枯菌接种后于0、1、3、5、7和9 d 取样分析。均以为内参。
1.8 水稻叶片中活性氧的测定
用打孔器将6周龄水稻叶片打下若干小圆片,在无菌水中浸泡过夜。配制10 mLLuminol混合液(10 μL 20 mmol/L L-012、1 μL 10 mg/mL辣根过氧化酶和9989 μL ddH2O),于96孔板中每孔加入反应液100 μL,将浸泡过夜的叶片放于其中,浸泡30 min。快速加入几丁质(或flg22)至反应液中,使其终浓度为400 nmol/L(或500 nmol/L),立即放入酶标仪中测定激发光。每分钟测量一次数据,持续检测50 min,每个样品至少重复测定9次。
2 结果与分析
2.1 OsLOX10响应稻瘟菌和白叶枯菌的侵染
用浓度为1×105cfu/mL的稻瘟菌孢子悬浮液对3周龄的水稻幼苗(野生型日本晴)进行喷雾接菌,以0.02%的吐温水作对照。在喷雾接种后的不同时间点(0、12、24、48和72 h)取水稻叶片,qRT-PCR分析在稻瘟病菌侵染下表达量的动态变化(图1-A),与对照组相比,在接种稻瘟病菌的24 h后,开始上调表达,48 h发生回落,而在72 h又上调,最高上调了4.5倍。表明它可能在水稻与稻瘟菌的互作中发挥一定的作用。

图中数据为平均值±标准误,*、**分别代表处理间在P<0.05和P<0.01水平差异达显著水平(t-检验)。
Fig. 1. Expression profiles ofafter inoculation with(A) and(B) in rice.
对5周龄野生型水稻接种白叶枯菌,接种后0、1、2、4和8 d取病灶处叶片,qRT-PCR分析表达量的动态变化(图1-B)。与对照组相比,接种1 d后,表达量显著上调,接种2 d后,表达量达到最高(18.3倍),但在接种4和8 d,其表达量均维持在较低水平,说明可能在白叶枯菌浸染的早期发挥作用。
2.2 OsLOX10敲除载体的构建及转基因水稻的筛选验证
在的编码序列中选择2个靶点,在targetDesign(http://skl.scau.edu.cn/targetdesign/)中设计靶点接头引物,将靶点接头分别与酶切过的U3-gRNA和U6a-gRNA表达盒连接,在表达盒中进行第1轮和第2轮PCR扩增,琼脂糖凝胶电泳验证正确后,将纯化回收的第2轮产物与CRISPR/Cas9载体连接,将构建好的载体进行大肠杆菌转化,菌液PCR验证正确后,转入农杆菌,进行水稻遗传转化,获得转基因水稻。
在靶点附近设计引物,以转基因植株的基因组DNA为模板,扩增目的片段,测序结果采用在线分析工具DSDecode进行比对。U3靶点纯合突变体中4个为缺失突变,3个为插入突变,U6a靶点纯合突变体中2个为插入,1个为缺失突变。因为基因编辑的不确定性,使得U3与U6a两个靶点并不一定能同时表现出纯合突变,试验中仅选择CDS序列中较前的U3靶点,考虑到碱基的替换只是个别氨基酸的改变,并不一定会影响基因功能,仅选择插入和缺失突变体进行后续的表型验证。最终选择了18#与24#的纯合突变体进行后续的表型分析,其中18#插入1个T碱基,而24#缺失C和T碱基,都使编码的蛋白提前终止(图2)。
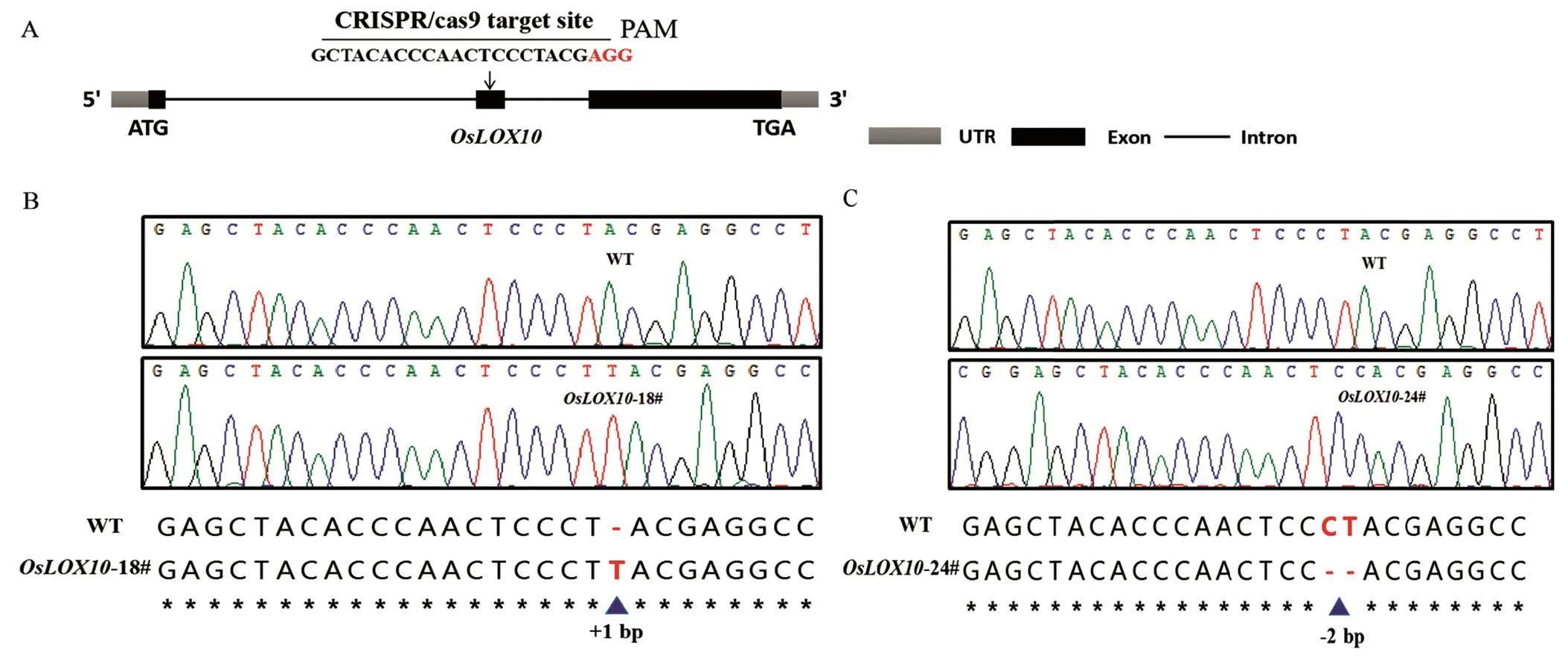
A-OsLOX10结构和编辑位点;B-OsLOX10 T0代18号植株的突变位点检测;C-OsLOX10 T0代24号植株的突变位点检测。
Fig. 2. Identification of homozygous mutant ofby gene editing.

图3 qRT-PCR分析OsLOX10在其过表达植株中的表达量
Fig. 3. Expression analysis ofby qRT-PCR in overexpressed lines.

图4 OsLOX10转基因水稻对稻瘟病的抗性分析
Fig. 4. Response oftransgenic rice to
2.3 OsLOX10过表达载体的构建及转基因水稻的筛选验证
从日本晴的cDNA中扩增出,长度为2 607 bp,将目的基因与pCXUN-HA载体连接,转入大肠杆菌,菌液PCR验证正确后,提取质粒,测序正确的质粒转入农杆菌,送到武汉伯远公司进行遗传转化。提取每株转基因水稻的RNA,反转录成cDNA,qRT-PCR分析的表达量(图3)。得到15个表达量上调的株系,表达量上调800~3000倍。基因表达量上调幅度很大,这与水稻生长过程中该基因的正常表达量很低有关。有研究表明,主要在水稻乳熟期表达[8]。同时由于表达量高的株系可能会存在不孕的情况,后续试验中仅选用种子多且表达量较高的水稻株系(-17# 和LOX10-18#)进行功能分析。
2.4 OsLOX10转基因株系对于稻瘟病菌和白叶枯菌的抗性分析
对敲除(-KO)和过表达(-OE)的转基因水稻以及野生型水稻NPB喷雾接种稻瘟病菌(Guy11),7 d后进行调查,日本晴中2级病斑居多,并且数量有限,而-KO中病斑数量明显增加,其中3级病斑数量居多,而且还有一定量的4级病斑存在,部分病斑连接成片。相比之下,-OE水稻中病斑几乎全为1级病斑,虽然数量很多,但无典型的病斑症状。进一步对-KO和日本晴打孔接种稻瘟病菌,7 d后调查病情,同时统计病斑面积和相对生物量(图4),发现敲除水稻中病斑面积和病叶中的相对生物量都明显高于野生型,进一步证实了上述喷雾接种的结果,说明可以正调控水稻对稻瘟菌的抗性。

图5 OsLOX10转基因稻接种白叶枯菌的症状
Fig. 5. Symptom oftransgenic lines inoculated withby leaf clipping method.
对敲除水稻和日本晴接种白叶枯菌,14 d后调查病情(图5),发现基因敲除水稻的病斑长度是野生型的2.5倍,说明的敲除显著降低了水稻对白叶枯菌的抗性。
2.5 OsLOX10敲除和过表达转基因水稻中抗病相关基因表达量的变化
对的敲除和过表达水稻在接种Guy11后一些抗病相关基因的表达量进行检测(图6),发现3个病程相关蛋白基因、、和水杨酸(SA)通路基因以及茉莉酸(JA)合成通路上的2个基因和在转基因水稻中表达量均有变化。6个基因在-OE转基因水稻中表达量明显上调,而在-KO中却保持在较低水平,并且在24 h开始出现显著性变化。与野生型对照相比,SA通路标志基因在过表达转基因水稻中表达量最大提高了2.1倍左右,而JA合成通路中的两个标志基因和表达量最大提高了12.8倍和8.3倍。推测基因可能同时参与JA和SA介导的抗病反应。
对的转基因水稻接种,于0、1、3、5、7、9 d 取样进行相关基因的表达量进行检测(图7),发现病程相关蛋白基因和SA通路基因以及JA合成通路上的3个基因和在转基因水稻中表达量均有变化。5个基因在-OE转基因水稻中表达量明显上调,而在-KO中却保持在较低水平,在7 d表现出显著性差异。与野生型对照相比,SA通路标志基因在-OE中表达量是日本晴的3.0倍,而JA合成通路中的和表达量提高了4.6倍和3.0倍。
2.6 OsLOX10敲除水稻对几丁质和flg22的响应
如图8所示,在几丁质和flg22诱导后,野生型与基因敲除水稻均有活性氧的暴发,但是基因敲除水稻(-KO)中的活性氧的积累显著低于野生型。几丁质诱导后,野生型水稻在16 min达到峰值,-KO在18 min达到峰值,起峰时间相对滞后。而flg22诱导后野生型和-KO均在15 min达到峰值。KO在几丁质诱导后ROS积累的峰值仅为野生型的68%,flg22诱导后ROS积累的峰值为野生型的60%。可见,的敲除使水稻对几丁质和flg22的敏感性降低。

图6 OsLOX10转基因水稻相关抗病基因在稻瘟病菌侵染早期的qRT-PCR分析
Fig. 6. qRT-PCR analysis of disease resistance-related genes intransgenic lines during the early infection of rice blast fungus.

图7 OsLOX10转基因水稻相关抗病基因在白叶枯病菌侵染早期的qRT-PCR分析
Fig. 7. qRT-PCR analysis of disease resistance-related genes intransgenic lines during the early infection of bacterial blight.
3 讨论
迄今科学家已经发现数个能同时改变水稻对稻瘟病和白叶枯病抗性的基因,如[19]、[20-21]、[22]、[23]、[24]、[25]、[26]、OsACBP5[27]和OsMESL[28]等。
LOX作为JA合成途径中的关键酶,决定着JA 在植物体内的水平,从而间接调控植物对各种胁迫的响应。丙二烯氧合酶(AOS)是JA生物合成途径中另一个关键酶。OsAOS2 在叶片的表达受稻瘟病菌的显著诱导。用(受病原菌的强诱导)的启动子驱动,转基因株系中积累了较高水平的JA,特别是在受到病原菌侵染之后。过表达激活了其他病程相关基因(如、和)的表达,增加了抗性[29]。

A-几丁质诱导的转基因水稻OsLOX10-KO和日本晴中活性氧的暴发情况,水稻叶片用400 nmol/L的几丁质和水处理;B-flg22诱导的转基因水稻OsLOX10-KO和日本晴中活性氧的暴发情况,水稻叶片用500 nmol/L的flg22和水处理。
Fig. 8. Response of-KO transgenic rice and wild-type Nipponbare to flg22 and chitin.
科学家对的研究重点是水稻种子贮存等[13-14],在抗病性方面的研究很少。本研究以为研究对象,该基因与同源性最高[7],5的表达受到赤霉病菌侵染的诱导[30]。此外,玉米是重要的抗虫害相关基因。突变体被害虫咬食后,通过调控绿叶挥发素和茉莉酸酯的产生来抵御害虫侵害[31];在拟南芥中异源表达薄皮甜瓜,与转录因子MYC2结合,促进茉莉酸积累,诱导气孔关闭来增强拟南芥的耐旱性[32]。
本研究发现在稻瘟病菌侵染后的24 h和72 h,的表达量被显著诱导,说明可能在水稻与稻瘟病菌的互作中起作用。在此基础上获得了该基因的敲除和过表达水稻,筛选得到纯合的突变植株。对转基因水稻喷雾接种稻瘟病菌Guy11,相对于野生型,敲除突变体更感病,而过表达突变体中感病程度很轻。同时打孔接种稻瘟病菌后,发现敲除突变体的病斑面积及真菌相对生物量明显高于野生型。为进一步阐明抵抗稻瘟病菌侵染的作用机制,利用qRT-PCR分析了接种稻瘟菌后一些抗病相关基因在敲除和过表达转基因水稻中的表达水平。结果显示,相比野生型,3个基因、和,SA通路基因以及茉莉酸合成相关基因和的表达量在过表达株系中显著上调,相反,敲除株系中的表达水平发生显著下降。说明在水稻抵抗稻瘟病菌中起着正调控的作用,该作用可能同时涉及了水杨酸与茉莉酸通路。
本研究利用qRT-PCR分析白叶枯菌侵染水稻后的实时表达水平,发现可能参与水稻与白叶枯菌的早期互作中。对敲除水稻接种白叶枯菌,发现敲除突变体的感病程度明显高于野生型,说明在水稻与白叶枯菌的互作中确实发挥一定的作用。
寄主植物的活性氧的暴发是病原菌成功侵染的标志之一。而植物中活性氧含量的升高会导致叶片中程序性细胞死亡的局部产生,从而防止进一步感染[33]。本研究用几丁质和flg22分别处理的敲除转基因水稻及其野生型,发现的敲除使水稻被诱导的活性氧显著性降低,同时还会使起峰时间推迟,说明参与了病原菌分子模式触发的免疫途径,正向调控水稻对稻瘟菌和白叶枯的抗性并伴随着抗病相关基因表达量的上调,是SA与JA通路协同作用的结果。同时还在水稻抵抗白叶枯菌中发挥着重要作用,然而它们是如何参与到水稻与白叶枯菌的互作中还有待进一步研究。
[1] Khush G S. What it will take to feed 5.0 billion rice consumers in 2030[J]., 2005, 59(1): 1-6.
[2] Ke Y, Deng H, Wang S. Advances in understanding broad-spectrum resistance to pathogens in rice[J]., 2017, 90: 738-748.
[3] Liu W, Wang G L. Plant innate immunity in rice: A defense against pathogen infection[J]., 2016, 3: 295-308
[4] Ngou B P M, Ahn H K, Ding P, Jones J D G. Mutual potentiation of plant immunity by cell-surface and intracellular receptors[J]., 2021: 1-6.
[5] Yuan M, Jiang Z, Bi G, Nomura K, Liu M, Wang Y, Cai B, Zhou J M, He S Y, Xin X F. Pattern-recognition receptors are required for NLR-mediated plant immunity[J]., 2021: 1-5.
[6] Umate P. Genome-wide analysis of lipoxygenase gene family inand rice[J]., 2011, 6(3): 335-338.
[7] Marla S S, Singh V K.genes in blast fungus () resistance in rice[J]., 2012, 12(2): 265-275.
[8] Mizuno K, Iida T, Takano A, Yokoyama M, FujimuraT. A new 9-lipoxygenase cDNA from developing rice seeds[J]., 2003, 44: 1168-1175.
[9] Shirasawa K, Takeuchi Y, Ebitani T, Suzuki Y. Identification of gene for rice () seed lipoxygenase-3 involved in the generation of stale flavor and development of SNP markers for lipoxygenase-3 deficiency[J]., 2008, 58: 169-176.
[10] Gayen D, Ali N, Ganguly M, Paul S,Datta S K. RNAi mediated silencing of lipoxygenasegene to maintain rice grain quality and viability during storage[J]., 2014, 118(2): 229-243.
[11] Gayen D, Ali N, Sarkar S N, Datta S K, Datta K. Down-regulation of lipoxygenase genereduces degradation of carotenoids of golden rice during storage[J]., 2014, 242(1): 353-363.
[12] Ma L, Zhu F, Li Z, Zhang J, Li X, Dong J, Wang T. TALEN-based mutagenesis of lipoxygenase LOX3 enhances the storage tolerance of rice () seeds[J]., 2015, 10(12): e0143877.
[13] Xu H, Wei Y, Zhu Y, Lian L, Xie H, Cai Q, Chen Q, Lin Z, Xie H, Zhang J. Antisense suppression ofgene expression in rice endosperm enhances seed longevity[J]., 2015, 13: 526-539.
[14] Huang J, Cai M, LongQ, Liu L, Lin Q, Jiang L, Chen S, Wan J., a rice type I lipoxygenase, confers opposite effects on seed germination and longevity[J]., 2014, 23(4): 643-655
[15] Ohta H, Shida K, Peng Y L, Furusawa I, Aibara S, Morita Y. A lipoxygenase pathway is activated in rice after infection with the rice blast fungus[J]., 1991, 97: 94-98.
[16] Ma X, Zhang Q, Zhu Q, Liu W, Chen Y, Qiu R, Wang B, Yang Z, Li H, Lin Y, Xie Y, Shen R, Chen S, Wang Z, Chen Y, Guo J, Chen L, Zhao X, Dong Z, Liu Y G. A robust CRISPR/Cas9 system for convenient, high- efficiency multiplex genome editing in monocot and dicot plants[J]., 2015, 8(8): 1274-1284.
[17] Chen S, Songkumarn P, Liu J, Wang G L. A versatile zero background T-vector system for gene cloning and functional genomics[J]., 2009, 150(3): 1111-1121.
[18] Hong Y, Liu Q, Cao Y, Zhang Y, Cheng S, Cao L. Thenegatively regulatesanddisease resistance via SA and JA signaling pathway in rice[J]., 2019, 10: 752
[19] Wang G, Ding X, Yuan M, Qiu D, Li X, Xu C, Wang S. Dual function of ricegene in disease resistance and thiamine accumulation[J]., 2006, 60: 437-449.
[20] Qiu D, Xiao J , Ding X, Xiong M, Cai M, Li X, Xu c, Wang S.mediates rice disease resistance by regulating defense-related genes in salicylate- and jasmonate-dependent signaling[J].2007, 20(5): 492-499.
[21] Qiu D, Xiao J, Xie W, Liu H, Li X, Wang S. rice gene network inferred from expression profiling of plants overexpressing, a positive regulator of disease resistance[J]., 2008, 1(3): 538-551.
[22] Tao Z, Liu H, Qiu D, Zhou Y, Xu C, Wang S. A pair of allelicgenes play opposite roles in rice-bacteria interactions[J]., 2009, 151: 936-948.
[23] Harkenrider M, Sharma R, de Vleesschauwer D, Tsao L, Zhang X, Chern M, Canlas P, Zuo S, Ronald P C. Overexpression of rice wall-associated kinase25 (OsWAK25) alters resistance to bacterial and fungal pathogens[J].2016, 11: e0147310.
[24] Tonnessen B W, Manosalva P, Lang J M, Baraoidan M, Bordeos A, Mauleon R, Oard J, Leung H, Leach J E. Rice phenylalanine ammonialyase gene OsPAL4 is associated with broad spectrum disease resistance[J]., 2015, 87: 273-286.
[25] Dubouzet J G, Maeda S, Sugano S, Ohtake M, Hayashi N, Ichikawa T, Kondou Y, Horii Y, Matsui M, Hirochika H, Takatsuji H, Mori M. Screening for resistance against Pseudomonas syringae in rice-foxarabidopsis lines identified a putative receptor-like cytoplasmic kinase gene that confers resistance to major bacterial and fungal pathogens inand rice[J]., 2010, 9: 466-485.
[26] Zhao X, Zhang T, Feng H, Qiu T, Zhao W. OsNBL1, a multi-organelle localized protein, plays essential roles in rice senescence, disease resistance, and salt tolerance[J]., 2021, 14(1): 10.
[27] Narayanan S P, Lung S C, Liao P, Lo C, Chye M L. The Overexpression ofprotects transgenic rice against necrotrophic, hemibiotrophic and biotrophic pathogens[J]., 2020, 10(1): 14918.
[28] Han B, Zhou Y, Zhou Z H, Sun B, Zhou F, Yin C X, Ma W H, Chen H, Lin Y J. Repressedexpression-triggers reactive oxygen species mediated broad-spectrum disease resistance in rice[J]., 2021, 19(8): 1511-1522
[29] Mei C, Qi M, Sheng G, Yang Y Y. inducible overexpression of a rice allele oxide synthase gene increases the endogenous jasmonic acid level,gene expression, and host resistance to fungal infection[J]., 2006, 19(10): 1127-1137.
[30] Nalam V J, Alam S, Keereetaweep J, Shah J. Facilitation ofinfection by 9-lipoxygenases inand wheat[J]., 2015, 28(10): 1142-1152
[31] Christensen S A, Nemchenko A, Borrego E, Murray I, Sobhy I S, Bosak L, Deblasio S, Vaughn K A, Herrfurth C, Tumlinson J, Nansen C, Meeley R, Kolomiets M V. The maize lipoxygenase, zmlox10, mediates green leaf volatile, jasmonate and-herbivore-induced plant volatile production for defense against insect attack[J]., 2013, 74(1): 59-73.
[32] Xing Q J, Liao J J, Cao S X, Li M, Lü T H, Qi H Y. Cmlox10 positively regulates drought tolerance through jasmonic acid-mediated stomatal closure in oriental melon (var. Makuwa Makino)[J]., 2020, 10: 17452
[33] Torres M A, Jones J D, Dangl J L. Reactive oxygen species signaling in response to pathogens[J]., 2006, 141: 373-378.
Positively Regulates Defense Responses of Rice to rice blast and bacterial blight
Zhou Yonglin1, 2, Shen Xiaolei1, 2, Zhou Lishuai1, 2, Lin Qiaoxia1, 2, Wang Zhaolu1, 2, Chen Jing1, 2, Feng Huijie1, Zhang Zhenwen1, Chen Xiaoting1, 2, 3, *, LU Guodong2
(1College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, China;2Key Laboratory of Biopesticide and Chemical Biology, Ministry of Education, Fujian Agriculture and Forestry University, Fuzhou 350002, China;3Fujian Key Laboratory for Monitoring and Integrated Management of Crop Pests, Fuzhou 350013, China;*Corresponding author, E-mail: xiaotingchen@fafu.edu.cn)
【Objective】Rice blast caused byand bacterial blight caused bypv() seriously affect rice yield and quality. The transgenic materials ofwere created to evaluate the resistance toandThe possible mechanism ofin regulating the defense responses to rice blast and bacterial blight were elucidated.【Method】The knockout vector ofwas constructed using CRISPR/Cas9 system, and the overexpression vector ofwas constructed by linearizing pCXUN-HA with restriction enzymeⅠ and linking with TA ligation. Transgenic rice was obtained by genetic transformation, and the homozygous transgenic lines were screened for fungal and bacterial resistance analysis. The expression dynamics of SA (salicylic acid) and JA (jasmonic acid) pathway marker genes were analyzed by qRT-PCR after infection withThe outbreak of reactive oxygen species (ROS) induced by chitin and flg22 in rice was also observed. 【Result】qRT-PCR analysis showed that theexpression was up-regulated 24 h after inoculation withand. Theknockout lines were more susceptible to the rice blast than that of the wild type (Nipponbare) when inoculated with the spore suspension ofGuy11, while the overexpressed lines had no typical disease symptoms. At 6, 12, 24 and 36 hours post inoculation, the transcriptional levels of three pathogenesis-related genes,,andand two JA pathway genes,and, and SA pathway gene, were significantly down-regulated in the knockout transgenic lines. However, they were significantly up-regulated in overexpressed transgenic lines. Thetransgenic rice was inoculated with(), and theknockout lines were more susceptible to bacterial blight. qRT-PCR analysis showed that the relative expression levels ofandthe three genes (and) involved in theJA synthesis pathway were up-regulated inoverexpression lines, significantly down-regulated inknockout lines seven days afterinoculation.knockout also significantly reduced the ROS level induced by chitin and flg22 in rice, delayed the peaking time of ROS induced by chitin, and reduced the sensitivity of rice to chitin and flg22.【Conclusion】could be induced by infection withandmay be involved in pathogen-associated molecular patterns triggered immunity, and play a positive regulatory role in rice resistance to rice blast and bacterial blight. Moreover, themay regulate rice resistance toandthrough SA and JA mediated signaling pathways.
; CRISPR/Cas9; disease resistance; rice blast; bacterial blight; signal pathway
2021-06-10;
2021-09-30。
国家自然科学基金资助项目(31972251);福建省作物有害生物监测与治理重点实验室开放课题(MIMCP-202001);福建农林大学科技创新专项(KFA17308A, CXZX2020152D);福建农林大学生物学高原学科建设经费资助项目(71201800810)。
10.16819/j.1001-7216.2022.210604

