HCO3−和灌溉方式对水稻铁吸收和利用的交互影响
张新疆 王祥斌 刘玲慧 危常州, *
HCO3−和灌溉方式对水稻铁吸收和利用的交互影响
张新疆1, 2王祥斌1, 2刘玲慧1, 2危常州1, 2, *
(1石河子大学 农业资源与环境系,新疆 石河子 832000;2新疆生产建设兵团绿洲生态农业重点实验室,新疆 石河子832000;*通信联系人,E-mail:changzhouwei@126.com)
【目的】膜下滴灌水稻是一项兼顾高产和节水潜力的水稻栽培技术。然而,在石灰性土壤上膜下滴灌水稻经常表现出缺铁(Fe)黄化症状。前期研究发现,在滴灌条件下HCO3−对水稻Fe吸收的抑制强度弱于淹灌,但内在机制并不清楚。本文主要探讨HCO3−对两种灌溉型水稻土壤DTPA-Fe浓度、水稻木质部伤流液pH值、Fe吸收和利用的影响。【方法】在两种灌溉水稻[淹灌(FI)和覆膜滴灌(DI-PFM)]处理下设四种灌溉水HCO3−浓度处理(0,2,10和40 mmol/L HCO3−,分别表示为BC-0,BC-2,BC-10和BC-40)。【结果】DI-PFM土壤DTPA-Fe含量显著低于FI。随着HCO3−浓度增加,土壤pH增加,而土壤DTPA-Fe浓度呈降低趋势。水稻木质部伤流液pH值随灌溉水中HCO3−浓度的增加而增加,FI处理水稻木质部汁液pH值显著高于DI-PFM。水稻叶片和根系质外体铁浓度均随HCO3−浓度的上升表现为先减少后增加的趋势,在BC-40处理下最高。两种灌溉型水稻叶片活性铁浓度、共质体铁浓度、水稻生物量和全铁积累量均随HCO3−浓度的上升而降低,但DI-PFM处理下这些参数的降幅小于FI。水稻根系和叶片中共质体Fe与质外体Fe浓度比值随HCO3−浓度的增加而降低,FI处理水稻根系和叶片中共质体Fe与质外体Fe浓度比值大于DI-PFM。【结论】HCO3−引起水稻木质部伤流液pH升高影响水稻铁吸收和利用,但HCO3−并不是造成滴灌水稻缺铁的主要因子。石灰性土壤上滴灌水稻缺铁的主要原因可能仍是因为土壤铁有效性低引起的。
质外体铁;HCO3−;铁吸收和利用;共质体铁;木质部伤流液
水稻是耗水量最大的作物。据统计,到2025年世界上约有1500万至2000万hm2的稻田将遭受不同程度的缺水[1]。中国是世界上最大的水稻生产国,水稻种植面积和产量分别占全球的20%和32%[2],水资源缺乏加速了中国水稻节水技术的发展[3-6]。因此,减少水稻生产用水是必要的。
中国新疆地区农业生产尝试用膜下滴灌技术(DI-PFM)种植水稻,DI-PFM水稻产量高达12.0 t/hm2 [7]。在DI-PFM系统中,土壤含水量保持在田间持水量的90%左右,土壤表面没有明显水层。从土壤水分状况来看, DI-PFM水稻与旱稻栽培类似,但土壤湿度更大,土壤水分含量变幅更小。相比传统淹灌栽培稻,DI-PFM可以减少60%的灌溉用水[8]。尽管膜下滴灌水稻有很大的潜力,但在石灰性土壤上DI-PFM水稻经常发生缺铁问题,缺铁严重会导致稻苗死亡,严重影响水稻产量提升和该项技术的推广。
较高的土壤pH值和氧化还原电位会降低植物对铁的有效吸收[9]。除此以外,研究表明HCO3−是石灰性土壤上诱发植物缺铁的主要因素[10-13]。但关于HCO3−引起植物缺铁的发生机制仍存在争议,主要观点有两方面:1)研究认为HCO3−抑制了植物根系对根际Fe的获取[14-15];2)也有研究认为HCO3−导致植物体液碱化,进而引起植物叶片质外体铁失活是导致植物缺铁的原因[10, 12]。铁在质外体中的积累和活化受植物基因型、氮素形态、pH和HCO3−浓度影响较大。研究发现,即使植物根系质外体中存在丰富的铁源,高浓度的HCO3−仍会导致玉米和葡萄缺铁失绿[15-16]。木质部导管是营养物质从地下部运输到地上部分的主要通道,植物根系吸收的铁主要通过木质部向上运输,并从木质部卸载至韧皮部,进而运输至各器官[17]。木质部伤流液在植物水分、养分和代谢物的长距离运输中起主要作用。我们前期研究发现在石灰性土壤上淹灌(FI)水稻叶片活性Fe浓度和土壤DTPA-Fe含量均显著高于DI-PFM,但HCO3−对FI水稻铁吸收的抑制效果比膜下滴灌水稻更为强烈[18],其深层机制还不清楚。
本研究通过设置两种灌溉方式和四个灌溉水HCO3−浓度,研究HCO3−对不同灌溉方式下水稻伤流液pH、生物量累积、不同部位质外体和共质体铁浓度以及铁吸收和分配的影响,分析土壤中HCO3−的增加是否导致水稻木质部伤流液pH升高,从而影响水稻铁吸收和分配。
1 材料与方法
1.1 试验地概况
试验于2016年5月-9月在新疆石河子市石河子大学农学院试验站网室进行。试验开展期间日平均气温27.2℃,日降水量5.41 mm,日蒸发量为8.91 mm。供试水稻材料为T-43(L.)。供试土壤为石灰性灰漠土,土壤基础理化性质:pH 8.2,有机质含量15.7 g/kg,碱解氮含量93.7 mg/kg,有效磷含量19.4 g/kg,速效钾含量251.0 g/kg,电导率0.24 ms/cm,DTPA-Fe 12.7 mg/kg,DTPA-Mn 13.9 mg/kg,DTPA-Zn 1.0 mg/kg,碳酸钙 85.5 g/kg。
1.2 试验设计
两因素完全随机试验设计。设置两个灌溉处理,分别为传统淹灌(FI)和覆膜滴灌(DI-PFM)。每个灌溉处理下设四个HCO3−处理,灌溉水中NaHCO3浓度为0、2、10和40 mmol/L(分别表示为BC-0,BC-2,BC-10和BC-40)。水稻出苗长至2叶1心时开始灌溉处理,在水稻拔节期和成熟期(播种后的85 d和150 d)分两批采集土壤和植物样品。通过向HCO3−浓度为2 mmol/L的井水中添加NaHCO3形成不同HCO3−梯度的灌溉水,不同灌溉处理中投入的Na+用NaCl补齐。BC-0处理使用0.1 mol/L的盐酸调节灌溉水pH值至5,目的是除去灌溉水中自然状态下的HCO3−。每个处理重复5次。
取石河子大学农学院试验站耕层深度为0~30 cm土壤,土壤自然风干后过4 mm筛,装入陶瓷花盆(15 cm内径×30 cm高度),每个陶瓷花盆装土壤20 kg。每个盆栽处理施肥量相同,因陶瓷花盆装土量有限,所以施肥量比传统大田多50%。氮肥(尿素,折合纯氮0.20 g/kg)分四次施用:播种前15%,分蘖期30%,拔节期40%,孕穗扬花期15%。磷肥(重过磷酸钙,折合P2O50.15 g/kg)和钾肥(硫酸钾,折合K2O 0.2 g/kg)在播种前一次性随土和匀基施。水稻种子播在自制的根袋(300目)中以便于根系取样和根际土壤采集。为了适应水稻不同生育期根系生长,预先制定不同规格的根袋,分别是宽8 cm、高8 cm(拔节期)和12 cm(成熟期)。每个陶瓷花盆装土前均匀埋有5个根袋,根袋装土后,随土埋在花盆中。盆栽装土后用足量的水完全淹没土壤,土壤自然沉降8 d后,测定土壤含水量随后播种。稻种在播种前在水中浸泡24 h,然后播在相应根袋(每穴12粒种子)。待水稻长至2叶1心时,定苗至每穴6株开始灌溉处理。
每个传统淹灌处理陶瓷花盆底部都留有渗漏小孔,保证水分渗透速率为10 mm/d。在传统淹灌处理中,整个水稻生长期要保持土壤表面3~7 cm水层。利用医用输液器模拟滴灌灌水,滴灌处理土壤表面覆盖7 μm厚塑料膜。覆膜滴灌处理使用称重法进行灌水管理,通常每2 d灌溉一次,维持土壤含水量在土壤饱和持水量的90%以上。水稻全生育期滴灌灌水量为33.5 L/盆,传统淹灌处理为72.0 L/盆。
1.3 水稻木质部伤流液、土壤和水稻植株样本的收集和预处理
于水稻拔节期,从7:00开始使用不锈钢刀片将水稻从根基部1 cm处割断,用去离子水冲洗水稻基部,使用医用注射器连续收集水稻伤流液2 h后,立即测定伤流液pH值。伤流液收集完成后,挖出每个重复的根袋,取三穴根系用自来水轻轻洗去根系表面土壤。将地上部分为叶、茎、叶鞘。另取两穴水稻根系收集根际土壤,将收集的土壤样品放至冰盒内带回实验室,测定土壤溶液中的HCO3−和土壤DTPA-Fe浓度。土壤和根系样品置于冰盒中,带回实验室测定根系活力等指标。新鲜的水稻植株和土壤样品在采集后立即进行测定[19]。水稻根系先用去离子水洗净,后用0.5 mmol/L CaSO4溶液冲洗根系5遍[20]。地上部样品用去离子水清洗后再用0.1 mol/L HCl溶液冲洗5遍。
于水稻成熟期收获籽粒,并分地上、地下部取样,将地上部分为叶、茎、叶鞘、籽粒。不同植株部位铁含量测定预处理方法同上。
1.4 指标测定
木质部伤流液pH值使用IQ150不锈钢探针酸度计(光谱技术公司,美国)测定。根据Zhang等[18]的方法获得土壤溶液,土壤溶液中的HCO3−浓度用0.02 mol/L HCl和溴酚蓝作为指示剂测定。取新鲜土壤除杂后,按照土∶水=2∶5振荡摇匀3 min后,待土壤沉淀后直接使用混合电极pH计(pH Meter IQ150)测定土壤pH。在25℃下用DTPA-TEA (0.005 mol/L二乙烯三胺五乙酸+ 0.1 mol/L三乙醇胺+ 0.01 mol/L氯化钙,调节pH至7.3)提取土壤中DTPA-Fe。使用α -萘胺(α-NA)氧化速率表征根系活力(ROA)[21]。根据Takkar和Kaur的方法测定水稻叶片活性Fe浓度[22]。每个盆栽随机选择30片剑叶,分别在单片叶的中部和上下各3 cm处测定叶绿素含量。30片叶片不同部位叶绿素含量的平均值作为一个处理的观察值。
根据Biel等和Matichenkov等的方法测定水稻叶片和根系共质体和质外体铁浓度[23-24],具体过程如下:用不锈钢剪刀将植物样品切成小块(0.2~0.5 cm宽)。将新鲜样品(1.0 g)转移到含有50 mL去离子水的三角瓶中,振荡浸提1 h后,使用原子吸收分光光度计测定滤液铁浓度,此部分为质外体铁浓度。取浸提1 h后植株残渣用去离子水洗涤数次后,将植物样品转移至研钵中研磨,研磨后的样品转移到含有50 mL去离子水的三角瓶中,持续振荡1 h,此时滤液中为共质体铁,使用原子吸收分光光度法测定滤液铁浓度。
植物样品称量后用不锈钢研磨机研磨,样品在硝酸-高氯酸(硝酸∶高氯酸=2∶8)中消化。铁浓度用原子吸收分光光度计(日立Z-2000,日本)测定。
根据下列方程计算水稻收获指数和铁收获指数[25]:
收获指数=籽粒质量/(籽粒质量+秸秆质量);
铁收获指数=籽粒铁吸收量/(秸秆铁吸收量+籽粒铁吸收量)。
1.5 数据处理和统计分析
所得数据用Excel 2003进行数据整理后,用Graph Pad Prism 5作图。用SAS 8.0对数据进行双因素方差分析,在0.05水平进行差异显著性检验(LSD法)。
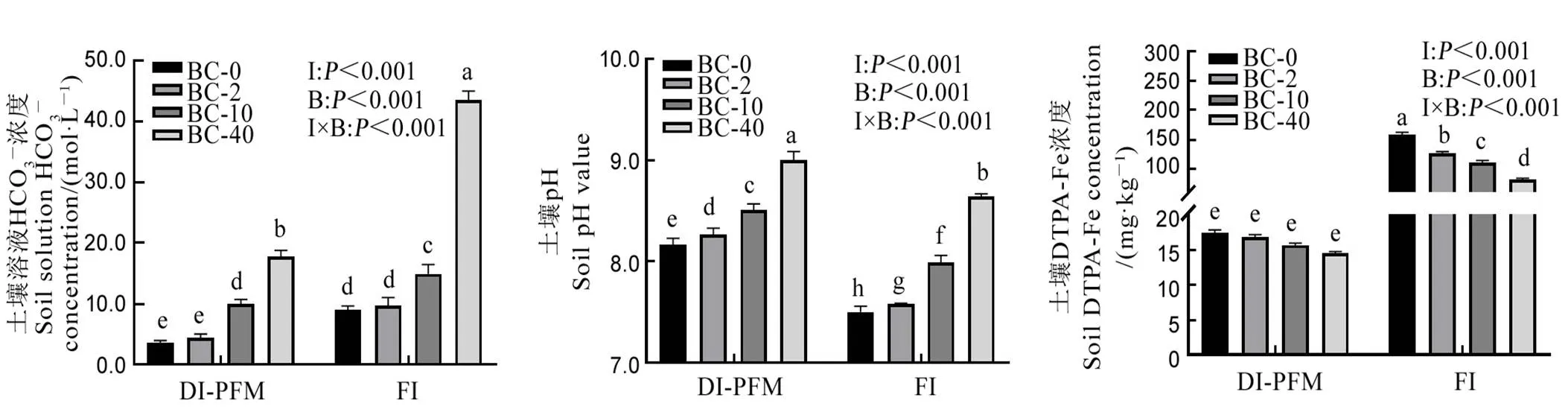
BC-0,BC-2,BC-10和BC-40表示灌溉水中HCO3−浓度分别为0,2,10和40 mmol/L。DI-PFM和FI分别表示覆膜滴灌栽培和水稻传统淹灌。I,B和I×B分别表示灌溉方式、灌溉水中HCO3−浓度及两者间的交互影响。误差线表示标准误(n=5);柱上相同字母表示处理间无显著差异(P < 0.05,LSD检验)。下同。
Fig. 1. Effects of irrigation method and HCO3−concentration of irrigation water on soil HCO3−concentration, soil pH, soil DTPA-Fe concentration at jointing stage.
2 结果与分析
2.1 土壤溶液中HCO3−浓度、土壤pH值、土壤DTPA-Fe浓度
灌溉方式、灌溉水中HCO3−浓度及其交互作用均对土壤溶液HCO3−浓度、土壤pH值和土壤DTPA-Fe浓度有显著影响(图1)。
土壤溶液HCO3−浓度和土壤pH整体上均表现为随灌溉水中HCO3−浓度的增加而显著升高,土壤DTPA-Fe浓度表现为随灌溉水中HCO3−浓度的增加而降低。在相同灌溉水HCO3−浓度下,土壤溶液HCO3−浓度和土壤DTPA-Fe浓度均在FI处理下显著高于DI-PFM,而土壤pH值在FI处理下显著低于DI-PFM。在FI条件下,随灌溉水HCO3−浓度的增加,土壤DTPA-Fe浓度显著降低,而在DI-PFM条件下,土壤DTPA-Fe浓度有降低趋势,但无显著性差异。
2.2 木质部伤流液pH值
灌溉方式、灌溉水中HCO3−浓度及其交互作用均对水稻木质部伤流液pH有显著影响(图2)。随着灌溉水中HCO3−浓度的增加,水稻木质部伤流液pH有升高趋势,且在DI-PFM和FI处理下,BC-10处理木质部伤流pH均显著高于BC-2和BC-0。FI水稻伤流液pH在BC-0和BC-2处理下均显著高于DI-PFM,但在BC-10处理下水稻伤流pH值在DI-PFM和FI间无显著性差异。
2.3 根系活力、叶片SPAD值和叶片活性铁浓度
灌溉方式、灌溉水中HCO3−浓度及其交互作用均对水稻根系氧化力和叶片活性铁浓度有显著影响。灌溉方式对水稻叶片SPAD值无显著影响,而灌溉水中HCO3−浓度及其交互作用对水稻叶片SPAD值有显著影响(图3)。
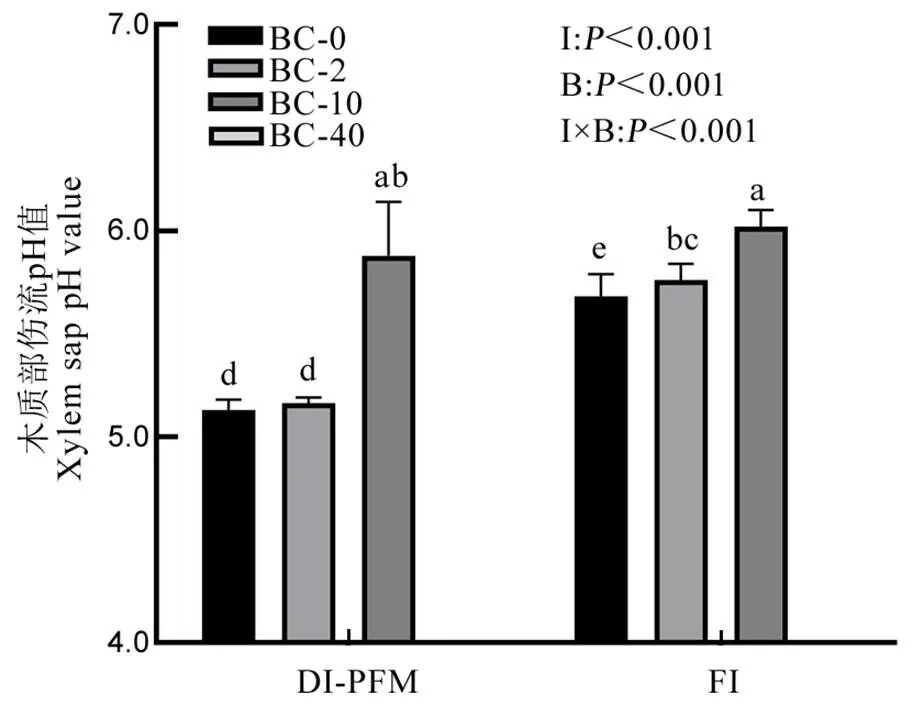
图2 水稻拔节期灌溉方式和灌溉水中HCO3−浓度对水稻木质部伤流液pH值的影响
Fig. 2. Effects of irrigation method and HCO3−concentration of irrigation water on the xylem sap pH value of rice at jointing stage.
在同一灌溉水HCO3−浓度处理下,DI-PFM水稻根系氧化力显著高于FI。随着HCO3−浓度增加,水稻根系氧化力逐渐降低,降幅表现为DI-PFM大于FI(相比BC-2,DI-PFM水稻在BC-10和BC-40处理下根系氧化力分别降低8.43%和15.50%,FI水稻在BC-10和BC-40处理下根系氧化力分别降低2.93%和5.40%)。在两种灌溉方式下,水稻叶片SPAD值均随灌溉水中HCO3−浓度的增加而显著降低,降幅表现为DI-PFM小于FI。在BC-0,BC-2和BC-10处理下,DI-PFM处理水稻叶片SPAD值显著低于FI,而在BC-40处理下,水稻叶片SPAD值在DI-PFM与FI处理间无显著性差异。在同一灌溉水HCO3−浓度处理下,DI-PFM水稻叶片活性铁含量显著低于FI处理。水稻叶片活性铁均随灌溉水HCO3−浓度增加而显著降低,降幅表现为FI大于DI-PFM(图3)。
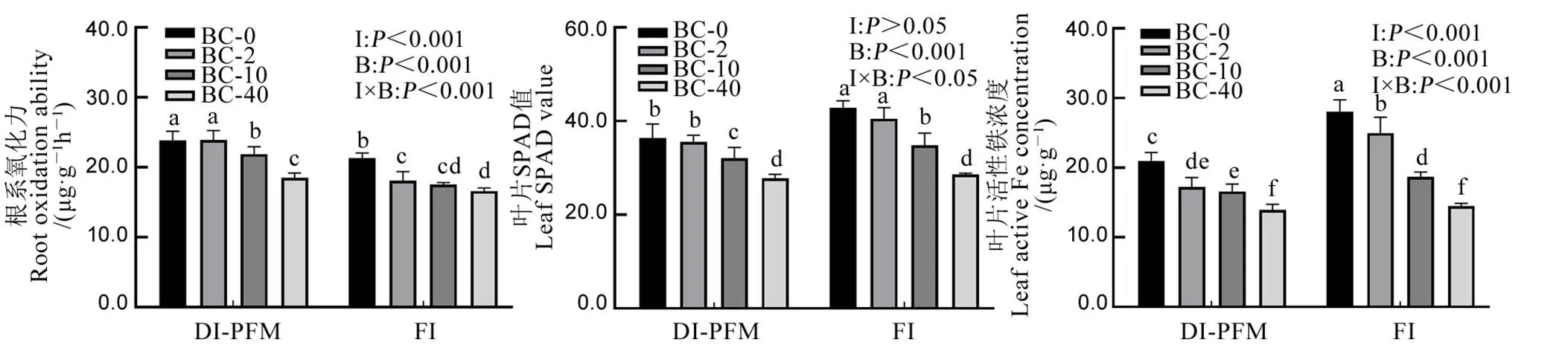
图3 水稻拔节期灌溉方式和灌溉水中HCO3−浓度对水稻根系氧化力、叶片SPAD值和叶片活性铁浓度的影响
Fig. 3. Effects of irrigation method and HCO3−concentration of irrigation water on rice root oxidation ability, leaf SPAD value and leaf active Fe concentration at jointing stage.
以上数据表明,HCO3−对水稻根系氧化力的抑制在DI-PFM下更为强烈,但灌溉水中HCO3−对水稻叶片SPAD值和活性铁的抑制作用在DI-PFM处理弱于FI处理。
2.4 水稻叶片、根系质外体和共质体铁浓度
灌溉方式、灌溉水中HCO3−浓度及两者的交互作用均对水稻叶片和根系质外体铁、共质体铁浓度及叶片共质体/质外体铁浓度比(Ls/a Fe)、根系共质体/质外体铁浓度比(Rs/a Fe)有显著影响(表1)。
叶片质外体和共质体铁浓度在DI-PFM处理下显著高于FI,而根系质外体、共质体铁浓度,Ls/a Fe和Rs/a Fe均在DI-PFM处理下显著低于FI。在DI-PFM和FI处理下,水稻叶片和根系质外体铁均随HCO3−浓度的增加表现为先减少后增加的趋势,其中在BC-40处理下最高。水稻叶片和根系共质体铁均表现为随HCO3−浓度的增加而显著降低,其中以BC-40处理下最低。在DI-PFM和FI处理下,灌溉水中HCO3−增加会显著降低水稻Ls/a Fe和Rs/a Fe。在DI-PFM下,BC-40相比BC-2处理,Ls/a Fe 和 Rs/a Fe分别减少了0.16和0.80,而在FI处理下,Ls/a Fe和Rs/a Fe分别减少了0.21和1.52 (表1)。
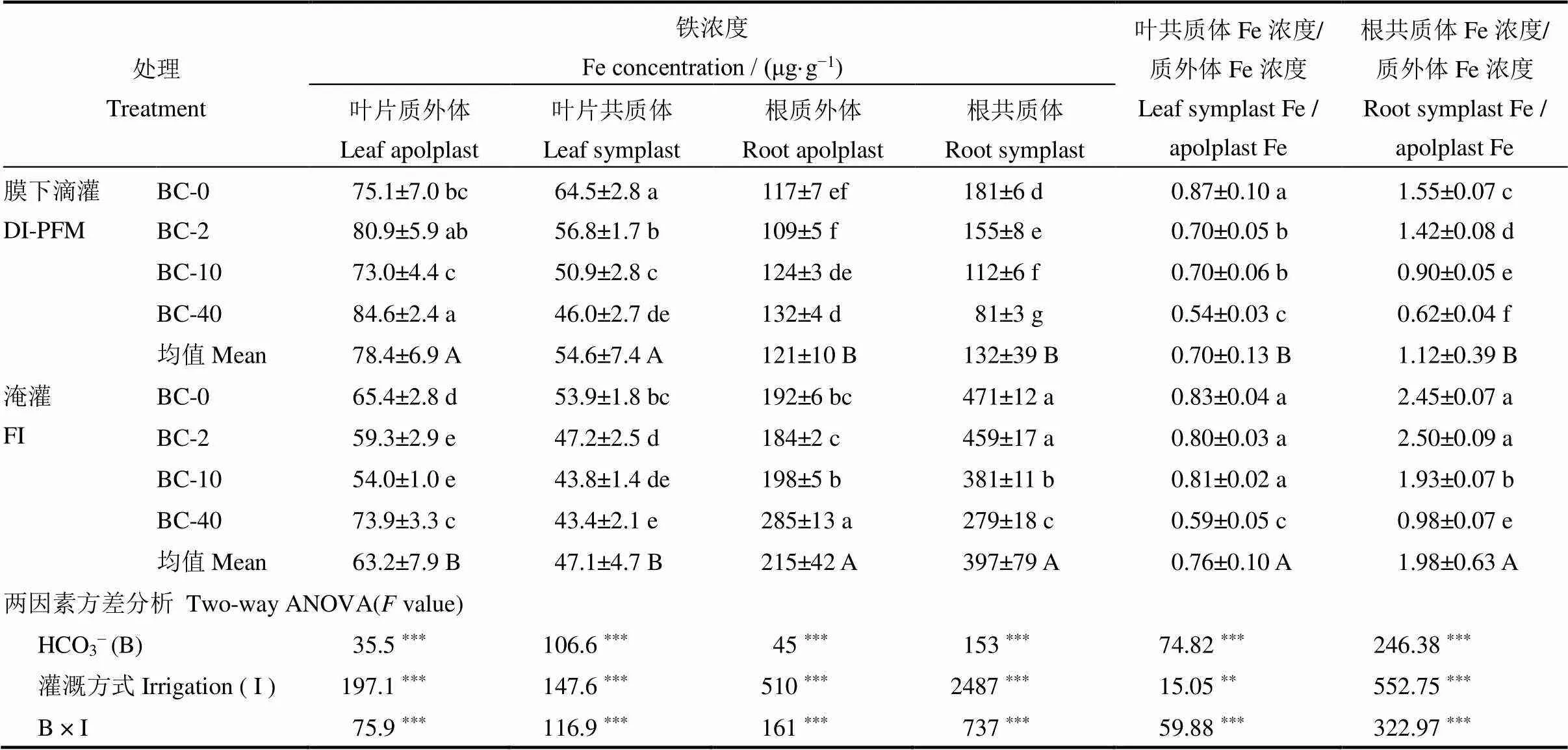
表1 水稻拔节期不同灌溉方式下灌溉水中HCO3−对水稻叶片、根系质外体铁和共质体铁浓度的影响
表中数据为平均值±标准误。同一列内不同小写字母表示通过LSD法多重比较处理间差异显著(< 0.05);同一列内不同大写字母表示不同灌溉方式间在< 0.05水平上存在显著差异。*,**和***分别表示在0.05,0.01和0.001水平差异显著,ns 表示差异不显著。下同。
Values are Mean±SE (=5). Different lowercase letters within a column mean significant difference at 5% by LSD multiple range test; Different uppercase letters within a column indicate that the means for different irrigation methods across different HCO3−concentrations of the irrigation water treatments are significantly different at the< 0.05 level. *, ** and *** indicate significant difference at the 0.05, 0.01 and 0.001 probability levels, respectively. ns indicates no significant difference. The same as below.
以上结果表明,灌溉水中较高的HCO3−会增加水稻叶片和根系质外体铁浓度,但会降低共质体铁浓度,且高浓度的HCO3−会降低水稻体内铁由质外体向共质体的转运,这种降低在FI处理比DI-PFM明显。
2.5 水稻生物量、铁吸收及分配
灌溉方式、灌溉水中HCO3−浓度及其交互作用均对水稻叶、茎、籽粒生物量积累和根、叶、籽粒铁浓度有显著影响(表2)。
水稻根系和鞘干物质量在DI-PFM和FI间无显著差异,而FI水稻叶片、茎、籽粒干物质量显著高于DI-PFM。随灌溉水中HCO3−浓度的增加,水稻生物量呈下降趋势。FI水稻生物量减少量高于DI-PFM(BC-40与BC-2相比,DI-PFM处理根、叶、茎、鞘和穗干物质量分别降低2.25,1.76,1.04,1.49和3.18 g/盆,FI处理根、叶、茎、鞘和穗干物质量分别降低4.08,1.29,4.26,1.57和7.43 g /盆)(表2)。
水稻根系铁浓度在DI-PFM下显著高于FI,而叶片和籽粒铁浓度在DI-PFM显著低于FI,且茎、鞘部铁浓度在DI-PFM和FI间无显著性差异。FI处理水稻根系全铁浓度随灌溉水中HCO3−浓度增加先逐渐降低,后又有所增加,且BC-40处理全铁浓度最高。DI-PFM处理水稻叶片全铁浓度随灌溉水中HCO3−浓度的增加而增加,而FI处理水稻叶片全铁浓度在BC-10处理最低,在BC-0、BC-2和BC-40处理间没有显著性差异,且BC-40处理叶片全铁浓度显著高于BC-10。DI-PFM和FI处理籽粒全铁浓度均随HCO3−浓度的增加而增加(表2)。

表2 水稻成熟期不同灌溉方式下灌溉水中HCO3−对水稻生物量和全铁浓度的影响
HCO3−对水稻铁吸收量、铁总积累量、籽粒收获指数和铁收获指数的影响见表3。水稻根系、茎、籽粒铁吸收量、水稻铁总积累量、穗收获指数和铁收获指数均在DI-PFM处理下显著低于FI,而叶片铁吸收量在DI-PFM下显著高于FI。水稻不同器官铁吸收量和水稻铁积累量均随HCO3−浓度的增加而降低。相比DI-PFM,灌溉水中HCO3−对水稻铁积累量的抑制在FI处理下更为强烈(BC-2与BC-0相比,DI-PFM水稻铁积累量降低2612 μg/盆,FI降低7653 μg/盆;BC-40与BC-0相比,DI-PFM水稻铁积累量降低4472 μg/盆,FI降低20217 μg/盆)。

表3 水稻成熟期不同灌溉方式下灌溉水中HCO3−浓度对水稻铁吸收量、铁积累量、水稻籽粒收获指数、铁收获指数的影响
总体来看,高浓度的HCO3−会抑制水稻生物量积累、铁吸收量和铁积累量,并且这种抑制作用在FI下强于DI-PFM。
3 讨论
3.1 HCO3−诱导水稻木质部汁液pH升高影响水稻铁吸收和利用
一般认为植物木质部汁液呈弱酸性,这使得植物体内铁可以和有机酸形成稳定的螯合物进行运输[17, 26],而影响铁在植物体内吸收利用的关键因子之一是细胞质膜铁还原酶活性,植物质外体pH的升高会降低其活性,抑制植物体内三价铁的还原吸收,进而影响铁在植物体内的吸收和分配[27]。早期研究指出土壤中的HCO3−会通过根系吸收进入植物体,引起植物体pH稳态的改变,进而导致植物发生缺铁现象[10-11]。本研究结果显示,当灌溉水HCO3−浓度增加至10 mmol/L时,两种灌溉方式下水稻木质部伤流液pH值均显著增加,并且传统灌溉水稻木质部伤流液pH值高于覆膜滴灌(图2)。与此同时,灌溉水中HCO3−增加导致水稻叶片SPAD值和叶片活性铁的显著降低(图3),水稻根系和叶片共质体铁浓度、叶片和根系中的共质体/质外体铁浓度比也均随着HCO3−浓度的增加而降低(表1),且传统灌溉水稻的降幅大于覆膜滴灌。水稻供应硝态氮同样会导致木质部伤流液pH值上升[28],水稻叶片表现出缺铁黄化现象。以上结果表明,HCO3−诱导水稻木质部伤流液pH值的升高会减缓水稻体内铁的有效利用。
在本研究中,传统灌溉(FI)处理水稻根系全铁浓度,质外体和共质体铁浓度均高于覆膜滴灌(DI-PFM),而叶片全铁浓度,共质体和质外体铁浓度则在DI-PFM下较高(表1),数据似乎表明DI-PFM水稻体内Fe由地下部向地上部的转运率高于FI,然而实际上在石灰性土壤上往往是滴灌水稻更容易遭受缺铁胁迫[9, 18]。可见,仅凭计算植物体内全铁含量由根系向地上部的分配效率来判断水稻铁运输效率是有局限性的。造成上述结果的可能原因如下:1)FI条件下土壤pH值低于DI-PFM,土壤中有效铁含量更高(图1),相应植株根部铁吸收量更多;2)FI处理水稻伤流液pH值高于DI-PFM(图2),这降低了FI水稻体内铁由根部向地上部的运输效率,导致DI-PFM水稻叶片共质体铁与质外体铁浓度比高于FI(表1)。此外,也有研究认为全铁含量并不能直接用来评价植物缺铁水平,而使用活性铁(Fe-HCl)可以有效评价植物铁营养状况[29-32]。我们前期研究和本次研究结果均发现,HCO3−处理显著降低了水稻叶片活性铁含量和叶片SPAD值(图3),且两种灌溉方式下水稻BC-40处理水稻叶片和根系质外体铁含量均高于其他HCO3−浓度处理,而根系和叶片共质体铁含量在BC-40处理下最低(表1),可见HCO3−诱导水稻木质部汁液pH升高会导致大量铁沉积在质外体[16],并且土壤中HCO3−越高,沉积在根系质外体的无效铁就越多,这也是FI水稻铁吸收运输效率低于DI-PFM的主要原因。以上研究结果与他人研究类似,HCO3−诱发向日葵缺铁会导致向日葵质外体pH升高,并且引发大量铁在质外体沉积而无效化[11, 33]。Nikolic和Kastori也报道过类似的结果,他们发现葡萄幼苗在含有游离铁的溶液中根系质外体铁浓度会增加,但在含HCO3−的所有处理中共质体铁浓度都会显著降低[15]。以上结果表明,HCO3−诱导水稻木质部伤流液pH的升高造成大量铁在质外体的无效化是水稻缺铁的主要原因。
谷类作物土壤缺铁临界水平一般认为是5 mg/kg (DTPA-Fe)[34]。在本研究中土壤DTPA-Fe浓度在DI-PFM处理下显著低于FI,但整体土壤DTPA-Fe含量仍高于5 mg/kg(图1),而灌溉水中HCO3−浓度在10 mmol/L时水稻叶片SPAD和活性铁含量均表现出降低趋势,且DI-PFM处理水稻叶片SPAD值整体低于FI(图3)。可见,水稻的缺铁临界值可能要高于5 mg/kg。新疆地区发展的滴灌水稻栽培仍是选择耐旱性较好的水稻种质资源,水稻属水生作物,在长期的淹水栽培中逐渐通过适应性改变形成了耐铁毒害能力,因此,在传统的淹灌栽培制度下很少见水稻铁毒现象发生。与其他禾本科作物相比,一般认为5 mg/kg的土壤有效铁含量并不能直接作为判断水稻是否遭受缺铁胁迫的土壤临界水平。
3.2 HCO3−抑制水稻生长影响铁积累
HCO3−影响水稻铁吸收和分配的同时也会抑制水稻根系和地上部的生长(表1~表3),这与前人研究结果相似。Gruber和Kosegarten认为植物缺铁引起的生长受限早于叶片出现失绿症,这种植株表面上看似乎健康,但实际上已经遭受缺铁胁迫[35]。在本研究中,土壤HCO3−浓度的增加抑制了水稻生物量的积累,而且FI水稻的这种受抑制程度比DI-PFM更大,原因是FI土壤中积累了更多的HCO3−(图1)。在本研究中我们注意到,高浓度HCO3−处理水稻根系颜色呈深棕色,可见HCO3−对水稻根系生长造成了伤害。此外,本研究中BC-40没有收集到足够伤流液进行pH测试,原因也和水稻根系活力有关。因为伤流液动力来源于根部膨压[36],而膨压又与植株的生长生理活性相关。根据前人研究,HCO3−至少通过两种机制影响植物根系生长:1)影响根系质外体pH缓冲性;2)干扰根部细胞的新陈代谢[37]。有研究发现缺铁植物早期地上部生长受限[38],这与我们的试验结果相似,HCO3−明显抑制了水稻生物量累积(表2)。总之,多项研究结果表明HCO3−对植物生长有直接伤害,而HCO3−引起水稻根系受损也是导致水稻生长受限和发生缺铁障碍的原因之一。
两种灌溉型水稻叶片活性铁浓度均随灌溉水HCO3−浓度的增加而降低(图3),BC-10和BC-40处理水稻叶部全铁含量低于BC-0和BC-2处理,但是在个别生育期前者高于后者(表2),这种现象称为“黄化悖论”,可以用“稀释现象”解释[35]。正常植物叶片快速生长时叶片中的铁浓度会随着叶片的生长而被稀释,但由于HCO3−抑制了植物叶片的生长,此时缺铁植物叶片内铁浓度会“浓缩”,所以生长受抑植株的叶片中铁含量往往高于正常绿色叶。本研究发现“黄化悖论”现象不仅在叶片发生,在根系中也有同样现象(表2)。由此可见,HCO3−抑制水稻生长是缺铁的一个重要表现。我们发现其他测试指标,例如水稻铁积累量、铁含量、水稻收获指数、铁收获指数都随HCO3−浓度的增加而降低(表2,表3)。图1和表3数据显示,DI-PFM处理水稻土壤有效铁和水稻铁积累量显著低于FI处理(DI-PFM 17135 μg/盆;FI 40335 μg/盆),而HCO3−对水稻叶片活性铁和全铁吸收的抑制作用都是在水稻淹灌时更为严重,因此我们对实际生产中滴灌水稻容易发生缺铁原因的解释是土壤铁有效性下降和水稻铁吸收不足,而石灰性土壤上HCO3−并不是滴灌水稻缺铁的主要诱发因子。
4 结论
HCO3−诱导水稻木质部伤流液pH升高会减缓水稻质外体铁向共质体铁的有效吸收。HCO3−减少水稻铁吸收和积累量,主要是因为限制了水稻生物量的积累。石灰性土壤上HCO3−并不是导致滴灌水稻发生缺铁的主要因子,造成滴灌水稻发生缺铁的原因可能还是因为土壤有效铁和水稻铁吸收不足。
[1] Kijne J W, Barker R, Molden D. Water productivity in agriculture: Limits opportunities for improvement // Tuong T P, Bouman B A M. Rice Production in Water-scarce Environments [M]. Wallingford, UK: CAB International 2003, 1:13-42.
[2] Shi R L, Hao H M, Fan X Y, Karim M R, Zhang F S, Zou C Q. Responses of aerobic rice (L.) to iron deficiency[J]., 2012, 11(6): 938-945.
[3] Belder P, Bouman B A M, Spiertz J H J. Exploring options for water savings in lowland rice using a modelling approach[J]., 2007, 92(1-3): 91-114.
[4] Belder P, Bouman B A M, Spiertz J H J, Peng S, Castañeda A R, Visperas R M. Crop performance, nitrogen and water use in flooded and aerobic rice[J]., 2005, 273(1): 167-182.
[5] Liu X J, Ai Y W, Zhang F S, Lu S H, Zeng X Z, Fan M S. Crop production, nitrogen recovery and water use efficiency in rice–wheat rotation as affected by non-flooded mulching cultivation (NFMC)[J]., 2005, 71(3): 289-299.
[6] Tao H B, Brueck H, Dittert K,Kreye C, Lin S, Sattelmacher BGrowth and yield formation of rice (L.) in the water-saving ground cover rice production system (GCRPS)[J]., 2006, 95(1): 1-12.
[7] 郭庆人, 陈林. 水稻膜下滴灌栽培技术在我国发展的优势及前景分析[J]. 中国稻米, 2012, 18(4): 36-39.
Guo Q R, Chen L. Analysis on the advantages and prospects of rice drip irrigation under plastic film in China[J]., 2012, 18(4): 36-39. (in Chinese with English abstract)
[8] He H B, Ma F Y, Yang R, Chen L, Jia B, Cui J, Fan H, Wang X, Li LRice performance and water use efficiency under plastic mulching with drip irrigation[J]., 2013, 8(12): e83103.
[9] Zhang X J. Hou J W, Wang X J, Zhang Z Y, Dai F, Wang J, Wei C ZHigh soil redox potential contributes to iron deficiency in drip-irrigated rice grown in calcareous[J]., 2019, 65(7): 337-342.
[10] Mengel K. Iron availability in plant tissues-iron chlorosis on calcareous soils[J]., 1994, 165(2): 275-283.
[11] Mengel K, Planker R, Hoffmann B. Relationship between leaf apoplast pH and iron chlorosis of sunflower (L.)[J]., 1994, 17(6): 1053-1065.
[12] Sattelmacher B. The apoplast and its significance for plant mineral nutrition[J]., 2001, 149(2): 167-192.
[13] Toulon V, Sentenac H, Thibaud J B, Davidian J C, Moulineau C, Grignon CRole of apoplast acidification by the H+pump[J]., 1992, 186(2): 212-218.
[14] Broadley M, Brown P, Cakmak I, Rengel Z, Zhao F J. Function of Nutrients: Micronutrients // Marschner P. Marschner's Mineral Nutrition of Higher Plants [M]. Third Edition. London: Academic Press, 2011: 198-200.
[15] Nikolic M. Kastori R. Effect of bicarbonate and Fe supply on Fe nutrition of grapevine.[J]. 2000, 23(11-12): 1619-1627.
[16] Kosegarten H. Koyro H W. Apoplastic accumulation of iron in the epidermis of maize () roots grown in calcareous soil[J]., 2001, 113(4): 515-522.
[17] Takahashi M, Terada Y, Nakai I, Nakanishi H, Yoshimura E, Nishizawa M N K. Role of nicotianamine in the intracellular delivery of metals and plant reproductive development[J]., 2003, 15(6): 1263-1280.
[18] Zhang X J, Zhang S J, Zhao H H, Zhu Q C, Bai R X, Yang Y Z, Wang M, Wang J, Wei C Z. Effect of HCO3−on rice growth and iron uptake under flood irrigation and drip irrigation with plastic film mulch[J]., 2015, 178(6): 944-952.
[19] Wang Z W, Shan X Q, Zhang S Z. Comparison between fractionation and bioavailability of trace elements in rhizosphere and bulk soils[J]., 2002,46(8): 1163-1171.
[20] Kosegarten H, Wilson G H, Esch A. The effect of nitrate nutrition on iron chlorosis and leaf growth in sunflower (L.)[J]., 1998, 8(3-4): 283-292.
[21] Ota Y. Diagnostic method for measurement of root activity in rice plant[J]., 1970, 5(3): 1-6.
[22] Takkar P N, Kaur N P, Fomina I. HCl method for Fe2+estimation to resolve iron chlorosis in plants[J]., 1984, 7(1-5): 81-90.
[23] Ji X H, Liu S H, Juan H, Bocharnikova E A, Matichenkov V V. Effect of silicon fertilizers on cadmium in rice () tissue at tillering stage[J]., 2017, 24(11): 10740-10748.
[24] Matichenkov V V, Bocharnikova E A, Kosobryukhov A A, Biel K Y. Mobile forms of silicon in plants[J]., 2008, 418 (2): 279-281.
[25] Gao X P, Zou C Q, Fan X Y, Zhang F S, Hoffland EFrom flooded to aerobic conditions in rice cultivation: Consequences for zinc uptake[J]., 2006, 280(1-2): 41-47.
[26] López-Millán A F,Morales F, Abadı́a A, Abadı́a JEffects of iron deficiency on the composition of the leaf apoplastic fluid and xylem sap in sugar beet. Implications for iron and carbon transport[J]., 2000, 124(2): 873-884.
[27] 申红芸, 熊宏春, 郭笑彤, 左元梅. 植物吸收和转运铁的分子生理机制研究进展[J]. 植物营养与肥料学报, 2011, 17(6): 1522-1530.
Shen H Y, Xiong H C, Guo X T, Zuo Y M. Progress of molecular and physiological mechanism of iron uptake and translocation in plants[J]., 2011, 17(6): 1522-1530. (in Chinese with English abstract)
[28] Zhang X J, Liu H, Zhang S J, Wang J, Wei C ZNH4+-N alleviates iron deficiency in rice seedlings under calcareous conditions[J]., 2019, 9(1): 1-11.
[29] Clarkson D T, Hanson J B. The mineral nutrition of higher plants[J]., 1980, 31(1): 239-298.
[30] Katyal J C, Sharma B D. A new technique of plant analysis to resolve iron chlorosis[J]., 1980, 55(1): 105-119.
[31] Olsen R A, Brown J C, Bennett J H, Blume D. Reduction of Fe3+as it relates to Fe chlorosis[J]., 1982, 5(4-7): 433-445.
[32] Römheld V. The chlorosis paradox: Fe inactivation as a secondary event in chlorotic leaves of grapevine[J]., 2000, 23(11-12): 1629-1643.
[33] Kosegarten H U, Hoffmann B, Mengel K. Apoplastic pH and Fe3+reduction in intact sunflower leaves[J]., 1999, 121(4): 1069-1079.
[34] Dodermann A, Fairhurst T. Rice: Nutrient Disorders and Nutrient Management[M]. Singapore: International Rice Research Institute (IRRI), 2000
[35] Gruber B, Kosegarten H. Depressed growth of nonchlorotic vine grown in calcareous soil is an iron deficiency symptom prior to leaf chlorosis[J]., 2002, 165(1): 111-117.
[36] Canny M J. A new theory for the ascent of sap—cohesion supported by tissue pressure[J]., 1995, 75(4): 343-357.
[37] Peiter E, Yan F, and Schubert S. Lime-induced growth depression in Lupinus species: Are soil pH and bicarbonate involved?[J], 2001, 164(2): 165-172.
[38] Römheld V. The chlorosis paradox: Fe inactivation as a secondary event in chlorotic leaves of grapevine[J]., 2000, 23(11-12): 1629-1643.
Interactive Effects of HCO3−and Irrigation Methods on Iron Uptake and Utilization in Rice
ZHANG Xinjiang1, 2, WANG Xiangbin1, 2, LIU Linghui1, 2, WEI Changzhou1, 2, *
(Department of Resources and Environmental Science, Shihezi University, Shihezi 832000, China; Key Laboratory of Oasis Ecology Agriculture of Xinjiang Production and Construction Group, Shihezi 832000, China; Corresponding author, E-mail: changzhouwei@126.com)
【Objective】Drip-irrigated rice with plastic film mulch (DI-PFM) is a rice cultivation technique with both high yield and water-saving potential. However, DI-PFM rice on calcareous soil often exhibits Fe-chlorosis symptoms. Previous studies found that the inhibitory intensity of HCO3−on Fe uptake of DI-PFM rice was weaker than that of flooding irrigation rice, but the underlying mechanism remains unclear. The effects of HCO3−on soil DTPA-Fe concentration, xylem sap pH, Fe absorption and distribution of two kinds of irrigated rice were studied. 【Methods】The experiment included two irrigation methods [flooding irrigation (FI) and DI-PFM] and four HCO3−concentrations (0, 2, 10 and 40 mmol/L HCO3−, were expressed as BC-0, BC-2, BC-10 and BC-40, respectively) of irrigation water. 【Results】The concentration of soil DTPA-Fe in DI-PFM was significantly lower than that in FI. With the increase of HCO3−concentration, soil pH increased, while soil DTPA-Fe concentration decreased. Xylem sap pH of rice increased with the increase of HCO3−concentration in irrigation water, and the xylem sap pH of FI rice was significantly higher than that of DI-PFM. With the increase of HCO3−concentration, the apoplast Fe concentration in rice leaves and roots decreased at low HCO3−level and increased at high HCO3−level, and peaked under BC-40 treatment. The leaf active Fe concentration, symplastic Fe concentration, rice biomass and total Fe accumulation of two kinds of irrigated rice decreased with the increase of HCO3−concentration, but the decrease of these parameters under DI-PFM treatment were less than that of FI. The concentration ratio of symplastic Fe to apoplast Fe in rice roots and leaves decreased with the increase of HCO3−concentration, and the concentration ratio of symplastic Fe to apoplast Fe in rice roots and leaves in FI was higher than that of DI-PFM. 【Conclusion】The increased pH in xylem sap of rice caused by HCO3−affected the absorption and utilization of Fe in rice, but HCO3−was not the main factor leading to Fe deficiency in DI-PFM rice. The main reason for Fe deficiency of DI-PFM rice on calcareous soil may still be due to the low availability of soil Fe.
apoplastic Fe; HCO3−; Fe uptake and utilization; symplastic Fe; xylem sap
10.16819/j.1001-7216.2022.210904
2021-09-11;
2022-05-11。
国家自然科学基金资助项目(31860587,31471947)。

