水稻类病斑突变体lmm7的鉴定与基因定位
孙志广 代慧敏 陈庭木 李景芳 迟铭 周振玲 刘艳 刘金波 徐波 邢运高 杨波 李健 卢百关 方兆伟 王宝祥, * 徐大勇, *
水稻类病斑突变体的鉴定与基因定位
孙志广1代慧敏2陈庭木1李景芳1迟铭1周振玲1刘艳1刘金波1徐波1邢运高1杨波1李健1卢百关1方兆伟1王宝祥1, *徐大勇1, *
(1连云港市农业科学院/江苏省现代作物生产协同创新中心, 江苏 连云港 222006;2连云港市生产力促进中心, 江苏 连云港 222006,*通信联系人, E-mail: wbxrice@163.com; xudayong3030@sina.com)
【目的】对水稻类病斑突变体的研究有助于解析其与植物生长和防御反应的关系。【方法】本研究在粳稻品系FI135胚培养过程中获得了1个类病斑突变体()。通过对其进行系统的表型鉴定、农艺性状考查、超微结构观察、生理学特性分析,阐明基因对植物生长的调控。通过病原菌抗性鉴定,明确对植物防御反应的影响。利用9311B与突变体杂交所得F2群体对该突变体进行了遗传分析和基因精细定位。【结果】该突变体苗期表型正常,分蘖初期,植株基部叶片从叶尖开始不断出现褐色斑点,并向整株扩散,且斑点数目随植株生长不断增加。与野生型相比,突变体的株高、穗长、有效穗数、每穗粒数、结实率及剑叶长宽都显著降低,但籽粒性状和抽穗期没有显著性差异。遮光处理表明,突变体的表型受到光照诱导,抽穗期突变体叶肉细胞严重失绿,光合色素含量显著降低。组织化学分析表明,突变体病斑处的H2O2含量显著升高。透射电镜观察结果表明,突变体叶肉细胞的叶绿体数目减少,叶绿体类囊体片层结构严重受损,细胞器肿胀解体,并出现大量嗜锇小体,同时病斑内部和周围区域积累了大量的ROS。抗性鉴定结果显示突变体稻瘟病抗性水平显著高于野生型。遗传分析表明的突变表型受单个隐性基因控制。利用图位克隆的方法,目的基因被定位于水稻第7染色体短臂两InDel标记7B35和7B43之间,区间范围约260 kb。测序结果表明该区间内候选基因第2891位碱基T发生了单碱基缺失,导致后续移码突变及翻译提前终止。【结论】与互为等位基因,其突变抑制了植株的生长,同时增强了对稻瘟病的抗性。
水稻;类病斑突变体;表型鉴定;基因定位
植物类病斑突变体是指在没有病原菌侵染、环境胁迫或机械损伤时,植物组织上自发形成与病原菌侵染引起过敏性反应(hypersensitive response, HR)介导的细胞程序性死亡(programmed cell death, PCD)类似病斑的这一类突变体[1-3]。类病斑的产生是一种典型的植物自发防御反应,该反应涉及活性氧(reactive oxygen species, ROS)积累、病程相关基因的表达、细胞壁的增厚和细胞程序性死亡等多种生理生化过程[4-5],而这些过程往往和植物免疫反应以及细胞凋亡相关联。大多数类病斑突变体在没有病原侵染的情况下组成性激活植物免疫反应,增强植物对一种或多种病原菌的抗性[6]。因此,加强对植物类病斑突变体的研究有助于对植物抗病分子机制的理解。
目前已在多种植物中发现了类病斑突变体,比如拟南芥[7]、玉米[8]、小麦[9]、番茄[10]、大麦[11]和水稻[12]等。近年来,水稻类病斑突变体被大量报道,这些类病斑基因编码不同的功能蛋白,如膜相关蛋白[13-16]、离子通道家族成员[17-19]、锌指蛋白[20]、热激转录因子[21]、E3泛素连接酶[22]、格网蛋白相关接头蛋白[23]、脂肪酸/脂类生物合成相关蛋白[24-25]、卟啉[26-27]和酚醛树脂等[28]。这些蛋白涉及不同的防御信号途径,比如ROS产生、病虫害抗性、钙调信号、蛋白质泛素化或磷酸化以及脂肪酸代谢等,其中有些类病斑基因不仅影响过敏性反应介导的植物对病原菌的抗性,还通过不同的生理途径影响了植物对非生物胁迫的响应[29-30]。因此,调控植物类病斑细胞死亡和抗性的分子机制十分复杂。挖掘更多的类病斑突变体,并克隆相关基因,可为水稻抗病防御体系和细胞程序性死亡机制的研究提供借鉴,同时可为抗性育种提供有用的种质资源。
本研究在粳稻品系FI135胚培养过程中,鉴定到一个稳定遗传的类病斑突变体,该突变体苗期叶片表现正常,分蘖期初期基部叶片开始出现褐色圆形斑点,并不断向整株扩散。本研究对该突变体进行表型鉴定、农艺性状考查、超微结构观察、生理学特性分析、病原菌抗性鉴定,并对该突变体进行了遗传分析和精细定位,以期为该基因的克隆、功能分析及应用奠定基础。
1 材料与方法
1.1 试验材料与种植条件
突变体是连云港市农业科学院选育的粳稻高世代品系FI135在胚培养过程中产生的类病斑突变体,经多代自交,突变体类病斑表型能稳定遗传。2019年将野生型FI135(WT)、突变体、籼稻9311B以及突变体和9311B衍生的F1、F2群体均种植于连云港市农业科学院东辛农场试验基地(E 119°32′,N 34°56′),种子均来源于连云港市农业科学院水稻种质资源库。
1.2 农艺性状调查
将野生型和突变体种植于田间,每小区6行,每行10株,3次重复,随机从野生型和突变体小区中央选择10株进行农艺性状考查:在抽穗期调查的有株高、剑叶长、剑叶宽、有效穗数、抽穗期;籽粒成熟后调查的有穗长、每穗粒数、结实率、粒长、粒宽、粒厚和千粒重,并作检验统计分析。
1.3 光合色素含量测定
在抽穗期,选取野生型和突变体的剑叶、倒2叶和倒3叶的平展部分进行光合色素含量的测定:用剪刀去除叶脉,剪碎后称取样品25 mg,浸泡于5 mL 95%乙醇中,置于4℃下避光保存,期间多次震荡,浸提48 h后,以95%乙醇为空白对照,利用UV759紫外可见分光光度计分别测定665 nm、649 nm和470 nm下的吸光值,每组样品重复测量5次。参照Lichtenthaler等[31]计算光合色素含量。
1.4 透射电镜观察
分别选取成熟期突变体剑叶中部及野生型对应位置叶片,置于2.5%的戊二醛溶液中固定,避开叶脉区域将叶片切成3 mm×3 mm的方块状,抽真空使材料沉于管底,固定24 h后4℃下避光保存。参照Fang等[32]的方法进行样品制备,随后置于高反差型透射电子显微镜(日立H-7800)下对叶片细胞进行观察并拍照记录。
1.5 遮光处理
在田间自然条件下,于水稻抽穗期,用宽约2 cm的锡箔纸对突变体仅在叶尖出现少量病斑的叶片中间部位进行锡箔纸遮光处理,在野生型相同位置进行同样处理,1周后除去遮光处理,观察病斑变化,并拍照记录。
1.6 组织化学分析
为检测突变体在类病斑形成过程中是否存在细胞死亡和过氧化氢积累,在抽穗期取突变体出现病斑叶片以及野生型对应部位叶片,利用南京森贝伽生物科技有限公司DAB辣根过氧化物酶显色试剂盒进行染色,利用台盼蓝染色液(0.4%)染色,显微镜下观察叶片染色情况并拍照记录。
1.7 稻瘟病和水稻黑条矮缩病抗性鉴定
在连云港市农业科学院东辛农场试验基地温室内对野生型和突变体分别进行稻瘟病和水稻黑条矮缩病抗性鉴定。稻瘟病鉴定参照刘永峰[33]的方法,在水稻孕穗初期,用注射器吸取1 mL菌液在幼穗中上部缓缓注入稻苞内,每品种接种20株,每株接种1个穗子。稻瘟病菌菌液为ZB7、ZC11、ZD7、ZF1、ZG1共5种菌株的混合菌液(引自江苏省农业科学院植物保护研究所),鉴定流程和评价标准参照国际水稻研究所(IRRI)水稻稻瘟病评级系统标准执行[34]。参照Zhou等[35]的方法对野生型和突变体进行水稻黑条矮缩病人工接种鉴定。所用毒源取自田间鉴定圃内典型的水稻黑条矮缩病病株。选择饥饿1 d的3龄灰飞虱若虫,置于水稻黑条矮缩病病株上饲毒3 d,随后将存活的灰飞虱移入预先育有苏御糯幼苗的5 L烧杯中,度过10 d左右的循回期,随后将野生型和突变体种子催芽播种于周转箱中,每重复40粒种子,3个重复。在3叶1心时进行间苗,保留30株整齐一致的健康植株,按10头/株的虫口密度接入饲毒水稻黑条矮缩病后的灰飞虱,为保证接毒的均匀一致,用毛笔将灰飞虱驱散均匀,每天5次,3 d后将灰飞虱导出,接毒完成。接毒后的植株移栽到温室中,用防虫网与外界隔离,进行正常的田间肥水管理,在水稻分蘖期进行表型调查,以发病率作为表型值进行分析,并作检验统计分析。
1.8 遗传分析与基因定位
2018年以突变体为母本、9311B为父本配制杂交组合,2019年在连云港对F1植株和F2群体进行表型观察和统计分析,利用卡方测验检验F2群体的分离比,以进行遗传分析和后续基因定位。利用分布于水稻12条染色体上的674对SSR/InDel引物,筛选9311B和之间多态性良好的标记。利用57个类病斑极端个体和11个正常个体完成基因初定位;然后在初定位区间内设计InDel标记,利用包含1363个单株的/9311B F2群体进行基因的精细定位。
利用MapMaker 3.0分析软件对所得基因型数据进行分析,并将Kosambi函数转化为遗传距离(cM),绘制遗传图谱,并对交换单株进行后代表型验证,以确保结果的可靠性。
2 结果与分析
2.1 突变体表型观察
与野生型相比,突变体苗期叶片表型正常,未出现类病斑。从分蘖初期开始,突变体基部叶片在叶尖处出现褐色小斑点,随着时间推移,病斑数量逐渐增多,病斑颜色逐渐加深,并向整株扩散,至成熟期时,整个植株似火烧状,颖壳、叶鞘等部位也出现病斑(图1-A~D)。此外,伴随病斑的出现,突变体的株高受到显著影响,通过比较成熟期野生型和突变体主茎不同节间长度,发现两者之间越靠近穗部的节间长度差距越大(图1-E、F)。
2.2 农艺性状考查
为了分析类病斑表型对植株生长发育的影响,分别调查并比较了野生型和突变体的农艺性状(表1)。结果发现,和野生型相比,突变体的株高、穗长、每穗粒数及叶片长宽都极显著降低,有效穗数和结实率也受到严重影响。值得注意的是,突变体的抽穗期和籽粒性状与野生型没有显著性差异。

图1 野生型(WT)和突变体的表型鉴定
Fig. 1. Phenotypic identification of WT plants and.
A―分蘖期野生型(WT)和突变体()植株表型,红色箭头指示出现类病斑叶片;B―分蘖期野生型(WT)和突变体()基部叶片;C―大田条件下,野生型(WT)和突变体()成熟期植株;D―野生型(WT)和突变体()成熟种子大小的比较;E~F―植株主茎穗和节间长度的比较。在A中,比例尺为5 cm;在B中比例尺为2 cm;在C和E中,比例尺为10 cm;在D中,比例尺为10 mm。
A, Plants of wild type (WT) andmutant at the tillering stage, red arrows indicate lesion mimic leaves; B, Basal leaves of wild type (WT) andat the tillering stage; C, Plants of wild type (WT) andat the mature period in field conditions; D, Comparisons of the size of mature seeds from WT andplants; E-F: Panicles and internodes of main culms. P, Panicle; I to VI indicate corresponding internodes from top to bottom. Bars =5 cm in A; 2 cm in B; 10 cm in C, E; 10 mm in D.
2.3 光合色素含量分析
在大田环境下,取突变体及野生型抽穗期叶片进行光合色素含量测定,发现突变体倒3叶、倒2叶的叶绿素a/b的比值没有显著性变化,但叶绿素a、叶绿素b、总叶绿素含量及胡萝卜素含量均显著下降,而且叶片越靠近基部光合色素含量越低(图2-B~C),表明在抽穗期突变体的叶片光合色素开始逐渐降解,进入衰老阶段,而突变体和野生型剑叶的光合色素含量没有显著差异(图2-A),因为此时突变体的剑叶平展部位尚未出现病斑,说明突变体叶片的光合色素降解是伴随着类病斑的出现而发生的。
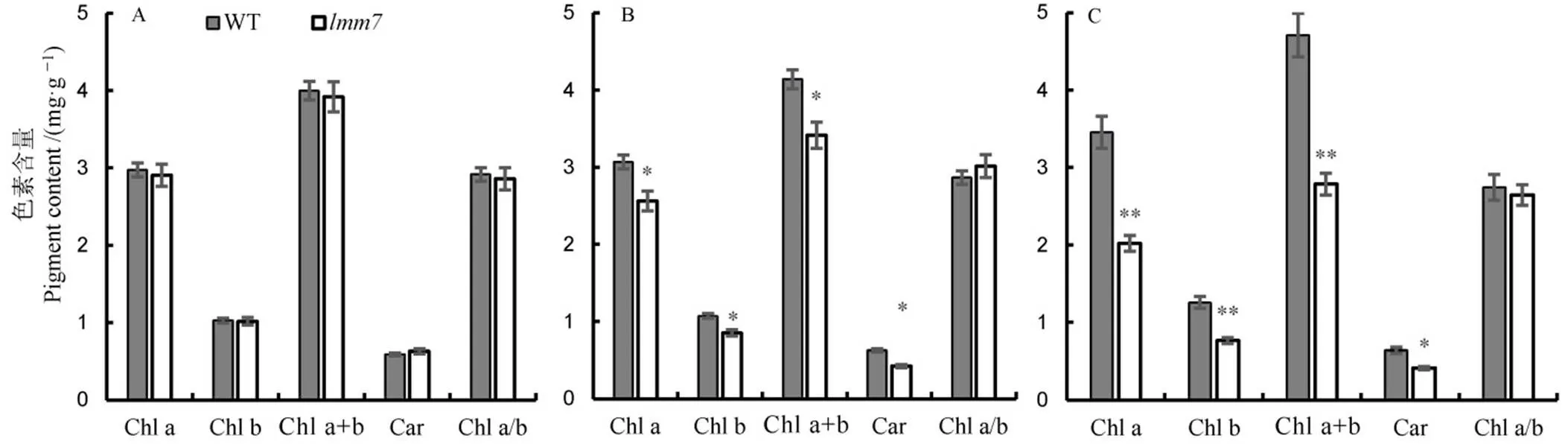
A―抽穗期野生型(WT)和突变体lmm7的剑叶光合色素含量;B―倒2叶光合色素含量;C―倒3叶光合色素含量。*在0.05水平上差异显著;**在0.01水平上差异显著。
Fig. 2. Photosynthetic pigments contents of the wild type and themutant at heading stage.
2.4 细胞超微结构观察
为了观察突变体细胞的生理变化,对突变体和野生型成熟期剑叶进行透射电镜观察。结果显示,野生型的叶肉细胞叶绿体呈椭圆形、数量较多,具有较多的淀粉粒,轮廓清晰、结构完整(图 3-B~D);突变体类病斑部位的叶肉细胞内叶绿体数量较少,细胞松弛,细胞间的空隙增大,细胞膜不同程度受损,细胞质空泡化,叶绿体的大小和形态异常,叶绿体类囊体片层结构模糊、排列疏松。此外,细胞内嗜锇小体的数量和体积显著增加(图 3-F~H)。表明随着类病斑的产生,突变体的叶肉细胞中的叶绿体结构损伤,叶绿体开始降解,致使其光合色素含量下降,进而导致植株变矮,有效穗数、穗长等农艺性状显著降低。
Fig. 3. Ultrastructure of mesophyll cells in the wild type (WT) and themutant at mature period.
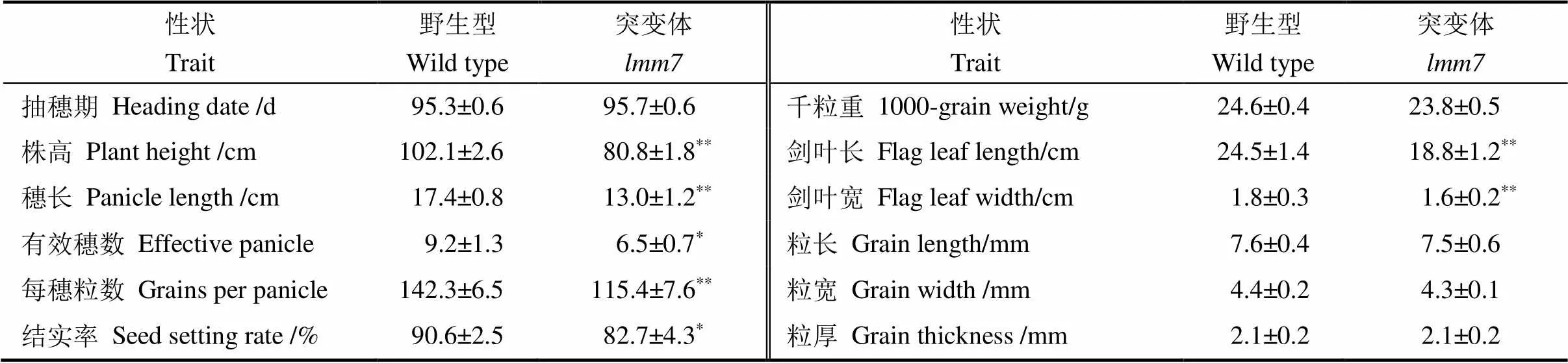
表1 野生型(WT)和lmm7突变体的农艺性状比较
表中各性状的表现以“平均值±标准差”形式呈现。星号代表检验的显著性差异(*< 0.05;**< 0.01)。
Phenotypic performance are listed as means ± standard deviation.**means significant difference at< 0.01 by-test;*means significant difference at< 0.05 by-test.
2.5 lmm7突变体表型受光照诱导
对野生型和突变体抽穗期叶片进行遮光处理后发现,突变体遮光部位未出现类病斑,邻近的未遮光部位则出现大量病斑,而野生型无论遮光与否均未出现类病斑(图4-A),说明突变体类病斑表型受光诱导或暗抑制,显示该基因可能参与了光呼吸途径,为光依赖型类病斑突变体。
2.6 活性氧水平检测
为了明确类病斑突变体中可能发生的生理生化反应,我们利用台盼蓝对突变体和野生型叶片进行染色。结果显示,突变体叶片有类病斑的部位及其周围被染成深蓝色,而野生型的叶片较少部位被染成浅蓝色,这可能是由于产生类病斑的部位发生了过敏性反应而导致细胞程序性死亡造成的(图4-B)。DAB染色结果显示,突变体的叶片上有大量褐色斑点,而野生型叶片上并未出现类似的斑点(图4-C),表明突变体在类病斑产生的过程中伴随着大量H2O2的积累,而H2O2是植物细胞程序性死亡过程中的一种重要信号分子,因此突变体类病斑的形成可能是细胞程序性死亡造成的。
2.7 抗性检测
类病斑的产生往往伴随着植株抗性的提高。为了探明突变体是否增强了植物对病原菌的抗性,分别对野生型和突变体进行水稻黑条矮缩病和稻瘟病室内人工接种鉴定。结果表明,突变体和野生型的水稻黑条矮缩病发病率没有显著差异,但相比于野生型,突变体稻瘟病的抗性水平显著提高(图5),说明基因的突变提高了植物对稻瘟病病原菌的抗性。

A―遮光处理7 d后野生型(WT)和突变体lmm7的叶片;B―野生型(WT)和突变体lmm7叶片的台盼蓝染色观察;C―野生型(WT)和突变体lmm7叶片的DAB染色观察。在A、B、C中,比例尺均为1 cm。
Fig. 4. Shading treatment and histochemical analysis of the wild type andmutant.
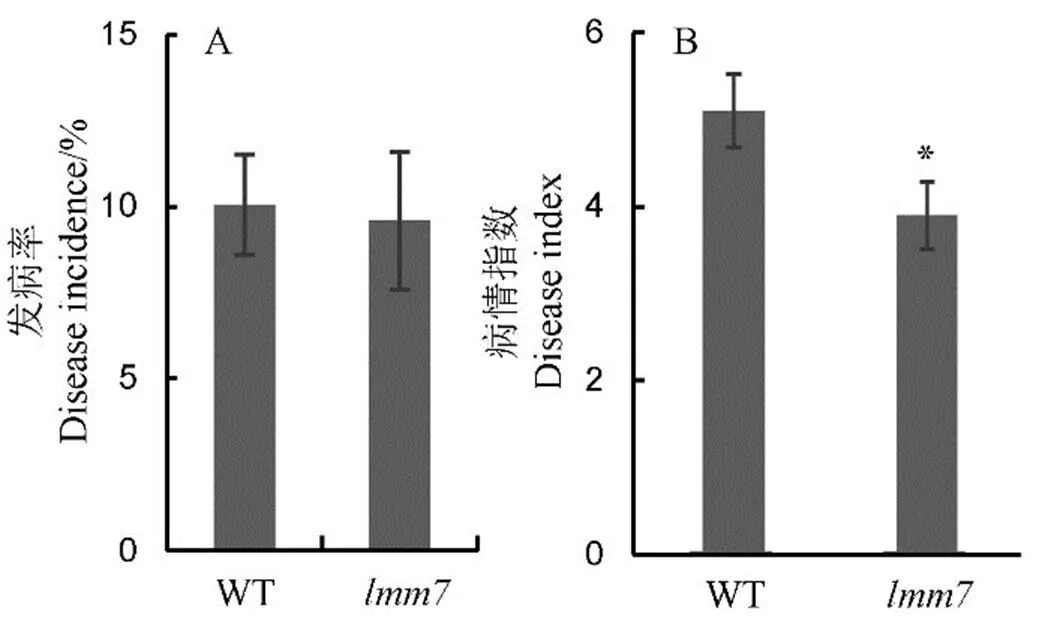
A―人工接种鉴定条件下,野生型(WT)和突变体lmm7的水稻黑条矮缩病平均发病率;B―人工接种鉴定条件下,野生型(WT)和突变体lmm7的稻瘟病病情指数。*P < 0.05(t检验)。
Fig. 5. Resistance evaluation of wild type (WT) andmutant to rice black-streaked dwarf virus disease (RBSDVD) and rice blast under artificial inoculation condition.
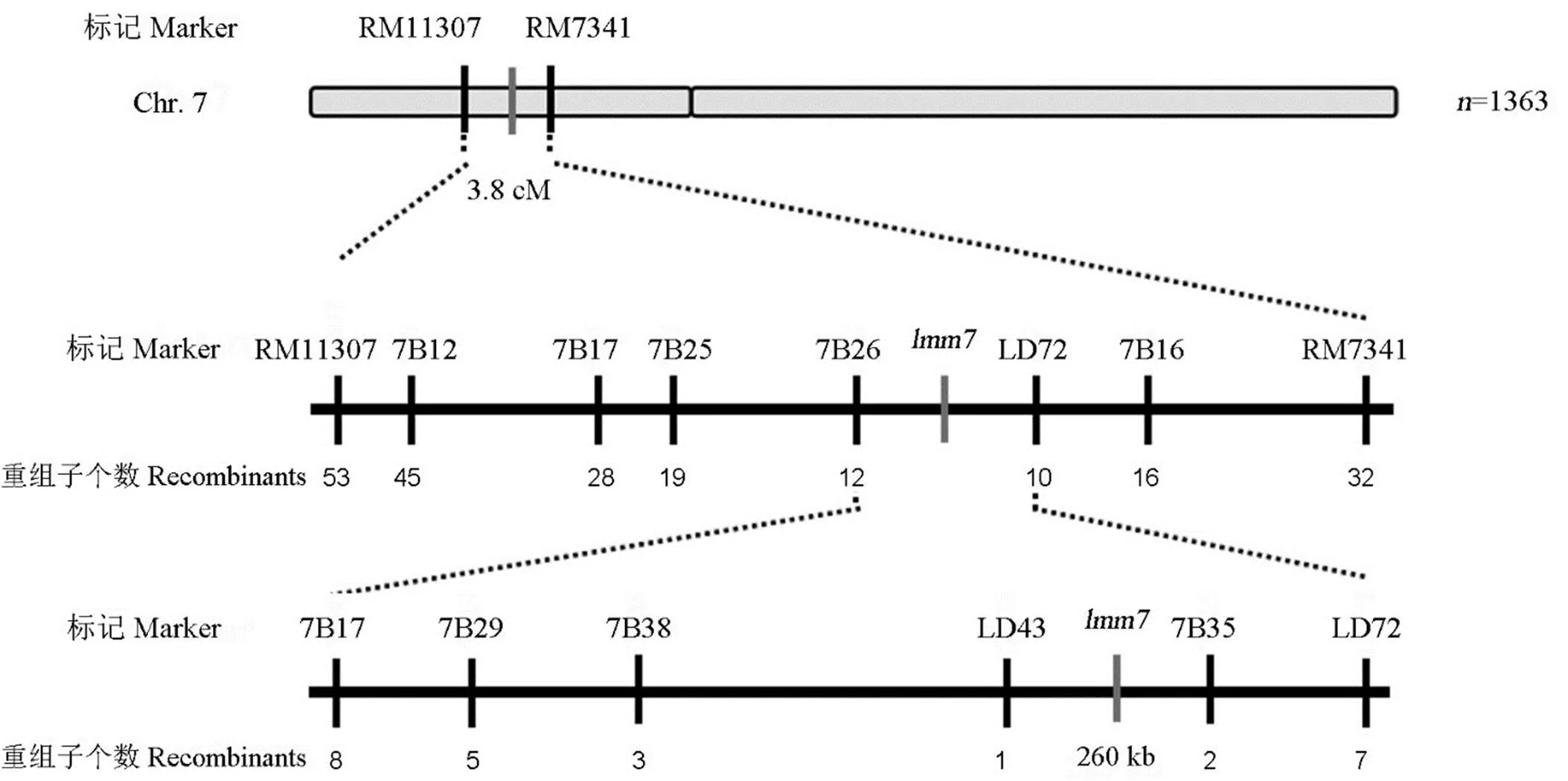
图6 lmm7基因在水稻第7染色体上的分子定位
Fig. 6. Molecular mapping ofon chromosome 7.
2.8 遗传分析及基因定位
利用突变体和9311B配制杂交组合,表型观察表明,F1植株叶片未发生类病斑,F2群体后代出现了明显的表型分离,正常株数为1000株,突变株为363株,其比值为2.76∶1,经卡方检验χ2= 0.63 <χ20.05= 3.84,符合理论上的3∶1分离比,这说明突变体的类病斑表型由单个隐性核基因控制。
利用/9311B的F2分离群体进行突变位点的定位。采用极端个体分组法,选取F2群体中的11个病斑型极端个体和11个正常个体进行连锁分析,在水稻第7染色体短臂上检测到1个显著关联位点。进一步利用46个类病斑表型单株,将目的基因初定位于水稻第7染色体的两个SSR标记RM11307和RM7341之间约3.8 cM的区间内(图6)。为了进一步缩小区间范围,利用F2群体的1363个单株,最终将基因锁定在InDel标记7B35和7B43之间,物理距离约260 kb。随后利用Gramene数据库(http://www.gramene.org)、NCBI数据库(http://www.ncbi.nlm.nih.gov)和RiceGAAS (http://ricegaas.dna.affrc.go.jp)对候选基因进行预测,在定位区间内共发现44个注释基因,其中包含已克隆类病斑基因,因此对该基因进行测序分析。结果显示,突变体中基因的第2891位碱基T缺失,导致后续移码突变,并在2956碱基位置翻译提前终止。初步推测该基因可能为控制类病斑产生的目的基因。
3 讨论
过敏性反应介导的细胞程序性死亡是植物限制病原菌侵染的一种重要防御反应,因此,在没有病原菌侵染条件下自发产生细胞凋亡的类病斑突变体是研究植物生长和免疫反应的理想材料[36]。突变体是由粳稻品系FI135胚培养过程中发现的,该突变体在水稻分蘖期时基部叶片开始产生褐色斑点,随着水稻的生长,突变体病斑的数量不断增多,颜色逐渐加深,在颖壳和叶鞘部位也出现病斑,最后整个植株呈现火烧状。尽管所有类病斑突变体都表现出自发的细胞凋亡现象,但是类病斑出现的时间却不尽相同,比如在播种10 d以后就出现淡褐色病斑[37],[38]、[39]分别在苗期和花期后叶片开始出现圆形病斑,而本研究中突变体在分蘖期基部叶片开始出现类病斑,而且不会导致植株更早产生类似病斑。因此,过敏性反应介导的细胞程序性死亡引起的类病斑依赖于一定的生长发育过程,这在拟南芥、玉米等植物的类病斑突变体中也得到印证。
是一个典型的水稻类病斑突变体,表现为光合色素含量显著下降,株高等农艺性状显著降低。电镜结果显示,叶片中的叶绿体数量较少、细胞质空泡化,叶绿体的大小和形态异常,表明该突变体叶绿体结构损伤,叶绿体开始降解,并伴随有大量的活性氧积累和细胞程序性死亡。前人研究表明随着类病斑突变体病斑的产生可能会激活植物的防御反应基因,有助于提高植物对生物或非生物的抗性,比如,()是一个转录激活因子,编码植物系统获得抗性(systemic acquired resistance, SAR)中的一个关键蛋白,的过表达能够组成性激活水稻的免疫反应,增强水稻植株对稻瘟病和白叶枯病的抗性水平,并在叶片上产生HR介导的病斑[40]。()编码一个典型的CC-NB-LRR蛋白,缺失能够组成性地自激活的R蛋白,激活SA和NPR1依赖的防御反应[41];此外,在类病斑突变体中,线粒体GTP酶相关蛋白1E (OsDRP1E) 通过控制线粒体结构和细胞色素的释放负调控细胞死亡和免疫反应,在突变体中,植株对真菌和细菌的抗性均有所增强[42]。因此,我们对突变体进行了抗性鉴定,发现基因的突变提高了水稻对稻瘟病的抗性水平,这可能是由于突变体病斑产生过程中激活了植物病程相关基因,进而引起了植物防御反应。
本研究利用/9311B F2群体进行遗传分析和基因定位,发现突变体的类病斑表型受到一个单隐性基因控制,并将基因定位于水稻第7染色体短臂两InDel标记7B35和7B43之间约260 kb范围内。目前已报道的定位于水稻第7染色体上的类病斑基因有6个,分别为[43-44]、spl[45]、[46]、[47]、[48]和[49],其中、和均位于水稻第7染色体长臂上,而位于水稻第7染色体短臂上,因此,与、和不是相同基因。spl和被定位于第7染色体短臂上,突变体spl表现出与相似的病斑症状和稻瘟病抗性水平,基因芯片显示突变体spl植株内许多病程相关基因上调表达,此外该突变体还组成性自激活SA下游信号途径,这可能是突变体spl增强稻瘟病抗性的原因,经过位置比对发现,spl与有较远的物理距离,表明两者不是同一个基因。突变体是由粳稻品种农林8号经γ射线辐射诱变而来,在播种15~20 d后,叶片出现较小的红色类病斑,区别于其他类病斑突变体,编码一个特定的剪切因子3b亚基3(SF3b3),通过调节突变体中的RNA剪切来负调控转录因子、邻氨基苯甲酸合成酶、色氨酸合酶和色氨酸脱羧酶的表达,促进5-羟色胺的积累,进而来调节细胞程序性死亡和抗性反应。经过比对,发现的定位区间内包含()。为了验证两者是否为等位基因不同位点突变导致,进行测序分析,发现突变体在基因第2891位碱基T缺失,导致后续移码突变,并在2956碱基位置翻译提前终止,导致翻译后的蛋白质失去其原有的生物学功能,引起类病斑表型出现,而的类病斑表型则是由该基因第2386位碱基G缺失引起的,因此,和互为等位基因但两者表型出现时间、病斑颜色、大小以及对农艺性状的影响都有明显区别,这可能是由于遗传背景及突变位点不同造成的。
[1] 王晨, 王备芳, 张迎信, 曹永润, 张越, 江敏, 边康吉, 张小惠, 刘群恩. 水稻类病斑突变体的鉴定与基因的精细定位[J]. 中国水稻科学, 2021, 35(4): 352-358.
Wang C, Wang B F, Zhang Y X, Cao Y R, Zhang Y, Jiang M, Bian K J, Zhang X H, Liu Q E. Identification and gene mapping of a lesion mimic mutantin rice[J]., 2021, 35(4): 352-358. (in Chinese with English abstract)
[2] Hu G, Richter T E, Hulbert S H, Pryor T. Disease lesion mimicry caused mutations in the rust resistance gene[J]., 1996, 8(8): 1367-1376.
[3] Wu C J, Bordeos A, Madamba M R S, Baraoidan M, Ramos M, Wang G L, Leach J E, Leung H. Rice lesion mimic mutants with enhanced resistance to diseases[J]., 2008, 279: 605-619.
[4] Shirsekar G S, Vega-Sanchez M E, Bordeos A, Baraoidan M, Swisshelm A, Fan J, Park C H, Leung H, Wang G L. Identification and characterization of suppressor mutants of-mediated cell death in rice[J]., 2014, 27: 528-536.
[5] Wang S, Lei C L, Wang J L, Ma J, Tang S, Wang C L, Zhao K J, Tian P, Zhang H, Qi C Y, Cheng Z J, Zhang X, Guo X P, Liu L L, Wu C Y, Wan J M., encoding an eEF1A-like protein, negatively regulates cell death and defense responses in rice[J]., 2017, 68: 899-913.
[6] Hofius D, Tsitsigiannis D I, Jones J D, Mundy J. Inducible cell death in plant immunity[J]., 2007, 17: 166-187.
[7] Dietrich R A, Richberg M H, Schmidt R, Dean C, Dangl J L. A novel zinc finger protein is encoded by thegene and functions as a negative regulator of plant cell death[J]., 1997, 88: 685-694.
[8] Hoisington D A, Neuffer M G, Walbot V. Disease lesion mimics in: I. Effect of genetic background, temperature, developmental age, and wounding on necrotic spot formation with[J]., 1982, 93(2): 381-388.
[9] Yao Q, Zhou R H, Fu T H, Wu W R, Zhu Z D, Li A L, Jia J Z. Characterization and mapping of complementary lesion-mimic genesandin common wheat[J].2009, 119: 1005-1012.
[10] Spassieva S, Hille J. A lesion mimic phenotype in tomato obtained by isolating and silencing an, homologue[J]., 2002, 162: 543-549.
[11] Wolter M, Hollricher K, Salamini F, Schulze-Lefert P. Theresistance alleles to powdery mildew infection intrigger a developmentally controlled defence mimic phenotype[J]., 1993, 239: 122-128.
[12] 张宏根, 王茂宇, 张丽佳, 胡雅, 马佳琦, 张翼帆, 汤述翥, 梁国华, 顾铭洪. 水稻类病斑突变体的鉴定和基因定位[J]. 中国水稻科学, 2016, 30(3): 239-246.
Zhang H G, Wang M Y, Zhang L J, Hu Y, Ma J Q, Zhang Y F, Tang S Z, Liang G H, Gu M H. Characterization and gene mapping of lesion mimic mutantin rice[J]., 2016, 30(3): 239-246. (in Chinese with English abstract)
[13] Buschges R, Hollricher K, Panstruga R, Simons G, Wolter M, Frijters A, Daelen R, Lee T, Diergaarde P, Groenendijk J, Topsch S, Vos P, Salamini F, Schulze-Lefert P. Thegene: A novel control element of plant pathogen resistance[J]., 1997, 88: 695-705.
[14] Jambunathan N, Siani J M, Mcnellis T W. A humidity sensitivecopine mutant exhibits precocious cell death and increased disease resistance[J]., 2001, 13: 2225-2240.
[15] Lorrain S, Lin B, Auriac M C, Kroj T, Saindrenan P, Nicole M, Balague C, Roby D. Vascular associated death1, a novel GRAM domain-containing protein, is a regulator of cell death and defense responses in vascular tissues[J]., 2004, 16: 2217-2232.
[16] Noutoshi Y, Kuromori T, Wada T, Hirayama T, Kamiya A, Imura Y, Yasuda M, Nakashita H, Shirasu K, Shinozaki K. Loss ofassociates with cell death and defense responses in[J]., 2006, 62: 29-42.
[17] Balague C, Lin B, Alcon C, Flottes G, Malmstrom S, Kohler C, Neuhaus G, Pelletier G, Gaymard F, Roby D. HLM1, an essential signaling component in the hypersensitive response, is a member of the cyclic nucleotide-gated channel ion channel family[J]., 2003, 15: 365-379.
[18] Rostoks N, Schmierer D, Mudie S, Drader T, Brueggeman R, Caldwell D G, Waugh R, Kleinhofs A.encodes the cyclic nucleotide-gated ion channel 4 homologous to the[J]., 2006, 275: 159-168.
[19] Mosher S, Moeder W, Nishimura N, Jikumaru Y, Joo S H, Urquhart W, Klessig D F, Kim S K, Nambara E, Yoshioka K. The lesion-mimic mutantshows alterations in abscisic acid signaling and abscisic acid insensitivity in a salicylic acid-dependent manner[J]., 2010, 152: 1901-1913.
[20] Wang L, Pei Z, Tian Y, He C. OsLSD1, a rice zinc finger protein, regulates programmed cell death and callus differentiation[J]., 2005, 18: 375-384.
[21] Yamanouchi U, Yano M, Lin H, Ashikari M, Yamada K. A rice spotted leaf gene,, encodes a heat stress transcription factor protein[J]., 2002, 99: 7530-7535.
[22] Zeng L, Qu S, Bordeos A, Yang C, Baraoidan M, Yan H, Xie Q, Nahm B H, Leung H, Wang G., a negative regulator of plant cell death and defense, encodes a U-box/armadillo repeat protein endowed with E3 ubiquitin ligase activity[J]., 2004, 16: 2795-2808.
[23] Qiao Y, Jiang W, Lee J, Park B, Choi M S, Piao R, Woo M O, Roh J H, Han L, Paek N C, Seo H S, Koh H J.encodes a clathrin-associated adaptor protein complex 1, medium subunit micro 1 (AP1M1) and is responsible for spotted leaf and early senescence in rice ()[J]., 2010, 185: 258-274.
[24] Kachroo P, Shanklin J, Shah J, Whittle E J, Klessig D F. A fatty acid desaturase modulates the activation of defense signaling pathways in plants[J]., 2001, 98: 9448-9453.
[25] Brodersen P, Petersen M, Pike H M, Olszak B, Skov S, Odum N, Jorgensen L B, Brown R E, Mundy J. Knockout ofencoding a sphingosine transfer protein causes activation of programmed cell death and defense[J]., 2002, 16: 490-502.
[26] Hu G, Yalpani N, Briggs S P, Johal G S. A porphyrin pathway impairment is responsible for the phenotype of a dominant disease lesion mimic mutant of[J]., 1998, 10: 1095-1105.
[27] Ishikawa A, Okamoto H, Iwasaki Y, Asahi T. A deficiency of coproporphyrinogen III oxidase causes lesion formation in[J]., 2001, 27: 89-99.
[28] Gray J, Close P S, Briggs S P, Johal G S. A novel suppressor of cell death in plants encoded by thegene of[J]., 1997, 89: 25-31.
[29] Undan J R, Tamiru M, Abe A, Yoshida K, Kosugi S, Takagi H, Yoshida K, Kanzaki H, Saitoh H, Fekih R. Mutation in, a gene encoding a protein with two double-stranded RNA binding motifs causes lesion mimic phenotype and early senescence in rice (L.)[J]., 2012, 87(3): 169-179.
[30] Wang Z, Wang Y, Hong X, Hu D, Liu C, Yang J, Li Y, Huang Q, Feng Y, Gong H, Li Y, Fang G, Tang H, Li Y. Functional inactivation of UDP-N-acetylglucosamine pyrophosphorylase 1 (UAP1) induces early leaf senescence and defence responses in rice[J]., 2015, 66: 973-987.
[31] Lichtenthaler H K. Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes[J]., 1987, 148: 350-382.
[32] Fang L K, Li Y F, Gong X P, Sang X C, Ling Y H, Wang X W, Cong Y F, He G H. Genetic analysis and gene mapping of a dominant presenescing leaf genein rice (L.)[J]., 2010, 55: 2517-2521.
[33] 刘永锋, 陆凡, 陈志谊, 吉建安, 陈毓苓, 高渊. 江苏省水稻新品种(系)对稻瘟病的抗性评价[J]. 中国水稻科学, 2002, 16(1): 96-98.
Liu Y F, Lu G, Chen Z Y, Ji J A, Chen Y L, Gao Y. Resistance evaluation of new rice varieties (lines) to rice blast in Jiangsu Province[J]., 2002, 16(1): 96-98.
[34] International Rice Research Institute. Standard Evaluation System for Rice (SES). Los Baños, Philippines: International Rice Research Institute, 2002: 14-18.
[35] Zhou T, Du L, Wang L J, Wang Y, Gao C Y, Lan Y, Sun F, Fan Y J, Wang G L, Zhou Y J. Genetic analysis and molecular mapping of QTLs for resistance to rice black-streaked dwarf disease in rice[J]., 2015, 5: 10509.
[36] Zhu X B, Ze M, Chen M S, Chen X W, Wang J. Deciphering rice lesion mimic mutants to understand molecular network governing plant immunity and growth[J]., 2020, 27(4): 278-288.
[37] 奉保华, 杨杨, 施勇烽, 林璐, 陈洁, 黄奇娜, 魏彦林, LEUNG H, 吴建利. 水稻淡褐斑叶突变体的遗传分析与基因定位[J]. 中国水稻科学, 2012, 26(3): 297-301.
Feng B H, Yang Y, Shi Y F, Lin L, Chen J, Huang Q N, Wei Y L, Leung H, Wu J L. Genetic analysis and gene mapping of a light brown spotted leaf mutant in rice[J]., 2012, 26(3): 297-301. (in Chinese with English abstract)
[38] 王建军, 朱旭东, 王林友, 张利华, 薛庆中, 何祖华. 水稻类病斑突变体的生理与遗传分析[J]. 植物生理与分子生物学学报, 2004, 30(3): 331-338.
Wang J J, Zhu X D, Wang L Y, Zhang L H, Xue Q Z, He Z H. Physiological and genetic analysis of lesion resembling disease mutants () ofL[J]., 2004, 30(3): 331-338. (in Chinese with English abstract)
[39] Yoshimura A, Ideta O, Iwata N. Linkage map of phenotype and RFLP markers in rice[J]., 1997, 35: 49-60.
[40] Chern M, Xu Q F, Bart R S, Bai W, Ruan D L, Sze-To W H, Canlas P E, Jain R, Chen X W, Ronald P C. A genetic screen identifies a requirement for cysteine-rich- receptor-like kinases in rice()-mediated immunity[J]., 2016, 12(5): e1006049.
[41] Tang J Y, Zhu X D, Wang Y Q, Liu L C, Xu B, Li F, Fang J, Chu C C. Semi-dominant mutations in the CC-NB-LRR-type R gene,, lead to constitutive activation of defense responses in rice[J]., 2011, 66: 996-1007.
[42] Li Z Q, Ding B, Zhou X P, Wang G L. The rice dynamin related protein OsDRP1E negatively regulates programmed cell death by controlling the release of cytochrome c from Mitochondria[J]., 2017, 13(1): e1006157.
[43] Chen X F, Pan J W, Cheng J, Jiang G H, Jin Y, Gu Z M, Qian Q, Zhai W X, Ma B J. Fine genetic mapping and physical delimitation of the lesion mimic gene() in rice (L.)[J]., 2009, 24(4): 387.
[44] Chen X F, Hao L, Pan J W, Zheng X X, Jiang G H, Jin Y, Gu Z M, Qian Q, Zhai W X, Ma B J., a cell death and defense related gene, encodes a putative splicing factor 3b subunit 3 (SF3b3) in rice[J]., 2012, 30(2): 939-949.
[45] Babu R, Jiang C J, Xu X, Kottapalli K R, Takatsuji H, Miyao A, Hirochika H, Kawasaki S. Isolation, fine mapping and expression profiling of a lesion mimic genotype,splthat confers blast resistance in rice[J]., 2011, 122: 831-854.
[46] Li Z, Zhang Y, Liu L, Liu Q, Bi Z, Yu N, Cheng S, Cao L. Fine mapping of theand() in rice ()[J]., 2014, 80: 300-307.
[47] 夏赛赛, 崔玉, 李凤菲, 谭佳, 谢园华, 桑贤春, 凌英华. 水稻类病斑早衰突变体的表型鉴定与基因定位[J]. 作物学报,2019, 45(1): 46-54.
Xia S S, Cui Y, Li F F, Tan J, Xie Y H, Sang X C, Ling Y H. Phenotypic characterizing and gene mapping of aand() mutant in rice (L.)[J]., 2019, 45(1): 46-54. (in Chinese with English abstract)
[48] 郭丹, 施勇烽, 王惠梅, 张晓波, 宋莉欣, 徐霞, 贺彦,郭梁, 吴建利. 一个水稻显性斑点叶突变体的鉴定和基因精细定位[J]. 作物学报, 2016, 42(7): 966-975.
Guo D, Shi Y F, Wang H M, Zhang X B, Song L X, Xu X, Guo L, Wu J L. Characterization and gene fine mapping of a rice dominant spotted-leaf mutant[J]., 2016, 42(7): 966-975. (in Chinese with English abstract)
[49] Sun L T, Wang Y H, Liu L L, Wang C M, Gan T, Zhang Z Y, Wang Y L, Wang D, Niu M, Long W H, Li X H, Zheng M, Jiang L, Wan J M. Isolation and characterization of amutant with early leaf senescence and enhanced defense response in rice[J]., 2017, 7: 41846.
Phenotypic Identification and Gene Mapping of a Lesion Mimic Mutantin Rice
SUN Zhiguang1, DAI Huimin2, CHEN Tingmu1, LI Jingfang1, CHI Ming1, ZHOU Zhenling1, LIU Yan1, LIU Jinbo1, XU Bo1, XING Yungao1, YANG Bo1, LI Jian1, LU Baiguan1, FANG Zhaowei1, WANG Baoxiang1, *, XU Dayong1, *
(1Lianyungang Academy of Agricultural Sciences/Jiangsu Collaborative Innovation Center for Modern Corp Production, Lianyungang 222006, China;2Lianyungang Productivity Promotion Center, Lianyungang 222006, China;*Corresponding author, E-mail: wbxrice@163.com; xudayong3030@sina.com)
【Objective】The study of lesion mimic mutants (LMMs) is helpful to understand the interaction between growth and defense response in plants.【Method】We herein reported a novel() derived from arice variety FI135 by embryo culture. For deciphering the effect ofon plant growth, phenotype and agronomic traits were compared between the wild type (WT) andplants. The ultrastructure of mesophyll cells and histochemical characterization was done in WT andplants. Evaluation of WT andwas observed for resistance to pathogens was employed to explore the underlying effect ofon plant defense response. An F2population derived from the cross betweenmutant and 9311B was used for genetic analysis and gene mapping.【Result】The seedlings ofwere normal at the seedling stage, but the basal leaves began to exhibit brown spots at the initial tillering stage, which then spread to the whole plant, and the number of mosaic spots increased along with the development ofplants. Compared with the wild type, agronomic traits including plant height, panicle length, effective panicle number, grain number per panicle, and seed setting rate were significantly decreased in themutant. However, no significant difference in seed traits and heading date was observed between WT andplants. The shading assay indicated that lesion formation inwas induced by light. The mesophyll cells ofmutant were seriously chlorotic, and the photosynthetic pigment contents of the mutant were significantly decreased at the heading stage. Histochemical analysis showed that a large amount of hydrogen peroxide (H2O2) accumulated at the lesion sites. The observation with a transmission electronic microscope (TEM) demonstrated that the number of chloroplasts in mesophyll cells ofplants was decreased, the lamellar structure of chloroplasts was seriously damaged, and osmiophilic granules were obviously increased in the mutant. Moreover, the levels of reactive oxygen species (ROS) were increased in the internal and surrounding regions of the lesions. Theplants displayed higher resistance to rice blast compared to the wild type. Genetic analysis revealed that inthe mutation was controlled by a single recessive gene. Using a map-based cloning strategy,was narrowed down to a 260 kb region between InDel markers 7B35 and 7B43 on the short arm of chromosome 7 in rice. Sequencing analysis revealed that a deletion of T base at 2891 nucleotide position occurred in the DNA sequence of, resulting in a frame-shift mutation and a premature stop codon.【Conclusion】The results reveal the target gene is allelic to, and the mutation ofenhances resistance to rice blast, while it curbs the growth and development ofplants.
L.; lesion mimic mutants; phenotypic identification; gene mapping
10.16819/j.1001-7216.2022.210711
2021-07-30;
2021-08-30。
现代农业技术体系建设专项资金资助项目(CARS-01-61); 江苏省农业重大品种创制计划资助项目(PZCZ201704); 江苏省自然科学基金面上项目(BK20201214); 苏北科技专项(LYG-SZ201930, LYG-SZ202040); 连云港市财政专项资金资助项目(QNJJ1902, QNJJ2001)。

