高压电烧伤合并肢体血管损伤治疗10年回顾性分析
贾伟,刘建龙,覃凤均,田轩,蒋鹏,程志远,周也平,王成
(北京积水潭医院 1.血管外科 2.烧伤科,北京 100035)
我国烧伤年发病率约为1.5%~2%,每年因烧伤死亡的人数仅次于交通事故,排在第2 位。我国高压电烧伤患者例数约占总烧伤患者例数的10%[1-2],美国等发达国家每年电烧伤的患者占全部烧伤患者的3%~5%[3]。尽管近几十年来烧伤的总体诊治有了很大进展,但是高压电烧伤尤其是重度高压电烧伤的患者,截肢率高达24%~49%[4-5],远期的生活质量和身体状况也要差于其他烧伤患者[5-6],因此高压电烧伤的诊治是目前国内外关注的焦点之一。高压电烧伤不同于其他烧伤的特点在于:电流通过人体,有明显的入口和出口。病例统计中,入口多数位于上肢,出口常常位于潮湿的部位,如腋窝、腹股沟或者足底。电烧伤不仅导致皮肤烧伤,入口和出口之间的深层组织如:肌肉、肌腱、神经、血管、骨骼、内脏器官都可能受损,造成广泛、立体的损伤,有“外浅内深、口小底大”的特点[7]。血液是电的良导体,电流沿血液传播,范围远远大于体表的烧伤范围,会造成广泛血管内皮细胞进行性变形、坏死,血管容易发生延迟损伤破裂[8]。高压电烧伤后漏诊血管损伤,缺血逐渐加重会导致肢体远端组织失去血液灌注和进行性坏死[9],如何通过影像学及时准确地判断是否存在血管损伤也是急诊医生面临的难题[10]。本研究回顾北京积水潭医院近10年来接诊高压电烧伤合并动脉损伤患者资料,旨在对不同血管重建方式及其并发症进行分析,为治疗提供参考和依据。
1 资料与方法
1.1 临床资料
选取2010年1月—2020年1月间因高压电烧伤在北京积水潭医院住院治疗的患者。纳入标准:⑴肢体或躯干发生III 度以上高压电烧伤;⑵患者肢体有急性缺血表现;⑶患者出现无诱因创面突发或迟发大出血。排除标准:⑴I~II 度高压电烧伤;⑵低压电烧伤;⑶高压电烧伤后由于坠落、跌倒等原因导致骨折而发生的血管损伤。根据上述纳入标准和排除标准,收治高压电烧伤合并血管损伤的94 例患者;男83 例,女11 例(男女比例7.5∶1);年龄7~72 岁,平均(30.4±20.1)岁;受伤至入院2 h 至12 d,平均13.4 h;受伤部位上肢80 例(腋动脉损伤12 例、肱动脉损伤19 例,腕部动脉损伤49 例),下肢14 例(股动脉损伤7 例,腘动脉损伤3 例,小腿动脉损伤4 例)。
1.2 治疗方法
患者入院后评估一般状态,给予生命支持,维持生命体征稳定,评估各器官功能。影像学检查明确存在血管损伤后急诊行手术治疗。术中如局部有肉眼可见的变性组织如焦痂、肌腱、肌肉、神经、血管等则进行彻底清创,直至显露有活力组织。探查动脉损伤段,游离远近端至结构完整内膜光滑的正常血管。切除失活段动脉,根据血管缺损程度、局部创面感染情况,选择不同的血管重建方式:直接局部修补血管、大隐静脉或人工血管重建。动脉重建后使用自体皮瓣或负压吸引材料覆盖创面。术后如发生延迟损伤破裂出血或假性动脉瘤,依据患者情况和出血部位选择再次切开血管重建或介入置入覆膜支架。合并大静脉损伤的患者,应同期重建静脉。术后给予抗感染、抗凝、扩血管治疗。高压电烧伤动脉诊治流程见图1。
1.3 观察指标
观察术后患者肢体血运改善情况,2 周内有无感染、血栓形成、迟发破裂出血、假性动脉瘤等并发症,随访3~6 个月后肢体血运情况及功能状况。
2 结果
2.1 手术结果
94 例患者中,7 例入院时肢体严重毁损,广泛肌肉、神经、肌腱或骨关节坏死,虽有血管损伤但无保肢可能,行截肢术。87 例完成血管修复,29 例行局部修补术,53 例采用自体血管重建,5 例采用人工血管材料重建,技术成功率100%。完成血管修复的患者中,术后2 周发生急性血栓形成共11 例,均行了动脉切开取栓术恢复肢体血运。延迟破裂出血/假性动脉瘤共7 例(图2A),局部修补患者发生2 例,行切开止血自体/人工血管重建各1 例(图2B);自体血管重建患者发生4 例,切开止血再次重建1 例,介入置入覆膜支架3 例;人工血管重建患者发生迟发破裂大出血1 例,行介入置入覆膜支架。因术后感染截肢3 例,均在自体血管重建患者中(表1)。
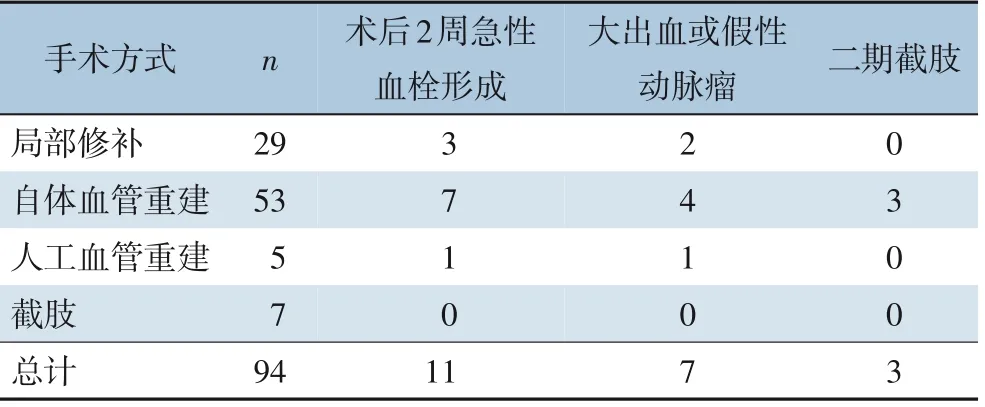
表1 手术方式及术后并发症(n)Table 1 Surgical procedures and complications(n)
2.2 随访结果
75 例患者获随访3~6 个月,重建血管通畅率89.3%(67/75),所有患者患肢未因缺血出现功能障碍(图3)。
3 讨论
3.1 高压电烧伤合并动脉损伤的诊断
不能根据动脉外膜是否完整来评估有无动脉损伤。电流经过血管传导时,电能量沿着含水量丰富、电阻最低的部位传导,通过热损伤和电化学作用造成双重损伤,血管内膜是血管壁结构中电阻最低的部分,损伤会由内层向外层传递,因此血管内壁最为明显,而外膜损伤较内膜轻[11]。术前可使用彩色多普勒超声、血管造影、MRA、CTA 评估血管损伤情况,术中探查可直接观察到有无动脉损伤[12-14]。探查时发现动脉灰白色、无波动、无血流、血栓形成,可以明确有血管损伤;如动脉暗红色、肿胀、弹性差,即使血管内有血流也要高度怀疑血管损伤,及时评估血管内膜情况(图4)。
3.2 血管重建方式
高压电烧伤患者入口多发生在上肢,以腕部为主,所以腕部血管损伤最多见,文献[15-17]报道的截肢部位也是腕部比例最高。出口多在潮湿的腋下、腹股沟或足底,所以下肢动脉血管损伤的概率也不低[18]。腕部血管纤细,周围神经、肌腱较多,血管损伤范围相对局限(<1 cm),血管修复一般以局部修补为主。损伤段>1 cm,没有直接吻合的条件,则应进行血管桥接,桥接血管材料首选自体血管[19]。本组患者中,我们对股动脉等中大血管使用人工血管材料进行重建,也取得了良好的效果。在5 例人工血管重建的患者中,1 例发生术后血栓形成,1 例出现迟发破裂出血,没有因为移植物感染导致的截肢,与自体血管重建相比,无明显差异。人工血管材料节省了自体血管取材的时间,对于及时恢复肢体血运而言,要优于自体血管材料。另外,人工血管材料避免了自体血管可用长度不够的弊端,可以使清创更为彻底。笔者认为,无论使用何种材料,重建前都要彻底清创,清除坏死组织及损伤的血管段,这是减少术后并发症的关键。
3.3 迟发破裂出血或假性动脉瘤
电烧伤导致的血管损伤可能出现在任何一个时期,甚至在烧伤后10 d 以后才出现明显的临床症状[20]。早期发现血管可能通畅,但是迟发内膜损伤后形成附壁血栓,导致血栓形成和远端肢体缺血。动物实验发现电烧伤血管损伤有迟发性血管损伤[21],受损组织的细胞变性并不是只发生在烧伤早期。严重烧伤后大量炎性介质的生成和释放,继而发生细胞内溶酶体膜被破坏,纤溶、凝血系统被启动激活,造成广泛的血管内皮炎症。而这会使在烧伤初期对损伤血管范围的评价出现偏差。电烧伤后4~7 d 炎症因子释放达到高峰,往往患者会在伤后1 周左右出现迟发大出血问题,从而使病情恶化[22]。有学者[23]认为血管吻合位置应距损伤区3~5 cm 以上,本研究中心的经验是初次手术时剪除受损血管“宁长勿短”,能避免二次开放手术带来的感染风险。本组患者中有7 例发生术后迟发性破裂出血或假性动脉瘤,究其原因均与剪除受损血管不彻底有关。
3.4 腔内介入治疗
腔内介入技术近年来发展迅速,在血管损伤的治疗中已有大量的应用[24-25],也在烧伤合并血管损伤患者中尝试[26],但是高压电烧伤合并血管损伤的病例尚无报道。本组4 例迟发破裂出血或假性动脉瘤形成患者,采用腔内介入治疗,均取得了良好的效果。高压电烧伤的动物实验[27]发现,即使肉眼下大致正常的动脉,3~7 d 时显微镜下发现全层退变,此时动脉内血流通畅,但是内膜、中膜和弹力膜空泡样变,血管周围炎性浸润,此时血管吻合手术成功率低。提示临床上如果发生迟发破裂出血或假性动脉瘤,再次手术可能需要清除更多的组织和血管。本研究中心的经验是,怀疑患者有迟发破裂出血或假性动脉瘤时行动脉造影,明确诊断的同时置入覆膜支架,起到迅速控制出血,避免再次开放手术增加感染风险,是损伤小、并发症更少的微创方法。但介入手术的不足在于无法判断受损血管范围,覆膜支架可能仍无法完全覆盖病变血管,有再次发生破裂出血风险。
3.5 创面感染与覆盖
高压电烧伤导致的血管损伤与其他创伤导致的血管损伤不同,皮肤及皮下组织烧伤后,深层组织(神经、血管、肌肉)失去了天然抗感染屏障[28]。随着时间的推移,暴露在外界环境中的创面会感染机会逐渐增加。烧伤复苏后有>60%的患者发生感染,早期以革兰氏阳性球菌为主,随后革兰氏阴性杆菌逐渐增多,真菌感染也开始出现[29]。残留坏死组织往往会出现坏死、液化、感染,导致血管吻合失败甚至截肢,本组自体血管重建中有3 例患者因术后发生严重感染,导致血管重建失败而截肢。因此,在血管重建前必须进行彻底清创是关键。创面覆盖也是避免术后感染的重要步骤之一,电烧伤损伤范围大,组织缺损广泛,应尽量选择能提供较大组织量、血供好的游离皮瓣或肌皮瓣进行修复、覆盖创面,利用血运丰富的组织瓣促进创面愈合可控制感染。手术结束时使用转移皮瓣或负压吸引装置覆盖创面,能有效抑制细菌的生长,加速引流,促进水肿液回吸收,增加创面血流,促进细胞增殖、组织修复和肉芽组织生长[30]。
综上所述,电烧伤导致的血管损伤具有特殊性、毁损性、跳跃性和迟发性。临床上应该早期准确评估受损范围并尽快手术重建血运,彻底清创的前提下可以使用自体血管或人工材料重建。腔内介入治疗有一定的优势,但是尚需积累病例。
利益冲突:所有作者均声明不存在利益冲突。

