产PVL金黄色葡萄球菌对奶牛乳腺上皮细胞内质网应激和自噬的影响
海珍珍,范永鑫,马小霞,马海娟,张东涛,周学章
(1 宁夏大学 生命科学学院 西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021;2 吉林大学 生命科学学院,吉林 长春 130015)
奶牛乳腺炎是兽医临床常见病,由多种微生物引起,目前从患病奶牛奶样中分离出的病原微生物已达150多种,涉及细菌、病毒、支原体等种类,其中细菌以金黄色葡萄球菌、大肠杆菌和停乳链球菌为主[1]。金黄色葡萄球菌是一种兼性胞内寄生菌,有报道称5%~50%的奶牛乳腺炎由金黄色葡萄球菌感染所致[2],其能够分泌α或β溶血素、杀白细胞素、超级抗原、蛋白酶A等多种免疫逃避因子,通过黏附、定殖、入侵的方式引起宿主细胞不同程度的损伤。PV-杀白细胞素(Panton-Valentine leukocidin,PVL)是金黄色葡萄球菌分泌的一种双组分成孔毒素,其可与宿主细胞表面的特异性受体结合,形成一环状结构的八聚体并在宿主细胞膜上形成孔道,进而损伤细胞,导致细胞内环境稳态失衡并最终裂解[3]。近年来PVL基因在患乳腺炎奶牛乳汁中的检出率逐渐升高,寿何庆等[4]分离的277株临床金黄色葡萄球菌菌株中,15.5%携带PVL基因;2021年陈婷婷等[5]调查了甘肃省部分地区牛源金黄色葡萄球菌常见毒力因子的分布情况,其中PVL基因阳性菌株率为14.3%。可见金黄色葡萄球菌PVL在导致奶牛乳腺炎发生过程中起着重要作用。
内质网应激是真核细胞普遍存在的应激-防御机制,自噬则是真核细胞内相对保守的降解机制,研究表明,二者相互影响,与炎症和疾病的发展密切相关[6]。本课题组前期研究发现,产PVL金黄色葡萄球菌、PVL基因缺失(ΔPVL)金黄色葡萄球菌和体外重组PVL(rPVL)均能引起奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)的凋亡,但由于PVL蛋白表达水平的差异,产PVL菌株引起的BMECs凋亡率和坏死率明显高于ΔPVL株[7]。陆娟等[8]研究表明,表达PVL的金黄色葡萄球菌可诱导人THP-1单核细胞自噬和凋亡。关于产PVL金黄色葡萄球菌在BMECs中是否会加剧细胞内质网应激和自噬目前尚未见报道。本试验用产PVL金黄色葡萄球菌菌株ATCC49775、ΔPVL49775和rPVL感染BMECs,初步探究PVL对BMECs内质网应激和自噬程度的影响,以期为完善金黄色葡萄球菌及PVL感染BMECs的致病机制提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 菌株与细胞 产PVL金黄色葡萄球菌标准菌株ATCC49775,购自美国典型菌种保存中心;PVL基因缺失金黄色葡萄球菌菌株ΔPVL49775,由哈尔滨兽医研究所张万江研究员课题组提供。奶牛乳腺上皮细胞系,由山东农业大学生命科学学院提供。
1.1.2 主要试剂 体外重组PV-杀白细胞素(rPVL),由宁夏大学生命科学学院周学章教授课题组原核表达并纯化保存;胰蛋白胨大豆肉汤(TSB)和胰蛋白胨大豆琼脂(TSA),均购自青岛海博生物公司;DMEM-High Glucose培养液、胰蛋白酶EDTA溶液(2.5 g/L胰蛋白酶,0.2 g/L EDTA,酚红),均购自以色列BI公司;胎牛血清(FBS),购自美国Gibico公司;BCA蛋白含量检测试剂盒、CCK-8细胞增殖-毒性检测试剂盒、全蛋白提取试剂盒,均购自南京凯基生物公司;超敏化学发光检测试剂盒,购自上海雅酶生物公司;PVDF膜,购自美国Millipore公司;细胞自噬染色检测试剂盒(MDC法)、溶葡萄球菌酶、4 g/L多聚甲醛,均购自北京索莱宝生物公司;兔抗CHOP、GRP78、LC3-Ⅱ、ATG5、Beclin 1、p62以及鼠抗GAPDH一抗,均购自江苏亲科生物公司;辣根过氧化物酶标记的山羊抗兔、山羊抗鼠二抗,均购自北京中杉金桥生物公司;蛋白Maker(14~120 ku)、6×Protein Loading Buffer,均购自北京全式金生物公司。
1.2 试验方法
1.2.1 金黄色葡萄球菌的培养 将金黄色葡萄球菌菌株ATCC49775与ΔPVL49775划线接种于TSA平板培养基后,于37 ℃ 恒温培养箱中过夜培养,挑取单菌落于TSB液体培养基,放置于37 ℃、120 r/min恒温摇床中纯培养。当细菌处于对数生长期时,离心(5 000 r/min,5 min)收集菌体,1×PBS清洗2次,最后用DMEM-High Glucose培养液调整细菌密度为后续试验所需密度。
1.2.2 BMECs的复苏与培养 将完全培养基预热并在超净工作台中吸取适量于离心管中,将冻存于液氮罐中的BMECs迅速取出,立即置于37 ℃无菌水浴锅中轻轻晃动使其快速融化。待细胞完全融化后转移至离心管中离心(1 000 r/min,5 min)洗涤,去除有毒物质,此步骤重复2次。最后一次离心结束后移去上清液,加入1 mL完全培养液重悬后接种于细胞培养皿中,放置于37 ℃、5%(体积分数)CO2以及完全湿度的培养箱中培养。培养期间,用倒置显微镜观察细胞的生长状况及形态,当细胞生长至 80%~90% 汇合时进行消化传代,如未达到所需细胞量,每48 h更换1次新鲜培养基继续培养。
1.2.3 试验设计与处理 (1)金黄色葡萄球菌胞内感染BMECs模型的建立。用2.5 g/L胰酶消化细胞,1 000 r/min离心5 min,收集细胞沉淀,用不含双抗的完全培养基重悬,用细胞计数仪计数。按4.0×105孔-1的量将细胞接种于六孔板,过夜贴壁培养后,消化1孔细胞重新计数,将其余孔的细胞培养液弃去,用无菌1×PBS清洗细胞3次后,加入用DMEM调整好细菌密度的ATCC49775或ΔPVL49775菌悬液(感染复数=30),置于二氧化碳培养箱中培养,分别感染3和6 h。3 h感染组正常收样,6 h感染组在细菌感染3 h后,用含溶葡萄球菌酶(10 mg/L)的DMEM培养液处理细胞12 min,杀死未入侵到细胞内的细菌,最后再更换为DMEM培养液继续培养3 h,此步骤是为了保持3和6 h细菌感染组入侵细胞的细菌数目一致,备检。
(2)rPVL感染BMECs模型的建立。将BMECs按5.0×105孔-1的量接种于六孔板,过夜培养后,根据本课题组前期研究结果,用100 ng/mL rPVL分别处理1,3和6 h,备检。试验以正常BMECs为空白对照组(CK)。
1.2.4 自噬体的荧光显微镜观察 单丹磺酰尸胺(dansylcadaverine,MDC )是一种荧光色素,为嗜酸性染色剂,常用作自噬体的特异性标记染色剂。将上述建模的BMECs按2.0×105孔-1的量接种于提前放置好爬片的六孔板中过夜培养。去除培养液,用1×Wash buffer清洗细胞,用4 g/L多聚甲醛于4 ℃固定15 min,1×Wash buffer清洗后用MDC染色15 min,用1×Wash buffer清洗3次,每次5 min,将细胞爬片倒置于载玻片上,用荧光显微镜进行观察(激发滤光片波长355 nm,阻断滤光片波长512 nm)并拍照。
1.2.5 内质网应激和自噬相关蛋白相对表达量的测定 弃去上述模型细胞六孔板中的旧培养液,使用1 mL预冷的无菌1×PBS洗涤2次,向六孔板中滴加70 μL Lysis Buffer(按照凯基全蛋白提取试剂盒说明配制)后将其置于冰上,慢速摇床上振荡30 min裂解细胞;随后用细胞刮刀将细胞从六孔板底部刮下来收集到1.5 mL EP管中,置于冰上,在摇床上振荡30 min使其充分裂解,4 ℃下12 000 r/min 离心10 min,将上清(细胞全蛋白提取物)转移至新的1.5 mL EP管中,备用。以GAPDH为内参蛋白,采用Western blot法检测BMECs内质网应激相关蛋白(CHOP和GRP78)和自噬相关蛋白(LC3-Ⅱ、ATG5、Beclin1和p62)的相对表达量。用BCA试剂盒测定各组全蛋白浓度后,使用Lysis Buffer和6×蛋白缓冲液调整全蛋白质量浓度为2 μg/μL,金属浴中放置10 min使蛋白充分变性。振荡混匀后进行SDS-PAGE电泳、转膜;转印后的PVDF膜用5 g/L脱脂牛奶封闭1 h,1×TBST洗5次,每次6 min;加入稀释好的一抗4 ℃过夜孵育,1×TBST洗5次,每次6 min;室温下用二抗孵育1 h,1×TBST洗5次,每次6 min;最后加入超敏ECL发光液检测目的蛋白,使用Image J软件进行灰度分析。
1.3 数据分析
所有试验均重复3次,数据均以“平均值±标准误”表示。所获数据采用SPSS 22.0分析软件中的One-way ANOVA进行单因素方差分析。
2 结果与分析
2.1 金黄色葡萄球菌对BMECs自噬体荧光强度的影响
由图1可知,ATCC49775、ΔPVL49775感染BMECs的蓝色荧光强度均极显著(P<0.01)高于CK;处理时间相同时,ATCC49775感染BMECs自噬体的荧光强度均极显著(P<0.01)高于ΔPVL49775感染的BMECs。表明金黄色葡萄球菌感染可以加剧BMECs自噬体的生成,且PVL可以增强金黄色葡萄球菌的毒性作用。

ΔPVL 49775 3 h、ΔPVL 49775 6 h分别代表ΔPVL 49775感染后3和6 h处理,ATCC49775 3 h、 ATCC49775 6 h分别代表ATCC49775感染后3和6 h处理,图3,4同。图柱上标**表示与CK差异极显著(P<0.01),标##表示同一处理时间ATCC49775处理与ΔPVL 49775处理差异极显著(P<0.01)
2.2 rPVL对BMECs自噬体荧光强度的影响
由图2可知,rPVL处理BMECs的蓝色荧光强度均极显著高于CK(P<0.01);随着时间的延长,rPVL处理BMECs的自噬体荧光强度逐渐下降。上述结果表明,rPVL感染可以加剧BMECs自噬体的形成,但随着时间的延长,BMECs可以逐步修复rPVL带来的损伤。
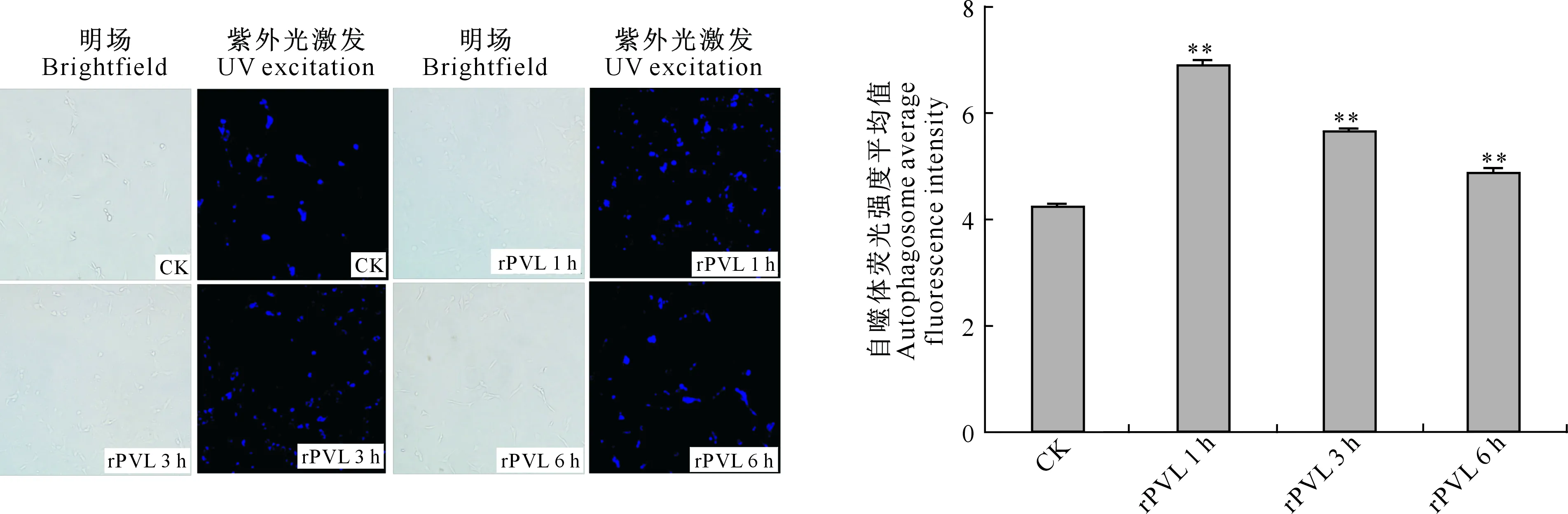
rPVL 1 h、 rPVL 3 h、 rPVL 6 h分别代表rPVL作用1,3和6 h处理,图5,6同图柱上标**表示与CK差异极显著(P<0.01)
2.3 金黄色葡萄球菌对BMECs内质网应激和自噬相关蛋白表达的影响
由图3、图4和表1可知,ATCC49775、ΔPVL49775感染后大部分时间,BMECs内质网应激相关蛋白(CHOP和GRP78)和自噬相关蛋白(LC3-Ⅱ、ATG5、Beclin1和p62)的表达水平显著(P<0.05)或极显著(P<0.01)高于CK;ATCC49775感染BMECs内质网应激和自噬相关蛋白的表达水平均显著(P<0.05)或极显著(P<0.01)高于ΔPVL49775感染的BMECs,说明金黄色葡萄球菌感染可以加剧BMECs的内质网应激和自噬程度,且PVL可以增强BMECs内质网应激和自噬的程度。

图3 金黄色葡萄球菌感染(MOI=30)BMECs后内质网应激相关蛋白的电泳结果
2.4 rPVL对BMECs内质网应激和自噬相关蛋白表达的影响
由图5、图6和表2可知,rPVL处理后大部分时间BMECs内质网应激相关蛋白(CHOP和GRP78)和自噬相关蛋白(LC3-Ⅱ、ATG5、Beclin1和p62)的表达水平极显著(P<0.01)高于CK,说明rPVL加剧了BMECs内质网应激和自噬的程度。

图5 rPVL(质量浓度100 ng/mL)处理后BMECs内质网应激相关蛋白的电泳结果

图6 rPVL(质量浓度100 ng/mL)处理后BMECs自噬相关蛋白的电泳结果

表2 rPVL(质量浓度100 ng/mL)对BMECs内质网应激和自噬相关蛋白相对表达量的影响
3 讨 论
内质网主要负责蛋白质折叠和蛋白质的质量控制、脂质合成和钙储存[9]。在一些病理、逆境或生理(如细胞ATP水平波动、Ca2+失衡、缺氧、病毒感染、炎性细胞因子刺激、营养剥夺和环境毒素等)条件下,会引起内质网稳态丧失,蛋白折叠能力降低,最终导致内质网腔内未折叠蛋白聚集,诱发其内质网应激,进而影响各种生物过程,如增殖、代谢、炎症、自噬和细胞凋亡[10]。自噬是一种高度保守的基本细胞过程,通过循环利用有缺陷的细胞器或蛋白质来维持细胞内环境的稳定,自噬也可以通过各种先天性和适应性免疫机制来消除细胞内病原体,保护宿主细胞免受侵害[11]。研究发现,内质网应激与自噬之间存在相互作用,内质网应激可以通过PI3K/AKT/mTORC和AMPK/TSC/mTORC1途径诱导自噬[12-13]、内质网中的Ca2+也可调控自噬[14]。
金黄色葡萄球菌是一种兼性胞内病原体,可入侵多种类型的宿主细胞,如内皮细胞和成骨细胞,是奶牛乳腺炎的主要致病菌,其分泌的多种毒力因子在菌体逃逸宿主细胞的免疫反应中起重要作用,最终与宿主细胞共生[15]。有研究表明,金黄色葡萄球菌可通过小菌落突变的表型转换,使菌体生长缓慢,毒力因子表达减少,新陈代谢速度减慢,从而不致引起强烈的宿主细胞反应,使得抗生素类药物难以将其清除[16-17]。有研究发现,表达黏附作用相关因子如Agr的金黄色葡萄球菌能抑制自噬体成熟,这有利于金黄色葡萄球菌从自噬体逃逸至细胞质中,进而导致宿主细胞死亡[18-20]。Mestre等[21]研究表明,α-溶血素能够诱导细胞发生自噬,但并不能将LC3蛋白招募到含有细菌的自噬体中,这是一条非经典的自噬途径。施岚等[22]研究发现,PVL S组分LukS-PV在AML细胞THP-1和HL-60中通过下调SET8抑制细胞增殖。葡萄球菌杀白细胞素,尤其是PVL,可导致人骨髓白细胞溶解,特别是最成熟的髓源性白细胞[23]。可见金黄色葡萄球菌及其产生的毒素可从多方面对宿主细胞的生存造成威胁。
Beclin1蛋白对于自噬的启动不可或缺,其可与 PI3KC3 形成复合物,参与自噬体形成与成熟;ATG5复合物和LC3负责协同启动自噬体膜的延伸,在自噬体逐步成熟过程中,LC3Ⅱ蛋白也会稳定存在于自噬体膜上;p62是一种选择性自噬接头蛋白,可与LC3Ⅱ直接结合并被自噬体包裹降解,通常可以通过p62蛋白表达的降低和 LC3Ⅱ蛋白表达的升高判断细胞自噬是否被激活[24]。Shaukat等[25]研究表明,金黄色葡萄球菌在RAW264.7细胞中可以激活内质网应激。
本研究中,使用产PVL金黄色葡萄球菌和ΔPVL金黄色葡萄球菌感染BMECs后,细胞自噬体荧光强度极显著升高,内质网应激相关蛋白和自噬相关蛋白的表达水平均显著高于空白对照,说明金黄色葡萄球菌可加剧BMECs内质网应激反应及自噬。陆娟等[8]使用表达 PVL 的MRSA(MRSAPVL+)和不表达 PVL的MRSA(MRSAPVL-)感染人THP-1 细胞,发现MRSAPVL+对THP-1细胞的P13K/AKT/mTOR信号通路抑制作用更强,可促进ATG12/ATG7/ATG5自噬通路活化,增加THP-1细胞自噬;同时,MRSAPVL+诱导THP-1细胞ROS增加,促进细胞凋亡。本研究结果显示,产PVL金黄色葡萄球菌和PVL基因缺失金黄色葡萄球菌均能引起BMECs内质网应激和自噬,但是产PVL金黄色葡萄球菌引起的BMECs内质网应激和自噬的效应显著强于PVL基因敲除株,且rPVL处理也可显著上调BMECs内质网应激和自噬相关蛋白的表达,该结果与陆娟等[8]的研究结果相似,证实PVL的表达可以增强金黄色葡萄球菌的毒力。

