番木瓜果实酵母双杂交文库的构建及CpMYB114L互作蛋白的筛选
周陈平,杨 敏,郭金菊,邝瑞彬,杨 护,黄炳雄,魏岳荣
(广东省农业科学院 a 果树研究所,农业农村部南亚热带果树生物学与遗传资源利用重点实验室,广东省热带亚热带果树研究重点实验室,b 设施农业研究所,广东 广州 510640)
番木瓜(CaricapapayaL.)果实属于典型的呼吸跃变型果实,对低温敏感,不适宜冷藏运输,果实进入破色期后会快速转黄、软化,进而达到生理成熟并迅速腐烂,严重影响果实商品品质和货架期,导致30%~60%的果实失去经济价值[1-4]。因此,开展延缓番木瓜果实成熟与衰老、延长果实贮藏期的研究,对促进番木瓜产业发展、提高其经济效益具有重要意义[5]。
R2R3-MYB转录因子的N端含有保守R2R3序列结构域,主要与目标基因结合;C端为非保守序列,具有调节蛋白质活性的作用[6]。R2R3-MYB转录因子在植物细胞分化、激素应答及次级代谢物、花青苷和类胡萝卜素合成等方面起到重要作用,是调控果实成熟的重要转录因子[7-8]。目前在苹果、香蕉、梨、番茄、桃、葡萄、草莓、柑橘等作物上已开展了关于R2R3-MYB转录因子的研究。在猕猴桃中,AdMYB7通过激活番茄红素β-环化酶(LCY-β)的表达来调控果实成熟过程中胡萝卜素的积累[9]。在番茄中,SlMYB72同时调控果实类胡萝卜素、叶绿素和类黄酮的代谢[10]。据Meng等[11]研究报道,与野生型番茄相比,R2R3-MYB转录因子SlAN2的基因过表达可使转基因番茄果实中乙烯生成量升高、类胡萝卜素积累增加、果实软化加快,从而导致果实提早成熟。Yao等[12]通过QTL技术在梨果实中克隆到与花青苷合成相关的候选基因PyMYB114,该基因编码蛋白能够与PyERF3和PyHLH3互作,共同调控梨果实花青苷的合成,表明PyMYB114转录因子通过乙烯信号路径参与调控梨果实成熟。然而,苹果R2R3-MYB转录因子MdMYB1调控果实成熟的机理与梨有所不同,当苹果果实进入成熟阶段,乙烯响应因子MdEIL1能够直接结合MdMYB1启动子,激活该基因表达,正向调控苹果着色;同时,MdMYB1又可通过正向反馈直接调控乙烯合成相关基因MdERF3的表达,促进乙烯合成,从而加快苹果成熟进程[13]。上述研究结果表明,R2R3-MYB转录因子可能通过乙烯信号通路参与调控果实成熟,但在不同物种中的调控路径存在一定差异。
本研究从前期完成的番木瓜4个不同成熟期果实的转录组中,选取一个与果实成熟相关的R2R3-MYB型转录因子,命名为CpMYB114L,通过扩增CpMYB114L基因的CDS区,对其进行生物信息学分析,并构建酵母双杂交诱饵载体pGBKT7-CpMYB114L,利用酵母双杂交技术从番木瓜果实cDNA文库中筛选与CpMYB114L互作的蛋白,以期探究CpMYB114L参与调控番木瓜果实成熟的分子机制。
1 材料与方法
1.1 试验材料
以广东省农业科学院果树研究所选育的番木瓜‘GZBG’品种两性株为研究对象,于2018年定植,采用常规栽培技术进行管理,植株生长状态健康良好。参照周陈平等[14]的方法,于2020年9月21日采集表皮无损伤、大小均匀的绿熟期(GS)、破色期(CB)、熟化期(HY)和腐熟期(FY)果实为试验材料。每个时期取样3个,取果实中间部位的果肉10 g,切成小块,用液氮速冻后贮存于-80 ℃超低温冰箱中备用。
1.2 CpMYB114L基因CDS区的克隆与分析
前期从番木瓜不同成熟期果实的转录组中筛选出一个与果实成熟相关的转录因子,在NCBI(https://www.ncbi.nlm.nih.gov/)官方网站上进行blast比对后分析其同源性,最终命名为CpMYB114L(NCBI登录号:XM_022042529.1)。
果实样品在液氮保护下研磨后,采用Trizol法提取总mRNA,利用Evo M-MLV反转录试剂盒(艾科瑞生物,中国)反转录得到cDNA,用软件Pri-mer Premier 5设计CpMYB114L基因CDS区特异克隆引物,上游引物CpMYB114L-F为5′-ATGGGAGGAGCTGCATGGAC-3′,下游引物CpMYB114L-R为5′-TCACAATGTTCCATTCCACAAATC-3′。以合成的cDNA为基础模板,用PrimerStar Max DNA Polymerase(Takara,日本)扩增该基因的CDS区,用1%琼脂糖凝胶电泳验证,回收条带胶。回收产物连接到pMD19-T载体上,热激法将重组载体转化DH5α大肠杆菌感受态,接种于LB固体培养基,挑选单克隆进行PCR鉴定,将阳性克隆菌液送至上海生工测序比对。用ExPasy(https://web.expasy.org/protparam/)在线工具预测CpMYB-114L蛋白的基本理化性质,用MEGA-X软件对CpMYB114L蛋白序列进行同源性比对。
1.3 酵母文库的构建
按Oligotex mRNA Kits试剂盒(Qiagen,德国)说明书步骤分离纯化mRNA,按Supscript double stand cDNA Kit试剂盒(Invitrogen,美国)说明书步骤将纯化后的mRNA反转录合成双链cDNA,三框attB1重组接头与cDNA连接,使用1%琼脂糖凝胶电泳分离和收集1 000 bp以上的双链cDNA。将双链cDNA与pGADT7载体进行all-direct重组,转化大肠杆菌DH10B感受态,取转化后细菌原液10 μL稀释100倍后,取10 μL涂布于LB平板(含Amp+)上进行库容量鉴定,库容量(CFU/mL)=平板上的克隆数/10 μL×1 000倍×1×103μL,总库容量(CFU)=库容量×文库菌液总体积(mL)。从平板中随机挑取24个单克隆菌落进行PCR鉴定,分析其插入片段的长度和重组率。
1.4 诱饵载体pGBKT7-CpMYB114L的构建
根据CpMYB114L基因CDS区的cDNA序列,分别在其两端添加SfiⅠ的酶切位点序列设计扩增引物,上游引物CpMYB114L-S-F为5′-AAGGCCATTACGGCCATGGGAGGAGCTGCATGG-AC-3′,下游引物CpMYB114L-S-R为5′-CCGGCCGAGGCGGCCTCACAATGTTCCATTCCACA-AATC-3′。以pMD19-T-CpMYB114L为模板,扩增CpMYB114L基因的cDNA片段,扩增方法按TransStart FastPfu DNA Polymerase试剂盒(全式金,中国)说明书进行。扩增产物和载体经SfiⅠ酶切后,将酶切产物用1%琼脂糖凝胶电泳检测并回收,利用DNA Ligation Kit(TOYOBO,日本)将克隆连接到pGBKT7载体(上海宝吉生物技术有限公司)。将连接产物转化至大肠杆菌Top10感受态上,涂布于LB平板(含Kan+),随机挑选6个单克隆菌落进行PCR检测,测序后进行序列比对,验证pGBKT7-CpMYB114L诱饵载体是否构建成功。
1.5 诱饵蛋白pGBKT7-CpMYB114L的自激活检测
以pGADT7-LARGET/pGBKT7-p53为阳性对照组、pGADT7-LARGET/pGBKT7-LAMINC为阴性对照组、pGADT7/pGBKT7-CpMYB114L为自激活检测组,分别共转化酵母受体菌AH109。用500 μL 0.1 mol/L LiAc重悬菌体,取5 μL重悬液稀释40倍,分别涂布于SD/-Trp/-Leu(SD/-TL)缺陷型固体培养基上,30 ℃培养4 d,从生长出的转化子中随机挑选6个菌落点板于SD/-TL+X-α-Gal和SD/-Trp/-Leu/-His/-Ade(SD/-TLHA)2种缺陷型固体培养基上,30 ℃恒温培养4 d,观察其生长状态。
1.6 酵母双杂交文库转化效率的测定与CpMYB-114L互作蛋白的筛选
用含有正确pGBKT7-CpMYB114L诱饵质粒的AH109酵母转化子作为受体菌制备感受态,取25 μg酵母双杂交文库质粒转入其中,用8 mL无菌水重悬菌体,分别取20 μL重悬液稀释10,100和1 000倍,将20 μL稀释液涂布于SD/-Trp/-Leu/-His(SD/-TLH)+5 mmol/L 3-AT缺陷型固体培养基上,分别标记为A、B和C,30 ℃恒温培养3 d后,观测转化效率。转化总数量(TNT)=(平板A上的克隆数/20+平板B上的克隆数/2+平板C上的克隆数/0.2)×1/3×8 000;转化效率(TE/μg)=TNT/25 μg。用无菌绒布影印清除筛库平板背景菌落,继续培养7 d;从筛库平板中挑取阳性克隆单菌落,转接到SD/-TL固体培养基中培养3 d;挑选初始转化子点种至SD/-TL+X-α-Gal和SD/-TLHA缺陷型固体培养基上,30 ℃恒温培养3 d;挑选阳性克隆提取质粒,送至上海生工测序,将测序结果在NCBI官方网站上进行blast比对,确定互作蛋白的CDS序列区域。
1.7 互作蛋白的回转验证及其功能分类
将26种阳性克隆质粒分别转化含有正确pGBKT7-CpMYB114L诱饵质粒的AH109酵母转化子感受态,以进行回转试验,转化方法同1.6节。通过在NCBI网站上进行比对,对26个阳性克隆编码蛋白进行功能分类及功能预测。
1.8 互作蛋白在番木瓜不同成熟期果实中的表达
通过前述试验,筛选到与CpMYB114L互作的4类蛋白,利用前期的番木瓜果实转录组数据,对4类蛋白基因在番木瓜不同成熟期果实中的表达量进行分析。
2 结果与分析
2.1 番木瓜果实的总RNA提取与cDNA的合成
提取‘GZBG’4个不同成熟时期果实样品的总RNA(图1),有明显的28S和18S rRNA条带,用Oligotex mRNA Kits分离纯化得到mRNA,将mRNA反转录获得双链cDNA,用于后续的CpMYB114L转录因子CDS区的克隆和建库。

GS.绿熟期;CB.破色期;HY.熟化期;FY.腐熟期
2.2 CpMYB114L基因的克隆与生物信息学分析
通过分析番木瓜4个不同成熟时期果实转录组数据中的转录因子,选出与果实成熟相关的转录因子CpMYB114L,其表达量随果实成熟逐渐上升,而在腐熟期略有下降(图2),这与番木瓜果实成熟过程中呼吸速率先跃变上升后再下降的变化趋势一致。
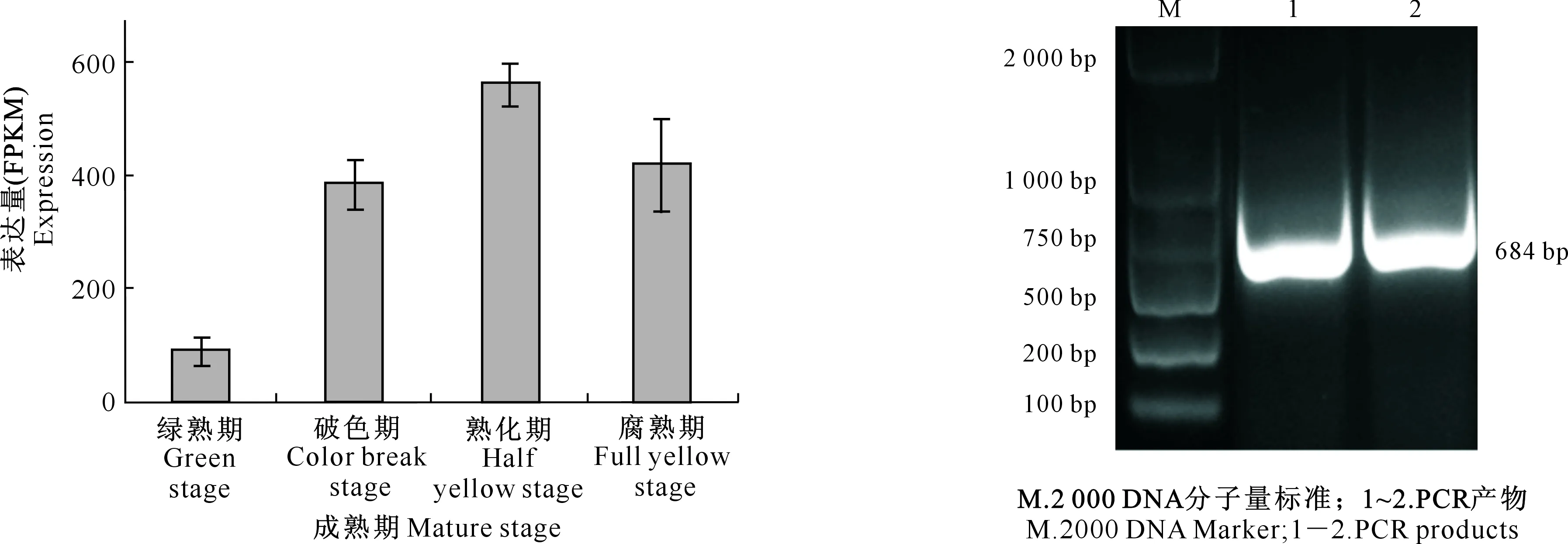
图2 CpMYB114L在番木瓜不同成熟期果实中的表达量
利用特异引物对CpMYB114LCDS区进行PCR扩增,测序结果显示CpMYB114L基因的CDS区长度为684 bp(图3),编码227个氨基酸,预测其相对分子质量为26 304.3,理论等电点为6.23,亲水性总平均值为-0.893。
将CpMYB114L基因编码的蛋白序列输入拟南芥(https://www.arabidopsis.org/)、番茄(https://solgenomics.net/)、柑橘(https://www.citrusge-nomedb.org/)、苹果和甜樱桃(https://www.rosaceae.org/)等物种的信息资源网站及NCBI官方网站进行序列比对,获得34个同源基因的蛋白序列。利用MEGA-X软件对这35个蛋白序列进行同源性分析,采用最大似然法构建进化树,结果(图4)显示,CpMYB114L转录因子与拟南芥、番茄、柑橘等的同源性较远,与甜樱桃(PaWERL)、蒺藜苜蓿(MtMYB1)、黧豆(MpMYB113)、大豆(GmMYB1)和苹果(MdMYB308L)的同源性较近。
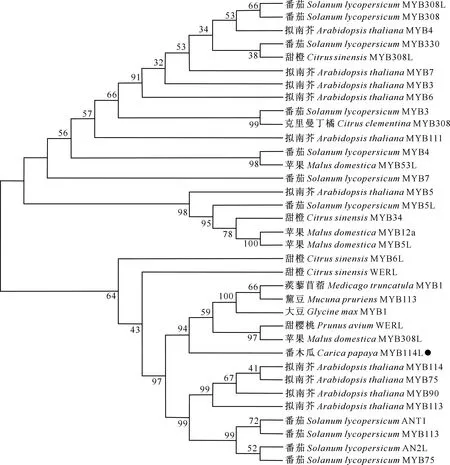
图4 CpMYB114L编码蛋白序列的同源性比对
2.3 番木瓜果实酵母双杂交文库的构建与鉴定
将合成的双链cDNA与pGADT7载体进行all-direct重组,转化大肠杆菌,取10 μL转化后的细菌原液稀释100倍,取10 μL涂布于LB平板(含Amp+),共获得230个克隆,进一步计算可知库容量为2.3×106CFU/mL,总库容量为1.15×107CFU。从平板中随机挑选24个单克隆菌落进行PCR检测,1%琼脂糖凝胶电泳检测结果(图5)显示,插入片段长度为750~2 000 bp,无空载,重组率为100%,满足文库要求,可用于文库筛选试验。

M.5 000 DNA分子量标准;1~24.PCR产物
2.4 诱饵载体pGBKT7-CpMYB114L的构建
以pMD19-T-CpMYB114L为模板,用加酶切位点的CpMYB114L-S-F/R引物扩增CpMYB114L的CDS区,1%琼脂糖凝胶电泳检测结果表明扩增产物在正确位置。将扩增产物酶切后与pGBKT7载体连接,转化大肠杆菌,涂布于LB平板(含Kan+)过夜培养,随机挑选6个单克隆进行PCR菌落扩增后,经1%琼脂糖凝胶电泳检测及测序比对,其结果与CpMYB114L基因CDS序列完全一致(图6),说明pGBKT7-CpMYB114L诱饵载体构建成功。

M.5 000 DNA分子标准;1~6.PCR产物
2.5 诱饵载体pGBKT7-CpMYB114L的自激活检测
图7表明,pGADT7-LARGET/pGBKT7-p53阳性对照、pGADT7-LARGET/pGBKT7-LAMINC阴性对照和pGADT7/pGBKT7-CpMYB114L自激活检测组均能在SD/-TL+X-α-Gal缺陷型平板上生长,而仅有阳性对照还可在SD/-TLHA缺陷型平板上生长,pGADT7/pGBKT7-CpMYB114L转化子在2种平板上的生长状态与阴性对照相同,说明pGBKT7-CpMYB114L不存在自激活。

pGADT7/pGBKT7-CpMYB114L.自激活检测组;pGADT7-LARGET/pGBKT7-p53.阳性对照;pGADT7-LARGET/pGBKT7-LAMINC.阴性对照
2.6 pGBKT7-CpMYB114L筛选文库的转化效率
将25 μg文库质粒转入含有正确pGBKT7-CpMYB114L诱饵质粒的AH109酵母转化子感受态,分别取20 μL重悬液稀释10,100和1 000倍,取20 μL稀释液涂布于SD/-TLH+5 mmol/L 3-AT平板上,得到克隆总数分别为1 336,121和9个(图8),转化总数量为4.59×105,转化效率为1.83×104/μg,文库转化效率满足要求,可进行下一步互作蛋白的筛选。

图8 pGBKT7-CpMYB114L筛选文库的转化效率
2.7 CpMYB114L互作蛋白的筛选及其回转验证与功能分类
为了消除背景生长菌落的干扰,在培养到第3天时,用无菌绒布影印清除筛库平板的背景菌,继续培养7 d,从平板中挑取30个阳性单克隆菌落,转接到SD/-TL+X-α-Gal和SD/-TLHA缺陷型平板中,以pGADT7-LARGET/pGBKT7-p53为阳性对照、pGADT7-LARGET/pGBKT7-LAMINC为阴性对照,30 ℃培养3 d,结果由图9可以看出,这30个初始阳性克隆均能同时激活HIS3、ADE2和MEL1报告基因。

1~30.筛选的阳性克隆的编号;+.阳性对照;-.阴性对照
对30个阳性克隆进行测序后,除去重复序列和无法获得序列的克隆,最终得到26个序列长度不同的蛋白编码基因。将这26个pGADT7-互作蛋白质粒分别转化含pGBKT7-CpMYB114L诱饵质粒的AH109酵母受体菌以进行回转验证,结果显示仅24号阳性克隆在SD/-TL+X-α-Gal平板中不能激活MEL1报告基因,且在SD/-TLHA平板上生长较弱,其他25个阳性克隆均生长正常。
在NCBI网站上进行序列比对的结果显示,这26个互作阳性克隆编码蛋白包括酰基辅酶A硫酯酶13(acyl-coenzyme A thioesterase 13,Acots13)、乙烯响应受体1(ethylene response sensor 1,ERS1)、热休克蛋白42(heat shock protein 42,HSP42)和叶绿体转运子159(translocase of chloroplast 159,TOC159) 4类蛋白,其在互作阳性克隆中的占比分别为15.4%,73.1%,7.7%和3.8%(表1)。生物学功能预测结果显示,CpAcots13主要催化酰基辅酶A水解为游离脂肪酸和辅酶A(CoASH),调节细胞内酰基辅酶A、游离脂肪酸和CoASH的水平;CpERS1(CDS序列全长为1 914 bp)具有HisKA(位于CDS序列1 036~1 233 bp区域)和HATPase(位于CDS序列1 372~1 764 bp区域)激酶结构域,参与乙烯信号转导的调控;CpHSP42主要保护细胞免受盐胁迫的损害;CpTOC159参与识别细胞质中的光合前体蛋白,并将其转入叶绿体。CpAcots13、CpERS1、CpHSP42和CpTOC-159与CpMYB114L互作的CDS序列区域分别为102~567,859~1 751,304~1 033和615~1 451 bp。

表1 酵母双杂交文库筛选获得的与CpMYB114L互作的蛋白
2.8 与CpMYB114L互作的候选蛋白基因在番木瓜不同成熟期果实中的表达
由图10中4类蛋白基因在番木瓜不同成熟期果实中的表达量分析结果可以看出,CpHSP42(LOC110815119)在破色期和熟化期果实中表达量剧增,而后急速下降;CpERS1(LOC110808109)的表达量随果实成熟先逐渐上升,最后下降,这与CpMYB114L的表达模式一致;CpAcots13(LOC110819429)的表达量与果实成熟呈正相关;CpTOC159(LOC110821515)的表达量在破色期剧增后趋于平稳。

GS.绿熟期;CB.破色期;HY.熟化期;FY.腐熟期
3 讨 论
R2R3-MYB转录因子参与众多的生物过程,在植物生长发育、次生代谢、胁迫响应等方面起到重要的调控作用[15-17]。在有关R2R3-MYB型转录因子互作蛋白筛选的研究中,四季秋海棠BsMYB62基因受低温和高光强诱导表达,酵母双杂交筛选出12个互作蛋白[18];西瓜中响应低温胁迫的MYB(Cla007586)转录因子,通过筛选文库获得13个互作蛋白[19];花生参与干旱及高盐胁迫响应的基因AhMYB44,在筛选文库中与16个蛋白相互作用[16]。本研究从cDNA文库中共筛选出26个互作阳性克隆,分为4类蛋白,分别包括CpERS1、CpAcots13、CpHSP42和CpTOC159,功能包括乙烯信号转导、酰基辅酶A水解、盐胁迫响应和光合相关前体蛋白转运。
ERS1是人们最早从模式植物拟南芥中分离出的5个乙烯受体家族成员之一,根据受体结构的相似性,ERS1和ETR1属于亚家族Ⅰ,ETR2、EIN4和ERS2属于亚家族Ⅱ[20]。ERS1定位于内质网膜上,具有组氨酸激酶和丝氨酸/苏氨酸激酶活性,可以与CTR1结合,在乙烯信号转导中起到主要作用,是调控果实成熟的主要乙烯受体之一[21-23]。当利用1-MCP处理果实后,1-MCP与ERS/ETR乙烯受体结合,同乙烯竞争乙烯受体上的金属离子结合位点,阻断乙烯所诱导的果实成熟信号转导,进而延长果实货架期[24-26]。本研究中,CpERS1在番木瓜果实中的表达量随着果实成熟度上升而逐渐上调,该结果与草莓、芒果、梨等果实ERS1的表达结果一致[27-30]。目前对于乙烯受体的研究主要集中在ETR1基因上,通过对拟南芥ers1突变体的研究表明,ERS1基因的作用与ETR1相似,但其在乙烯受体信号转导中的生化机制及调控机制尚未完全阐明[31]。
有关MYB转录因子互作蛋白的研究报道中,MYB转录因子通常与EILs、ERF等乙烯信号转导通路的下游调控因子互作,共同参与调控果实成熟[12-13,32]。本研究结果表明,CpMYB114L转录因子与乙烯受体CpERS1的C端(含HisKA和HATPase激酶结构域)互作。因此推测,CpERS1通过磷酸化CpMYB114L蛋白上的氨基酸使其活化,进而启动与果实成熟相关的分子调控反应,但这还需通过磷酸化蛋白鉴定试验进一步明确。本研究利用酵母双杂交技术,初步鉴定MYB与ERS1之间具有关联性。因此,本研究对进一步开展番木瓜果实CpMYB114L的功能研究及分子调控机制,丰富和完善乙烯信号转导通路相关基因在果实成熟过程中的作用机理具有一定的指导意义。

