2-氨基吡啶类双核铜(Ⅱ)配合物的合成、晶体结构及性质
佟 萍 吴江萌 徐 萍 王晓莹 李海南 王 城 杨斯淇 周嘉荟 许瑞波
(江苏海洋大学药学院,连云港 222005)
关键字:双核铜(Ⅱ)配合物;氨基吡啶;晶体结构;电化学性质;生物活性
铜(Ⅱ)离子是生物体不可或缺的一种必需微量元素,具有内源生物相容性;作为酶的重要辅助因子,铜(Ⅱ)离子在酶发挥其生物功能时起到关键作用[1-3]。Cu(Ⅱ)半径较小,可呈现+1、+2、+3三种氧化态,具有很强配位能力,易与N、O等原子配位形成结构稳定、配位模式多样的单核、多核铜配合物[4]。铜配合物的脂溶性比Cu(Ⅱ)离子好,更容易通过细胞膜发挥生物学功能[5-6]。近年来,国内外利用过渡金属配合物开发新型金属基药物的兴趣日益浓厚,尤其是铜配合物的相关报道很多。研究表明,铜配合物具有优良的抗菌[7]、抗病毒[8]、抗氧化[9]等生物活性,同时,也可以调节分子与靶点之间的特异性相互作用,从而降低螯合效应引起的毒性[10]。因此,在医学上被广泛用来探索其对各种疾病的治疗[11-14]。
吡啶环上氮原子具有一对定域孤对电子,易与不同金属离子配位,配位后不仅可以稳定不同氧化态的金属离子[15],而且构建的吡啶配合物结构繁多、功能各异,在临床、分析、催化等领域具有很好应用前景[16]。由于一些铜配合物具有催化活化小分子化合物性能,而且生物体中许多酶的活性部位含有双核铜结构单元,因此,设计含有吡啶环的双核铜配合物具有重要意义。基于此,我们分别以3-甲基-2-氨基吡啶(L1)、5-溴-2-氨基吡啶(L2)为配体,设计、合成了2个具有笼状结构的双核铜吡啶配合物1、2,利用多种手段对其结构进行表征。采用琼脂平板扩散抑菌法和DPPH(1,1-二苯-2苦基肼)法初步研究了1和2抑菌活性和抗氧化能力,并采用循环伏安(CV)法研究其电化学性质。
1 实验部分
1.1 实验试剂及仪器
L1、L2、无水醋酸铜、无水乙醇、1,1-二苯-2苦基肼自由基(DPPH·)、营养琼脂培养基及其他溶剂等均为市售分析纯试剂,直接使用。大肠杆菌(E.coli)、金黄色葡萄球菌(S.aureus)、枯草芽孢杆菌(B.subtilis)等菌种均为江苏海洋大学药学院实验室自行保存。
主要仪器:SGW X-4型显微熔点测定仪(上海精密科学仪器有限公司)、Nicolet-iS10型傅里叶红外光谱仪(Thermo Fisher Scientific 公司)、UV-Vis 2550型紫外分光光度计(日本岛津公司)、F-7000荧光光谱仪(日本日立公司)、Bruker Smart-1000单晶衍射仪(德国BRUKER公司)、CHI 660E电化学工作站(上海辰华仪器公司)。
1.2 配合物合成
1.2.1 配合物[Cu2(CH3COO)4(L1)2](1)的合成
将无水醋酸铜(0.181 6 g,1 mmoL)与乙醇(15 mL)加入圆底烧瓶,80℃水浴搅拌溶解,再加入L1(0.216 3 g,2 mmoL),反应2 h,冷却至室温,过滤。在滤液中加入氯仿(2~3 mL),置于烧杯中静置,待溶剂缓慢挥发后析出蓝色晶体,过滤。将晶体用少量乙醇淋洗、干燥,产率为52.3%。m.p.>290℃。FT-IR(KBr,cm-1):3 465(m),3 357(m),2 977(w),1 627(m),1 606(s),1 477(s),1 460(s),1 434(s),1 353(m),1 199(s),795(m),764(m),680(s),630(m),474(m)。 HRMS(ESI):C20H29Cu2N4O8([M+H]+)的m/z计算值579.057 7,实测值579.055 3。
1.2.2 配合物[Cu2(CH3COO)4(L2)2](2)的合成
将L1换为L2(0.348 g,2 mmoL),其余步骤与1的制备相同,得到蓝色晶体,产率约为57%。m.p.>290 ℃。FT-IR(KBr,cm-1):3 451(m),2 976(w),1 631(s),1 600(s),1 481(w),1 433(m),1 354(m),1 262(w),1 138(m),1 067(m),955(m),866(m),82(w),669(m),624(w),540(w),526(w)。HRMS(ESI):C18H22Br2Cu2N4O8([M+2]+)的m/z计算值707.839 6,实测值707.219 1。
1.3 晶体结构测定
分别选取尺寸为0.15 nm×0.14 nm×0.12 nm(1)、0.18 nm×0.16 nm×0.14 nm(2)的单晶置于BRUKER SMART 1000 CCD单晶衍射仪上,用石墨单色化的MoKα(λ=0.710 73 nm)射线,以ω-2θ扫描方式,于296(2)K下测定。全部强度数据还原在Bruker SAINT程序上进行。以Lp因子修正数据,晶体结构采用SHELX-97软件由直接法解出,理论加氢,全部非氢原子的坐标和各向异性热参数经全矩阵最小二乘法修正收敛。详细晶体学数据见表1,部分键长和键角数据见表2。

表2 配合物1和2结构中部分键长(nm)和键角(°)Table 2 Selected bond lengths(nm)and bond angles(°)of complexes 1 and 2
CCDC:2123588,1;2123589,2。
1.4 UV-Vis和荧光光谱测试
以N,N-二甲基甲酰胺(DMF)为溶剂,配制浓度为 20 μmol·L-1的 L1、L2、1和 2 的待测液,以 DMF 为参比,测定样品的UV-Vis谱图。同时,测定样品在室温下的荧光激发光谱(EX)和发射光谱(EM)。其中,L1和1激发狭缝为2.5 nm,发射狭缝为5.0 nm;而L2和2激发和发射狭缝均为10 nm。
1.5 电化学分析
将 1、2溶于 DMF 配成 1 mmol·L-1溶液,以 0.1 mol·L-1KCl为支持电解质,扫描速率为50 mV·s-1,于-1.0~0.8 V范围内进行CV扫描。
1.6 抑菌活性测试
参照文献[17]的牛津杯法进行抑菌活性实验。样品用二甲基亚砜溶解,配制成质量浓度为5.000、2.500、1.250、0.625 0、0.312 5 mg·mL-1的溶液。移取100 μL菌悬液于固体培养基上,均匀涂布,等距离放置5个牛津杯,分别移入100 μL上述溶液。把培养皿置于37℃恒温培养箱中培养16~24 h,测定配合物1、2对3种受试菌株的抑制作用。
1.7 抗氧化活性测试
配制0.3 mmol·L-1的DPPH·甲醇溶液和不同质量浓度(0.05、0.1、0.2、0.5、0.8、1 mg·mL-1)的样品待测液备用。将文献[18]的方法略加改动,测定抗氧化活性。
1.7.1 反应时间的确定
在25 mL具塞棕色比色管中加入0.3 mmol·L-1DPPH·甲醇溶液10 mL,再加入1 mg·mL-1待测液10 mL,摇匀,置于37℃水浴锅中,避光反应,反应一定时间(5、30、40、50、60、70和80 min)时取样,以甲醇为参比,测定516 nm处吸光度(A)。按照如下公式计算配合物对DPPH·的清除率(r),确定最佳反应时间:

其中A0是空白对照的吸光度,Ai是加样品液后吸光度,Aj是样品液本底吸收。
1.7.2 DPPH·清除率与质量浓度关系
取6支10 mL具塞棕色比色管,分别加入2 mL 0.3 mmol·L-1DPPH·甲醇溶液和2 mL不同质量浓度的样品待测液,再用1 mL甲醇定容至5 mL。摇匀,置于37℃水浴锅中,避光反应60 min。取样,以甲醇为参比,测定516 nm处吸光度。对DPPH·的清除率计算方法同上。
2 结果与讨论
2.1 红外光谱分析
配合物1和2的红外光谱如图1所示。从图中可以看出:1和2在3 480、3 327 cm-1和3 465、3 357 cm-1处的2个中强吸收峰可归属于配体上氨基N—H的对称与反对称伸缩振动;在1 627、1 617 cm-1与1 434、1 424 cm-1处的2个强吸收峰可归属于醋酸根上COO-的反对称和对称伸缩振动,其峰值差Δν均为193 cm-1,表明该羧酸根与Cu(Ⅱ)发生双齿配位[19]。在1 606和1 599 cm-1处的吸收峰分别归属为配体L1和L2吡啶环上C=N伸缩振动[16]。

图1 配合物1和2的FT-IR谱图Fig.1 FT-IR spectra of complexes 1 and 2
2.2 紫外可见光谱和荧光光谱
2.2.1 紫外可见光谱
配体和配合物的UV-Vis谱图如图2所示。由图可知,L1、L2分别在296 nm和268、313 nm处出现宽而强的吸收峰,可归属为吡啶环π-π*、n-π*跃迁及NH2增色效应;而1、2在290 nm和264、311 nm处出现类似吸收峰,分别蓝移6 nm和4、2 nm,且峰强度明显减弱,但峰宽变化不大,可能是由于Cu2+引起配体与金属之间的电荷转移,减少了配体共轭体系的电子云密度[20-22]。此外,在320~450 nm范围内,出现较弱的由金属中心d-d跃迁引起的吸收带[23]。

图2 配体、1和2的UV-Vis谱图Fig.2 UV-Vis spectra of the ligands,1,and 2
2.2.2 荧光光谱
配体和配合物的荧光光谱如图3所示。从图3可以看出,L1与1、L2与2的激发与发射光谱谱图相似,说明配合物1、2的荧光可能是配体吡啶环的ππ*跃迁所致。与配体相比,1、2最大发射波长分别蓝移了1、3 nm,可能是吡啶环上N原子与Cu(Ⅱ)离子配位后,配体共轭程度减弱引起的[24];同时,1的荧光强度明显减弱,约为L1的一半;而2的变化很小,略高于L2。配体荧光强度的差异主要是2个配体吡啶环上取代基的差异引起的。L1上3-CH3为供电子基,而L2上5-Br为强吸电子基,产生了重原子效应,使荧光强度明显减弱;配合物荧光强度的变化可能是配体的N通过电子转移与Cu(Ⅱ)配位,引起了分子刚性、共轭程度等改变所致[22,25]。

图3 配体、1和2的荧光谱图Fig.3 Fluorescence spectra of the ligands,1,and 2
2.3 晶体结构分析
单晶分析结果表明,1属于正交晶系,Pbca空间群;2为单斜晶系,P21/n空间群。1、2的分子结构如图4、5所示。由图可知,1、2均为对称的双核铜配合物,都是由2个配体分子(L1或L2)、4个醋酸根离子和2个Cu2+组成。每个Cu2+都是五配位的,分别与1个来自L1或L2吡啶环的N原子、4个来自于醋酸根的O原子配位。每一个醋酸根均以二齿桥联配体形式与2个Cu2+配位,形成双核铜笼状结构,其轴向被吡啶环上N占据。双核铜1、2的金属离子中心间距分别为 0.269 04(8)、0.264 54(12)nm,小于 2个铜原子的范德华半径之和(0.286 nm),大于2个铜离子半径之和(0.255 nm)[24]。1、2中五配位的铜离子均为四方锥几何构型,对1而言,O1、O2#1、O3、O4#1四个原子处于同一平面(平均偏离该平面距离为0.000 06 nm),构成四方锥的锥底;Cu1距离该平面的距离为0.024 38 nm,而N1位于锥顶,与Cu1距离为0.222 7(2)nm。对2而言,O1#1、O2、O3、O4#1四个原子可近似看作处于同一平面(平均偏离该平面距离为0.000 1 nm),构成四方锥的锥底;Cu1距离该平面的距离为0.021 73 nm,而N1位于锥顶,与Cu1距离为0.222 6(3)nm。通过对比中心Cu2+相关的键长、键角等数据,可知1、2均为变形的四方锥结构。图6、图7是1、2沿a轴的晶胞堆积图,配合物通过范德华力、吡啶环之间的π-π堆积作用等分子间作用力,形成了三维空间结构。

图4 配合物1的分子结构Fig.4 Molecular structure of complex 1

图5 配合物2的分子结构Fig.5 Molecular structure of complex 2

图6 配合物1沿a轴的晶胞堆积图Fig.6 Cell stacking diagram along the a-axis of complex 1
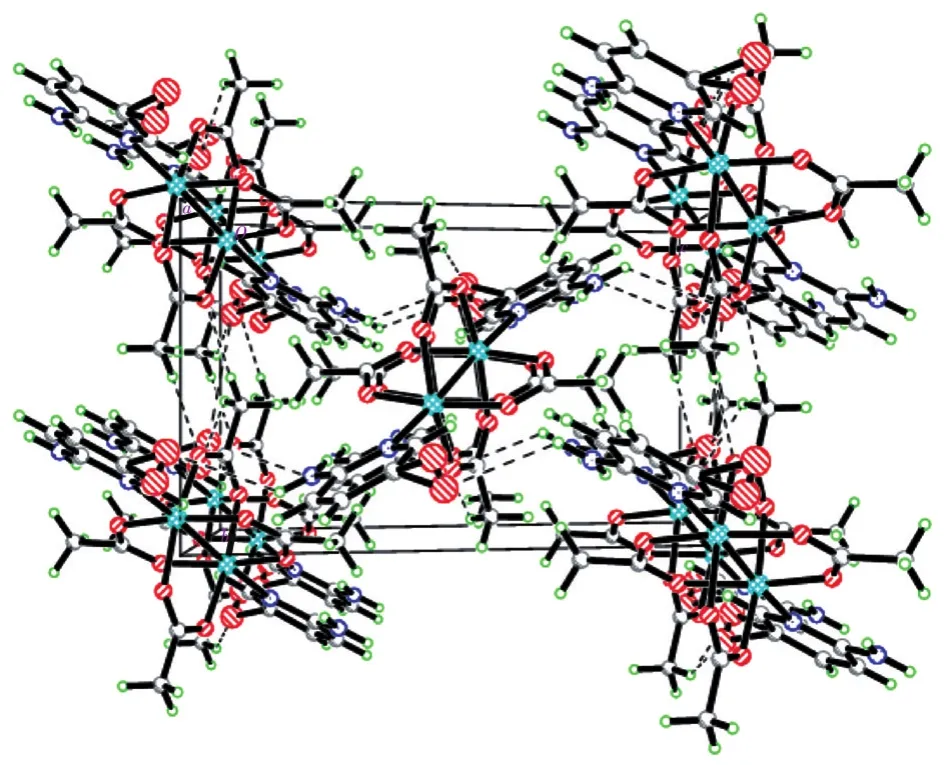
图7 配合物2沿a轴的晶胞堆积图Fig.7 Cell stacking diagram along the a-axis of complex 2
2.4 电化学分析
配合物1和2的CV曲线如图8所示。由图可知,配合物1、2在-1.0~0.8 V范围内分别给出了2对氧化还原峰。配合物1氧化峰电位Epa1=-0.153 V,Epa2=0.202 V,还原峰电位Epc1=-0.392 V,Epc2=0.133 V。峰电位差ΔEp1=0.239 V,ΔEp2=0.069 V;半峰电位Ep1/2,1=0.119 V,Ep1/2,2=0.034 V;峰电流比Ipa1/Ipc1=6.046,Ipa2/Ipc2=1.201。配合物 2 氧化峰电位Epa1′=-0.148 V,Epa2′=0.218 V,还原峰电位Epc1′=-0.505 V,Epc2′=0.114 V。峰电位差 ΔEp1′=0.357 V,ΔEp2′=0.104 V;半峰电位Ep1/2,1′=0.178 V,Ep1/2,2′=0.052 V;峰电流比Ipa1′/Ipc1′=1.878,Ipa2′/Ipc2′=1.093。
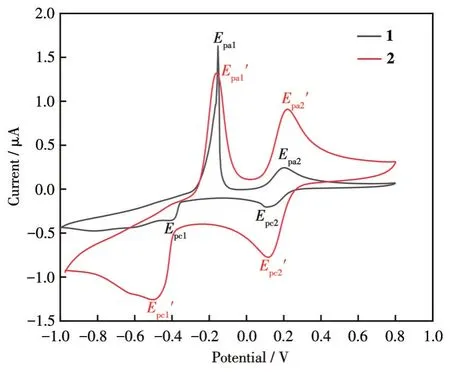
图8 配合物1和2的CV曲线Fig.8 CV curves of complexes 1 and 2
由峰电位差、半峰电位和峰电流比可知,配合物1、2的2对氧化还原峰分别对应Cu(Ⅱ)+e-⇌Cu(Ⅰ)+e-⇌Cu(0)的氧化还原过程,因此可认为1、2中铜中心离子可以发生准可逆的氧化还原反应[23]。
2.5 抑菌实验分析
配合物的抑菌实验结果见表3。从中可以看出,在测试质量浓度范围内(0.312 5~5.000 mg·mL-1),随样品质量浓度(ρ)增加,样品对3种受试菌株的抑菌作用增强。配合物1和2对S.Aureus和B.subtilis抑制作用非常强,对E.coli抑制作用一般,与已有报道一致[26-27]。研究表明,E.coli抗药性越来越强,可能是其外膜的亲水多糖链起到配合物渗透屏障作用引起的[27-28]。
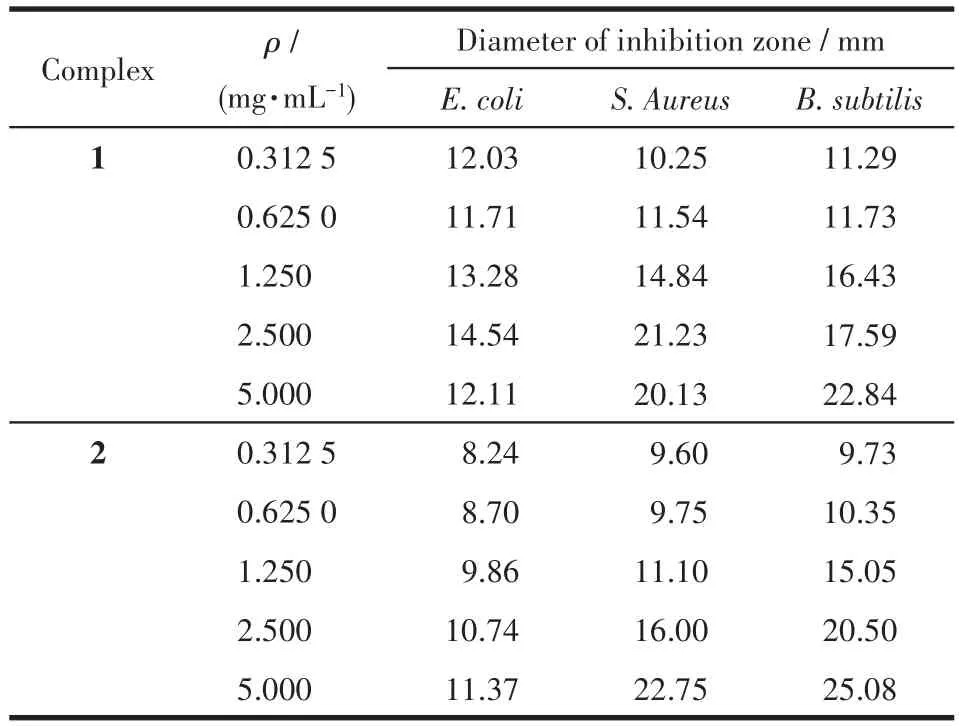
表3 配合物1、2的抑菌活性Table 3 Antibacterial activities of complexes 1 and 2
2.6 抗氧化活性分析
配合物1、2清除DPPH·的反应时间测定结果见图9。由图可知,1、2对DPPH·具有优良的清除作用;随着反应时间的延长,清除率不断增大,30 min时,1和2的清除率分别达到75%和72%,60 min时清除率最大(92%和93%),再延长时间,清除率基本不发生明显改变,故确定清除DPPH·的最佳反应时间为60 min。

图9 配合物1和2清除DPPH·的反应时间Fig.9 Reaction times of complexes 1 and 2 to scavenge DPPH·
图10是不同浓度的配合物1、2对DPPH·的清除率曲线。由图可知,随着质量浓度的增加,配合物对DPPH·清除率增大。在0.05~0.5 mg·mL-1范围内,1的质量浓度与DPPH·清除率呈良好线性关系,其回归方程为y=1.426x+0.197 5,R2=0.998 8,IC50为0.21 mg·mL-1;在0.05~1.0 mg·mL-1范围内,2的质量浓度与DPPH·清除率呈良好线性关系,其回归方程为y=0.730 3x+0.125 2,R2=0.996 8,IC50为 0.51 mg·mL-1。说明二者清除DPPH·能力良好,具有较强的抗氧化活性。
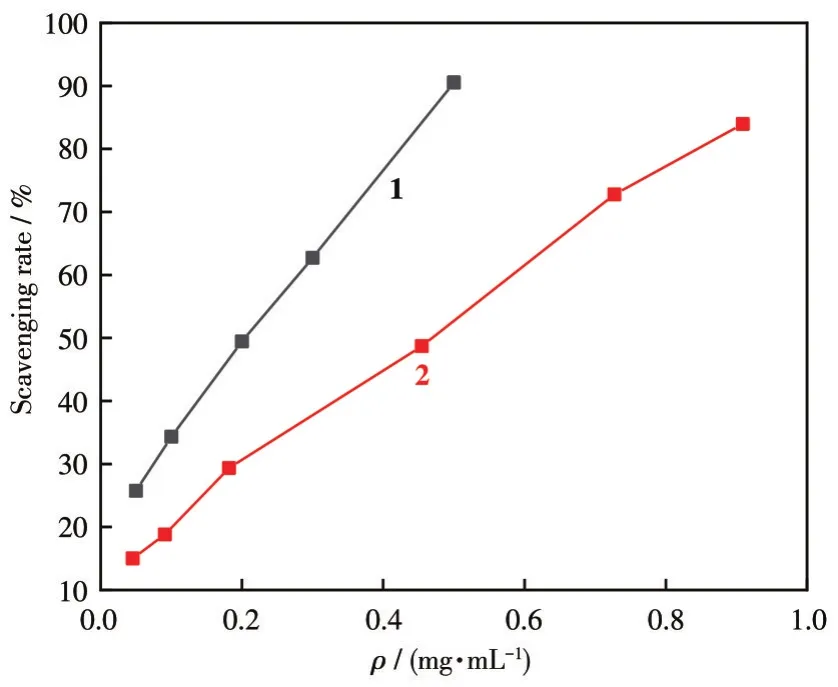
图10 配合物1和2对DPPH·的清除率曲线Fig.10 Curves of scavenging rate of complexes 1 and 2 to DPPH·
3 结 论
合成了2个新的双核铜配合物[Cu2(CH3COO)4(L1)2](1)和[Cu2(CH3COO)4(L2)2](2),并采用熔点、X射线单晶衍射、红外光谱、紫外可见光谱等手段进行了结构表征。配合物1、2均具有五配位的变形四方锥构型。循环伏安法实验结果表明,配合物1、2可发生准可逆氧化还原过程。生物活性实验结果表明,1、2对实验测试菌株B.subtilis、S.aureus表现出优良的抑制作用;对DPPH·具有良好的清除效率,IC50分别为 0.21和0.51 mg·mL-1。此外,它们具有一定的荧光发射性能。本研究结果对设计、开发具有优良生物活性、光学性能的铜配合物具有一定的参考价值。
- 无机化学学报的其它文章
- La-Doped BaSnO3/Multi-walled Carbon Nanotube Modified Separator:Synthesis and Application in Lithium-Sulfur Battery
- Co(Ⅱ)/Ni(Ⅱ) Coordination Polymer of Isomeric Terphenyl-2,2″,4,4″-tetracarboxylic Acids with a Single Water Bridge:Syntheses,Structures,and Magnetic Properties
- Micromotors Based on Ni-Mn Binary Oxide and Its Application for Effective Dye Adsorption
- Direct Synthesis of Dimethyl Carbonate from CO2 and Methanol by Mg-Doped Ceria Monolithic Catalyst
- Hydrogen Storage Capabilities of the Low-Lying Ca2B4Clusters
- 盘状镝簇合物的合成及缓慢磁弛豫

