miR-383通过调控FBXO5表达抑制人牙周膜细胞成骨分化和迁移
周俊 原辉婷 余少壮 朱兰省 (郑州植得口腔医院种植修复科,河南 郑州 450000)
牙周病指的是发生于牙龈、牙周膜等牙齿支持组织的慢性炎症性疾病,以牙槽骨进行性吸收和牙周支持组织破坏为主要特征,而诱导牙周膜细胞的成骨分化是牙周组织修复再生的关键因素之一〔1,2〕。基础治疗是诊治牙周病的主要手段,但有时疗效不佳,药物治疗成为诊治牙周病的必要辅助手段〔3〕;研究牙周膜细胞的成骨分化机制,寻找其特异性靶点开发分子靶向药物有助于临床治疗牙周病。研究发现微小RNA(miRNA)在细胞分化进程中发挥重要作用,其可靶向结合目的基因通过上调或下调促进或抑制成骨分化〔4〕。有研究报道miR-383是成骨细胞分化的关键调节因子,miR-383在大鼠骨髓间充质干细胞的成骨细胞分化过程中下调,过表达miR-383抑制骨髓间充质干细胞的成骨细胞分化,而miR-383的敲低促进成骨细胞分化〔5〕。miR-383还与细胞的迁移相关,有研究发现miR-383上调抑制结肠癌细胞的增殖,迁移和侵袭〔6〕。F-box蛋白(FBXO)5是F-box蛋白家族成员之一,微阵列数据的生物信息学分析表明,FBXO5的表达在成骨分化中发生了很大变化,说明FBXO5可能参与调节间充质干细胞的成骨分化〔7〕。研究报道在人牙周膜细胞(hPDLCs)成骨诱导后,FBXO5的表达上调,FBXO5的两个转录本过表达促进hPDLCs的迁移和成骨分化〔8〕。然而,miR-383对hPDLCs成骨分化和迁移的影响及miR-383是否通过调控FBXO5影响hPDLCs成骨分化和迁移还尚未清楚。本实验旨在研究miR-383是否通过调控FBXO5影响hPDLCs成骨分化和迁移。
1 材料与方法
1.1细胞与主要试剂 胎牛血清、α-MEM培养基、青/链霉素、胰蛋白酶购自美国Gibco公司;成骨诱导培养液购自美国Hyclone公司;RNA提取试剂盒、荧光定量试剂盒、LipofectamineTM2000转染试剂购自美国Invitrogen公司;放射免疫沉淀试验(RIPA)蛋白裂解液、二喹啉甲酸(BCA)试剂盒、聚偏氟乙烯(PVDF)膜、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒购自上海碧云天生物技术有限公司;抗体均购自北京博奥森生物科技有限公司;Transwell小室购于美国BD公司;双荧光素酶报告基因检测试剂盒购自北京Solarbio公司。miR-con、miR-383、anti-miR-con、anti-miR-383、si-con、si-FBXO5、pcDNA、pcDNA-FBXO5载体质粒购自上海斯信生物科技有限公司。Thermo FC酶标仪购自美国Thermo公司;荧光倒置显微镜购自日本Olympus公司。
1.2方法
1.2.1样本来源 取郑州植得口腔医院门诊因正畸拔出的牙,所有供者无传染疾病,口腔卫生良好,近期未有感染,且所有人签署知情同意书。
1.2.2hPDLCs原代培养 牙齿拔除在超净工作台中用含100 U/L青霉素和100 mg/L链霉素的α-MEM培养液反复冲洗后,用手术刀将牙根1/3处牙周膜刮取下来,剪碎后加入Ⅰ型胶原酶消化30 min后加入α-MEM培养液终止反应,800 r/min离心5 min后去上清将沉淀物于含10%胎牛血清、100 U/L青霉素和100 mg/L链霉素的α-MEM培养液在37℃恒温培养箱中培养,2~3 d换1次培养液,约4 d后有细胞从组织块中爬出,当细胞融合至80%左右时进行传代,后续试验用第3代hPDLCs。
1.2.3成骨细胞诱导 取第3代hPDLCs,接种于六孔细胞培养板进行扩增培养,当细胞融合至80%左右时,去除孔内培养基,换成成骨诱导培养液(含50 μg/ml抗坏血酸、100 U/L青霉素、100 mg/L链霉素、2 mmol/L谷氨酰胺、100 nmol/L地塞米松),每隔3 d换1次培养液,分别收集第0、1、7、14天细胞备用。
1.2.4细胞转染与分组 将miR-con、miR-383、anti-miR-con、anti-miR-383、pcDNA、pcDNA-FBXO5分别转染至hPDLCs中,分别记为miR-con组、miR-383组、anti-miR-con组、anti-miR-383组、pcDNA组、pcDNA-FBXO5组;将anti-miR-383分别与si-con、si-FBXO5共转染至hPDLCs中,记为anti-miR-383+si-con组、anti-miR-383+si-FBXO5组;具体转染步骤按照LipofectamineTM2000试剂盒进行。
1.2.5实时荧光定量-聚合酶链反应(qRT-PCR)检测miR-383和FBXO5 mRNA表达水平 提取成骨诱导第0、1、7、14天的细胞总RNA,用反转录试剂盒将RNA反转录成cDNA,按照荧光定量试剂盒使用说明进行PCR,miR-383和FBXO5 分别以U6和β-actin为内参进行PCR扩增,每个样品设3个重复,循环条件为95℃ 5 min,95℃ 30 s,60℃ 30 s;72℃ 30 s,共40个循环;60℃延长5 min。相对表达量用2-△△Ct法计算。miR-383上游引物序列:5′-CACGAAAGATCAGAAGGTGATTG-3′,下游引物序列:5′-TATCGTTGTTCTCGTCTCCATCTC-3′;U6上游引物序列:5′-GCTTCGGCAGCACATATACTA-3′,下游引物序列:5′-CGCTTCACGAATTTGCGTGTC-3′;FBXO5 上游引物序列:5′-GCTGTCATATTGGGTCACC-3′,下游引物序列:5′-GTCTACTGGTCT-CTAGTGCTTCT-3′;β-actin上游引物序列:5′-TTACTGCCCTGGCTCCTA-3′,下游引物序列:5′-ACTCATCGTACTCCTGCTTG-3′。
1.2.6Western印迹检测FBXO5、Runt相关转录因子(RUNX)2、碱性磷酸酶(ALP)、OSX、骨钙素(OCN)、核转录因子(NF)-κB抑制蛋白(IκB)α和p-IκBα蛋白表达水平 各组细胞培养48 h后提取总蛋白,BCA试剂盒测定蛋白浓度。将蛋白样品进行SDS-PAGE 90 min后转至PVDF上,用5 %脱脂奶粉室温封闭1 h,再分别加入一抗(1∶1 000),4℃孵育过夜,磷酸盐缓冲液(PBS)洗膜;加入二抗(1∶2 000)室温孵育90 min,PBS洗涤3次,每次5 min,用电化学(ECL)发光液显影,用ChemiDoc XRS+系统成像,将胶片用Quantity One凝胶分析软件处理,测定各组蛋白条带的吸光度,蛋白相对表达水平=目的条带吸光度值/β-actin条带吸光度值。每个蛋白样品设3个重复。
1.2.7划痕实验和Transwell实验检测hPDLCs迁移 划痕实验:将第3代hPDLCs按2×104个/孔的密度接种于6孔培养板中,待细胞单层贴壁后,用200 μl的枪头在6孔板底部划出1 mm宽的划痕,标记观测点,PBS冲洗掉脱落细胞后继续培养,分别于0、24 h观察拍照,计算细胞生长后两道划痕之间相对宽度,并拍照。
Transwell实验:取200 μl第3代hPDLCs细胞悬液接种于Transwell小室的上室,下室加入500 μl含10%胎牛血清的培养液,培养24 h后取出小室,吸弃培养液后用棉签轻轻擦去上层细胞,PBS洗涤,用4%多聚甲醛固定30 min,清水洗涤2次,再用0.1%结晶紫染色10 min,显微镜观察并拍照,计算结晶紫染色细胞数即为迁移细胞数。
1.2.8荧光素酶报告基因检测实验检测miR-383对FBXO5的靶向调控 构建含有miR-383结合位点的FBXO5-3′UTR野生型及突变型报告基因载体,在hPDLCs中转染miR-383 mimics和野生型及突变型报告基因载体。按照说明书进行检测。实验结果以荧光素酶活性和Renilla活性的比值进行统计学分析,实验重复3次。
1.3统计学方法 采用SPSS20.0软件进行t检验、单因素方差分析。
2 结 果
2.1hPDLCs成骨分化诱导过程中miR-383和FBXO5的表达 与1 d组相比,7 d、14 d组hPDLCs成骨分化诱导过程中miR-383表达水平显著降低,FBXO5 mRNA和蛋白表达水平显著升高(P<0.05)。见图1、表1。
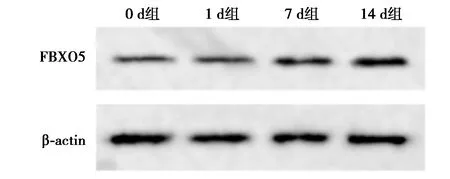
图1 Western印迹检测hPDLCs FBXO5蛋白的表达

表1 hPDLCs成骨分化诱导过程中miR-383和FBXO5的表达
2.2干扰miR-383表达促进hPDLCs成骨分化 与anti-miR-con组相比,anti-miR-383组hPDLCs中RUNX2、ALP、OSX和OCN蛋白表达水平显著升高(P<0.05)。见图2、表2。表明干扰miR-383表达促进hPDLCs成骨分化。
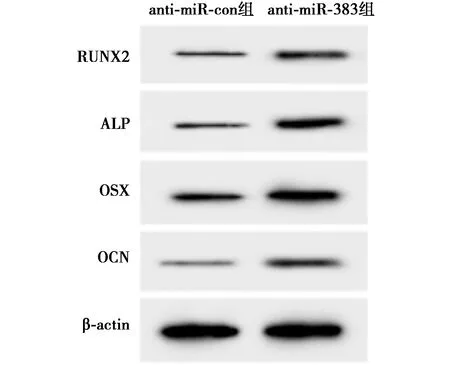
图2 Western印迹检测hPDLCs RUNX2、ALP、OSX和OCN蛋白表达

表2 干扰miR-383表达促进hPDLCs成骨分化
2.3干扰miR-383表达促进hPDLCs迁移 与anti-miR-con组相比,anti-miR-383组hPDLCs相对宽度显著降低,细胞迁移数显著升高(P<0.001)。见图3、图4、表3。表明干扰miR-383表达促进hPDLCs迁移。
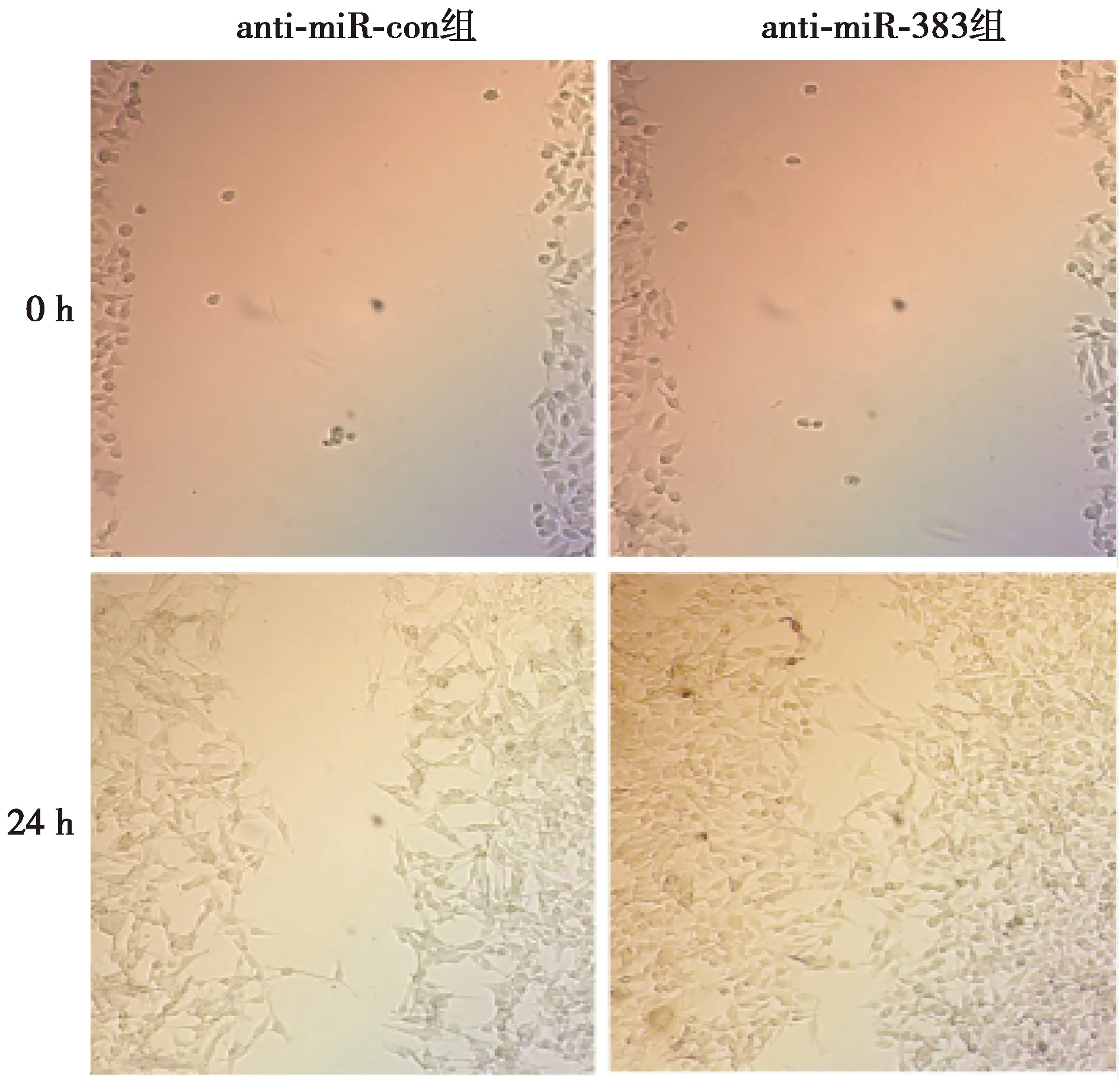
图3 两组迁移细胞划痕实验(×100)
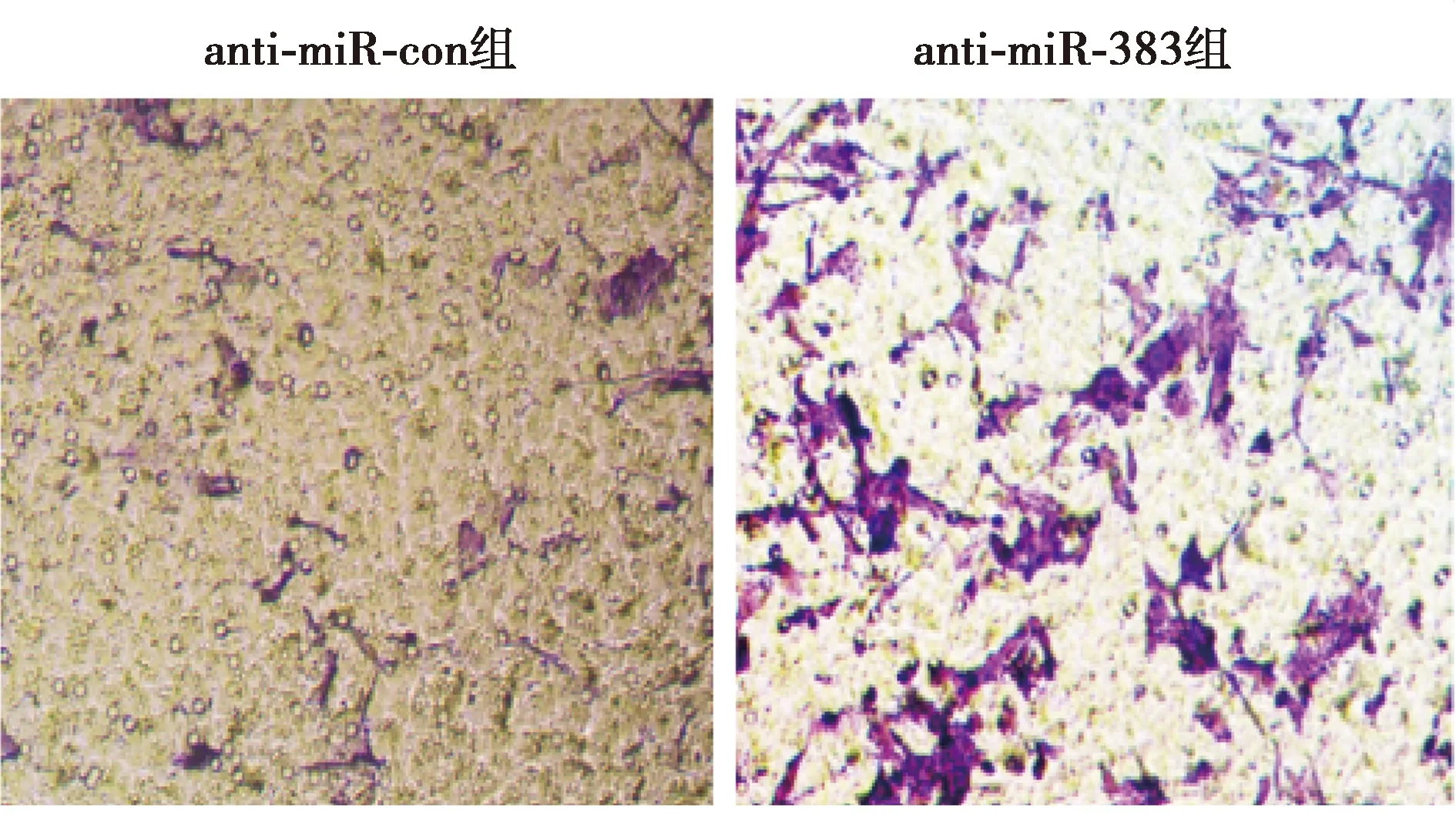
图4 Transwell实验检测两组hPDLCs迁移(结晶紫染色,×200)

表3 干扰miR-383表达促进hPDLCs迁移
2.4miR-383靶向FBXO5调控其表达 Targetscan预测FBXO5与miR-383存在结合位点,见图5。荧光素酶报告实验结果显示,相较于miR-con组,miR-383组转染野生型FBXO5表达载体的hPDLCs荧光素酶活性显著降低(P<0.001);而转染突变型FBXO5表达载体hPDLCs荧光素酶活性差异不显著(P>0.05)。见表4。相较于miR-con组FBXO5表达水平(0.58±0.08),miR-383组(0.37±0.04)显著降低;相较于anti-miR-con组FBXO5表达水平(0.61±0.05),anti-miR-383组(1.17±0.13)显著升高(P<0.05),见图6。表明miR-383可靶向调控FBXO5的表达。
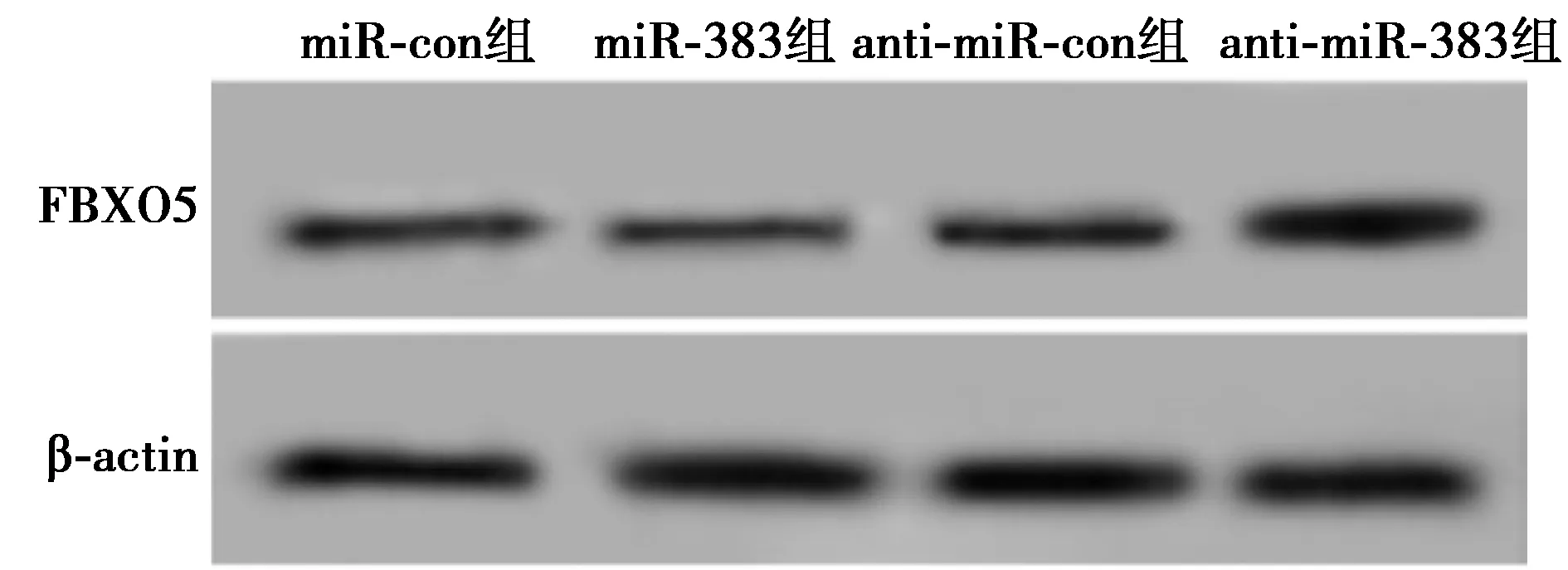
图6 miR-383调控FBXO5表达

表4 双荧光素酶报告实验

图5 miR-383与FBXO5互补的核苷酸序列
2.5过表达FBXO5促进hPDLCs迁移和成骨分化 与pcDNA组相比,pcDNA-FBXO5组hPDLCs中FBXO5、RUNX2、ALP、OSX和OCN蛋白水平和细胞迁移数显著升高,细胞间相对宽度显著降低(均P<0.001),见图7、表5。表明过表达FBXO5促进hPDLCs迁移和成骨分化。
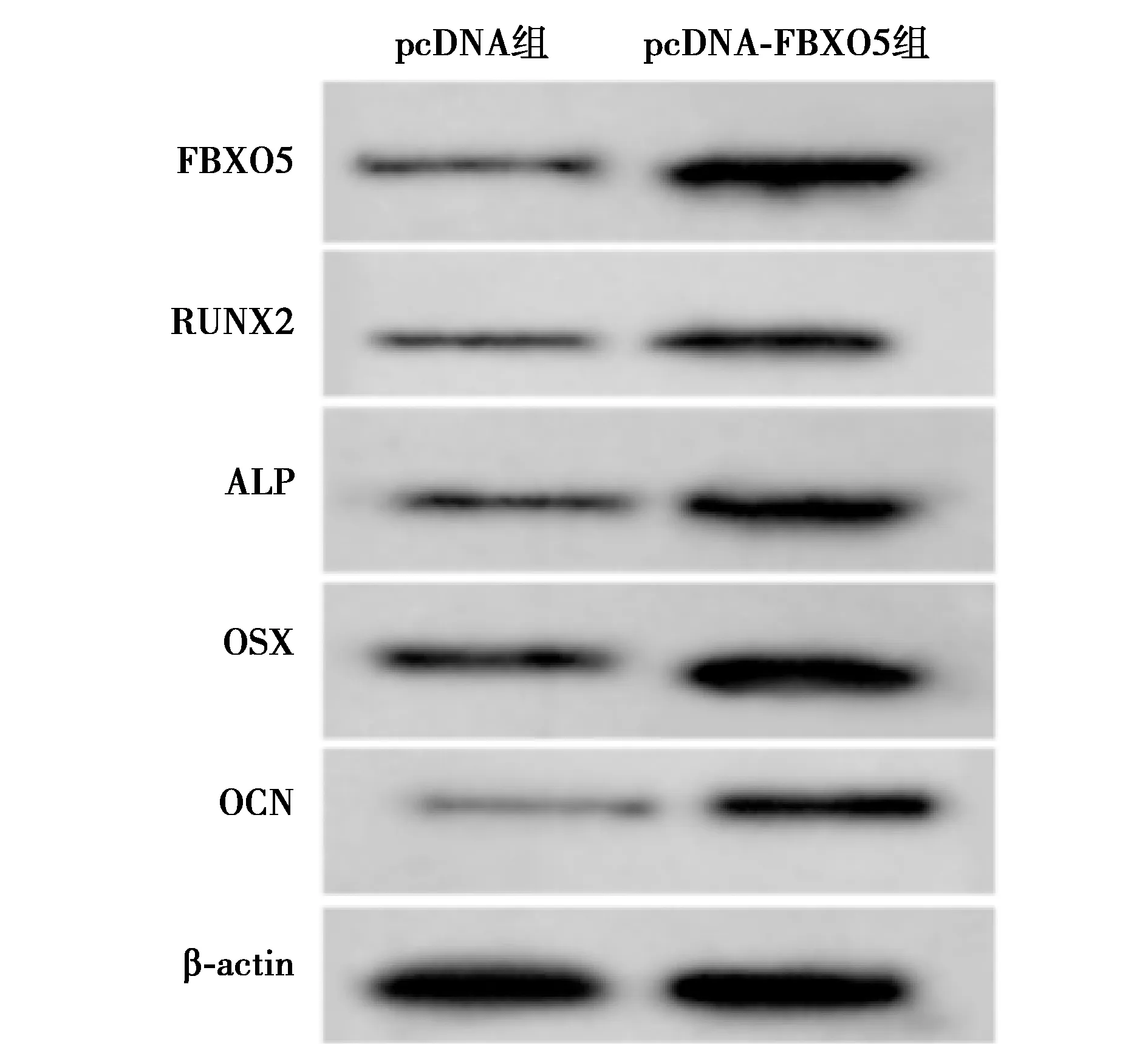
图7 Western印迹检测hPDLCs FBXO5、RUNX2、ALP、OSX和OCN蛋白的表达

表5 过表达FBXO5促进hPDLCs迁移和成骨分化
2.6沉默FBXO5部分逆转anti-miR-383 hPDLCs迁移和成骨分化的促进作用 与anti-miR-383+si-con组相比,anti-miR-383+si-FBXO5组hPDLCs FBXO5、RUNX2、ALP、OSX和OCN蛋白表达水平和细胞迁移数均显著降低,细胞间相对宽度显著升高(均P<0.001)。见表6、图8。表明沉默FBXO5部分逆转anti-miR-383对hPDLCs迁移和成骨分化的促进作用。

表6 沉默FBXO5部分逆转anti-miR-383促进hPDLCs迁移和成骨分化
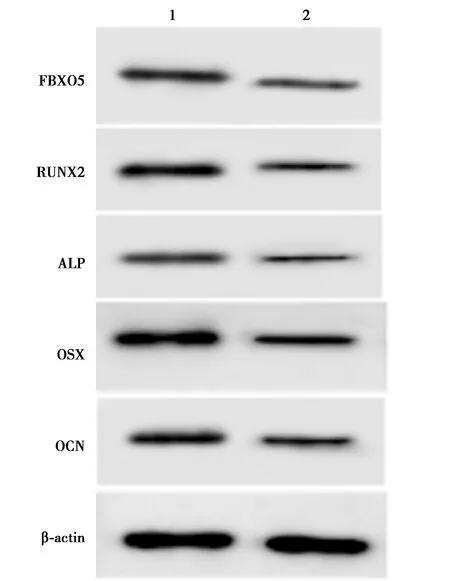
1,2:anti-miR-383+si-con组,anti-miR-383+si-FBXO5组图8 Western印迹检测hPDLCs FBXO5、RUNX2、ALP、OSX和OCN蛋白的表达
2.7miR-383和FBXO5表达对NF-κB信号通路的影响 与anti-miR-con组相比,anti-miR-383组hPDLCs中p-IκBα表达水平显著降低(P<0.05);与anti-miR-383+si-con组相比,anti-miR-383+si-FBXO5组hPDLCs中p-IκBα表达水平显著升高(P<0.05)。见图9、表7。表明干扰miR-383表达抑制NF-κB信号通路,而沉默FBXO5部分逆转干扰miR-383对NF-κB信号通路的抑制作用。
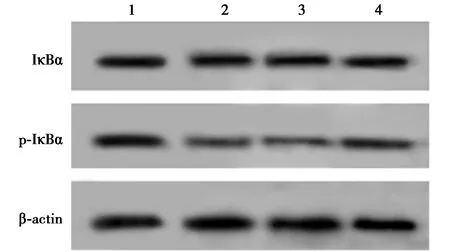
1~4:anti-miR-con组、anti-miR-383组、anti-miR-383+si-con组、anti-miR-383+si-FBXO5组图9 Western印迹检测hPDLCs IκBα和p-IκBα蛋白的表达

表7 沉默FBXO5和anti-miR-383对hPDLCs IκBα和p-IκBα蛋白的表达的影响
3 讨 论
牙周病是口腔常见病之一,随着病情的进展可能累及牙龈及深层牙周组织,严重影响患者生活质量〔9〕。hPDLCs能分化成成骨细胞,参与牙槽骨改建、修复和牙周再生〔10〕。有研究发现miRNA参与调控牙齿发育和牙再生〔11〕,还影响hPDLCs迁移〔12〕。研究报道miR-383与成骨细胞分化有关,过表达miR-383通过下调ALP、基质矿化、RUNX2和OCN mRNA和蛋白水平来抑制骨髓间充质干细胞的成骨细胞分化〔5〕。抑制miR-383可通过增加胶质细胞源性神经营养因子(GDNF)蛋白水平增强人骨髓间充质干细胞治疗脊髓损伤的治疗潜力〔13〕。本研究结果说明干扰miR-383表达促进hPDLCs迁移。
OCN是骨细胞外基质的重要成分,在骨骼的合成和重建过程中起重要作用,是能反映骨转换过程的特异性标志物〔14〕。RUNX2是成骨细胞分化及牙齿发育过程中重要的转录调控因子,可促进细胞外基质蛋白OCN的合成与表达,参与了正畸牙移动中的牙周组织改建〔15〕。ALP是成骨分化活性的重要标志物,其活性或表达水平越高表明成骨分化越明显〔16〕。OSX是与成骨细胞分化和骨形成有关的转录因子,lncRNA MALAT1通过靶向人骨髓间充质干细胞中的miRNA-143促进OSX表达调节成骨分化〔17〕。RUNX2、ALP、OCN分别是成骨分化早、中、晚期指标,研究发现人脂肪间充质干细胞体内外成骨分化时RUNX2、ALP、OCN表达水平均显著升高〔18〕。本研究结果说明干扰miR-383表达可促进hPDLCs成骨分化,提示miR-383可作为治疗牙周病的特异性靶点。
FBXO5作为泛素连接酶家族的特异性因子,参与泛素蛋白酶体系统降解〔19〕。有研究报道FBXO5的两个转录本过表达显著增加hPDLCs迁移,增强ALP活性和矿化,并增加hPDLSC中的RUNX2、OSX和OCN表达〔8〕。本研究结果说明过表达FBXO5可促进hPDLCs成骨分化和迁移,表明FBXO5可作为改善牙周组织再生的潜在靶标。且本研究提示miR-383可能通过调控FBXO5的表达影响hPDLCs迁移和成骨分化。
研究证明NF-κB信号通路与骨发育和形成密切相关,NF-κB参与调控成骨细胞、破骨细胞的增殖、分化和凋亡,影响骨的发育和重塑〔20〕。静息状态下,IκBα与NF-κB结合,外界刺激后IκBα磷酸化为p-IκBα,解离的NF-κB进入细胞核,NF-κB信号通路激活。有研究报道肿瘤坏死因子(TNF)-α能激活NF-κB信号通路,从而抑制hPDLSCs的成骨分化〔21〕。本研究结果说明干扰miR-383表达抑制NF-κB信号通路激活。而沉默FBXO5部分逆转干扰miR-383对NF-κB信号通路的抑制作用。提示miR-383可能通过FBXO5影响NF-κB信号通路的激活,进而影响成骨细胞分化。

