恶性肿瘤患者基于临床和血液学标记物的免疫检查点抑制剂相关不良事件预测模型的建立*
许辉茹 冯慧晶 任秀宝 张俊萍
我国的癌症发病率和死亡率持续上升,自2010年以来,癌症已经成为我国死亡率第1 位的疾病,并成为一个重大公共卫生问题,在我国最常见的4 种癌症是肺癌、胃癌、肝癌和食道癌[1]。近年来,免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)在癌症尤其是肺癌的治疗中[2]取得了较为满意的效果,较大地改变了传统的肿瘤治疗策略,为患者提供了更多的生存获益。ICIs 主要包括细胞程序性死亡受体-1/配体-1 (programmed cell death 1/programmed cell deathligand 1,PD-1/PD-L1)抑制剂和细胞毒T 淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)抑制剂。其关键机制是与PD-1/PD-L1 或CTLA-4 靶点特异性结合破坏肿瘤免疫耐受,激活淋巴细胞杀伤肿瘤细胞。一旦产生反应,就有可能实现长期的肿瘤控制。然而,激活的免疫系统也可能累及正常组织和器官,并引起相关的不良反应,称为免疫检查点抑制剂相关不良反应(immune-related adverse effects,irAEs)。这些症状可能发生在用药后数周或数年,几乎会影响任何器官系统,有些可能是严重的甚至是致命的。
虽然目前的研究发现,影响irAEs 发生的因素很多,包括药物类型和剂量、宿主因素、免疫微环境、免疫遗传学等,但目前还尚无标准的生物标志物来预测其发生。使用基于临床和血液学参数的生物标志物可能是最方便的方法。目前,ICIs 除了单药及双免联合以外,联合化疗、抗血管治疗、靶向治疗等均在不同肿瘤中显示出了不错的效果,但考虑联合治疗可能影响机体的免疫和炎症系统,降低预测效能,本研究的对象主要是ICIs 单药或双免治疗的患者。本研究旨在建立基于真实数据的单纯ICIs 治疗恶性肿瘤患者ir-AEs 的临床和血液学指标预测模型。
1 材料与方法
1.1 临床资料
本研究纳入2016 年1 月至2020 年12 月在天津医科大学肿瘤医院和山西白求恩医院接受ICIs 治疗的恶性肿瘤患者474 例。所有患者在治疗前均签署知情同意书。本回顾性研究依据《赫尔辛基宣言》进行,经天津医科大学肿瘤医院伦理委员会批准(批件号:bc2021248)。入组标准:1)经病理学确诊的实体恶性肿瘤;2)至少接受过1 剂ICIs 治疗;3)病史资料记录较完善;4)接受ICIs 治疗前1 周内有基线数据。排除标准:1)ICIs 联合其他治疗者,包括化疗、放疗、靶向治疗、抗血管生成治疗等;2)病史资料记录不完善;3)无基线数据或基线数据过少;4)有严重感染、慢性肝肾功能不全、活动性自身免疫性疾病及多器官功能衰竭等慢性疾病不适合接受治疗者。
1.2 方法
患者接受ICIs 治疗(包括抗PD-1 抗体、抗PDL1 抗体和抗CTLA-4 抗体)至少1 个周期,直到肿瘤进展、出现不可接受的药物毒性、停药或死亡。入组患者收集相关资料,包括人口学特征(年龄、性别、既往病史、过敏史)和临床特征,如肿瘤类型、分期、PDL1 表达、体力状况评分(Karnofsky performance status, KPS)、ICIs 药物类型和剂量、治疗线数。基线测量定义为接受ICIs 前1 周内的检验结果。基线外周血数据包括白细胞计数及分类、血小板计数、血红蛋白、生化和心肌酶、心肌标志物、凝血功能、甲状腺功能、皮质醇、C 反应蛋白、降钙素原和铁蛋白,以建立一个真实的肿瘤免疫治疗数据库。
利用外周血绝对中性粒细胞计数(absolute neutrophil count,ANC)、绝对单核细胞计数(absolute monocyte count,AMC)、绝对淋巴细胞计数(absolute lymphocyte count,ALC)、血小板计数(platelet count,PLT)、血清白蛋白(albumin,ALB)计算中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)即(ANC/ALC)、血小板/淋巴细胞比值(platelet to lymphocyte ratio,PLR)即(PLT/ALC)、淋巴细胞/单核细胞比值(lymphocyte to monocyte ratio,LMR)即(ALC/AMC)、预后营养指数(prognostic nutritional index,PNI)即ALB(g/L)+5×ALC(109/L)和系统免疫炎症指数(systemic immune-inflammation index,SII)即(PLT×ANC/ALC)用于后续统计分析。
采用美国国家癌症研究所不良事件通用术语标准(CTCAE)4.03 版评估不良事件。irAEs 被定义为反映免疫系统紊乱的不良事件,如发烧、皮疹、肺炎、肝炎、结肠炎、甲状腺紊乱和其他。记录irAE 的发生时间、类型、级别、持续时间、治疗和转归。
1.3 统计学分析
患者被分为低-和高-NLR[3](分别为<3 和 ≥3),低-和高-PLR[4](分别为<180 和≥180), 低-和高-LMR[5](分别为<2.5 和≥2.5), 低-和高-PNI[6](分别为<47 和≥47),和低和高-SII[7](分别为<730 和≥730)组。这些临界值是根据文献及其中位数选择的。
采用SPSS 25.0 软件进行统计学分析,t检验、χ2检验用于分析有无irAEs 患者的基线特征。采用Logistic 回归分析临床及血液学标志物与irAEs 之间的关系。根据单因素分析的临床相关性和统计学意义选择最终纳入多因素Logistic 回归模型的变量,最终建立预测模型。以P<0.05 为差异具有统计学意义。
2 结果
2.1 患者基本资料
本研究中,共纳入428 例在天津医科大学肿瘤医院接受了至少1 个周期ICIs 免疫治疗的恶性肿瘤患者(表1)。患者平均年龄为62(15~84)岁,肿瘤类型中肺癌占52.3%,大部分为Ⅳ期(91.6%), KPS 评分≥80 分者占59.6%,1 线治疗占23.1%,大部分为抗PD-1 单抗(94.9%),中位ICIs 治疗周期数为4.28(2.10~11.50)次。
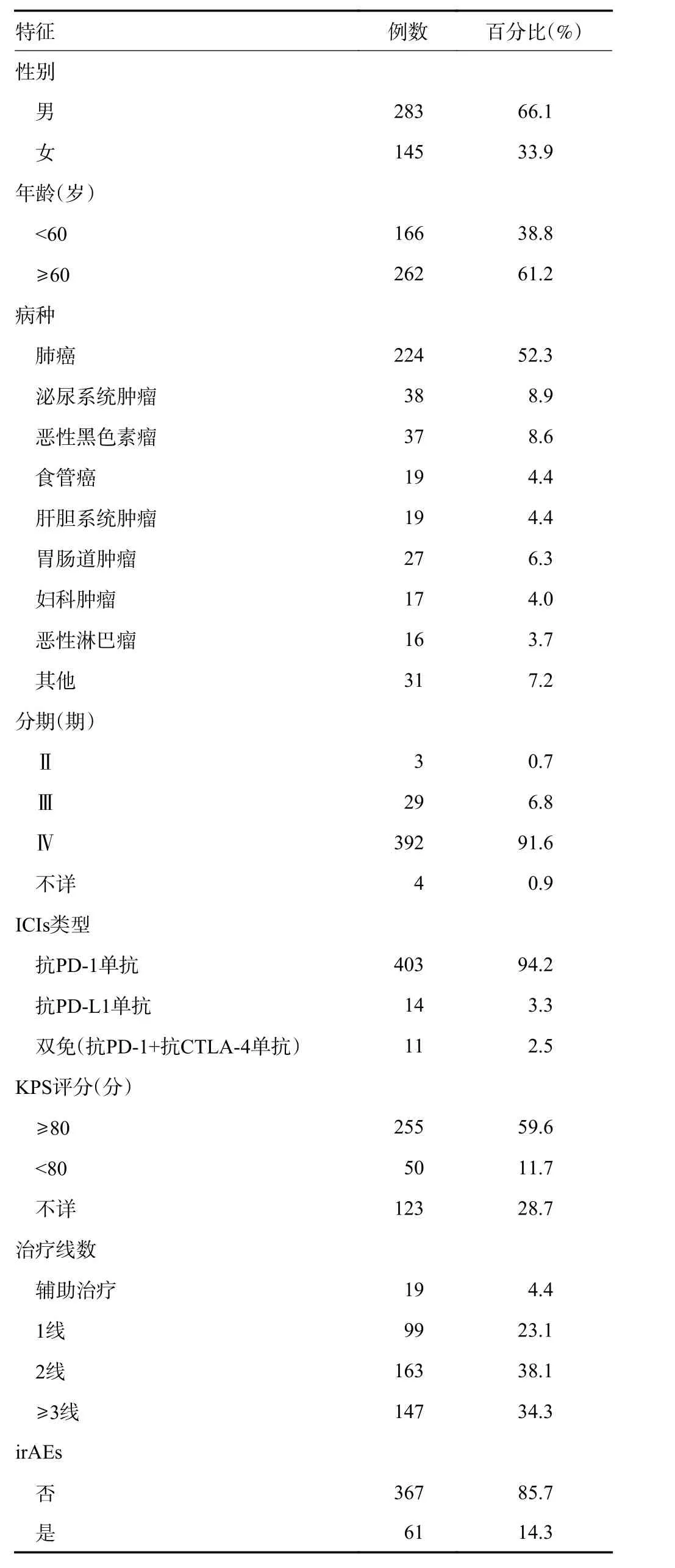
表1 患者临床特征(天津医科大学肿瘤医院)
另外,还纳入了46 例在山西白求恩医院胸部肿瘤科的患者(表2)。患者平均年龄为64.04(12.00~83.00)岁,主要病种为肺癌(56.5%)和恶性黑色素瘤(23.9%),大部分为中晚期患者,Ⅳ期占73.9%,KPS评分≥80 分者占95.7%;1 线治疗占23.9%,绝大部分为抗PD-1 单抗(95.6%),中位ICIs 治疗周期数为5.5(2.0~12.0)次。
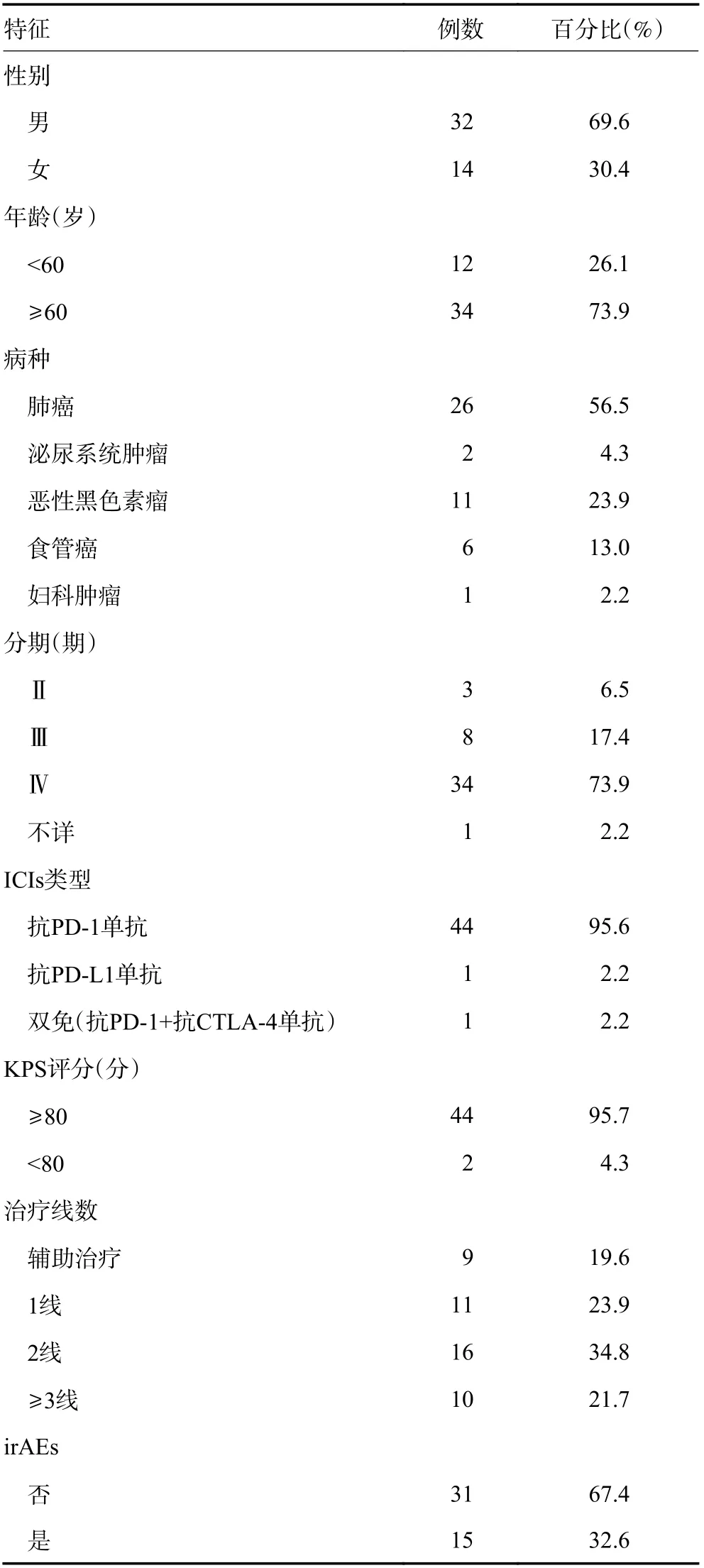
表2 患者临床特征(山西白求恩医院)
为了避免不同年份治疗的差异,将天津医科大学肿瘤医院肿瘤免疫治疗数据按年份随机分为2 个数据集,其中66.7%作为训练集,另外33.3%结合山西省白求恩医院免疫治疗数据作为验证集,对预测模型进行评价和验证。
首先,比较了285 例训练集和189 例验证集的基线特征,两组之间无统计学差异(P>0.05,)表3。
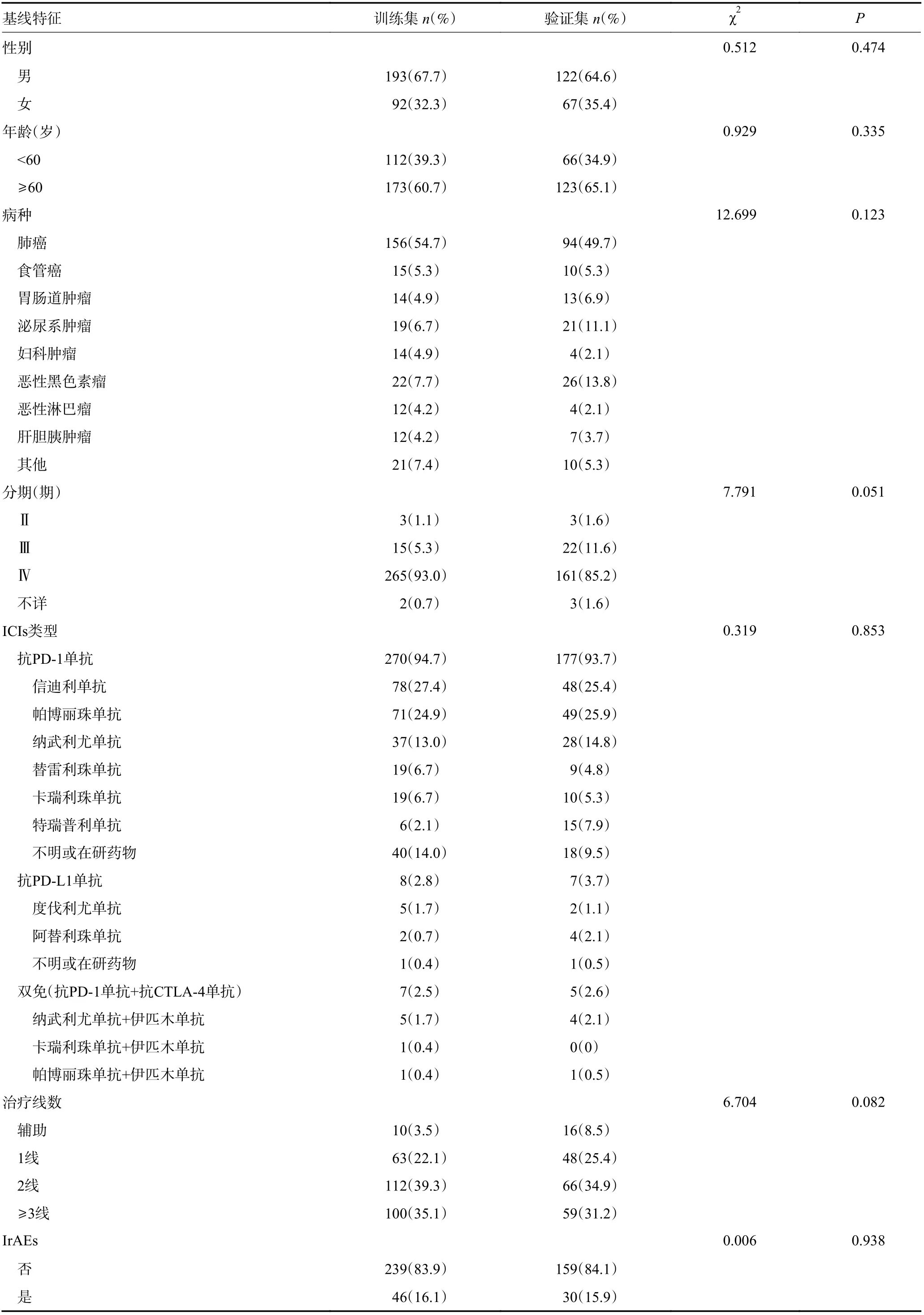
表3 训练集和验证集的基线特征
2.2 免疫相关不良事件
各级和严重(≥3 级)irAEs 的发生率分别为16.03%和2.32%。共76 例患者发生了105 次irAEs, 其中11 例患者发生了严重irAEs,10 例患者同时发生了3种及以上irAEs。抗PD-1 单抗中最常用的药物为信迪利单抗26.6%(126/474),其次为帕博丽珠单抗25.3%(120/474)和纳武利尤单抗13.7%(65/474),其irAEs 的发生率分别为19.0%、13.3%和10.8%,不同ICIs 治疗的irAEs 发生率,差异无统计学意义(χ2=5.888,P=0.825)。
约80%的irAEs 都发生在免疫治疗后半年之内,内分泌毒性(37.1%)是最常见的irAEs,其次是肺炎(19.0%)和皮肤毒性(15.2%),发生的中位时间分别为10 周、12 周和8 周;最常见的严重irAE 是肺炎(7.6%)。IrAEs 的毒性谱见图1,不同器官毒性的例数、发生时间、持续时间及治疗转归情况见表4。
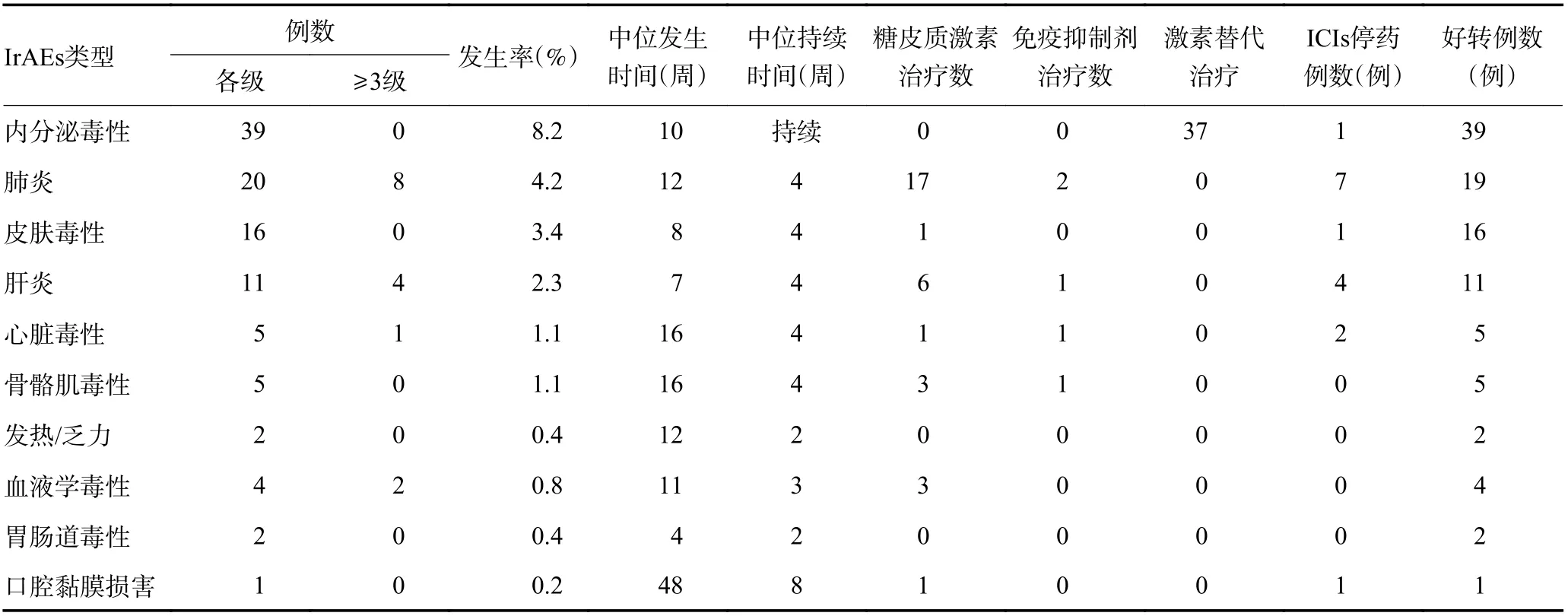
表4 irAEs 毒性谱、发生及持续时间、治疗情况及转归
发生irAEs 的患者均严格按照美国国立综合癌症网络(NCCN)及中国临床肿瘤学会(CSCO)《免疫检查点抑制剂相关毒性管理指南》进行治疗,主要采用糖皮质激素、免疫抑制剂、替代疗法和对症治疗。大多数经历严重irAEs 的患者使用糖皮质激素±免疫抑制剂治疗,且大部分患者预后良好。两组间差异无统计学意义(P>0.05, 表5)。
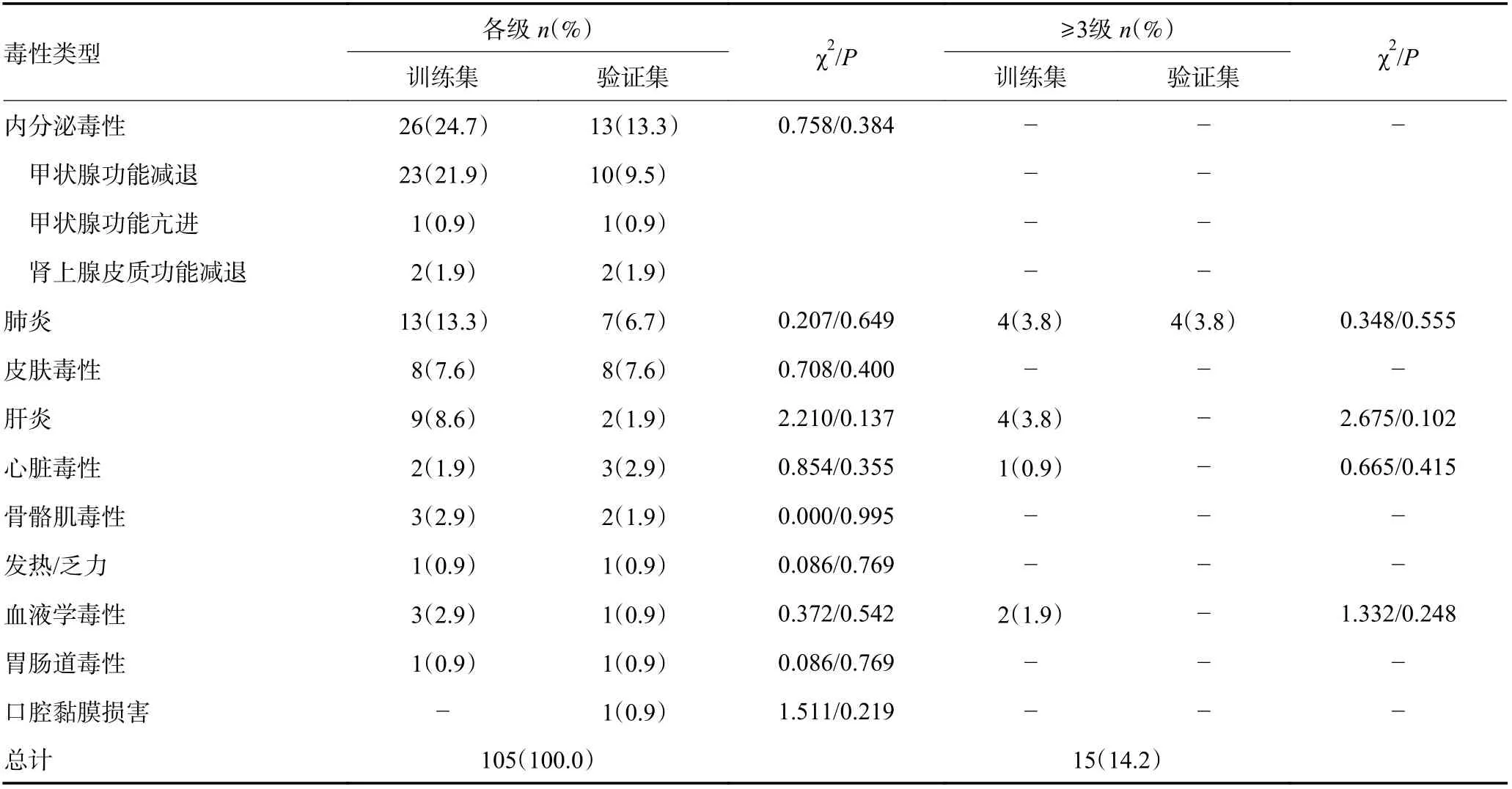
表5 训练集和验证集irAEs 发生情况
2.3 Logistic 回归分析筛选变量
在训练集中,首先采用单因素二元Logistic 回归分析筛选irAEs 的危险因素。根据单因素分析的临床相关性和统计学意义选择最终纳入多因素Logistic 回归模型的变量(截断值:P=0.20,表6)。
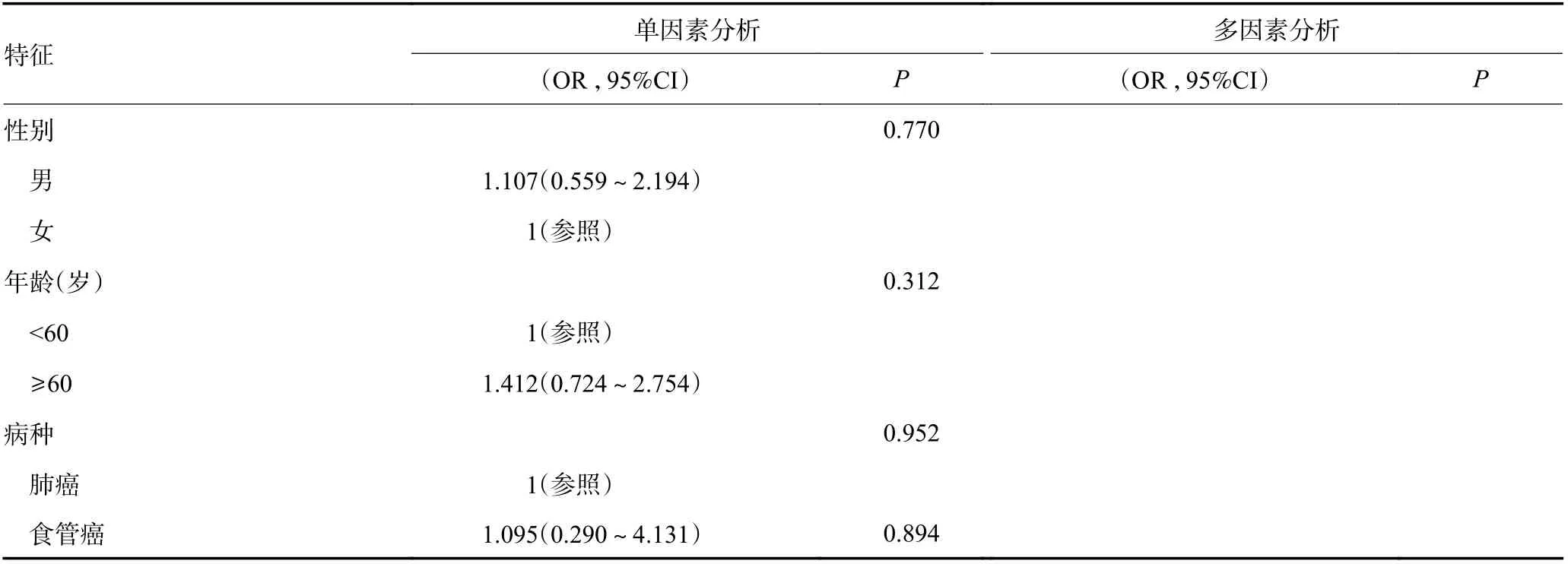
表6 单因素和多因素二元Logistic 回归分析结果
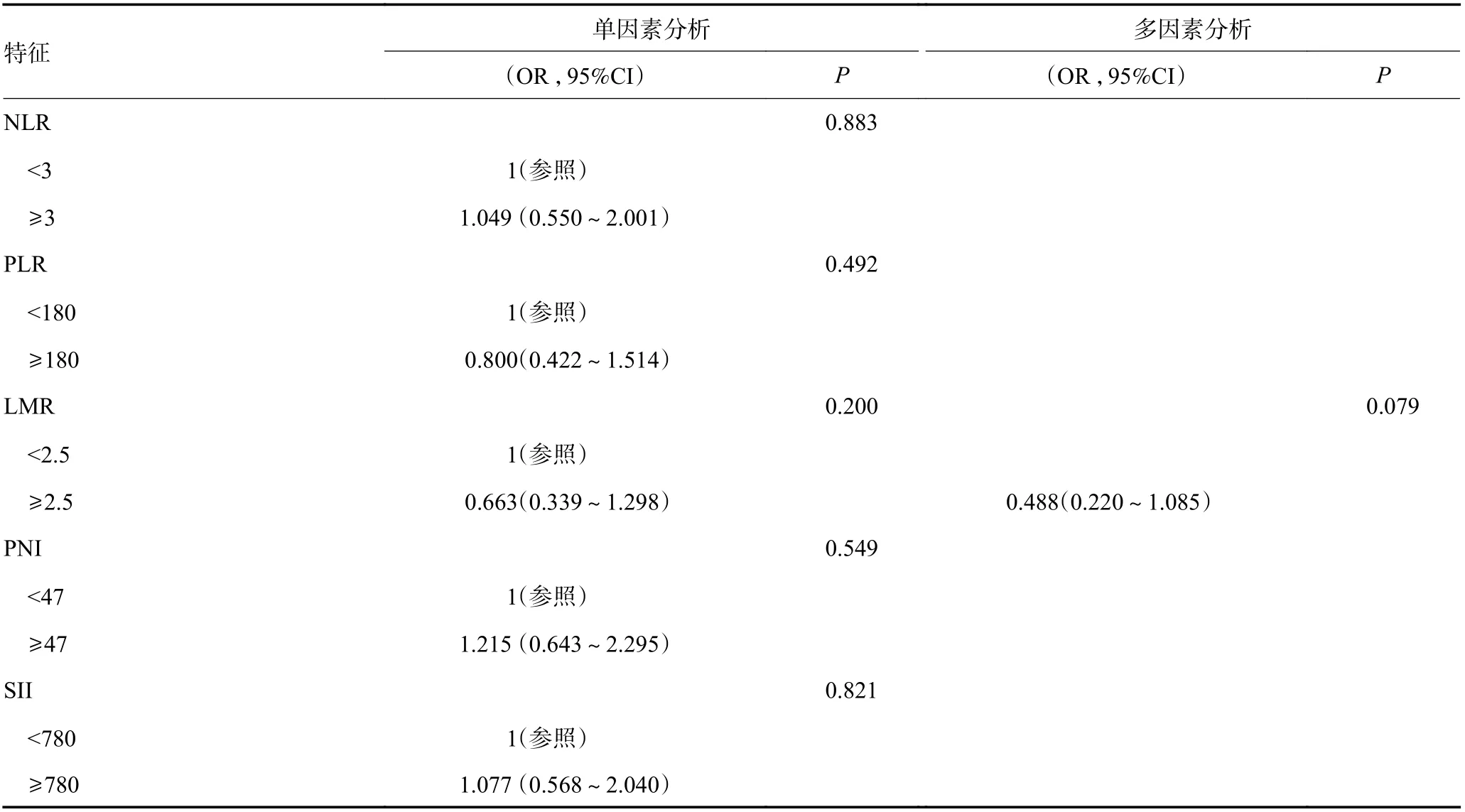
表6 单因素和多因素二元Logistic 回归分析结果 (续表6)
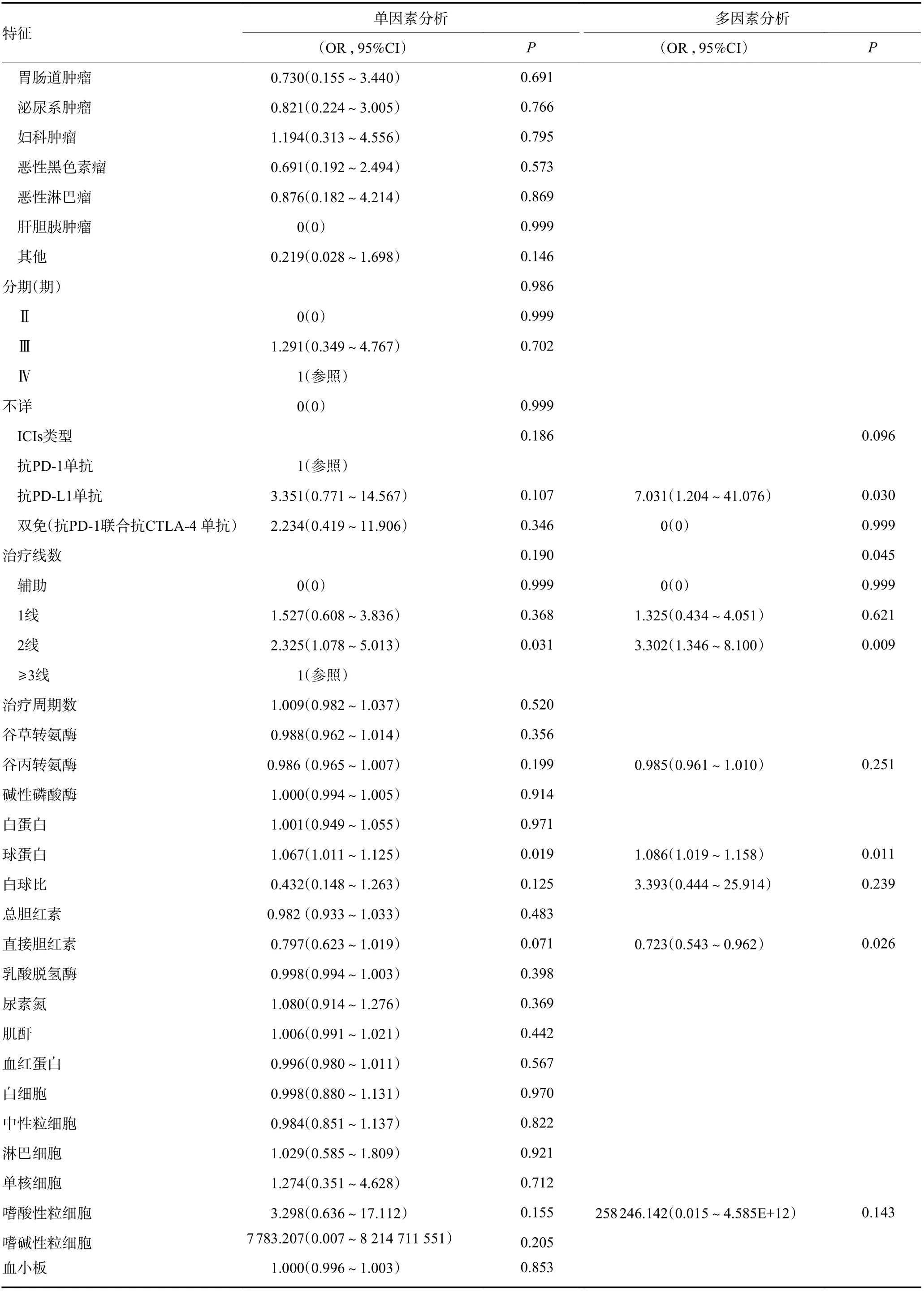
表6 单因素和多因素二元Logistic 回归分析结果 (续表6)
多因素Logistic 回归结果表明,与≥3 线治疗相比,2 线治疗irAEs 发生的风险更大(OR=3.302,P<0.05)。在血液学检查中,球蛋白(OR=1.086,P<0.05)与ir-AEs 的发生呈正相关,而直接胆红素(direct bilirubin,DBIL)(OR=0.723,P<0.05)与其呈负相关。
2.4 构建irAEs 预测模型
根据以上分析结果,采用Logistic 回归方法建立基于“ICIs 类型、治疗线数、球蛋白、DBIL 和LMR”的预测模型。绘制该模型下的受试者工作特征(receiver operating characteristic,ROC)曲线(图2A),曲线下面积(area under the curve,AUC)为0.775(95% CI:0.711~0.840,P<0.05),临界值为0.118,敏感度和特异度分别为92.5%和56.6%。
将上述参数输入验证集,绘制ROC 曲线,验证预测模型。AUC 为0.782(95% CI:0.684~0.880,P<0.05)(图2B),敏感度和特异度分别为100%和52.1%。

基线特征 训练集 n(%) 验证集 n(%) χ2 P性别 0.512 0.474男193(67.7) 122(64.6)女92(32.3) 67(35.4)年龄(岁) 0.929 0.335<60 112(39.3) 66(34.9)≥60 173(60.7) 123(65.1)病种 12.699 0.123肺癌 156(54.7) 94(49.7)食管癌 15(5.3) 10(5.3)胃肠道肿瘤 14(4.9) 13(6.9)泌尿系肿瘤 19(6.7) 21(11.1)妇科肿瘤 14(4.9) 4(2.1)恶性黑色素瘤 22(7.7) 26(13.8)恶性淋巴瘤 12(4.2) 4(2.1)肝胆胰肿瘤 12(4.2) 7(3.7)其他 21(7.4) 10(5.3)分期(期) 7.791 0.051Ⅱ3(1.1) 3(1.6)Ⅲ15(5.3) 22(11.6)Ⅳ265(93.0) 161(85.2)不详 2(0.7) 3(1.6)ICIs类型 0.319 0.853抗PD-1单抗 270(94.7) 177(93.7)信迪利单抗 78(27.4) 48(25.4)帕博丽珠单抗 71(24.9) 49(25.9)纳武利尤单抗 37(13.0) 28(14.8)替雷利珠单抗 19(6.7) 9(4.8)卡瑞利珠单抗 19(6.7) 10(5.3)特瑞普利单抗 6(2.1) 15(7.9)不明或在研药物 40(14.0) 18(9.5)抗PD-L1单抗 8(2.8) 7(3.7)度伐利尤单抗 5(1.7) 2(1.1)阿替利珠单抗 2(0.7) 4(2.1)不明或在研药物 1(0.4) 1(0.5)双免(抗PD-1单抗+抗CTLA-4单抗) 7(2.5) 5(2.6)纳武利尤单抗+伊匹木单抗 5(1.7) 4(2.1)卡瑞利珠单抗+伊匹木单抗 1(0.4) 0(0)帕博丽珠单抗+伊匹木单抗 1(0.4) 1(0.5)治疗线数 6.704 0.082辅助 10(3.5) 16(8.5)1线 63(22.1) 48(25.4)2线 112(39.3) 66(34.9)≥3线 100(35.1) 59(31.2)IrAEs 0.006 0.938否239(83.9) 159(84.1)是46(16.1) 30(15.9)

例数IrAEs类型 好转例数(例)各级 ≥3级 发生率(%) 中位发生时间(周)中位持续时间(周)糖皮质激素治疗数免疫抑制剂治疗数激素替代治疗ICIs停药例数(例)内分泌毒性 39 0 8.2 10 持续 0 0 37 1 39肺炎 20 8 4.2 12 4 17 2 0 7 19皮肤毒性 16 0 3.4 8 4 1 0 0 1 16肝炎 11 4 2.3 7 4 6 1 0 4 11心脏毒性 5 1 1.1 16 4 1 1 0 2 5骨骼肌毒性 5 0 1.1 16 4 3 1 0 0 5发热/乏力 2 0 0.4 12 2 0 0 0 0 2血液学毒性 4 2 0.8 11 3 3 0 0 0 4胃肠道毒性 2 0 0.4 4 2 0 0 0 0 2口腔黏膜损害 1 0 0.2 48 8 1 0 0 1 1

各级 n(%)≥3级 n(%)χ2/P训练集 验证集 训练集 验证集内分泌毒性 26(24.7) 13(13.3) 0.758/0.384 - - -甲状腺功能减退 23(21.9) 10(9.5) - -甲状腺功能亢进 1(0.9) 1(0.9) - -肾上腺皮质功能减退 2(1.9) 2(1.9) - -肺炎 13(13.3) 7(6.7) 0.207/0.649 4(3.8) 4(3.8) 0.348/0.555皮肤毒性 8(7.6) 8(7.6) 0.708/0.400 - - -肝炎 9(8.6) 2(1.9) 2.210/0.137 4(3.8) - 2.675/0.102心脏毒性 2(1.9) 3(2.9) 0.854/0.355 1(0.9) - 0.665/0.415骨骼肌毒性 3(2.9) 2(1.9) 0.000/0.995 - - -发热/乏力 1(0.9) 1(0.9) 0.086/0.769 - - -血液学毒性 3(2.9) 1(0.9) 0.372/0.542 2(1.9) - 1.332/0.248胃肠道毒性 1(0.9) 1(0.9) 0.086/0.769 - - -口腔黏膜损害 - 1(0.9) 1.511/0.219 - - -总计 105(100.0) 15(14.2)毒性类型χ2/P

单因素分析 多因素分析(OR ,95%CI) P (OR ,95%CI) P性别 0.770男1.107(0.559~2.194)女1(参照)年龄(岁) 0.312<60 1(参照)≥60 1.412(0.724~2.754)病种 0.952肺癌 1(参照)食管癌 1.095(0.290~4.131) 0.894特征
3 讨论
近年来,免疫治疗在多种恶性肿瘤的治疗中均占据越来越重要的地位,较大地延长了患者的生存期。然而,irAEs 会严重影响患者的生活质量,增加患者的负担,延迟或中断治疗,甚至危及患者的生命。因此恶性肿瘤免疫治疗不仅需要选择最可能获益的人群,而且要最大限度地降低irAEs 的风险。在当前的免疫治疗时代,寻找高效和特异的irAEs 预测生物标志物是势在必行的。目前几种具有早期预测价值的潜在生物标志物[8-10],这些标志物主要来自循环血液、受累器官、肿瘤微环境和临床参数,其中临床特征结合血液学生物标志物无疑是最方便、最容易获得的指标。如果在免疫治疗前就能预测到irAEs 的风险,那么不良事件的发生就能在很大程度上得到预防或避免。
在以往的研究中,irAEs 的发病率报道各不相同,但多达80%的接受ICIs 治疗的患者经历了irAEs[11-12]。在本研究中,16.03%的患者发生了irAEs。可能有下述几个原因:1)不需干预的轻度irAEs 可能不会被记录。由于本研究分析的数据来自回顾性研究,不良反应的发生率可能低于前瞻性临床试验报道的发生率;2)在某些情况下,糖皮质激素或苯海拉明的联合使用也可能掩盖某些irAEs 的症状;3)部分罕见症状,如关节痛和肌痛,临床医生了解较少,可能不太考虑归因于irAEs;4)可能由于检测和检查不充分,部分无症状的irAEs 无法及时发现。然而,对于有临床意义的irAEs,特别是需要干预的,均已纳入了本研究中。
PD-1 相关毒性一般与CTLA-4 不同。与PD-1抑制剂相比,CTLA-4 抑制剂治疗的患者倾向于出现更高级别的不良反应[13]。具体来说,所有级别的结肠炎、垂体炎和皮疹在CTLA-4 抑制剂中更常见,而PD-1 抑制剂则增加了肺炎、甲状腺功能减退、关节痛和白癜风的风险。本研究中,大多数患者给予PD-1 抑制剂治疗(94.9%);内分泌毒性是最常见的irAE,其次是肺炎和皮肤毒性。在本研究中,最常见的严重irAE 是肺炎,与其他研究相比,报道的发病率较高[14-15]。因为该研究中肺癌患者占52.7%,ICIs 相关毒性在不同肿瘤类型中表现出一定规律性。例如,胃肠道和皮肤毒性在黑色素瘤患者中更常见,而非小细胞肺癌的肺炎发病率较高[16],另一个原因是肺炎的发病率可能被高估了,因为其他情况可能被误认为是肺炎,如感染、间质纤维化等。
本研究将天津医科大学肿瘤医院的66.7%的数据作为训练集,另外33.3%联合山西白求恩医院的数据作为验证集,外部数据可更好地验证和评价预测模型的效能。通过分析接受ICIs 治疗的肿瘤患者的人口统计学和临床特征、实验室数据以及发生irAEs 的数据,并确定了与这些irAEs 相关的危险因素。最后建立了基于“ICIs 类型、治疗线数、球蛋白、DBIL 和LMR”的预测模型。训练集中绘制该模型下的ROC曲线,AUC 为0.775(95%CI:0.711~0.840,P<0.05),临界值为0.118,敏感性和特异度分别为92.5%和56.6%。而在验证集中,其AUC 也可达0.782(95%CI:0.684~0.880,P<0.05),验证了该预测模型的效能。该预测模型中,治疗线数、球蛋白、直接胆红素是独立的预测因素。
与≥3 线治疗相比,2 线治疗irAEs 发生的风险更大(OR=3.302,P<0.05),考虑治疗线数与肿瘤负荷及机体的免疫状态相关。治疗前肿瘤负荷越大,药物诱导T 细胞所需的活化反应越强。一项回顾性研究[17]分析了42 例接受ICIs 治疗的晚期非小细胞肺癌患者,发现高肿瘤负荷是严重irAEs 的重要独立预测因素。严重irAE 与肿瘤负荷>90 mm 的OR 为8.62(95%CI:1.96~37.9,P=0.004)。较后线的治疗也表明肿瘤负荷较高。而发生irAEs 的本质是激活的免疫系统累及正常的组织器官,≥3 线治疗时机体的免疫功能大部分处于免疫抑制甚至衰竭的状态,无法形成高度激活的效应T 细胞从而激活全身炎症反应,因此irAEs 发生率也就低于2 线治疗患者。
而球蛋白(OR=1.086,P<0.05)与irAEs 的发生呈正相关。众所周知,多种自身免疫性疾病的共同点之一就是伴有球蛋白的升高,而irAEs 本质上也是激活的免疫细胞攻击正常组织所致。多项研究表明患有自身免疫性疾病的患者发生irAEs 的风险升高,对经ICIs 治疗后的irAEs 患者进行多因素分析,既往存在的异常抗体如类风湿因子、抗核抗体、抗甲状腺球蛋白、抗甲状腺过氧化物酶等与irAEs 独立相关[18]。PD-1 在活化的B 细胞中高度表达,B 细胞也受T 细胞独立和依赖机制的调控,ICIs 的使用可能诱导B 细胞产生自身抗体,最终触发irAEs。
DBIL(OR=0.723,P<0.05)与irAEs 的发生呈负相关。DBIL 降低一般多考虑患者在近期之内进食蛋白类食物较少所致,而恶性肿瘤患者往往存在营养风险,低血清白蛋白被报道为PD1 相关性肺炎的独立危险因素[19]。但既往尚无DBIL 与irAEs 发生之间的相关报道,仍需进一步的研究确证。
另外一个进入预测模型的是ICIs 类型,一项Meta 分析显示CTLA-4 抑制剂引起irAEs 的发生率为53.8%,高于PD-1(26.5%) 和PD-L1 (17.1% )[20],毒性相关死亡率分别为 CTLA-4 1.08%,双免(PD-1/PD-L1 联合 CTLA-4)1.23%,PD-1 0.36%,PD-L1 0.38%[21]。因此,ICIs 的种类与不同毒性的发生密切相关。本研究中,ICIs 类型未达到统计学意义,但PDL1 抑制剂发生irAEs 风险最高,其次为PD-1,考虑为数据集中不同ICIs 类型比例不均衡所致。对于基础条件不同的患者,ICIs 的选择对患者的整体疗效和安全性具有重要意义。
血细胞计数作为一种高度可用的样本和irAEs 的信号得到了广泛的关注。传统血细胞计数是机体免疫状态的粗略反映,在典型的细胞免疫、体液免疫和肿瘤免疫中起着至关重要的作用。既往研究表明,在使用抗PD-1 抗体治疗的实体肿瘤(包括肺癌、肾癌、黑色素瘤等)患者中,基线较高及ICIs 治疗后升高的ALC、嗜酸性粒细胞(absolute eosinophils count,AEC)与irAEs 的发生密切相关(基线ALC>2 000, AEC≥100)[22]。一项多中心回顾性研究评估pembrolizumab 治疗非小细胞肺癌患者,结果治疗前ALC>1 450和LMR>1.6 与irAEs 发病风险降低显著相关,而NLR>2.3 和PLR>165 与其风险增加相关[23]。本研究预测模型中,LMR≥2.5 者irAEs 发病风险也是降低的,这与既往研究结果相一致[22,24]。
因此,基于“ICIs 类型、治疗线数、球蛋白、DBIL 和LMR”的预测模型可以反映不同的免疫治疗类型、肿瘤负荷、机体免疫状态、营养状态及药物代谢等多个方面的功能。它可以很好地预测单纯免疫治疗时irAEs 的发生,利用两个外部中心数据集对预测模型进行了验证。在本研究中,主要利用真实数据发现常规可用的临床特征、外周血数据和irAEs 之间的关联。这些生物标记物一旦经过验证,通常很容易获得,在临床实际中使用时不需要额外的费用或检查。另外,我们也针对非小细胞肺癌接受ICIs 治疗者建立了基于“治疗线数、天门冬氨酸转氨酶、乳酸脱氢酶、ALC、SII”的irAEs 的预测模型,其ROC 曲线的AUC 为0.722(95%CI:0.650~0.793,P<0.05),临界值为0.247,敏感度和特异度分别为62.9%和74.6%[25]。
本研究也存在一些局限性。首先,这项研究是回顾性的,因此,可能包含了信息偏移。其次,本研究的结果不包括治疗结果的评估,如总生存期和无进展生存期。需要进一步的研究确定治疗结果与irAEs 及其与生物标志物的关系。再次,本研究是基于临床特征和外周血生物标志物建立的预测模型。既往研究表明免疫细胞亚群[26]和多种细胞因子和趋化因子[27-28]也与irAEs 的发生密切相关;因此,后续计划开展前瞻性研究,在检测免疫细胞亚群和细胞因子/趋化因子水平的同时,对预测模型进行验证和评价,并对预测模型进行优化,以达到更好的预测效果。
综上所述,本研究基于真实的恶性肿瘤免疫治疗数据库,分析了ICIs 治疗后发生irAEs 的相关因素,并最终基于临床特征和血液学生物标志物建立了预测模型。这为肿瘤免疫治疗的临床研究提供了一定的方向。随着对健康相关成本和精准医疗的日益关注,临床特征和外周血标志物在肿瘤免疫治疗中的预测作用非常有意义,预防或尽量减少irAEs 的发生至关重要。

