Cys-C、sTRAIL、PDGF 血清表达与慢性乙肝肝硬化病情程度间关联性及预后预测价值探究
廉娜
(河南省焦作煤业集团有限责任公司中央医院检验科,河南 焦作454000)
流行病学调查显示, 我国肝硬化多继发于乙型肝炎病毒(HBV)感染,并随慢性乙肝患者增多,发病率呈明显升高趋势[1-2],同时,根据相关并发症严重程度, 慢性乙肝肝硬化患者1 年内病死率可达1~57%[3]。 Child-Pugh 肝功能分级为临床常用慢性乙肝肝硬化患者肝损伤评估指标, 但受主观因素影响,准确性较差。 近年来,随医学研究不断发展,利用有创性小的血清学指标,监测肝硬化发展进程已成为研究热点。 据报道, 在慢性乙肝患者中,随时间延长,肝实质反复炎症导致肝细胞外基质大量增生出现纤维化加重, 且在此基础上随病情进展可破坏肝小叶结构, 进一步发展成为肝硬化[4-5]。 而血清胱抑素-C(Cys-C)水平上升,可反映肝脏炎症过程。 可溶性肿瘤细胞坏死因子相关凋亡诱导配体(sTRAIL)可调节免疫系统,参与感染、炎症、自身免疫性疾病与细胞凋亡的过程。 血小板衍生生长因子(PDGF)可刺激肝纤维组织增生,促进肝纤维化进展。 既往研究已证实血清Cys-C、sTRAIL、PDGF 在慢性乙肝患者中的应用价值,但关于上述指标与慢性乙肝肝硬化患者病情程度的关系及联合表达对慢性乙肝肝硬化患者预后预测价值鲜有报道。基于此,本研究初次探讨血清Cys-C、sTRAIL、PDGF 表达与慢性乙肝肝硬化病情程度的相关性及对预后的预测价值。 具体分析如下。
1 资料和方法
1.1 一般资料 选取2017 年11 月至2019 年5 月我院慢性乙肝肝硬化患者119 例设为研究组,另选取健康体检者119 例设为对照组。研究组:女53例,男66 例,年龄46~78 岁,平均(62.19±7.22)岁;体质量指数 (BMI)17.2~27.6kg/m2, 平均 (23.36±1.54)kg/m2; 慢 性 乙 肝 病 程7.5~30.8 年, 平 均(20.83±4.75)年;依据Child-Pugh 肝功能分级分为轻度(A 级)49 例、中度(B 级)41 例、重度(C 级)29例;对照组:女50 例,男69 例,年龄48~76 岁,平均 (61.95±6.87) 岁;BMI 17.0~27.8kg/m2, 平 均(22.92±1.63)kg/m2。 两组基本资料 (年龄、 性别、BMI)均衡可比(P>0.05)。
1.2 选取标准
1.2.1 纳入标准 (1)研究组均符合《2015 JSGE 循证临床实践指南:肝硬化》[6]中诊断标准,并经腹部CT、B 超、肝组织活检等证实为肝硬化;乙肝表面抗原(HBsAg)阳性>6 个月;(2)两组临床资料均完整,且患者及家属签署知情同意书。
1.2.2 排除标准 (1)合并甲肝、丙肝感染或获得性免疫缺陷综合征者;(2)合并酒精性肝病、代谢遗传性肝病、 原发性胆汁性肝硬化或其他类型肝病者;(3)肝癌或其他部位恶性肿瘤者;(4)肾、肺等重要脏器器质性病变者;(5)既往有肝脏手术史者;(6)合并冠心病、糖尿病等基础疾病者;(7)认知功能障碍或精神行为异常者。
1.3 方法
1.3.1 检测方法 空腹取6 mL 静脉血, 离心12 min,3 000 r/min,离心半径16 cm,分离取血清,置于-20 ℃冰箱低温保存:(1) 采用乳胶增强免疫透射比浊法检测血清Cys-C 水平, 试剂盒购自郑州科欣生物技术有限公司;(2)采用单克隆双抗体夹心ABC 酶联免疫吸附试验 (ELISA) 检测血清sTRAIL 水平, 试剂盒购自上海钰博生物科技有限公司;(3) 采用ELISA 法检测血清PDGF 水平,试剂盒购自上海广锐生物科技有限公司, 上述操作均严格按照试剂盒说明书执行。
1.3.2 治疗方法 研究组均接受甘草酸二铵肠溶胶囊保肝治疗,饭后口服,每次3 粒,3 次/d,同时口服恩替卡韦,每次0.5 mg,1 次/d,持续服用12 个月。
1.4 统计学方法 应用SPSS 22.0 软件进行统计学分析,计量资料以均数±标准差表示,组间比较采用独立样本t 检验,多组间比较采用单因素方差分析,多重比较采用LSD-t 检验,计数资料用百分比表示, 采用χ2检验,Cys-C、sTRAIL、PDGF 与慢性乙肝肝硬化关联性采用Logistic 回归分析, 采用Spearman 相关性进行两变量的相关性分析, 绘制受试者工作特征曲线 (ROC) 得到曲线下面积(AUC),检验Cys-C、sTRAIL、PDGF 对慢性乙肝肝硬化预后预测价值,AUC>0.9 表示预测性能较高,0.71~0.90 表示有一定的预测性能,0.5~0.7 表示预测性能较差,<0.5 表示没有预测效能,P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清Cys-C、sTRAIL、PDGF 表达 研究组血清Cys-C、sTRAIL、PDGF 表达高于对照组 (P<0.05)。 见表1。
表1 两组Cys-C、sTRAIL、PDGF 比较(±s)
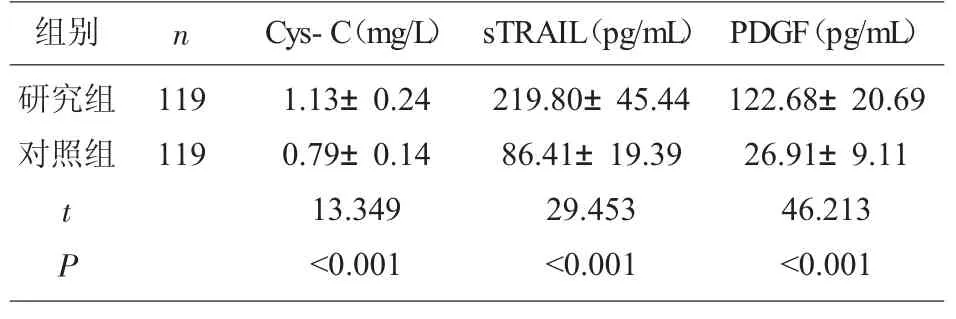
表1 两组Cys-C、sTRAIL、PDGF 比较(±s)
组别 n研究组对照组119 119 t P Cys-C(mg/L) sTRAIL(pg/mL)1.13±0.24 0.79±0.14 13.349<0.001 219.80±45.44 86.41±19.39 29.453<0.001 PDGF(pg/mL)122.68±20.69 26.91±9.11 46.213<0.001
2.2 Cys-C、sTRAIL、PDGF 与慢性乙肝肝硬化关联性 以慢性乙肝肝硬化作因变量, 将Cys-C、sTRAIL、PDGF 作自变量,纳入Logistic 回归分析模型,结果显示,Cys-C、sTRAIL、PDGF 与慢性乙肝肝硬化具有显著关联性(P<0.05)。 见表2。
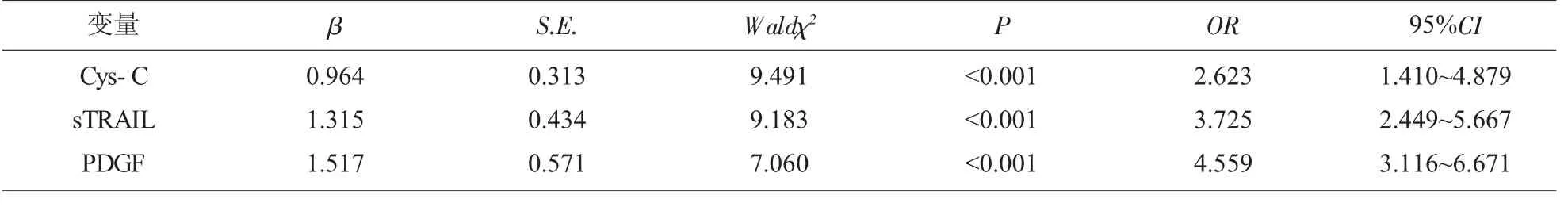
表2 Cys-C、sTRAIL、PDGF 与慢性乙肝肝硬化关联性
2.3 不同病情程度患者血清指标表达 不同病情程度慢性乙肝肝硬化患者血清Cys-C、sTRAIL、PDGF 表达间存在显著差异(P<0.05),且中度患者血清Cys-C、sTRAIL、PDGF 表达高于轻度患者(P<0.05);重度患者血清Cys-C、sTRAIL、PDGF 表达高于中度患者(P<0.05)。 见表3。
表3 不同病情程度患者血清Cys-C、sTRAIL、PDGF 表达(±s)
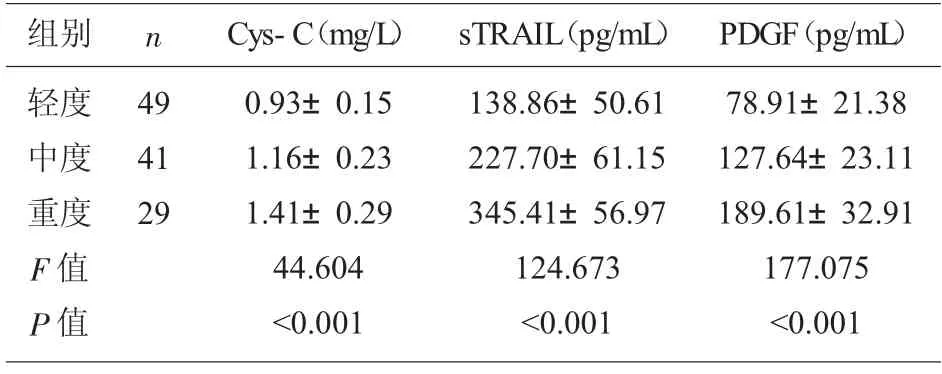
表3 不同病情程度患者血清Cys-C、sTRAIL、PDGF 表达(±s)
组别 n轻度中度重度F 值P 值49 41 29 Cys-C(mg/L) sTRAIL(pg/mL)0.93±0.15 1.16±0.23 1.41±0.29 44.604<0.001 138.86±50.61 227.70±61.15 345.41±56.97 124.673<0.001 PDGF(pg/mL)78.91±21.38 127.64±23.11 189.61±32.91 177.075<0.001
2.4 血清指标与慢性乙肝肝硬化病情程度相关性Spearman 分析得知,Cys-C、sTRAIL、PDGF 与慢性乙肝肝硬化病情程度呈正相关性(P<0.05),见表4。
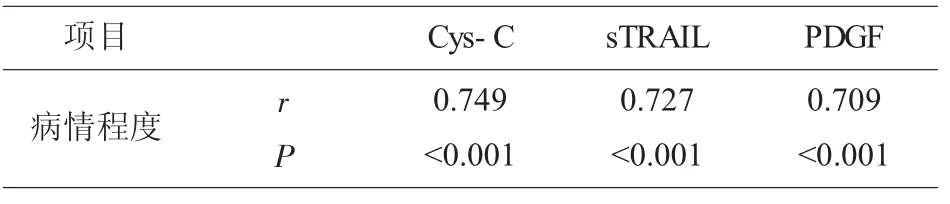
表4 Cys-C、sTRAIL、PDGF 与慢性乙肝肝硬化病情程度相关性
2.5 不同预后患者Cys-C、sTRAIL、PDGF 比较 随访6 个月, 研究组119 例患者中HBV-DNA 阳性者31 例, 预后良好者血清Cys-C、sTRAIL、PDGF表达低于预后不良者(P<0.05),见表5。
表5 研究组不同预后患者血清指标比较(±s)
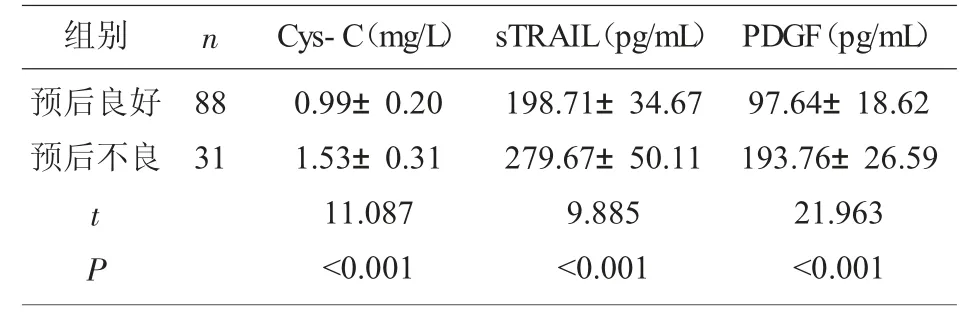
表5 研究组不同预后患者血清指标比较(±s)
组别 n预后良好预后不良88 31 t P Cys-C(mg/L) sTRAIL(pg/mL)0.99±0.20 1.53±0.31 11.087<0.001 198.71±34.67 279.67±50.11 9.885<0.001 PDGF(pg/mL)97.64±18.62 193.76±26.59 21.963<0.001
2.6 Cys-C、sTRAIL、PDGF 对慢性乙肝肝硬化预后预测价值 绘制Cys-C、sTRAIL、PDGF 对慢性乙肝肝硬化预后预测价值ROC 曲线,Cys-C AUC 为0.718,95%CI 为0.629~0.797,Z 值为3.709,P 值为0.000,当截断值>1.46 mg/L 时,敏感度为54.84%、特 异 性 为84.09%;sTRAIL AUC 为0.781,95%CI为0.696~0.851,Z 值为5.660,P 值为0.000,当截断值>231.00 pg/mL 时,敏感度为77.42%、特异性为69.32%;PDGF AUC 为0.809,95%CI 为0.727 ~0.875,Z 值 为7.272,P 值 为0.000, 当 截 断 值>131.31 pg/mL 时, 敏感度为70.97%、 特异性为81.82%;联合检测AUC 为0.875,95%CI 为0.788~0.962,Z 值 为8.467,P 值 为0.000, 敏 感 度 为77.42%、特异性为92.05%。 见图1。

图1 血清Cys-C、sTRAIL、PDGF对慢性乙肝肝硬化预后预测价值
3 讨论
肝纤维化是机体对慢性肝损伤的一种修复反应,也是慢性乙肝进展为肝硬化的必经环节[7-8]。 因此准确判断肝纤维化程度, 对判断肝硬化病情严重程度、评估预后具有积极意义。
Cys-C 属胱蛋白超家族中一员,具有抑制或调节组织蛋白酶活性作用, 是早期反映肾小球滤过率的生化标记物, 亦是评估早期肾功能损害的灵敏性指标[9-10]。本研究结果显示,慢性乙肝肝硬化患者血清Cys-C 表达明显高于健康体检者。 血清Cys-C 表达上调,一定程度会影响基质金属蛋白酶及其抑制物基质金属蛋白酶抑制剂的平衡, 参与细胞外胶原蛋白的生成与沉积,加重肝纤维化,参与慢性乙肝肝硬化的发生、进展[11]。另外,赵直光等[12]通过研究血清Cys-C 与Child-Pugh 肝功能分级关联性可知,血清CysC 是乙型肝炎性肝硬化发生的高危因素, 并与Child-Pugh 评分存在正相关关系,与本研究观点一致。 肝组织损伤后,可激活半胱氨酸蛋白酶等组织蛋白酶, 增强血管内皮细胞及肝细胞线粒体外膜通透性, 促进大量凋亡因子释放,从而导致细胞凋亡,而机体为对抗组织蛋白酶所致“损害效应”,会应激性增加CysC 含量,最终形成恶性循环, 加重慢性乙肝肝硬化患者病情程度[13]。 经ROC 曲线进一步证实,当截断值>1.46 mg/L 时, 血清Cys-C 对慢性乙肝肝硬化患者预后的预测特异性可达84.09%, 有力佐证了血清Cys-C 表达具有成为预测慢性乙肝肝硬化患者预后的特异性指标潜力,可选取个性化治疗方案,判断预后提供新靶点。
sTRAIL 通过结合细胞膜上相应受体, 在机体免疫调节、 免疫自稳及免疫监视中发挥重要作用[14]。 本研究发现,血清sTRAIL 在慢性乙肝肝硬化患者中过度表达, 考虑可能为活化肝星状细胞(HSC)表面TRAIL 受体蛋白表达升高,导致HSC对TRAIL 所致肝细胞凋亡敏感度也随之增强,从而引发组织、细胞严重坏死,加快肝纤维化进展。经Spearman 相关性分析, 血清sTRAIL 表达与慢性乙肝肝硬化患者病情程度存在明显正相关性。血清sTRAIL 与可溶性血管细胞黏附分子-1 (sVCAM-1)具有协同作用,当血清sTRAIL 水平异常高表达时,载体调节的细胞因子会产生主动转运,而经细胞因子级联反应, 损伤肝细胞会形成多元性瀑布效应,从而诱导肝细胞凋亡,加剧肝脏损伤严重程度,加重病情程度[15]。 进一步对比不同预后患者血清sTRAIL 表达显示, 血清sTRAIL 在预后不良患者呈异常升高态势,提示血清sTRAIL 高表达可能会增加慢性乙肝肝硬化患者死亡风险,严重影响预后改善。 推测早期下调血清sTRAIL 水平可能是促进慢性乙肝肝患者预后改善的重要原因。
PDGF 与细胞表面PDGF 受体结合,能介导下游信号通道转导,在肝纤维化发生、进展中发挥重要作用[16]。 通过ELISA 法检测发现,血清PDGF 在慢性乙肝肝硬化患者中呈异常高表达状态, 并随病情程度加重出现升高趋势,与林勇[17]结果相似。同时,刘典勋等[18]报道也证实,血清PDGF 表达提示乙型肝炎肝硬化患者肝功能损伤状况。PDGF 能激活并活化静止HSC,缩短HSC 分裂周期时间,加快HSC 增殖, 同时又促使新合成细胞迁移至相关部位,迅速结合受体,产生细胞外基质与相应胶原蛋白,诱导HSC 分泌转化生长因子β1(TGF-β1)等细胞因子, 一定程度会促进纤维连结蛋白及蛋白多糖的合成,加重肝脏组织损害程度[19]。 但Cys-C、sTRAIL、PDGF 预测慢性乙肝肝硬化患者预后价值均存在一定局限性, 故本研究采用联合预测方式,结果显示,Cys-C、sTRAIL、PDGF 联合预测慢性乙肝肝硬化患者AUC 优于上述指标单一预测,提示三者联合对慢性乙肝肝硬化患者预后具有一定指导价值,可为临床预后评估提供新途径。
综上可知,血清Cys-C、sTRAIL、PDGF 表达与慢性乙肝肝硬化患者病情程度存在明显正相关性, 三者联合有望成为评估慢性乙肝肝硬化患者预后的有效手段,为临床判断病情程度、预测预后提供循证指导。

