基于微流控芯片分析气滞胃痛片中不同药效组分对炎症细胞GES-1的影响
秦鑫鹏,包永睿,2,3,王帅,2,3,李天娇,2,3,孟宪生,2,3
(1.辽宁中医药大学药学院,辽宁 大连 116600;2.辽宁省中药多维分析专业技术创新中心,辽宁 大连 116600;3.辽宁省现代中药研究工程实验室,辽宁 大连 116600)
急性胃炎是指急性胃黏膜病变,具有发病急促、病情蔓延速度快等特征,极大地影响了患者的生活质量。随着时代的快速发展,生活节奏加快,饮食不规律等导致急性胃炎发病率显著提升[1-4]。目前临床上主要用奥美拉唑治疗急性胃炎[5]。奥美拉唑是一种质子泵抑制剂,短时间便可以发挥药效,但缺点也十分明显,即有很强的耐药性,一般一周左右便难以发挥药效。而且采用奥美拉唑仅是缓解症状,治标不治本。气滞胃痛片由柴胡、枳壳、醋香附、白芍、炙甘草、醋延胡索6味药材组成,具有疏肝理气、和胃止痛的作用,常用于肝郁气滞所致的胸痞胀满,胃脘疼痛等症[6-7],可快速缓解急性胃炎症状,治标治本,在临床上对于急性胃炎具有很好的治疗效果。但是,气滞胃痛片对急性胃炎的药效物质基础并不明确。
微流控芯片技术具有试剂消耗少、体积小、可精确控制流体流速等优点,在分析检测领域发展迅速[8-9]。与传统 96 孔板相比,微流控芯片可以动态培养细胞和动态给药,更接近人体给药实际过程,还可实现多组分药物的同时筛选。因此,本研究采用微流控芯片,从细胞死亡(包括凋亡和坏死)和炎症因子表达等角度,研究气滞胃痛片中不同药效组分对炎症细胞GES-1的影响,以期明确气滞胃痛片的抗炎药效物质基础。
1 材料
1.1 主要仪器与设备 LSP04-1A 型精密注射泵(保定兰格公司);TG-2U 型光刻机(北京中科同志科技有限公司);W2001R 型 CO2培养箱(美国 SIM 公司);SC-1B 型匀胶机、BP-2B 型烘胶台(北京创世威纳科技有限公司);SC-1B 型匀胶机、BP-2B 型烘胶台(北京创世威纳科技有限公司);NIKON ECLIPSE TI 荧光倒置显微镜(日本 Nikon 公司);HPDC-32G-2 型等离子清洗机(Harrick Plasma 公司);酶标仪(美国 Molecular Drvices 公司);Sorvall Fresco 高速离心机(美国科峻仪器公司);图像处理软件 Image ProPlus 6.0 ( IPP,美国 Median Cybernetics 公司)。
1.2 药材与试剂 气滞胃痛片(规 格:0.5 g/片, 批 号: 20220101 )由华润三九医药股份有限公司提供,柴胡、枳壳、醋香附、白芍、炙甘草、醋延胡索6味药材均经辽宁中医药大学药用植物教研室许亮教授依据《中国药典》2020年版鉴定为正品;黄芪甲苷对照品(成都普菲德生物技术有限公司,批号:19092903);细胞死活检测试剂盒[钙黄素Calcein-AM/碘化丙啶(PI),北京索莱宝科技有限公司];1640培养基、0.25%胰蛋白酶-EDTA、胎牛血清(美国GIBCO公司);细胞凋亡/坏死检测试剂盒(含Hoechst 33342染液和PI,碧云天生物技术研究所);负性环氧树脂光刻胶 SU-8 及显影液(美国Micro-Chem公司);青霉素/链霉素混合溶液(美国Hyclone公司);磷酸盐缓冲液(PBS,北京索莱宝科技有限公司);TNF-α含量检测试剂盒(美捷科技有限公司);CCK-8增强型溶液(Meilunbio公司)。
1.3 细胞株 人胃黏膜细胞GES-1购自上海艾研生物科技有限公司。
2 方法
2.1 气滞胃痛片各组分的选择 依据文献调研,气滞胃痛片中柴胡皂苷[10-11]、枳壳黄酮[12-13]、香附黄酮[14-15]、白芍皂苷[16]、甘草黄酮[17-18]、延胡索生物碱[19]6个药效组分报道较为广泛,推测可能与炎症相关,因此本研究选择这6组组分作为可能的抗炎药效组分,进行后续研究。
2.2 气滞胃痛片各组分的制备
2.2.1 柴胡皂苷 依据池雪洁等[20]的方法提取纯化柴胡皂苷,将柴胡皂苷提取液用D101大孔树脂分离洗脱,洗脱液水浴加热浓缩至近干,减压干燥,加入培养基配制成柴胡皂苷培养液。
2.2.2 枳壳黄酮 依据傅华强等[21]的方法提取纯化枳壳黄酮,将枳壳黄酮提取液用AB-8型大孔树脂分离洗脱,后续配备溶液方法同“2.2.1”项下。
2.2.3 香附黄酮 依据赵洪超[22]的方法提取纯化香附黄酮,将香附黄酮提取液用AB-8型大孔树脂分离洗脱,后续配备溶液方法同“2.2.1”项下。
2.2.4 白芍皂苷 依据陈佳亮[23]的方法提取纯化白芍皂苷,将白芍皂苷提取液用AB-8型大孔树脂分离洗脱,后续配备溶液方法同“2.2.1”项下。
2.2.5 甘草黄酮 依据康彤[24]的方法提取纯化甘草黄酮,将柴胡皂苷提取液用D101大孔树脂分离洗脱,后续配备溶液方法同“2.2.1”项下。
2.2.6 延胡索生物碱 依据孙静等[25]的方法提取纯化延胡索生物碱,将延胡索生物碱提取液用 732 型阳离子交换树脂分离洗脱,后续配备溶液方法同“2.2.1”项下。
2.3 溶液的配制
2.3.1 阳性药配制 取黄芪甲苷对照品适量,加入 1640 培养基配制成 0.1 mg·mL- 1的溶液,超声 15 min助溶,过 0.22 μm微孔滤膜即得,4 ℃保存备用[26]。
2.3.2 含药培养液的配制 依据冯峰等[27-28]的方法筛选安全给药浓度,确保细胞数目在给药前后无明显变化,便于 TNF-α炎症因子的含量检测和细胞凋亡坏死研究。称取适量气滞胃痛片及上述 6 个组分,依据“2.5”项实验结果配制各药物浓度,即:加入 1640 培养基分别配制成 0.05 mg·mL- 1复方含药培养液、0.2 mg·mL- 1柴胡皂苷含药培养液、0.05 mg·mL- 1枳壳黄酮含药培养液、0.1 mg·mL- 1香附黄酮含药培养液、0.01 mg·mL- 1白芍皂苷含药培养液、0.01 mg·mL- 1甘草黄酮含药培养液、0.05 mg·mL- 1延胡索生物碱含药培养液。
2.4 LPS诱导GES-1体外炎症模型的建立 将GES-1细胞以每孔 1×104接种于96孔板内,置于5% CO2、37 ℃的培养箱中常规培养 24 h ,弃上清并设立空白对照组及 LPS梯度浓度组(0.005、0.01、 0.1、0.25、0.5、1、2、5、10、50 μg·mL- 1)[29-30],每组设 3 个复孔,给药后继续避光培养24 h,采用CCK-8法,用酶标仪在 450 nm 处测定吸光度(OD)。细胞存活抑制率=(1-实验组OD值/对照组OD值)×100%,计算 IC50并筛选最佳造模浓度。
2.5 各组药物的细胞毒性和最佳给药浓度 按“2.4”项下培养方法常规培养细胞24 h后,弃上清,并设立空白对照组、阳性药、组分给药组(每组的组分给药梯度均为0.01、0.05、0.10、0.20、0.50、1.00 mg·mL- 1),每组设 3 个复孔,各组分别给药 100 μL 样品溶液,继续培养 24 h 后,采用 CCK-8 法用酶标仪在 450 nm 处测定OD值,并按照“2.4”项下方法计算给药组分对细胞存活的影响,以对细胞无增殖作用且抑制率小于5%为指标,筛选最佳给药浓度。
2.6 各组药物对炎症细胞GES-1合成分泌TNF-α含量的影响 按“2.4”项下培养方法常规培养细胞24 h后,弃上清,并按照“2.4”“2.5”项下筛选的最佳造模和最佳给药浓度设立空白组、炎症模型组、阳性药组及组分给药组,各组分别每孔给药 100 μL(阳性药组和给药组分组终浓度符合“2.4”“2.5”项下筛选浓度),空白组给1640培养基 100 μL,除空白组外,其余各组均给予LPS进行造模,避光培养24 h后,各组分别取上清,离心去杂,吸取上清液,按照 TNF-α试剂盒的步骤测量炎症因子的含量。
2.7 芯片的设计与制作 本实验构建一种集成有微阀结构的高通量药物筛选芯片,形似雪花称为“雪花芯片”,该芯片分为上、中、下三个部分,上部为微阀控制层,中部为流体通道层,下部为玻璃基底层。最外围 18 个红色孔为细胞及药物入口,半径为 1.8 mm;中部白色椭圆孔为细胞培养区,由 3×6 组培养通道构成,每组设 4 个复孔,培养腔为椭圆形,孔径为 1.2 mm×0.9 mm,每3个小组之间有一个白色圆孔,可以作为废液收集口;最中间的蓝色孔为共用废液口及细胞入口。整体芯片尺寸为长 5 cm,宽 5 cm,厚度约为 0.8 cm,示意图见图1。
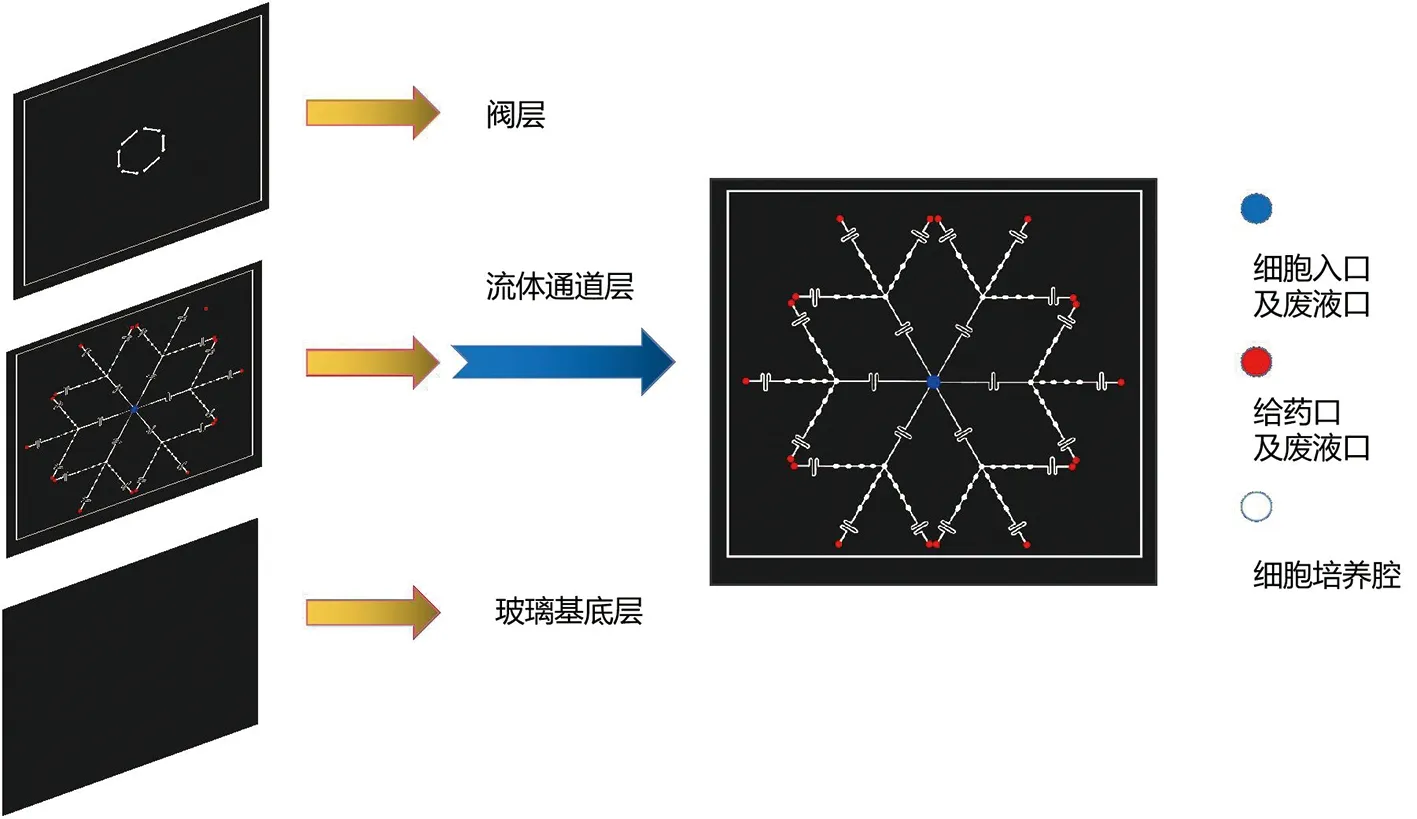
图1 微流控芯片结构示意图
雪花芯片基于实验室前期研究方法[31-33]进行制作。阀层通过液压的方式隔绝其他组别之间的干扰,可以由外围红色孔给不同浓度的药液,于中心蓝色孔收集废液,也可以由蓝色孔给予药液,红色孔收集废液作后续研究。每组4个复孔作为平行实验,也可以4个复孔作为一组,与其他组作平行实验。该芯片特点是正向反向可以同时使用,可按照实验的需要自由选择。中心蓝色孔可以作为总入口,通入细胞以及培养液等,均可由该孔一并完成,操作方便快捷,满足气滞胃痛片抗炎多组分的要求。该芯片可用于细胞培养、药效筛选、作用机制等研究,实物图见图2。

图2 微流控芯片实物图
2.8 芯片的预处理[34-35]向芯片流体通道内通入75%乙醇清洗10 min,再用无菌超纯水冲洗通道数次直至无乙醇残留,于60 ℃加热烘干,置于细胞超净台中紫外照射 30 min灭菌后即可使用。
2.9 芯片中GES-1细胞培养及生长状态考察 按“2.4”项下培养方法常规培养GES-1细胞,待细胞处于对数生长期时,调整细胞密度为5×105个/cm2,接种于微流控芯片中,待细胞贴壁后,将培养液以1 μL· min-1的流速通过精密注射泵注入芯片中进行动态培养。细胞在培养 24、 48、72 h后分别用活死试剂盒对其染色,检测GES-1细胞活力,绿色为存活细胞,细胞存活率(%)=活细胞数/总细胞数×100%。
2.10 气滞胃痛方中各组分对芯片中炎症细胞GES-1的凋亡和坏死作用 本实验以该芯片一条通路上的4个复孔为一组,与其他组作平行实验,按“2.4”和“2.9”项下方法培养细胞并接种于微流控芯片动态培养 24 h 后,以1 μL· min-1的流速通过精密注射泵向模型组注入 0.005 μg·mL-1脂多糖(LPS)溶液动态培养24 h,以1 μL· min-1的流速通过精密注射泵向组分给药组注入终浓度符合“2.4”“2.5”项下筛选浓度的溶液动态培养 24 h,以 1 μL· min-1的流速通过精密注射泵向空白组注入1640 培养基动态培养 24 h后,用Hoechst 33342/PI对细胞进行双染。
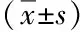
3 结果
3.1 各组造模以及最佳给药浓度和 TNF-α炎症表达 分别按“2.4”“2.5”“2.6”项下方法进行细胞常规培养和给药刺激,经过 SPSS 26.0软件对脂多糖(LPS)梯度和细胞存活抑制率进行预测,测得脂多糖(LPS)IC50为0.006 μg·mL- 1,本实验设置多个梯度,其中脂多糖(LPS)浓度为 0.01 μg·mL- 1时抑制率为50.42%,满足实验要求。为便于配制溶液,最终采用 0.01 μg·mL- 1脂多糖(LPS)浓度为最佳造模浓度;TNF-α炎症表达按照试剂盒步骤严格操作,最佳给药浓度以及TNF-α 炎症表达(见表1)。根据结果可得各组炎症因子含量,标准曲线为Y=0.001 3X+0.065 3(线性范围:31.5~1 000 pg·mL- 1),R2=0.997 2 ,各组与模型组相比均具有较好的抑制作用,炎症因子含量明显降低,且结果均具有统计学意义(P<0.05),其中甘草黄酮和延胡索生物碱这两组的药效最好,炎症表达与模型组相比差异显著(P<0.01),效果最好,药物各组分作用于炎症细胞GES-1后炎症因子的含量(见图3)。
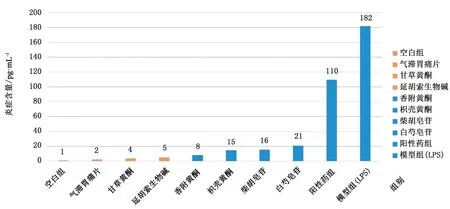
图3 药物各组分作用于炎症细胞GES-1后炎症因子的含量 注:图中橙色表示与模型组相比差异极显著(即P<0.01)
3.2 芯片中GES-1细胞生长活力检测 按“2.4”项下培养方法常规培养细胞至对数生长期,调整细胞密度后接种于微流控芯片中,一般2~ 4 h即基本贴壁,培养24、48、72 h后细胞形态正常,生长良好,细胞存活率90%以上,芯片观察示意图,如图4所示。不同时间点细胞活死检测试剂盒荧光图片,如图5所示。
图4 芯片观察示意图
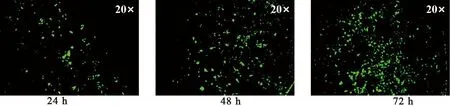
图5 不同时间点细胞活死检测试剂盒荧光图片
3.3 芯片中气滞胃痛片及各组分对炎症细胞GES-1的促凋亡和坏死的作用 按“2.10”项下方法培养细胞并进行荧光染色后,通过荧光倒置显微镜拍摄结果,蓝色为凋亡细胞,红色为坏死细胞,荧光结果见图6。将结果导入Image Pro Plus 6.0 分析计算凋亡坏死率,凋亡坏死率=(凋亡细胞数+坏死细胞数)/总细胞数,根据结果可知,各组与模型组相比均明显抑制了细胞的凋亡坏死,结果均具有统计学意义(P<0.05),并且气滞胃痛片、甘草黄酮和延胡索生物碱这三组抑制率最好,与空白组相比,凋亡坏死率无明显差异(P≥0.05),可认为这三组细胞已基本恢复正常,结果见表1。

表1 各组细胞凋亡坏死率、炎症因子含量和最佳给药浓度结果表

图6 各组作用于GES-1细胞24 h的Hoechst 33342/PI双染荧光图
4 讨论
微流控技术在体外药效筛选、显微荧光分析等方面具有较好的应用,随着研究技术、图像处理分析技术的不断发展,微流控技术在炎症药效筛选方面展现出极大的应用前景。本文设计了“雪花”芯片,整体形似雪花状,特点是可以正向和反向同时使用。本芯片安装有液压阀,在阀层通入液体即产生形变,阻断通道内液体的流动,其他通道内液体流动则不受影响,可以根据实验组别数量以及给药浓度的不同进行合理安排。“雪花”芯片内细胞生长良好,并且与传统96 孔板相比细胞以及给药过程更接近真实人体,同时雪花芯片能满足气滞胃痛片及其组分抗炎症多组分的同时筛选,结合荧光影像和图片分析技术对于抗炎的药效筛选大有裨益。
根据模型组凋亡和坏死的结果可知,细胞的凋亡和坏死数目较多,而在甘草黄酮和延胡索生物碱组中,仅见少量凋亡,坏死情况极少,结合邵敬宝等[36-37]的研究发现,甘草黄酮和生物碱不仅具有较好的抗炎作用,还具有极好地镇痛作用,因此细胞凋亡和坏死情况大大缓解,细胞坏死缓解尤为明显。香附黄酮、枳壳黄酮、柴胡皂苷和白芍皂苷也具有较好的作用,凋亡和坏死情况与模型组相比缓解明显,但是坏死情况与甘草黄酮和延胡索生物碱相比仍有差距,尤其是白芍皂苷和香附黄酮,坏死情况与其他组差距明显,推测其抗炎效果较好,但镇痛作用未能与其他组分达到同一水平。
本文通过TNF-α 试剂盒和 Hoechst 33342/PI 双染法对气滞胃痛片和不同药效组分抗炎作用进行研究,根据结果可知甘草黄酮和延胡索生物碱这两组在治疗炎症方面的药效最好,炎症因子的含量和炎症细胞GES-1凋亡坏死率均明显降低,与模型组相比差异显著(P<0.01),香附黄酮、柴胡皂苷等其他组分与模型组相比(P<0.05)具有统计学意义,具有较好的疗效。
综上所述,本实验基于微流控芯片技术,研究气滞胃痛片中有效组分对于细胞炎症的药效作用,初步明确了初步明确了气滞胃痛片对GES-1 炎症细胞的药效物质基础;同时设计了一块微流控芯片,可以更真实的模拟人体环境,正向反向同时快速筛选药效,方便快捷,操作简便。

