辣椒溶杆菌X2-3 GntR家族中一个HutC基因功能分析
李志远,赵 丹,韩胜男,韩 超,刘爱新
(山东农业大学植物保护学院,泰安 271018)
溶杆菌Lysobacter属于黄单胞菌科 Xanthomonadaceae,其中的许多种如产酶溶杆菌Lysobacter enzymogenesOH11、辣椒溶杆菌L.capsiciNF87-2等能分泌多种胞外酶、抗菌物质等,对丝状真菌、卵菌、植物病原细菌等有不同的抑菌活性,是一类重要的植物病害生物防治资源[1-3]。辣椒溶杆菌L.capsiciX2-3是本实验室从小麦根际分离得到的一株生防菌,对禾谷镰孢菌Fusariumgraminearum、小麦纹枯病菌Rhizoctoniacerealis、烟草黑胫病菌Phytophthoranicotianae、白地霉Geotrichumcandidum和麦根腐平脐蠕孢菌Bipolarissorokiniana等病原菌具有较好的抑菌活性[4],具有广阔的应用前景。
GntR(gluconate operon transcriptional repressor)是原核生物中分布最广泛的一类转录因子,参与包括运动性、发育、病原细菌的致病力等生物学过程[5,6]。GntR转录因子包含两个重要的功能域,分别是与DNA结合的N端结构域和与效应物结合的C端结构域。根据C-末端氨基酸残基的序列差异,GntR分为7个亚家族,即FadR、HutC、MocR、YtrA、DevA、PlmA和AraR,各亚家族在细菌代谢过程中有不同的调控作用[7]。
HutC属于GntR第二大亚家族,约占GntR数量的30%,该亚家族成员的C端结构域由170个氨基酸组成,包括α螺旋和β折叠。第一个HutC亚家族的转录因子是在恶臭假单胞菌Pseudomonasputida中发现的,是一个组氨酸利用操纵子阻遏物[8]。此后在革兰氏阴性和阳性细菌中被发现参与多种调控作用,如在苏云金芽孢杆菌BacillusthuringiensisBti75中,HutC主要调控N-乙酰氨基葡萄糖(GlcNAc)分解代谢[9],在荧光假单胞菌P.fluorescensSBW25中,HutC不仅调控组氨酸代谢,而且参与细胞运动和铁载体的产生[10],在红霉素产生菌Saccharopolysporaerythraea中HutC则调控红霉素产量、色素合成以及气生菌丝产生等[11]。作为一类重要的转录因子,HutC在PGPR(plant growth-promoting rhizobacteria)细菌中的作用报道较少,尤其在溶杆菌中,目前尚没有关于HutC在该属细菌中调控作用的详细报道。本研究利用同源重组技术获得辣椒溶杆菌X2-3的LC_HutC敲除突变体MT4090,并对突变体的功能进行了分析,研究结果为深入了解辣椒溶杆菌的定殖、趋向性、抑菌作用等及HutC对辣椒溶杆菌的调控作用提供重要参考。
1 材料与方法
1.1 供试菌株、质粒、培养条件和培养基
本试验所用菌株、质粒见表1。表中病原真菌和卵菌用于抑菌活性测定。

表1 本试验所用菌株、质粒Table 1 Strains、plasmids used in this study
所用培养基:NB培养基用于辣椒溶杆菌生长、生物膜产量分析;PDA培养基用于对真菌和卵菌抑菌活性分析;SWA培养基用于运动能力分析;培养基配方参考文献[12]。
1.2 基因分析、引物设计
根据前期X2-3(GenBank登录号:No.LBMI00000000.1)全基因组测序结果,查询得到一个预测为HutC的基因,基因编号为LC4090。对该基因进行BLAST比对并与已知功能的HutC结构域对比,分析该基因的功能结构域及与已知HutC的相似性。
根据目的基因序列设计上下游同源臂引物和目的基因引物。本研究所有引物均用Primer Premier6.0软件设计,并由上海生工生物技术有限公司合成(表2)。

表2 本试验中所使用的引物Table 2 Primers used in this study
1.3 DNA的提取、连接、转化及感受态的制备
DNA的提取、酶切、连接、转化及感受态的制备等操作参考文献[13]。
1.4 敲除载体构建和敲除突变体鉴定
本研究我们采用nptII(卡那霉素抗性基因)取代LC_HutC的方法构建HutC缺失突变体。首先,以辣椒溶杆菌X2-3基因组DNA为模板,HutC-AF/HutC-AR、HutC-BF/HutC-BR为引物分别扩增LC_HutC上下游同源臂A和B,再经overlap PCR扩增、获得连接的片段AB。将片段AB连接pMD19-T-Simple,经菌落PCR验证以及测序鉴定,获得中间质粒pMD19-AB。质粒pMD19-AB用SacⅠ酶切,并与从pBSL15中、用SacⅠ酶切的nptII基因片段连接,得到插入的重组质粒pMD19-A-nptII-B;用BamH Ⅰ和Hind Ⅲ从重组质粒中将-A-nptII-B-切下,连接到自杀载体 pBR325,经酶切验证获得质粒 pBR325-AnptIIB。将质粒 pBR325-AnptIIB电转入 X2-3感受态细胞,经卡那霉素(750 μg/mL)NA平板筛选、菌落 PCR验证(HutC-AF/HutC-BR)和序列测定,获得敲除突变体。
1.5 互补载体构建和互补菌株鉴定
以辣椒溶杆菌 X2-3基因组 DNA为模板,HutC-F/HutC-R为引物扩增LC_HutC,再连接pEASY-Blunt-Simple,经PCR验证得到重组质粒pEASY-HutC;用BamH Ⅰ和Hind Ⅲ从重组质粒中将-HutC-切下,连接到表达载体 pBBR1-MCS5,经酶切验证获得质粒 pBBR1-HutC。将质粒 pBBR1-HutC电转入MT4090感受态细胞,经庆大霉素(500 μg/mL)NA平板筛选、菌落PCR验证(HutC-YF/HutC-YR)和序列测定,获得互补菌株。
1.6 菌株生长曲线测定
分别挑取菌株 X2-3、MT4090和 MS4090单菌落于 50 mL NB培养液中,振荡培养24 h(28 ℃,220 r/min),再分别取活化菌液1 mL至新的NB培养液中振荡培养,直至OD600为1.0;分别按1%接种量,转接菌液到50 mL NB培养液相同条件下培养,间隔4 h取样测定OD600值,并根据各阶段的OD值绘制生长曲线,试验重复3次。
1.7 菌株运动能力测定
采用 SWA培养基对各菌株的运动能力进行测定[12]。按照 1.6的方法在 NB培养液中活化菌株X2-3,MT4090和 MS4090,至 OD600为 1.0;分别取2.5 μL菌液于SWA平板表面,28 ℃静置培养3~5 d,以菌落直径评估各菌株运动能力,试验重复3次。
1.8 菌株定殖能力测定
将质粒pBBR1-GFP分别电转入菌株X2-3,MT4090和MS4090中。收集10日龄小麦根系,并取小麦根尖1.5 cm置于200 μL上述含pBBR1-GFP的不同细菌培养物(OD600=1.0)中,28 ℃培养3~5 d;之后用无菌水清洗小麦根 3次;采用两种方法测定菌株的定殖能力:(1)菌落计数法:经上述处理的根系分别转移至含1 mL无菌水的离心管中充分振荡20 min,取100 μL振荡液均匀涂布于NA卡那霉素(50 μg/mL)平板上,以各菌株在平板上的菌落数来评估菌株的定殖能力,试验重复3次。(2)GFP测定:激光共聚焦观察不同菌株处理的小麦根系,根据各处理根系荧光分析定殖情况,试验重复3次。
1.9 菌株对小麦根系分泌物趋化能力测定
小麦根系分泌物的收集:使用传统的水培收集法,将用无菌水冲洗干净的植物根系放入装有无菌水的无菌容器中培养一周,之后将植株移走,收集培养液,过滤、浓缩,得到根系分泌物以备后用。
采用毛细血管法进行测定[14]:毛细玻璃管(内径为 0.5 mm)一端吸入小麦根系分泌物,另一端则用热熔胶密封。将毛细玻璃管插入到含500 μL菌液的1 mL离心管中,常温孵育60 min。用无菌水将毛细玻璃管外壁附着的菌液去除,然后将毛细玻璃管折断,把内含物转移到新的1.5 mL离心管中,并加入50 μL无菌水稀释,再将溶液吸出均匀涂布于NA平板上。25 ℃静置培养24 h,以毛细玻璃管中的单菌落数来衡量菌株对小麦根系分泌物的趋向能力,试验重复3次。
1.10 菌株生物膜产量测定
结晶紫染色法对各菌株的生物膜产量进行测定。按照 1.6的方法活化培养各菌株至 OD600为 1.0;分别取1%的菌液于10 mL的NB培养液中,28 ℃静置培养3~5 d。慢慢去除试管中的菌液,再用相同体积的无菌水清洗试管内壁2~3次,小心去除清洗液,然后试管中加入等体积的0.2%的结晶紫溶液,静置20 min。小心去除染色液,用相同体积的无菌水清洗试管内壁2~3次,并用37 ℃烘箱烘干试管内壁。最后试管中加入2 mL无水乙醇溶解紫色物质,并测定OD575下的吸光值。以OD575值的大小评估不同菌株生物膜产量,试验重复3次。
1.11 菌株抑菌作用测定
平板对峙法对各菌株的抑菌活性进行测定。按照 1.6的方法在 NB培养液中活化菌株 X2-3,MT4090和 MS4090至 OD600为 1.0;分别取2 μL菌液于PDA平板上,待菌液完全被吸收后,28 ℃恒温培养箱静置培养2 d。再将病原菌菌饼接种于已接种细菌的平板中央,28 ℃培养箱中继续培养,5 d之后观察并记录各菌株对病原菌的抑菌圈直径。以抑菌圈直径大小评估不同菌株的抑菌能力,试验重复3次。
1.12 数据统计与分析
试验数据采用Excel和SPSS软件进行统计与分析。每种处理的条形图上的不同字母表示通过Duncan的多重范围检验在P<0.05处存在显着差异,试验重复3次。
2 结果与分析
2.1 基因分析
经氨基酸序列比对,该预测蛋白与功能明确的恶臭假单胞菌P.putidaPBS1(GenBank登录号:P22773.1)和大肠杆菌E.coliMS115-1(GenBank登录号:EFJ97394.1)中的HutC氨基酸测序相似性分别为42.86%和41.04%(图1A)。
根据X2-3(GenBank登录号:LBMI00000000.1)全基因组序列,编号为LC4090的基因编码HutC转录因子,结构功能域分析发现,该预测蛋白有两个重要的结构域,即HutC亚家族保守的HTH/DNA结合域和UTRA/配体结合域(图1B)。
2.2 突变体与互补菌株的构建
将重组载体pBR325-AnptIIB电击转化至菌株X2-3感受态细胞中,经卡那霉素筛选,菌落PCR验证,初步获得敲除突变体,命名为MT4090。PCR验证结果如图2A,其中泳道1扩增出约2492 bp的条带,大小与-AnptIIB一致,泳道2条带大小约2225 bp,与对照-AHutCB一致;对该菌株进一步序列测定,所测MT4090的核苷酸序列与预期结果一致,说明获得的突变体MT4090为LC_HutC敲除突变体。
图2B是互补菌株筛选结果。重组载体pBBR1-HutC转化菌株MT4090细胞后,菌落PCR验证发现,突变菌株MT4090扩增不到代表部分LC_HutC的423 bp的条带,而互补菌株、野生株X2-3都可以得到423 bp的条带,说明互补菌株正确,命名为MS4090。
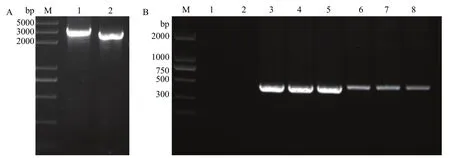
图2 突变体验证Fig.2 Confirmation of mutants
2.3 突变体生长能力分析
分光光度计法测定不同时间菌液OD600吸光值,绘制生长曲线(图3)。结果发现,在快速生长阶段(20~36 h),MT4090的生长速度显著低于X2-3和MS4090。在稳定生长阶段(40 h之后),MT4090的生长速度与X2-3差异不显著,且增长速率趋于稳定。说明LC_HutC基因的缺失使菌体生长早期显著减弱,后期(40 h后)生长能力基本稳定。

图3 不同菌株生长能力分析Fig.3 Growth rate of mutants and wild type strain
2.4 突变体运动能力分析
运动性是PGPR细菌向宿主植物根系趋向性运动的重要方式[15]。采用SWA平板测定各菌株的运动能力,结果发现,MT4090的运动区直径比X2-3减少了近60%,而MS4090与X2-3运动区直径相近,表明突变体MT4090的运动能力显著减弱(图4)。

图4 不同菌株运动能力分析Fig.4 Motility of mutants and wild type strain
2.5 突变体定殖能力分析
PGPR在植物根部成功定殖是其发挥作用的前提[16]。采用激光共聚焦观察和平板计数法测定各菌株的定殖能力,激光共聚焦观察发现,突变体在根系定殖能力显著降低(图 5A);进一步用平板计数法测定根系活菌数,发现突变体MT4090在小麦根上的活菌数为7.2×106CFU/g根,与野生株X2-3相比,减少了9×106CFU/g根,而互补菌株MS4090与X2-3在根上的活菌数没有显著差异,表明MT4090对小麦根的定殖能力显著降低(图5B)。
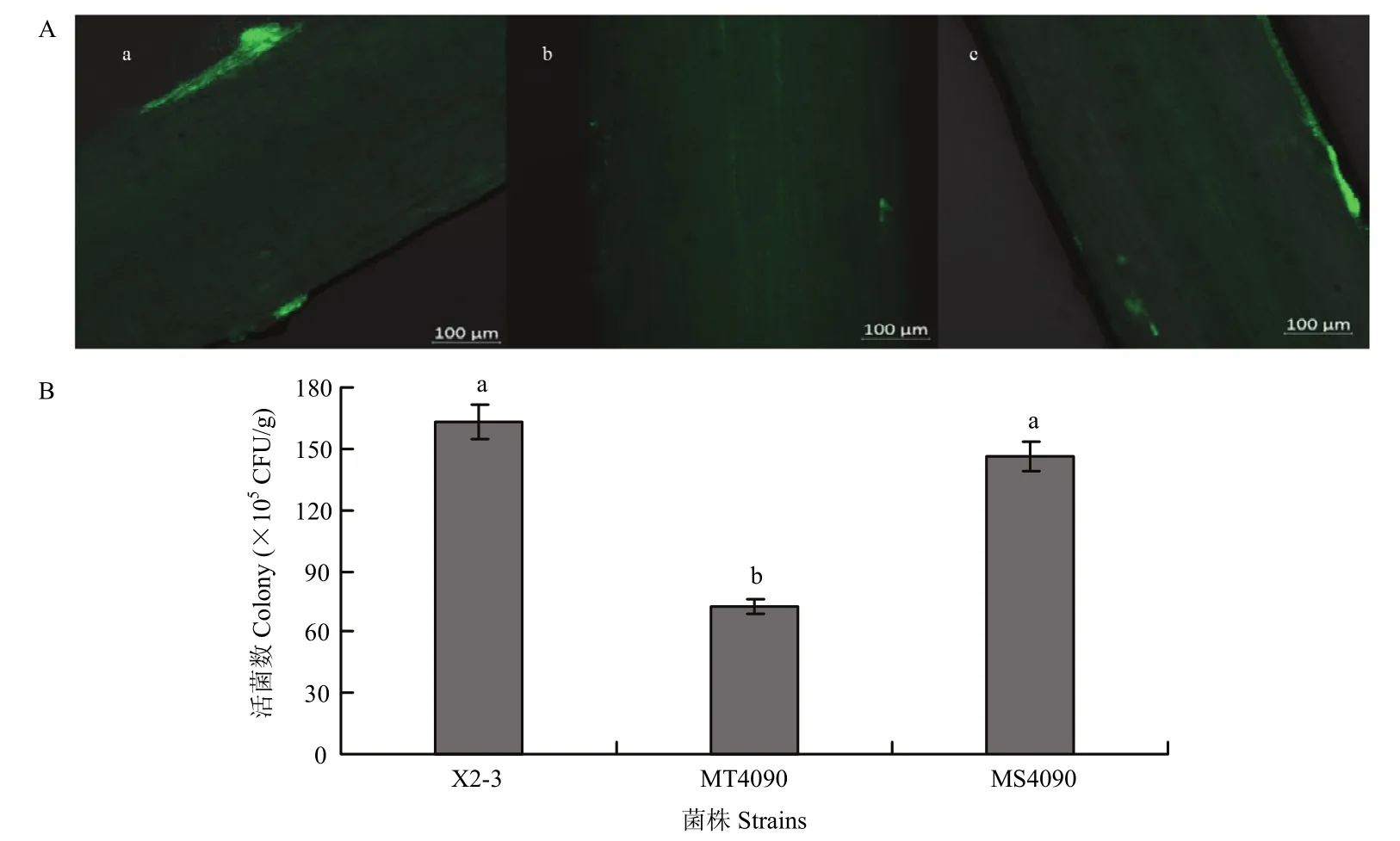
图5 不同菌株对小麦根系的定殖能力Fig.5 Colonization of mutants and wild type strain to wheat roots
2.6 突变体对小麦根系分泌物趋化能力分析
植物根系分泌物是诱导PGPR及其他微生物趋向运动的重要成分,对微生物在根系定殖发挥重要作用[14,17]。采用毛细玻璃管法测定了各菌株的趋化能力,结果发现,用毛细管吸取相同量(20 μL)的根系分泌物,经系列标准处理后,突变体MT4090在毛细管中的活细胞数约为野生株X2-3的40%,说明LC_HutC的缺失导致菌株X2-3对小麦根系分泌物趋化能力明显降低(图6),而互补菌株比X2-3略有降低,但差别不显著。

图6 不同菌株对小麦根系分泌物的趋化性分析Fig.6 Chemotaxis of mutants and wild type strain to wheat root exudates
2.7 突变体生物膜产量分析
细菌生物膜形成有利于PGPR菌株抵抗环境压力,从而在根系微环境中发挥作用[18]。结晶紫染色法对菌株X2-3、MT4090和MS4090的生物膜产量进行测定结果发现,突变体MT4090生物膜的产量显著高于野生型X2-3和突变体MS4090(图7A),约为野生株X2-3和突变体MS4090的两倍(图7B),说明LC_HutC的缺失显著提高了菌株X2-3的生物膜产量。
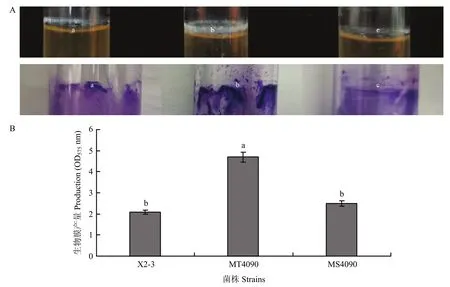
图7 不同菌株生物膜形成能力分析Fig.7 Biofilm formation of mutants and wild type strain
2.8 突变体抑菌作用分析
为了解LC_HutC是否与X2-3的抑菌活性有关,测定了突变体和野生型菌对真菌和卵菌的抑菌活性,结果如图8所示。可见X2-3,MT4090和MS4090对植物病原真菌和卵菌的抑菌圈直径没有明显差异,说明LC_HutC缺失对X2-3的抑菌作用没有明显的影响。
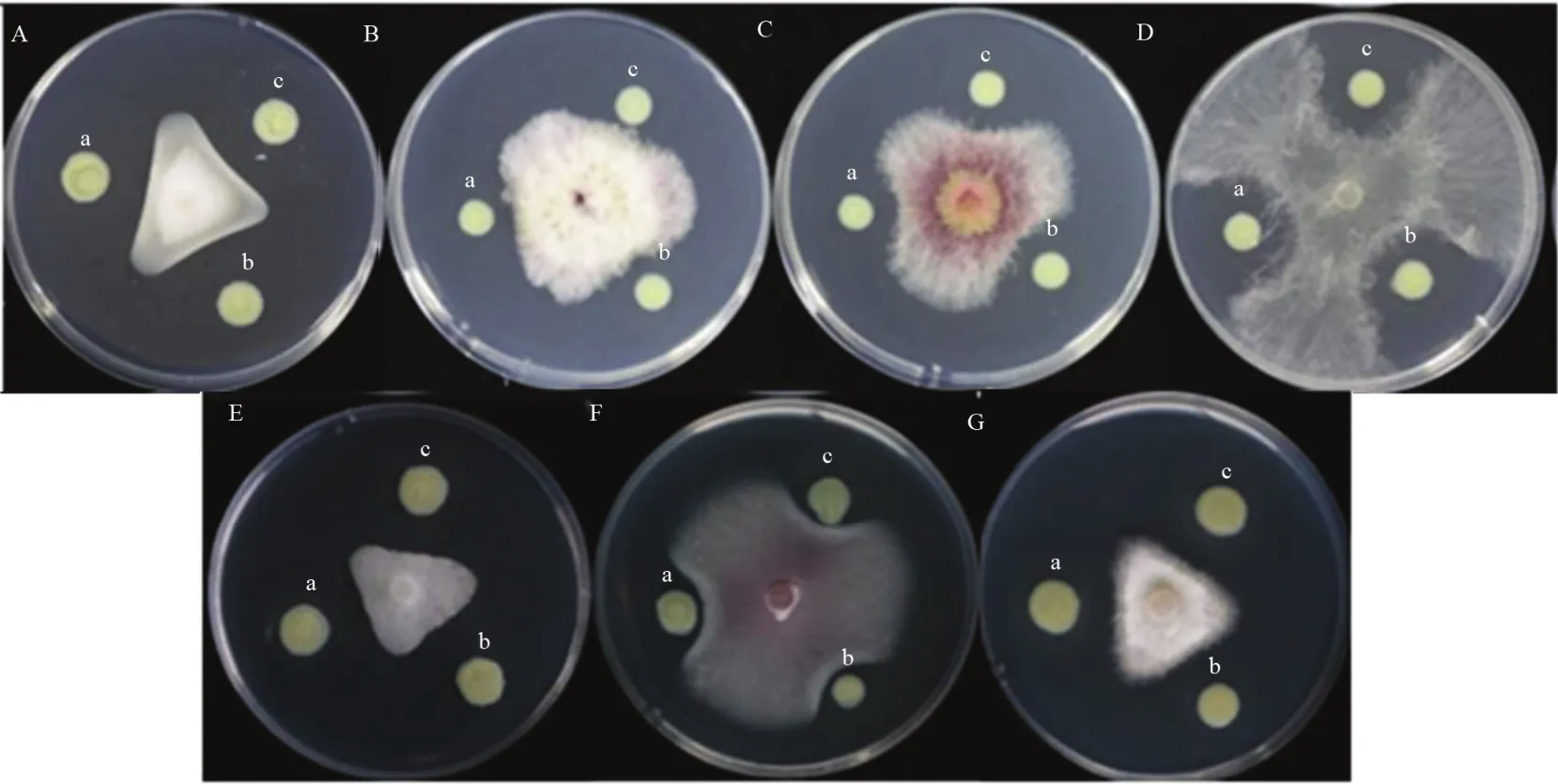
图8 不同菌株抑菌作用分析Fig.8 Antimicrobial activity of mutants and wild type strain
3 讨论
本研究分析了辣椒溶杆菌X2-3中一个LC_HutC对菌体生长、定殖及生物膜产量等的调控作用,发现LC_HutC基因的缺失使菌体的生长速度、运动能力、定殖能力及对根系分泌物的趋向性等都显著下降,生物膜产量明显提高,但对病原真菌和卵菌的抗菌能力没有明显影响,表明LC_HutC对X2-3的调控作用是一个复杂的过程。
有效的根系定殖是PGPR菌株促进植物生长和发挥防病作用的基础,研究表明植物根系分泌物可作为信号分子直接或间接影响有益微生物向根系移动和定殖,是调控土壤微生物群落结构的重要因素[19,20]。PGPR菌株在植物根系的定殖受多种基因的调节,Gao等[21]发现,蜡样芽胞杆菌B.cereus905在小麦根系的定殖能力受RecA基因调控,RecA基因缺失后,不仅使蜡样芽胞杆菌的运动能力显著降低,而且在根系的定殖能力比野生株减少1000-2500倍。Roberts等[22]在对阴沟肠杆菌Enterobactercloacae501R3的研究中发现,阴沟肠杆菌501R3的degS基因(编码周质丝氨酸蛋白酶)经插入突变后,该菌株对黄瓜根系分泌物的趋向性明显减弱,对根系定殖和对终极腐霉Pythiumultimum的防病效果也显著降低,表明菌体的趋化性、根系定殖及运动能力对PGPR菌株发挥功能有重要作用。本研究中发现,LC_HutC的缺失使辣椒溶杆菌X2-3的定殖和趋向运动都显著减弱,表明LC_HutC对X2-3发挥生物学功能有重要的调控作用,这也是关于HutC调控辣椒溶杆菌定殖和趋向运动的首次报道。
生物膜是由胞壁多糖、胞外蛋白和胞外多糖等组成的复杂成分,一般认为,形成生物膜有助于 PGPR菌株在根系有效定殖[18,23],不少研究结果也对支持这种观点,如Zhu等[24]研究发现枯草芽胞杆菌B.pumilusHR10可以在马尾松幼苗的根部持续定殖,而生物膜形成基因缺失突变体则表现定殖能力减弱。但生物膜结构组成复杂,受环境、营养及细菌种类等影响,不同细菌生物膜产量与细菌的定殖、运动并非完全一致。Zhang等[25]发现,青枯病菌Ralstoniasolanacearum中一个编码组装蛋白(assembly protein)的基因TapV缺失,突变体定殖、运动能力等均显著降低,但生物膜产量比野生株显著提高。Wang等[26]发现,铜绿假单胞菌P.aeruginosa中GntR/MpaR基因缺失,生物膜产量显著增加,但其在小鼠体内定殖能力显著减弱。这些结果与本研究结果类似。本研究中发现,LC_HutC突变体的生物膜产量比野生株X2-3明显增加,但定殖能力及趋向运动等显著减弱,表明LC_HutC对生物膜的形成可能有不同的作用,但详细调控机制需要进一步研究。
作为一类重要的转录因子,GntR参与调控原核生物的多种生物学过程。对柑橘黄单胞菌X.citri和十字花科黑腐病菌X.campestris等植物病原细菌的研究中,发现GntR不仅调节细菌的III型分泌系统、运动性和对寄主的黏附力[27],而且调节胞外多糖、胞外纤维素酶等基因的表达[28]。在变异链球菌Streptococcus mutans中,GntR对EPS产生、生物膜形成和糖转运蛋白基因的表达等都有不同的调节作用[29]。产酶溶杆菌L.enzymogenes是一种重要的PGPB菌株,其GntR的敲除不仅使菌体丧失了蹭行运动,而且降低了HSAF的产量[30],表明GntR在该菌株中参与抗菌物质HSAF的合成。本研究中我们发现,辣椒溶杆菌X2-3中的HutC转录因子主要调节菌体的定殖、趋向运动和生物膜形成等,但对病原真菌和卵菌的抗菌能力没有明显影响,表明,HutC在不同菌株中有不同的调节机制。

