煤燃烧过程中燃料型NOx生成及还原机理研究进展
龚 艳 艳
(1.煤科院节能技术有限公司,北京 100013; 2.煤炭资源高效开采与洁净利用国家重点实验室,北京 100013;3.国家能源煤炭高效利用与节能减排技术装备重点实验室,北京 100013)
0 引 言
2020年我国煤炭消费28.3亿t标煤,占能源消费总量的56.8%[1]。煤炭燃烧利用量占煤炭消费总量的80%以上,煤燃烧过程中会产生大量的SO2、NOx和烟尘。其中,NOx易导致酸雨、光化学烟雾、温室效应、雾霾和臭氧层空洞,是综合型大气污染的罪魁祸首[2]。高温烟气中NOx以NO为主要的存在形式,其占比在95%以上;少量以NO2和N2O的形式存在,且NO2和N2O均由NO进一步反应生成[3-4]。根据氮的来源和生成途径的差异,将煤燃烧过程中产生的NOx分为燃料型NOx、热力型NOx和快速型NOx,其中燃料型NOx占比75%以上[3,5]。热力型NOx受温度影响很大,通常在1 500 ℃以上才考虑热力型NOx;快速性NOx生成量相对较少,通常可以忽略不计[3]。
抑制煤燃烧过程中燃料型NOx的形成是低氮燃烧技术的关键所在,深入研究煤燃烧过程中N的迁移转化规律,有助于抑制燃烧过程中NOx的形成。煤燃烧过程中NOx的形成涉及很多复杂的均相反应和异相反应,且影响因素繁多,不仅与煤的结构、颗粒尺寸、成分、氮含量等煤种自身性质有关[6-7],还与氧气浓度、燃烧温度等燃烧条件有关[3,8],其反应机理十分复杂。同时燃料型NOx的形成涉及燃料N的氧化和NOx的还原,通常实验条件下只能得到燃料NOx的净生成率,难以对燃料氮的氧化-还原过程进行研究。很多学者对煤燃烧过程中N的迁移转化机理进行大量理论和试验研究,已形成很多规律性的认识,但由于试验条件的差异,针对一些关键影响因素难以得到一致的结论。
由于焦炭的燃尽时间(300 ms~1 000 ms)远大于挥发分的燃尽时间(10 ms),挥发分NOx和焦炭NOx的生成途径相互作用小,可以将其看作2个相对独立的过程[3,9-10]。笔者对煤燃烧过程中燃料型NOx形成机理的最新研究进行总结概括,从煤热解、挥发分燃烧、焦炭燃烧3个阶段阐述燃料N的迁移转化规律,归纳煤阶、粒径、温度、反应气氛等因素对燃料型NOx形成的影响,以期为低氮燃烧技术中降低NOx排放初值提供理论依据。
1 煤热解过程中N的迁移转化规律
煤中氮的含量范围为0.4%~3%,氮含量随煤阶的升高而增大。煤中无机氮的含量很低,通常只考虑有机氮。氮主要以吡咯氮(N-5)、吡啶氮(N-6)、季氮(N-Q)和氮氧官能团(N-X)的形式存在,如图1所示。

图1 煤中主要含氮官能团示意[3]
其中N-5、N-6、N-Q分别占比50%~80%、20%~40%、3%~20%,N-X含量相对较少[3]。煤化程度影响煤中氮含量和存在形式,随着煤化程度提高,煤表面固定的氧含量、N-X含量均相应增加[11];N-5含量随着煤化程度的升高逐渐降低,而N-6的含量随着煤化程度的升高逐渐升高[3]。
在高温燃烧条件下,煤粉首先热解析出挥发分。由于C—N键的键能较低(25.3×107J/mol~63×107J/mol),在热解时最先发生断裂,即C—N键是热解的引发键[12]。煤中氮(Coal-N)在热解过程中迁移至焦炭氮(Char-N)和挥发分氮(volatile-N),挥发分N和焦炭N在燃烧过程中进一步氧化形成挥发分NOx和焦炭NOx[13-14]。焦炭N和挥发分N的分配受多种因素影响,主要包括煤阶、粒径、升温速率、热解温度、压力和含氧量[3,15-17]。
煤的热解过程分为一次热解和二次热解,一次热解是指焦油和部分挥发分初步析出的过程,二次热解是指焦油和半焦进一步受热分解的过程。挥发分氮在热解过程中基本完全析出,如图2所示[18]。
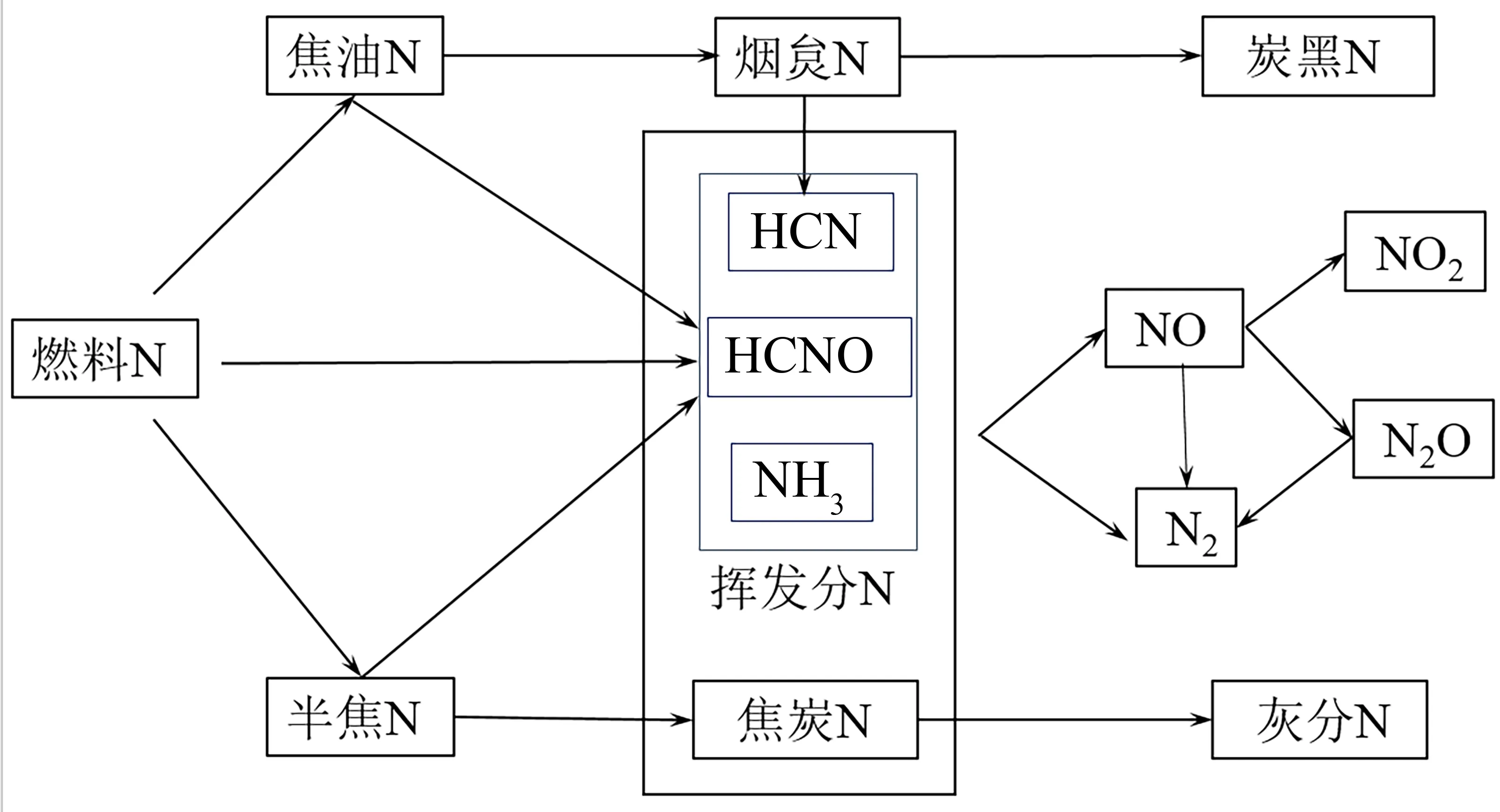
图2 煤中氮的迁移过程
当温度高于1 150 K时,焦油发生二次热解,形成H2、CO、CH4、C2H2和C2H4等轻质气体和固态的烟炱[5,19-20]。焦油中的氮主要存在于芳香族化合物中,与原煤中的氮结构基本相同,N-Q的含量相对较少[5,21]。位于杂环芳烃结构边缘的N-5和N-6受热分解,开环过程中先形成腈类物质,后进一步反应生成HCN[18]。而杂环芳烃结构内部N-Q裂解转化形成NH3,反应活化能较高且需要大量的含氢基团,此为HCN先析出的主要原因[13,22-23]。部分焦油会形成烟炱(soot),烟炱高温分解能产生HCN和少量炭黑N[24-25]。半焦二次热解也能析出挥发分N,快速热解过程释放的含氮气体主要为HCN,而慢速热解过程会释放NH3、HCN和NO[13]。此外,煤热解气中还存在大量N2,且Fe、Ca、K等矿物杂质有利于促进热解过程中NH3、HCN和char-N向N2的转化[5,15,26]。
挥发分N主要以HCN和NH3的形式存在,HCN主要来源于热不稳定含氮官能团N-5和N-6受热分解,而NH3主要来源于N-Q加氢反应和HCN在焦炭表面的二次反应[13,22-23]。HCN在热解前期基本完全释放,而NH3的生成要滞后于HCN,NH3的产量在1 000 ℃~1 100 ℃时趋于1个稳定值[12,27-28]。HCN和NH3的生成均需H自由基的参与,热解中后期生成NH3所需的H自由基基本均来自于半焦的二次热解[29]。随着热解温度的升高,半焦和焦油中的含氮官能团裂解加剧,且热解产生更多的H自由基,使得HCN和NH3生成量随之增加[17,20,29]。但当温度过高时,煤中的含氧官能团会与NH3发生反应,将NH3中的N固定在焦炭中,导致煤中氮的脱除率有所下降[23,30-31]。挥发分N的含量和种类与煤种有关,在热解过程中氮的释放与碳的释放有很强的相关性,通常挥发分含量越高,挥发分N的释放量也越大[27-28,32]。烟煤挥发分中HCN的比例较大;低价煤中的氨基官能团能在较低温度下直接分解产生NH3,且低价煤热解气中NH3/HCN相对较大;无烟煤挥发分含量较低,热解气中 NH3和HCN都相对较少[31,33]。
焦炭中N的分布规律和存在形式与原煤一致,主要以N-5和N-6的形式存在于碳的大分子结构中,单煤粉颗粒表面N的释放速率高于整个煤颗粒N的释放速率,造成N向内部偏析[11]。在煤的热解过程中,热稳定性较低的N-5、N-Q和N-X会转化为热稳定性较高的N-6,且随热解温度提高,N-6含量整体上呈现增加趋势[11,34]。
煤焦的孔隙为反应气体提供扩散通道,孔表面也为煤焦燃烧和气化反应提供场所。煤焦孔隙结构越发达,其反应活性越高[11]。挥发分析出使焦炭孔隙逐渐发展,温度和压力升高都会加剧挥发分的析出,使得煤焦的小孔不断生长,形成更多的中孔和大孔,焦炭比表面积和孔容积增大[35]。但当热解温度过高时,碳基质发生烧结,从而导致大量微孔缩并,致使比表面减小,同时碳结构石墨化程度加深,部分矿物质烧结形成玻璃体,造成焦炭的反应性下降,热解气中NH3、HCN的浓度也会降低[24,36-37]。
2 挥发分NOx的生成及均相还原机理
焦炭表面的HCN和NH3在火焰峰面处被氧化生成NOx,将从火焰峰面扩散而进的NO还原成N2,挥发分NOx的形成是挥发分N“氧化-还原”的综合结果。此外,烟气中的碳氢化合物(CHi)、CO、H2等还原性气体组分也能参与烟气中NOx的还原。
2.1 挥发分NOx生成机理
挥发分NOx前驱体主要以HCN和NH3的形式存在,也存在少量HNCO,3种物质对最终挥发分NOx的形成都有很大影响[38-39]。挥发分中HCN与NH3的含量和比值不仅取决于煤的性质,还与燃烧条件有关。在氧气充足的条件下,挥发分完全燃烧,挥发分N易被氧化形成NO[40]。
挥发分N经过一系列氧化—还原反应形成稳定的NO、NO2、N2O、N2,受C-H-O-N体系的综合影响,反应路径复杂。P.Glarborg等对均相氮化学反应机制进行全面综述,更新氮反应机理的偶合反应和反应速率参数,发布氮化学反应模型PG2018并讨论建模预测的准确性[39]。完整的PG2018模型包括151种物质和1397个基元反应,根据PG2018模型整理的挥发分N主要转化路径如图3所示。

图3 挥发分N的转化路径[39]
挥发分N氧化过程中具有较高反应速率的反应如下:

(1)

(2)
(3)

(4)

(5)

(6)
(7)

(8)
HCN在燃烧过程中转化形成HNCO和NH3,增加了HCN转化的复杂性。在高温还原性条件下,HCN通过异构化形成HNC并快速达到平衡。HNC具有更高的反应活性,可提供氰化物氧化的快速替代途径并促进HNCO的形成,即HCN可通过先形成HCNO后再迅速进入胺池,少量HCN也能直接氧化进入胺池[39]。HCN转化生成CN自由基,CN自由基与O2发生快速反应,主要包括NO和CNO 2个产物通道,在296 K~475 K的温度区间,NO通道占比20%左右,且受温度影响较小[41]。HCN→CN→NCO是HCN的主要消耗路径,HCN也能直接氧化生成NCO,NCO的不同反应路径决定HCN的最终产物[42]。在较低的温度下(<1 150 K),NCO转化为HNCO并稳定存在;在高温条件下HNCO又转换形成NCO[39]。NCO能氧化形成NO,也能将NO还原成N2和N2O,NCO还原NO是烟气中N2O的主要来源之一[3,43]。氧含量增加和燃烧温度升高都能促进HCN氧化形成NO[44-45]。
HCN的主要氧化路径如下:
HCN→CN→NO
HCN→CN→NCO→NO
HCN → HNCO → NCO → NO
HCN→ HNCO → NH2→ HNO → NO
在高温条件下,HNCO的消耗反应主要是形成NCO,其次是通过H还原进入胺池[39,46]。OH自由基是挥发分N反应的主要链载体,含氮中间体与OH的反应顺序为HCN>CO>HNCO[47-48]。
NH3主要与O/H自由基池反应形成NH2。NH2与O2的反应活性低,在少量NO存在的情况下能快速与NO反应生成N2,或先形成NNH再快速转化为N2,在1 100 K~1 400 K的温度范围内NNH的反应路径占比0.3~0.4[39,49]。但当O2充足的条件下,大部分NH2被氧化形成NO,少量参与NO还原形成N2,N2O的产量可忽略不计[50]。NNH与O2反应形成N2和HO2,HO2会促进NO氧化为NO2[39,51]。氧气含量增加也会导致HO2自由基浓度增加,从而促进NO氧化成NO2。在高温条件下(>1 400 K),NH2与O的反应加剧,有NH和HNO 2个产物渠道且以HNO为主。NH3的主要氧化路经如下:
NH3→ NH2→ HNO → NO
2.2 NOx均相还原机理
燃烧初期,随着煤的快速热解,烟气中HCN和NH3快速达到浓度峰值;由于HCN和NH3易被氧化成NO,NO也会达到浓度峰值;随着氧气快速消耗,NO的还原速率大于NO的生成速率,NO浓度下降[52-53]。烟气中HCN、NH3、CO、CHi等还原性气体组分均能对NOx进行均相还原,NOx均相还原路径如图4所示[54-56]。

图4 NO均相还原反应路径
在燃烧温度下,NH3向N2的转化速率是HCN的10~1 000倍,挥发分N的转化主要受NH3控制。高温会促进HCN反应生成NH3,有利于降低挥发分NOx的生成[57]。HCN主要通过NCO基团对烟气中NO进行还原,NCO与NO反应的产物通道有N2和N2O[43]。NH3主要通过氨自由基NH2和NH还原NOx,其中NH2+NO是NH3还原NO的关键反应;当存在催化剂时,NH3首先分解为NH,NH自由基与NO反应生成N2和N2O[58-59]。温度在300 K~2 200 K时,NH对NO反应有N2和N2O 2个产物通道,N2通道占70%~90%,而N2O只占10%~30%[51]。在温度高于2 200 K时,NH+NO存在第3个产物渠道NNH,但占比相对较小[60]。
NH3和HCN还原NO的主要反应见式(9)~式(11):

(9)

(10)

(11)
(12)
(13)

(14)
烟气中N2O来源于NO的还原反应,NH和NCO都能将NO还原成N2O,如反应(11)、(13)所示,其中反应(13)是均相还原NO形成N2O的主要反应[61-62]。随着温度升高,反应(13)受阻,且N2O的分解速率加快,均相N2O的生成量减少[63-64]。N2O的反应活性远大于NO,还原性气氛中O、OH等基团活性增强,N2O的消耗速率加快[65]。N2O能与H和O进一步反应,N2O+H反应主要形成N2;N2O+O反应有NO和N22个产物通道,由于N2通道的活化能远低于NO通道,在低温条件下N2O+O反应的产物以N2为主[66]。
由于NH3对能NOx的还原有很强的选择性,通常在煤的燃烧过程中使用氨水、尿素或异氰酸降低NOx的排放量。尿素和异氰酸分解除了产生NH3,还能生成部分HNCO,HNCO会通过NCO+NO反应将NO还原成N2O,使得烟气中N2O的含量升高[67]。NH3只有在850 ℃~1 100 ℃的温度区间才能有效还原NOx,温度高于1 100 ℃时,NH3容易被氧化形成NO[68]。
烟气中烃基自由基CHi、CO和H2等还原性气体都能还原NOx,还原性强弱顺序大致为CHi>NH3>HCN>CO>H2[43,56,69]。CHi与NO快速反应转化为异氰酸酯(NCO)和HCNO中间体[70-71]。NCO能通过反应(12)、(13)还原NO;HCNO易与OH和O反应形成H2NO和HNO,很大程度上又进一步氧化形成NO[56,72]。CO与NO的还原反应需要碳基质或矿物杂质的催化作用,且CO浓度要高于1%[73-74]。高温强还原性条件有利于CO的形成,促进CO对NO的还原[75-76]。当不存在焦炭时,即使在高温条件下CO也很难还原NO[21,77]。
Hu等对7个详细的均相NOx生成模型进行评估,研究结果表明PG2018是常规空气燃烧和富氧燃烧条件下NOx生成的最佳预测模型[78]。将完整的PG2018模型通过简化处理后得到只含35种物质和259种基元反应的简化模型,简化模型加快了计算速度而不显著降低计算精度,简化后的均相氮化学反应模型的主要路径如图5所示。

图5 挥发分N的主要转化途径[78]
2.3 挥发分NOx抑制技术
由于挥发分燃尽时间短,挥发分NOx的氧化和还原反应主要发生在煤粉燃烧初期,控制煤粉燃烧初期的强化还原性气氛是控制挥发分NOx形成的关键所在,常采用空气分级燃烧和低氮燃烧器来控制挥发分NOx的生成。对于高挥发分的褐煤和烟煤而言,均相还原是NOx还原的主要途径[79]。
空气分级燃烧是最常采用的低氮燃烧技术,通过空气分级燃烧在燃烧初期形成强还原性气氛,促进挥发分NOx均相还原。Fan Weidong等在20 KW的燃烧实验台架上进行深度空气分级燃烧实验,燃烧初期NOx的浓度先升高后降低,随着燃烧初期二次风量降低,NOx越快达到浓度峰值,且燃烧初期的NOx排放量逐渐降低;当二次风量足够低时,燃烧初期的NOx浓度会降到零[80]。但当炉膛内氧浓度低于3%时会引起炉内腐蚀与结渣,并导致CO和飞灰含碳量急剧上升,如何实现低NOx排放和高效燃烧的同时兼顾是当前研究的主要议题。

3 焦炭NOx的生成及异相还原机理
焦炭NOx的形成过程不仅涉及焦炭N氧化生成NOx,同时焦炭也能直接参与NO的异相还原或间接催化NO同相还原过程,焦炭NOx的形成是“氧化-还原”的综合结果,煤种、温度、反应气氛等都会异相焦炭N的转化。
3.1 焦炭NOx生成机理
现广泛应用的空气分级、燃料分级等低氮燃烧技术能有效抑制挥发分NOx的生成,在采用低氮燃烧技术后,焦炭NOx对最终NOx排放的贡献份额在60%以上[9,91]。焦炭燃烧过程中焦炭N氧化生成NOx有2种形式:① 焦炭燃烧先释放出HCN和含氮多环芳香化合物,再氧化生成NOx,与挥发分NOx的生成路径基本一致;② 焦炭N异相氧化直接生成NOx[8,21]。NO是焦炭N异相氧化的第一产物,而N2、N2O和NO2二次反应生成,具体反应路径如图6所示[92-93]。

图6 焦炭N氧化路径
焦炭N异相氧化主要包含3个反应:O2在焦炭表面的吸附反应,焦炭表面原子抽提或一系列原子重排的反应,CO和NO的脱附反应,具体反应路径如图6所示。张秀霞通过量子化学和实验研究表明氧气对焦炭表面的氮和碳没有强烈的选择性,焦炭燃烧过程中N和C的释放有很强的正相关性[21,94]。李相鹏的研究表明氧气对焦炭表面的氮和碳的选择性与煤阶有关,高阶煤O容易与C结合释放CO,而中、低阶煤更易释放NO[29]。焦炭燃烧初期,N元素富集在煤焦颗粒表面,随着燃烧的进行则NO/(CO+CO2)逐渐增加[11,95]。
焦炭N异相氧化的主要反应如下:

(15)

(16)
(17)

(18)
(19)
(20)
式中C()为碳活性位点,主要包括边缘碳原子、脂肪族氢、芳香族氢、羧基、酚羟基、缺陷位点和矿物杂质邻域。
在低温条件下焦炭燃烧由动力学控制,随着温度的升高则反应从动力学控制转变为扩散控制[94,96]。在低温条件下,C(NO)和C(O)的脱附为反应的速控步,O以多种含氧官能团在焦炭表面富集;而在高温条件下,焦炭表面的含氧官能团易脱附形成CO、CO2和NO,O2的扩散成为反应的速控步。在低温条件下C(O)不易脱附,焦炭氧化直接生成CO2,如反应(17)所示;高温条件下CO为主要的一次产物,而CO2是通过二次反应生成的[24,29,97-98]。由于CO的均相氧化速率远大于焦炭的异相氧化速率,燃烧烟气中CO2的浓度远高于CO[34]。低温条件下只有少量C(NO)经脱附反应生成NO,大量C(NO)富集在焦炭表面,与NO反应生成N2O的机率较大,且焦炭在低温条件下对N2O的还原能力较弱,最终导致烟气中N2O的浓度较高,此亦为流化床燃烧条件下N2O排放量高的主要原因之一[99]。
3.2 焦炭-NOx异相还原机理
焦炭可通过自身的还原性直接还原NOx,还能为NH3、CO等还原NOx提供反应表面,且耦合还原能力高于各自的还原能力[54,100-102]。焦炭—NO反应的方程式见式(21)~(26),其中的第1步是NO通过吸附、物理结合和共价键结合的方式吸附在焦炭表面活性位或焦炭内平面基质碳原子上,其中活性位点的反应性更高[15]。NO吸附形成的N—O键更倾向于断裂,形成表面碳氮组分C(N)和表面碳氧组分C(O),C(N)主要通过反应(23)和反应(24)释放N2。Chambrion P等采用焦炭(12C)吸附14N16O,再继续添加15N18O后形成14N15N,证明烟气中的NO能与C(N)结合释放出N2[103]。张秀霞等研究表明通过焦炭表面2个相邻的C(N) 相互也能形成N2,但由于反应所需能量更高,且2个NO分子以N相邻的方式吸附在焦炭表面的机率相对较小[21]。此外,焦炭也能先将NO还原成N2O,再经氧抽提反应释放出N2,通常焦炭与N2O的反应活性要远高于焦炭—NO反应[21,29]。

(21)
(22)
(23)

(24)
(25)

(26)
焦炭—NO反应速率常数与焦炭的燃烧程度和焦炭的燃烧条件有关,不同煤焦及灰分在孔隙结构、比表面积、矿物杂质含量和组成等方面不同,表现出不同的 NO异相还原反应性,相关动力学参数甚至相差几个数量级[15,104]。G Feng等研究表明在滴管炉中速率常数随燃尽的增加而逐渐减小,而在填充床中速率常数随燃尽的增加而增加[105]。
焦炭中的Fe、Ca、K、Na等矿物组分能催化焦炭—NO反应并增强焦炭的反应性[24,106-107],反应式见式(27)~(30)。矿物组分主要有2种催还机理:① 过渡金属、碱金属通过 “氧化-还原”循环过程,将氧传递给焦炭,以Fe为例如式(27)~(29)[108];② 碱土金属作为NO的吸附位点,促进NO的吸附,以Mg为例如式(30)[15,109]。张聚伟研究表明各金属催化焦炭—NO活性的顺序从强到弱为Mg、K、Na、Ca、Fe[24]。N2O与焦炭的反应活性较NO更强,各矿物组分对焦炭—NO和焦炭—N2O的催化作用也存在一定差异:Fe2O3>Al2O3>SiO2>MgO[29,110]。CaO不仅可将NH3、HCN等挥发分氮催化氧化为NOx,还能促进CO等还原性组分的氧化,抑制NOx的还原,此亦为炉内脱硝导致NOx排放量增大的主要原因[111-113]。

(27)

(28)

(29)
(30)
焦炭粒径对NOx的影响主要从2个方面考虑[15,21]:① 焦炭孔隙结构对焦炭—NO反应的影响,粒径越大NO从内部扩散到焦炭表面的停留时间延长,促进焦炭—NO反应;② 焦炭表面积对焦炭—NO的影响,粒径越小比表面积相对较大,有利于烟气中NOx的还原。单颗粒焦炭反应,粒径越大,NO转化率越低[114]。而沉降炉和鼓泡床反应器中煤或煤焦颗粒增大,燃料N向NO转化率降低[115-116]。Wu等通过固定床燃烧研究表明,粒径对燃料N向NO转化率与煤种有关,煤的粒度对褐煤和烟煤燃料型NO的转化几乎无影响,而随着粒径增加,无烟煤燃烧释放的燃料型NO增加[117]。焦炭粒径并不会显著改变焦炭—O2和焦炭—NO的本征反应,而是通过影响有效反应面积和扩散深度影响最终NO的形成[11,84,115]。
焦炭—NO反应在低温区受动力学控制,而在高温区则受扩散控制[24,96]。当温度低于600 ℃时,C(N)和C(O)的脱附为反应的速控步,焦炭对NO的还原能力较弱[21]。反应温度升高,焦炭表面C(N)和C(O)的脱附加快,焦炭对NO的还原能力加强[32,100,118]。高温能促进煤的气化反应,生成的CO进一步还原NO[119-120]。1 100 ℃以下,NO的还原以C(O)为主导,且需要碳活性位C()的参与,如反应(21)所示;随着温度升高,C(O)的脱附加剧,焦表面很难再形成大量稳定的含氧官能团,C()对NO的还原将占据主导地位,如反应(22)所示[29]。高温能同时促进焦炭N的氧化和焦炭-NO的还原反应,温度对焦炭N向NOx转化的影响是“氧化-还原”的综合结果。随着燃烧温度升高,焦炭氮向NOx的转化率先增大后减小,燃烧温度高于1 050 ℃后,NOx的转化率随温升高而降低[13,21,121-123]。但当温度过高时,焦炭反应活性降低,焦炭—NO反应受阻[15]。
O2对焦炭N向NO的转化率的影响同样是“氧化-还原”综合结果,低氧条件下(<2%)的燃烧,O2对NO的还原起主导作用;氧气浓度较高时,O2主要促进NO生成[13,32,124]。低浓度氧促进焦炭—NO反应的机理主要包括[11,24,32,53,125-126]:促进NO生成反应活性更强的NO2,NO2与焦炭的反应活性大于O2的反应活性;促进表面被堵塞的活性位的清除,增加焦炭表面新活性位,加快NO的吸附;促进焦炭表面C(O)形成,提高低温条件下NO的还原;提高焦炭颗粒表面温度,从而促进了焦炭—NO反应。
燃烧温度和氧气浓度对NOx的形成存在相互作用,在还原性条件下NOx排放随温度升高而降低,在氧化性条件下则出现相反的趋势[7]。在700 ℃~900 ℃范围内,增加氧浓度会导致NO转化率下降;而在1 100 ℃时,随氧浓度增加,NO 转化率略有上升趋势。在动力控制时,氧气浓度提高则促进氧气在颗粒内部扩散,导致扩散深度和有效反应面积变大,从而促进焦炭—NO反应。从动力控制向扩散控制过渡时,氧浓度增加会促进NOx的形成,高温强还原性气氛能有效抑制焦炭NOx的生成[11,127]。
3.3 焦炭NOx抑制技术
焦炭的高效燃烧需要足够的氧气,且焦炭燃烧过程中O2对N和C无强烈的选择性,导致焦炭N向NO的转化率远高于挥发分N,促进焦炭燃烧过程中焦炭—NO反应是抑制焦炭NOx形成的关键。
通过降低炉内总体氧量,抑制NOx生成。但当过量空气系数很低时,煤粉燃烧效率降低,同时NOx的排放量也会有所升高,维持焦炭燃烧过程中低浓度氧能有效促进焦炭—NO反应,降低NOx排放量[104,112]。通过燃烧器煤粉预热+炉膛无焰燃烧能有效抑制煤粉燃烧过程中NOx的生成,NOx初始排放浓度能控制在50 mg/Nm3(6% O2)[34]。
目前对于焦炭NOx的控制主要是对烟气中已形成的焦炭NOx进行还原,常采用再燃技术、SNCR和SCR还原烟气中的NOx[128-130]。我国燃煤锅炉主要通过SCR脱硝技术实现NOx超低排放的要求,但易出现喷氨过量的问题,造成空预器换热面出现灰分堆积和板结,导致空预器堵塞严重、机组高负荷时出力不足、能量损失大[131-132]。
4 结 语
煤燃烧过程中燃料氮的迁移转化涉及复杂的氧化-还原反应,且燃料特性和燃烧条件都会影响氮化学反应。氮的迁移转化过程主要包括煤热解过程中挥发分N的释放、挥发分燃烧过程中挥发分NOx的生成及还原过程、焦炭燃烧过程中焦炭NOx的生成及还原过程。
(1)煤热解过程中氮迁移形成挥发分N和焦炭N,迁移过程由煤种和热解条件共同决定。热解条件不仅影响挥发分N的释放,还影响焦炭的反应活性,从而影响焦炭燃烧及焦炭N的转化过程。
(2)挥发分N主要以HCN和NH3的形式存在,通过均相氮化学机理建立的挥发分NOx生成预测模型,能较为准确地预测煤燃烧过程中挥发分NOx的形成过程。
(3)焦炭N的转化过程主要涉及焦炭N-O2和焦炭-NO 2个反应,焦炭NOx的形成受煤种、温度、氧气浓度、矿物组分、焦炭粒径、焦炭反应活性等因素的交互影响的综合结果,研究焦炭N的转化需要综合考虑各因素的影响。

