儿童支原体肺炎伴气道黏液栓形成危险因素的列线图预测模型构建
肺炎支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)占儿童社区获得性肺炎的40%以上,发病率较高
。MPP通常是一种自限性疾病,多数患儿经积极抗生素等药物治疗后能够康复,但仍有部分患儿发展为难治性MPP
。研究发现,超过三分之一的难治性MPP伴有气道黏液栓形成
。气道黏液栓形成后常引起肺不张、胸腔积液及支气管扩张等并发症,但许多伴气道黏液栓的MPP患儿在胸部影像学检查并没有明显的肺不张表现
。因此,早期诊断MPP患儿气道黏液栓的发生,有助于指导医师尽早行支气管镜检查,去除气道黏液栓,降低肺不张等并发症发生的风险,促进患儿疾病康复
。气道黏液栓的形成与炎症因子、氧化剂和免疫反应有关。研究表明,难治性MPP患儿血清肿瘤坏死因子(tumor necrosis factor,TNF)-α、干扰素(IFN)-γ和白介素(IL)-18的血清浓度升高,是早期诊断难治性MPP的血清标志物
。本研究对MPP患儿的支气管肺泡灌洗液进行细胞因子检测,结合MPP患儿临床及实验室检查指标,对MPP患儿气道黏液栓形成的独立危险因素构建风险列线图预测模型,为MPP患儿气道黏液栓的早期预防和诊治提供参考。
5G传送标准进展………………………………………………………………张源斌,杨剑,占治国,周严伟 24-1-62
1 对象与方法
1.1 研究对象
选取2016年2月—2020年2月我院诊治的186例MPP患儿。收集患儿一般临床资料。患儿纳入标准:①MPP诊断符合儿童社区获得性肺炎中支原体肺炎诊断标准
;②临床资料及实验室检查资料完整;③患儿家属对本研究知情同意;④患儿年龄1~15岁。排除标准:①近1个月使用抗生素;②合并肺结核、肺栓塞等肺部疾病;③合并气道狭窄等不适合行支气管镜操作的疾病。根据支气管镜检查结果,将MPP患儿分为单纯MPP组(110例)和MPP伴黏液栓组(76例)。本研究符合赫尔辛基宣言原则,已通过我院伦理委员会审核。
椎管内麻醉是指将药物向椎管内某腔隙中注入,可对脊神经传导功能逆性阻断或使其兴奋性减弱的麻醉方法之一,分为蛛网膜下腔阻滞和硬膜外腔阻滞两种类型[1]。有研究文献指出[2],上述两种麻醉方法使术后患者产生尿潴留的可能性明显增大。尿潴留主要是指尿液在膀胱内充满而无法正常排出,如不及时处置,可继发尿路感染及返流性肾病等疾病,对患者健康构成严重威胁。本研究收集接受椎管内麻醉方法的100例骨科手术患者有关资料,对采取椎管内麻醉方法的患者术后产生尿潴留的有关影响因素进行前瞻性分析,现将有关情况总结如下。
1.2 治疗及检测方法
1.2.1 治疗方法
1.2.3 酶联免疫吸附实验(ELISA)检测炎性因子
决策人员构造直接影响矩阵如表4所示。将CFGJ转换为PD-HFLTS,并对评估信息进行冲突水平判定与调整,确定冲突水平依次为0.056,0.056,0.083,0.083,均小于群体冲突水平阈值因此群体评估信息的冲突水平在合理范围内;利用PD-HF-WA确定群体直接影响矩阵DI=(diny)4×4,如表5所示;将DI=(diny)4×4等价转换为EDI=(ediny)4×4,进而求得规范化综合影响矩阵为NTDI=(ntdiny)4×4,结果如表6所示。
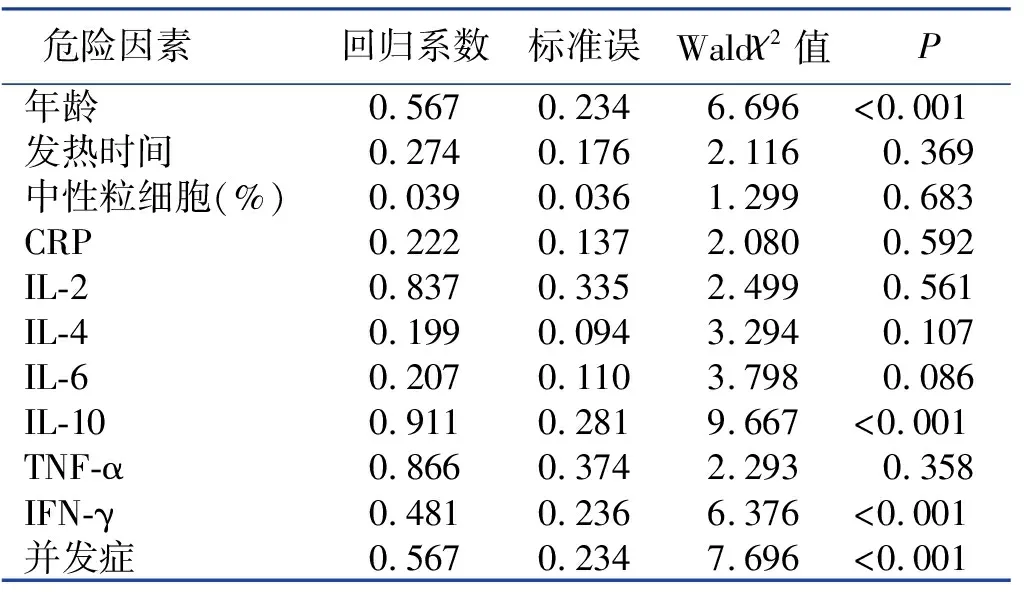
以MPP患儿并发气道黏液栓为因变量,以MPP患儿并发气道黏液栓危险因素的单因素分析中有统计学意义的因素(年龄、发热时间、中性粒细胞百分比﹑CRP、IL-2、IL-6、IL-10、IFN-γ及并发症)为自变量进行Logistic回归分析,各变量赋值情况为年龄:≤5岁=0,>5岁=1;发热时间:≤6 d=0,>6 d=1;中性粒细胞百分比:≤61%=0,>61%=1;CRP:≤29 mg/L=0,>29 mg/L=1;IL-2:≤10 ng/L=0,>10 ng/L=1;IL-6:≤10 ng/L=0,>10 ng/L=1;IL-10:≤10 ng/L=0,>10 ng/L=1;IFN-γ:≤30 ng/L=0,>30 ng/L=1;并发症:无=0,有=1。结果表明年龄、IL-10、IFN-γ及并发症是MPP患儿气道黏液栓形成的独立危险因素,结果详见表2。
朱家山路与长江大堤平行,月亮湾路则起于长江大堤下,从几乎与江堤成垂直的角度向腹地延伸,两条路相交的地方就是月半湾的位置。
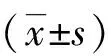
使用柔性视频支气管镜进行支气管镜检查(BF-3C30,日本奥林巴斯),具体操作步骤参考2008版诊断性可弯曲支气管镜应用指南
。术前禁食6 h,常规2% 利多卡因气道黏膜表面局部麻醉后,观察气管、各级支气管病变,如观察到黏液栓阻塞后用细胞刷将黏液栓清除,结合胸部CT或胸片对相应部位进行支气管肺段灌洗。具体步骤:固定支气管镜远端,滴注无菌温生理盐水,1 mL/kg,最大20 mL,15 kPa负压吸出,并收集灌洗液至无菌管中,1份送检细菌培养及药敏,另1份送至实验室后14 000 g离心10 min,留取上清,-80 ℃冰箱保存待测。
所有MPP患儿住院后均予以大环内酯类药物阿奇霉素治疗,剂量10 mg/(kg·d),连续静脉给药4 d,停3 d,为1个疗程,治疗2个或3个疗程。合并细菌感染时加用三代头孢,剂量80 mg/(kg·d)。全身炎症反应较重时加用甲泼尼龙琥珀酸钠,剂量2 mg/(kg·d)。
收集所有研究对象的临床资料,包括性别、年龄、发热时间及出生体重,入院后第1天实验室检查指标,包括血常规中血红蛋白(hemoglobin,Hb)、C反应蛋白(C-reactive protein,CRP)、降钙素原(procalcitonin,PCT)及血小板数目(platelet count,PLT)等,肝肾功能检查中丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移(aspartate aminotransferase,AST)及乳酸脱氢酶(lactate dehydrogenase,LDH)。
1.3 观察指标
应用ELISA法检测支气管肺泡灌洗液中IL-2、IL-4、IL-6、IL-10、IFN-γ及TNF-α。各细胞因子试剂盒购自北京索莱宝公司,实验步骤按照试剂盒说明书进行。每个标本重复3次,结果取平均值。
1.4 统计学分析
1.2.2 支气管镜检查及支气管肺泡灌洗
2 结果
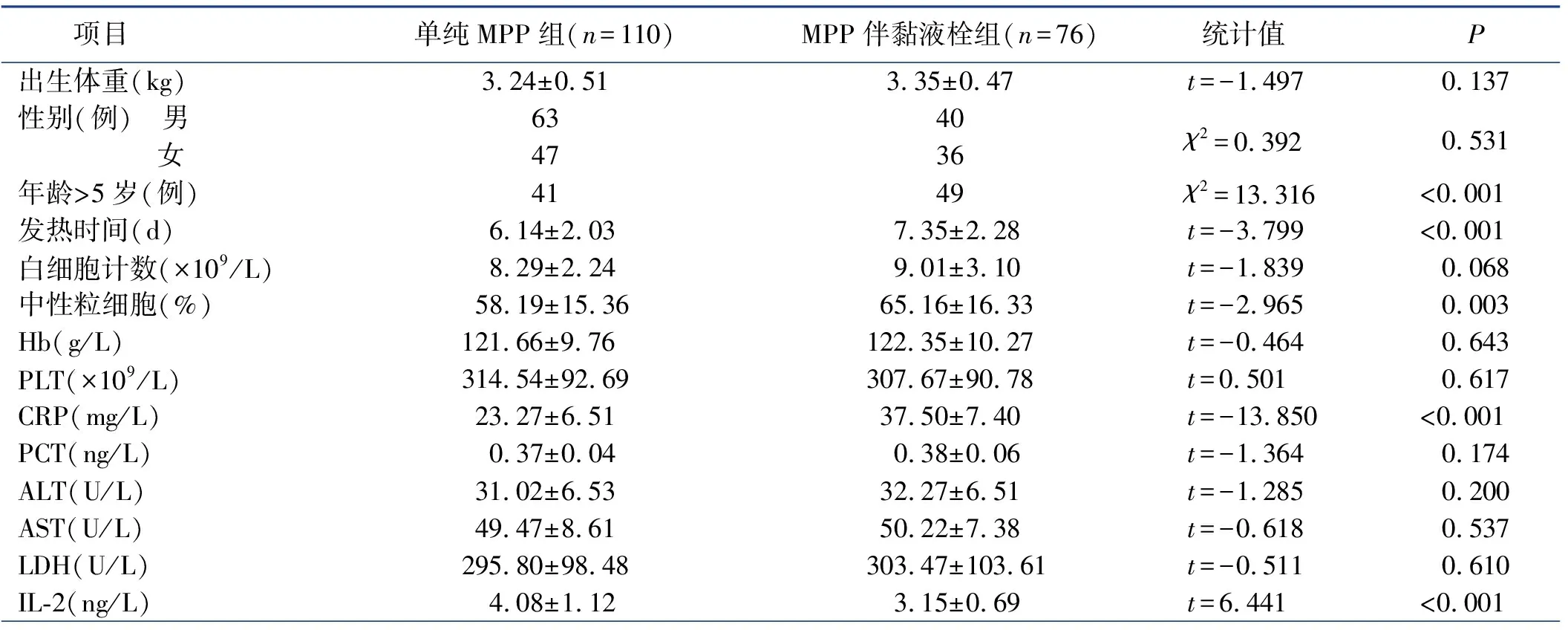
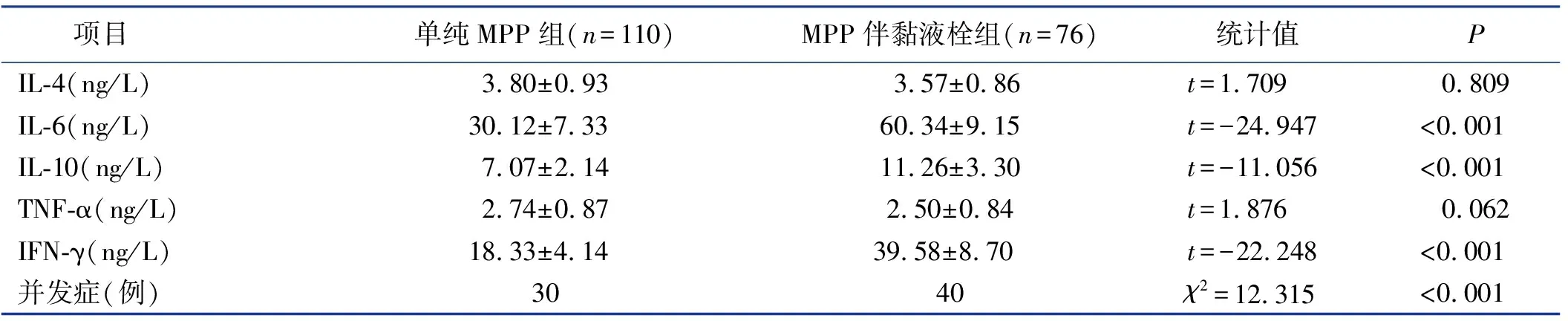
2.1 MPP患儿气道黏液栓形成的单因素分析
单因素分析结果,年龄、发热时间、中性粒细胞百分比、CRP、IL-2、IL-6、IL-10、IFN-γ及并发症是影响MPP患儿气道黏液栓形成的因素。相比于单纯MPP组,MPP伴气道黏液栓组患儿年龄大、发热时间长及中性粒细胞百分比高、CRP高、IL-2低、IL-6高、IL-10高、IFN-γ高,且并发症较多(均
<0.05)。见表1。
2.2 MPP患儿气道黏液栓形成危险因素的Logistic回归分析
利用GWR模型获得的不同区域发展城市旅游、提高旅游效率的主要因素以及制约性的条件,意味着区域之间城市效率的增长机制不是相同的,基于空间格局差异的前提与基础之上,对珠三角广府、粤东潮汕、粤东北客家、粤西滨海、粤北南岭生态的五大旅游板块进行了分析,基于产业结构优化、旅游设置以及投入冗余性问题、城市基础设施建设、政府、投入、旅游资源利用率等角度进行分析,在实践中要基于实际状况制定完善的发展规划。
2.3 MPP患儿并发气道黏液栓形成列线图预测模型建立
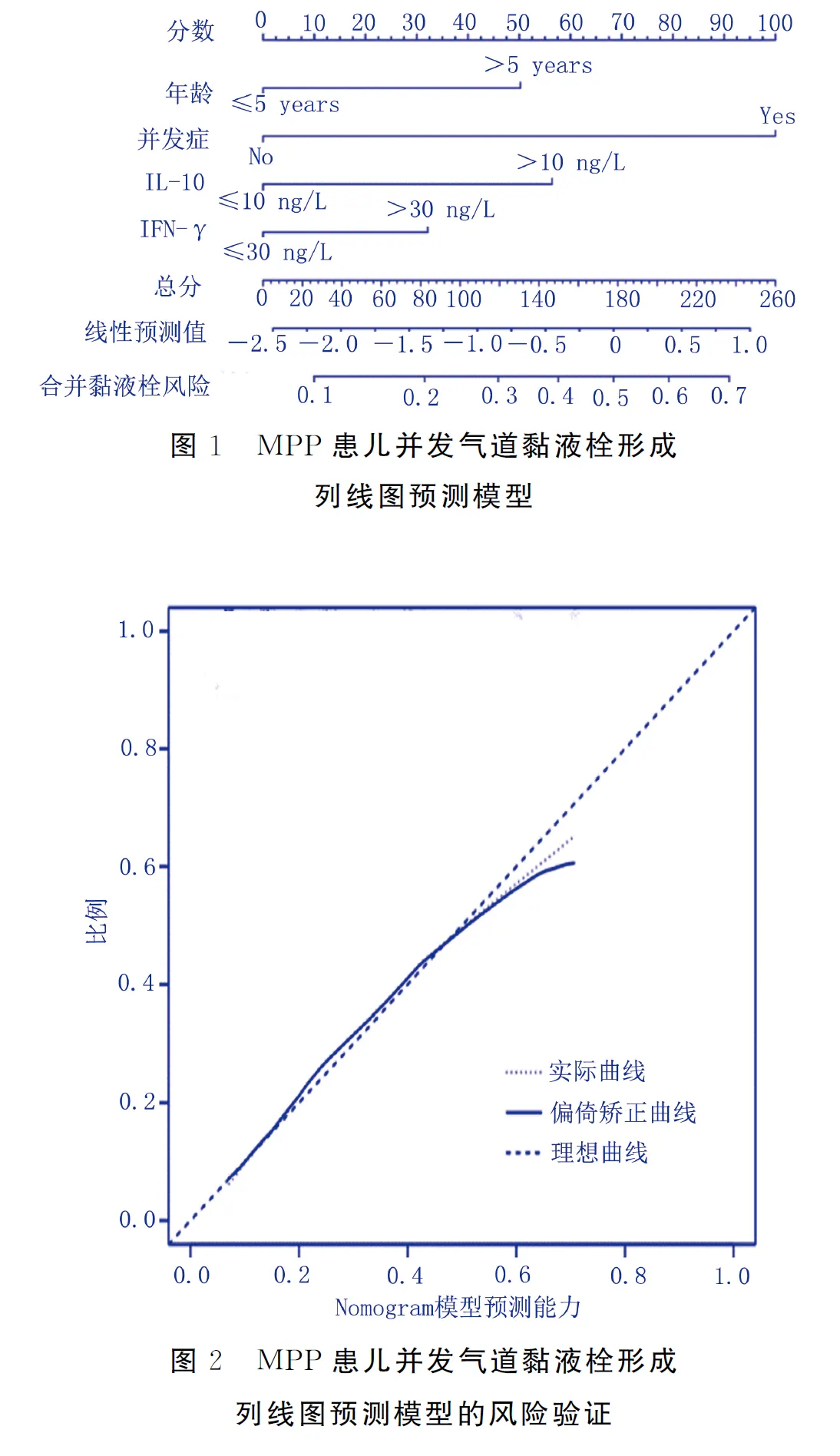
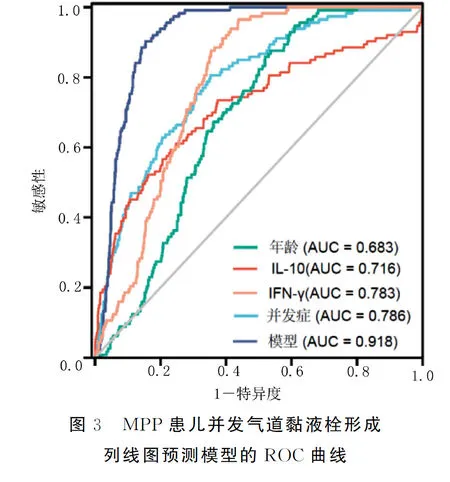
基于Logistic回归分析得到的4个影响因素(年龄、IL-10、IFN-γ及并发症)建立MPP患儿并发气道黏液栓形成列线图预测模型,见图1。采用Calibration曲线验证该模型的精准度,结果显示预测值接近实际值,见图2,C-index为0.815[95%CI(0.659,0.883)],采用ROC曲线检验模型的区分度,X轴为风险预测值,Y轴为实际风险值,结果校准验证曲线呈对角线对应关系,模型的预测概率与实际值具有良好的一致性。年龄、IL-10、IFN-γ、并发症单一预测因子及预测模型的ROC曲线下面积分别为0.683[95%CI(0.645,0.721)]、0.716[95%CI(0.657,0.774)]、0.783[95%CI(0.753,0.813)]、0.786[95%CI(0.744,0.823)]、0.918[95%CI(0.882,0.936)],预测模型的预测效能明显高于单个预测因子(
=6.163,6.958,7.863,10.380,均
<0.001),见图3。
3 讨论
肺炎支原体是儿童社区获得性肺炎的主要病原体。MPP患儿急性期气道黏膜充血肿胀,分泌物增多,导致黏液栓形成,阻塞气管口后导致段支气管通气不良,引起肺不张、胸腔积液等并发症。深入研究MPP气道黏液栓形成的危险因素,有利于MPP气道黏液栓的预防和早期临床干预治疗。
有研究发现,年龄、发热持续时间、CRP和LDH是难治性MPP患儿气道黏液栓形成的危险因素,联合4个指标对气道黏液栓形成的诊断的敏感性达71%,特异性达78.9%
。国内学者报道,年龄、D-二聚体、肺不张是MPP患儿气道黏液栓形成的独立危险因素
。不同报道的临床及实验室检查指标并不一致,难以在临床上推广应用。因此,有必要深入研究MPP患儿气道黏液栓形成的机制。近年来发现,气道黏液栓的形成与气道微生物菌群的改变和气道局部免疫功能紊乱关系密切,涉及大量炎性细胞因子的异常改变
。有研究表明,难治性MPP患儿血清中TNF-α、IFN-γ和IL-18等细胞因子表达水平增加,是新的MPP病情判断的分子标志物
。此外,MPP患儿肺泡灌洗液中也会出现炎性细胞因子表达失调的现象。既往研究亦表明,难治性MPP患儿的支气管肺泡灌洗液中IL-6,IL-10和IFN-γ浓度显著升高,特别是合并胸腔积液的患儿浓度升高更为显著
。因此,将MPP患儿临床参数与支气管肺泡灌洗液中细胞因子检测相结合,有助于预测MPP气道黏液栓的发生。本研究结果显示,患儿年龄>5岁、IL-10>10 ng/L、IFN-γ>30 ng/L和伴有并发症(胸腔积液和肺不张)是MPP患儿气道黏液栓形成的独立危险因素。分析其原因,可能是伴气道黏液栓的MPP患儿气道微生物菌群的异常改变有关。Xu等
研究发现,伴有气道黏液栓的MPP患儿普氏杆菌、链球菌、韦荣氏菌的相对丰度值显著高于无气道黏液栓的MPP患儿,韦荣氏菌能够促进气道黏膜微环境中的巨噬细胞,树突状细胞等局部免疫细胞分泌释放大量的IL-10,IFN-γ等细胞因子,导致气道黏膜充血肿胀,分泌物增多,引起气道黏液栓形成。此外,MPP患儿的年龄与气道微环境中链球菌的相对丰度呈显著正相关,对于年龄>5岁的MPP患儿,由于支原体感染后气道菌群微环境中链球菌丰度较高,易形成气道黏液栓。在临床工作中,医护工作者应当对具有气道黏液栓形成危险因素的MPP患儿及时采用敏感抗生素,当大环内酯类药物治疗效果较差时,必要时尽早联合其它抗生素或激素进行治疗,同时配合专业的护理措施,联合应用雾化吸入和震动排痰,促进患儿康复。既往研究表明,难治性MPP患儿血清CRP、LDH、IL-4、IL-6等细胞因子表达亦显著上调,并且是病人不良预后的独立危险因素
。本研究未发现组间上述指标存在显著差异,虽然合并黏液栓的MPP患儿发热时间、CRP、肺泡灌洗液中IL-2、IL-6水平高于单纯MPP患儿,但多元Logistic分析中,上述指标OR值相对较小,差异无统计学意义,未纳入列线图分析中。分析其原因,可能是不同研究病例纳入和排除标准不同,导致不同研究之间存在一定的偏倚。
列线图模型能够将预测模型量化为事件概率的数值估计,在预测结果方面具有较高的准确性和良好的判别能力
。本研究将年龄、IL-10、IFN-γ及并发症4个影响MPP患儿气道黏液栓形成的危险因素纳入列线图预测模型中,结果C指数值为0.815,表明预测值和实际观察值之间一致性较高,提示年龄>5岁,IL-10>10 ng/L,IFN-γ>30 ng/L及伴有并发症对于MPP黏液栓的发生具有较高的预测价值。因此,在临床工作中,临床医护工作者可以利用列线图作为评估MPP患儿是否合并黏液栓的工具,用于评估支气管镜检查的必要性,减少肺部并发症的发生。此外,在患儿护理过程中,应对患儿的呼吸,咳喘等症状体征进行密切观察,特别是当MPP患儿突然出现呼吸困难,喘憋加重等呼吸道梗阻的表现,应立即吸痰、吸氧,并采用雾化吸入和震动排痰联用的方法,促进痰液稀释,缓解支气管痉挛,改善呼吸道梗阻
。如上述处理患儿发绀仍不能缓解,并出现心率加快等症状,应通知医师共同救治。胸部影像学检查中,如果发现持续存在的肺不张是支气管镜介入治疗的适应证。本研究中,并发症在列线图预测中得分最高。因此,对于影像学检查提示肺不张的MPP患儿,无论是否存在气道黏液栓,都应尽早进行支气管镜检查
。此外,胸腔积液也是MPP患儿伴气道黏液栓的危险因素之一,但目前尚无关于MPP患儿胸腔积液与气道黏液栓形成关系的相关报道,其潜在机制需要进一步研究。本研究尚存在一定的不足。本研究使用Bootstrap法对模型进行内部验证,还需要进行前瞻性研究以进一步确认列线图的可靠性。此外,由于本研究未对除IL-2、IL-6、IL-10、IFN-γ以外的细胞因子,如IL-18等进行检测。因此,是否存在其他更高特异性的细胞因子,有待进一步研究。
4 小结
综上所述,年龄、支气管肺泡灌洗液中IL-10、IFN-γ水平及是否伴并发症是MPP患儿气道黏液栓形成的独立危险因素。根据年龄、IL-10、IFN-γ及并发症这4个影响因素建立MPP患儿伴气道黏液栓列线图预测模型,该模型具有较高的精准度和区分度,可用于早期识别MPP患儿气道黏液栓的发生,指导临床医护人员根据病人实际情况分析MPP患儿气道黏液栓发生风险,从而制定针对性的预防措施。
[1] KUTTY P K,JAIN S,TAYLOR T H,
Mycoplasma pneumoniae among children hospitalized with community-acquired pneumonia[J].Clinical Infectious Diseases,2019,68(1):5-12.
[2] ZHANG Y Y,ZHOU Y L,LI S X,
The clinical characteristics and predictors of refractory mycoplasma pneumoniae pneumonia in children[J].PLoS One,2016,11(5):e0156465.
[3] XU Q Y,ZHANG L Q,HAO C L,
Prediction of bronchial mucus plugs formation in patients with refractory mycoplasma pneumoniae pneumonia[J].Journal of Tropical Pediatrics,2017,63(2):148-154.
[4] 李佳,张慧玉,刘晓佳,等.不明原因肺不张纤维支气管镜检查准确度、镜下特征及并发症研究分析[J].中国实验诊断学,2018,22(3):505-506.
[5] EFRATI O,SADEH-GORNIK U,MODAN-MOSES D,
Flexible bronchoscopy and bronchoalveolar lavage in pediatric patients with lung disease[J].Pediatric Critical Care Medicine,2009,10(1):80-84.
[6] XU X F,LI X J,LIU J L,
Serum cytokine profile contributes to discriminating M.Pneumoniae pneumonia in children[J].Cytokine,2016,86:73-78.
[7] 中华人民共和国国家健康委员会,国家中医药局.儿童社区获得性肺炎诊疗规范(2019年版)[J].临床医学研究与实践,2019,4(6):201.
[8] 中华医学会呼吸病学分会介入呼吸病学学组.成人诊断性可弯曲支气管镜检查术应用指南(2019年版)[J].中华结核和呼吸杂志,2019,42(8):573-590.
[9] ZHANG J H,WANG T,LI R R,
Prediction of risk factors of bronchial mucus plugs in children with mycoplasma pneumoniae pneumonia[J].BMC Infectious Diseases,2021,21(1):67.
[10] 石苗苗,王玉,杨泽玉,等.儿童肺炎支原体肺炎合并气道黏液栓的临床特点及危险因素分析[J].新疆医科大学学报,2020,43(9):1213-1217.
[11] XU X F,WU L,SHENG Y J,
Airway microbiota in children with bronchial mucus plugs caused by mycoplasma pneumoniae pneumonia[J].Respiratory Medicine,2020,170:105902.
[12] WANG Y,ZHANG Y S,LU W T,
Serum tumor necrosis factor-α and interferon-γ levels in pediatric mycoplasma pneumoniae pneumonia:a systematic review and Meta-analysis[J].Canadian Respiratory Journal,2018,2018:8354892.
[13] 于畅,张晗,尚云晓.儿童难治性肺炎支原体肺炎支气管肺泡灌洗液细胞因子检查意义及与血清C反应蛋白相关性研究[J].国际儿科学杂志,2019,46(11):845-851.
[14] 李晓辉,董利利,张磊,等.儿童难治性肺炎支原体肺炎的临床特征及其免疫指标分析[J].中国合理用药探索,2020,17(6):41-44.
[15] 李俊梅,郑成中,张曼,等.儿童难治性肺炎支原体肺炎的临床特点及血清IL-4、IL-6、IL-10、IFN-γ的变化分析[J].现代生物医学进展,2018,18(24):4768-4772.
[16] JEONG S H,KIM R B,PARK S Y,
Nomogram for predicting gastric cancer recurrence using biomarker gene expression[J].European Journal of Surgical Oncology,2020,46(1):195-201.
[17] 贾萌萌,王诗晴,朱晓丽.优质护理在小儿难治性肺炎支原体肺炎纤支镜肺泡灌洗中的应用效果[J].中国民康医学,2020,32(15):152-154.
[18] 张华,孙晓萍,赵小艳,等.小儿难治性支原体肺炎的护理[J].中国现代药物应用,2014,8(16):190-191.
[19] SMEIJSTERS K M G,BIJKERK R M,DANIELS J M A,
Effect of bronchoscopy on gas exchange and respiratory mechanics in critically ill patients with atelectasis:an observational cohort study[J].Frontiers in Medicine,2018,5:301.
[20] BHAT J I,WANI W A,AHMAD Q I,
Flexible bronchoscopy in non-resolving pneumonia[J].Indian Journal of Pediatrics,2017,84(9):681-684.
