刺五加多糖纳米乳对免疫抑制小鼠的免疫增强作用
李向辉 , 黄 慧 , 周延州 , 闫盼盼 , 李清苗 , 黄莲菊 , 马 霞
(河南牧业经济学院动物医药学院 , 河南 郑州 450046)
刺五加多糖(Acanthopanaxsenticosuspolysaccharide,ASPS)是从五加科植物刺五加中提取出来的具有药效活性的成分[1]。它可以激活并促进免疫细胞的产生,增强机体的免疫活性[2-4]。袁学千等[5]研究发现,刺五加多糖可明显提高正常小鼠的脾脏和胸腺指数,促进肠系膜细胞增多,恢复免疫抑制小鼠的免疫功能;张英楠[6]研究发现,刺五加多糖对鸡具有一定的免疫调节作用,能促进脾脏、胸腺的发育和巨噬细胞细胞数目的增多。目前,关于刺五加多糖的制剂很少,未见有关刺五加多糖纳米乳(Acanthopanaxsenticosuspolysaccharide-nanoemulsion,ASPS-NE)对免疫抑制小鼠方面的研究。本试验在前期制备刺五加多糖纳米乳的基础上[7],利用环磷酰胺建立小鼠免疫抑制模型,通过对其胸腺、脾脏指数测定、脾细胞增殖活性检测、碳廓清试验、NK细胞活性检测等来研究刺五加多糖纳米乳对免疫抑制小鼠的免疫增强效果,从而为兽医临床提供一种新型有效的免疫增强剂,也为利用纳米技术开发中药免疫增强剂提供技术支撑。
1 材料与方法
1.1 主要试剂与药品 刺五加多糖,购自西安小草植物科技有限公司(产地辽宁沈阳,多糖含量95%);环磷酰胺(Cyclophosphamide,CTX),购自上海阿拉丁生化科技股份有限公司;小鼠淋巴细胞分离液,购自深圳市达科为生物股份有限公司;RPMI-1640培养液,购自北京索莱宝科技有限公司;10%胎牛血清,购自上海碧云天生物技术有限公司;刀豆球蛋白A(Concanavalin A,ConA)和脂多糖(Lipopolysaccharide,LPS),均购自美国Sigma公司;CCK-8,购自日本东仁化学科技公司;印度墨汁,购自北京恒奥德科技有限公司;刺五加多糖纳米乳(ASPS-NE)、空白纳米乳、刺五加多糖水溶液(ASPS),均由河南牧业经济学院动物医药学院药理学实验室制备。
1.2 主要仪器 倒置生物显微镜,日本奥林巴斯公司产品;CO2培养箱,上海跃进医疗器械有限公司产品;多功能酶标仪,美国赛默飞世尔公司产品;紫外分光光度计,上海仪田精密仪器公司产品;台式高速离心机,德国艾本德公司产品;超净工作台,郑州生元仪器有限公司产品;恒温水浴锅,上海一恒科技有限公司产品。
1.3 实验动物与细胞 SPF级BALB/c小鼠,雌雄各半,6~8周 龄,体重(18±2)g,购自郑州大学实验动物中心[实验动物质量合格证号:SCXK (豫)2020—0052],小鼠自由采食和饮水,饲养温度:(25±1) ℃、 相对湿度:40%±10%、光周期控制:12 h光-暗循环。YAC-1细胞,购自中国科学院上海细胞库。
1.4 试验方法
1.4.1 试验设计 将70只BALB/c小鼠随机分成7个组,每组10只,分别为ASPS水溶液组、ASPS-NE高剂量组、ASPS-NE中剂量组、ASPS-NE低剂量组、空白纳米乳组、CTX模型组和正常对照组。ASPS水溶液组以50 mg/(kg·bw)的剂量皮下注射ASPS水溶液;ASPS-NE高剂量组、ASPS-NE中剂量组和ASPS-NE低剂量组分别以100、50 mg/(kg·bw)和25 mg/(kg·bw)的药物剂量皮下注射ASPS-NE;正常对照组以0.1 mL/(10 g·bw)体重皮下注射生理盐水;空白纳米乳组以50 mg/(kg·bw)的用量皮下注射空白纳米乳,每日1次,连用7 d。
另外,除正常对照组外,其余各组在第1、2天和第5天均按照80 mg/(kg·bw·d)的剂量皮下注射环磷酰胺,共3次,末次给药24 h后将小鼠采用安乐死的方法致死后采集脾脏、胸腺等器官,收集脾细胞进行脾细胞增殖活性检测,在动物试验过程中严格遵守动物福利伦理的相关要求,减少对动物的应激和痛苦,采用对动物痛苦最少的方式进行处置。
1.4.2 免疫器官指数的测定 末次给药12 h后,取每组小鼠并称重,做好记录,将小鼠脱颈处死,取出每只小鼠的脾脏和胸腺,分别称重记录,最后按照公式(1)计算每组的脾脏指数和胸腺指数。

公式(1)
1.4.3 脾细胞增殖活性检测 末次给药12 h后,无菌采集小鼠脾脏进行研磨,用小鼠淋巴细胞分离液收集脾细胞,制成密度为5×105个/mL的脾细胞悬液。按照分组情况,在96孔板中先加入脾细胞悬液,每孔100 μL,再分别加入含ConA(终浓度为5 μg/mL) 或者LPS(终浓度为10 μg/mL)的RPMI-1640培养液,每孔100 μL。同时设立只加入200 μL RPMI-1640培养液的空白对照组。在37 ℃、5% CO2培养箱中培养44 h后,向每孔加入10 μL CCK-8溶液,将培养板在培养箱内孵育2 h,用酶标仪测定450 nm 处的吸光度(OD值),每个试验重复4次。
1.4.4 单核巨噬细胞的吞噬活性检测 参考文献[8] 方法进行碳廓清试验检测。末次给药12 h后,在小鼠尾静脉注射印度墨汁(以生理盐水按1∶5稀释)0.2 mL,注射完之后马上开始计时,分别在注射后的第2分钟(t1)和第10分钟(t2)进行眼眶采血,并将采集的血液(20 μL)加到2 mL 0.1% 的Na2CO3溶液中,摇匀,以此作为空白对照,用分光光度计测定波长600 nm处的吸光度OD值。处死小鼠后取出肝脏和脾脏,处理干净后进行称重,按公式(2)计算吞噬指数(α)。

公式(2)
其中,A1和A2分别为t1和t2时的吸光度OD值。
1.4.5 自然杀伤(NK)细胞活性检测 无菌条件下取出复苏好的YAC-1细胞,向其中加入含10%胎牛血清的RPMI-1640培养液进行稀释,制成密度为1×104个/mL 的YAC-1细胞悬液,作为靶细胞。效应细胞是制备的脾细胞悬液。试验分为试验孔、靶细胞对照孔、效应细胞对照孔和空白对照孔,试验孔中加入脾细胞悬液和YAC-1细胞悬液各100 μL;靶细胞对照孔加入YAC-1细胞悬液和RPMI-1640培养液各100 μL;效应细胞对照孔加入脾细胞悬液和RPMI-1640培养液各100 μL;空白对照孔每孔只需加入200 μL 的RPMI-1640 培养液,重复3孔。然后将制备好的96孔板放在CO2培养箱中培养44 h后,取出向每孔加入10 μL CCK-8溶液,将培养板在培养箱内孵育2 h,用酶标仪测定450 nm处的吸光度OD值。NK细胞活性通常用NK细胞杀伤率表示,按照公式(3)计算。

公式(3)
1.5 统计分析 试验结果以“平均值±标准差”方式表示,采用SPSS 22.0软件对数据进行统计分析,使用单因素方差分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 ASPS-NE对免疫抑制小鼠免疫器官指数的影响 结果如表1所示,与正常对照组相比,CTX模型组的脾脏和胸腺指数均极显著减小(P<0.01),说明环磷酰胺免疫抑制模型建模成功;与CTX模型组相比,空白纳米乳组对免疫抑制小鼠的免疫器官指数影响不明显(P>0.05),而ASPS水溶液组、ASPS-NE高剂量组、ASPS-NE中剂量组、ASPS-NE低剂量组的脾脏指数和胸腺指数均极显著提高(P<0.01); 与ASPS水溶液组相比,ASPS-NE高剂量组的脾脏指数和胸腺指数显著提高(P<0.05),ASPS-NE中剂量组的指数极显著提高(P<0.01)。
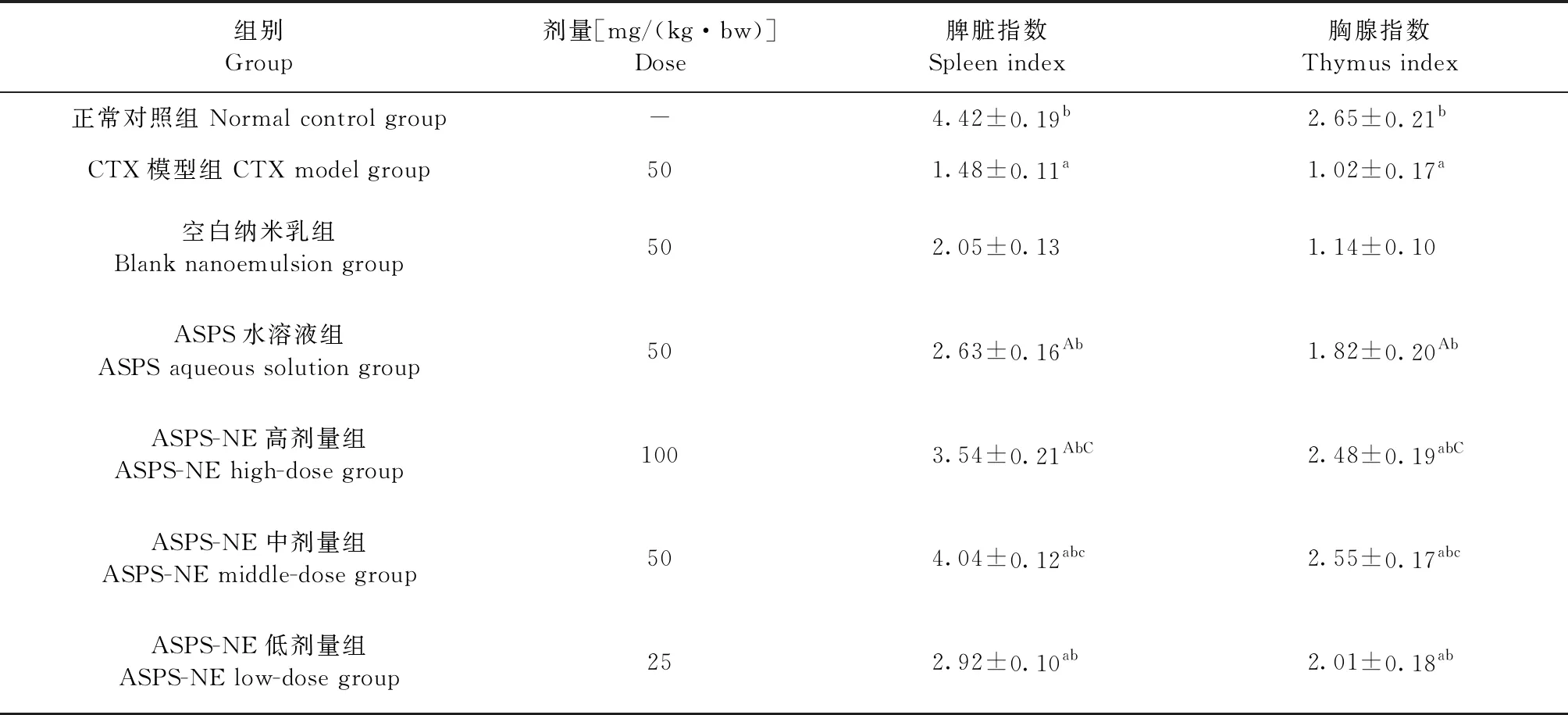
表1 ASPS-NE对免疫抑制小鼠免疫器官指数的影响
2.2 ASPS-NE对免疫抑制小鼠脾淋巴细胞增殖活性的影响 结果如表2所示,与正常对照组相比,CTX模型组由ConA和LPS诱导的脾淋巴细胞增殖活性(OD值)均极显著减小(P<0.01),说明环磷酰胺免疫抑制模型建模成功;与 CTX模型组相比,ASPS水溶液组、ASPS-NE高剂量组和ASPS-NE中剂量组由ConA和LPS诱导的脾淋巴细胞增殖活性(OD值)均极显著增高(P<0.01),而且ASPS-NE中剂量组由ConA和LPS诱导的脾淋巴细胞增殖的活性更强;与ASPS水溶液组相比,ASPS-NE中剂量组由ConA和LPS诱导的脾淋巴细胞增殖活性增强效果极显著(P<0.01)。结果表明,ASPS-NE高、中、低剂量组均能显著增强免疫抑制小鼠脾淋巴细胞的增殖活性,尤其是ASPS-NE中剂量的效果更佳。
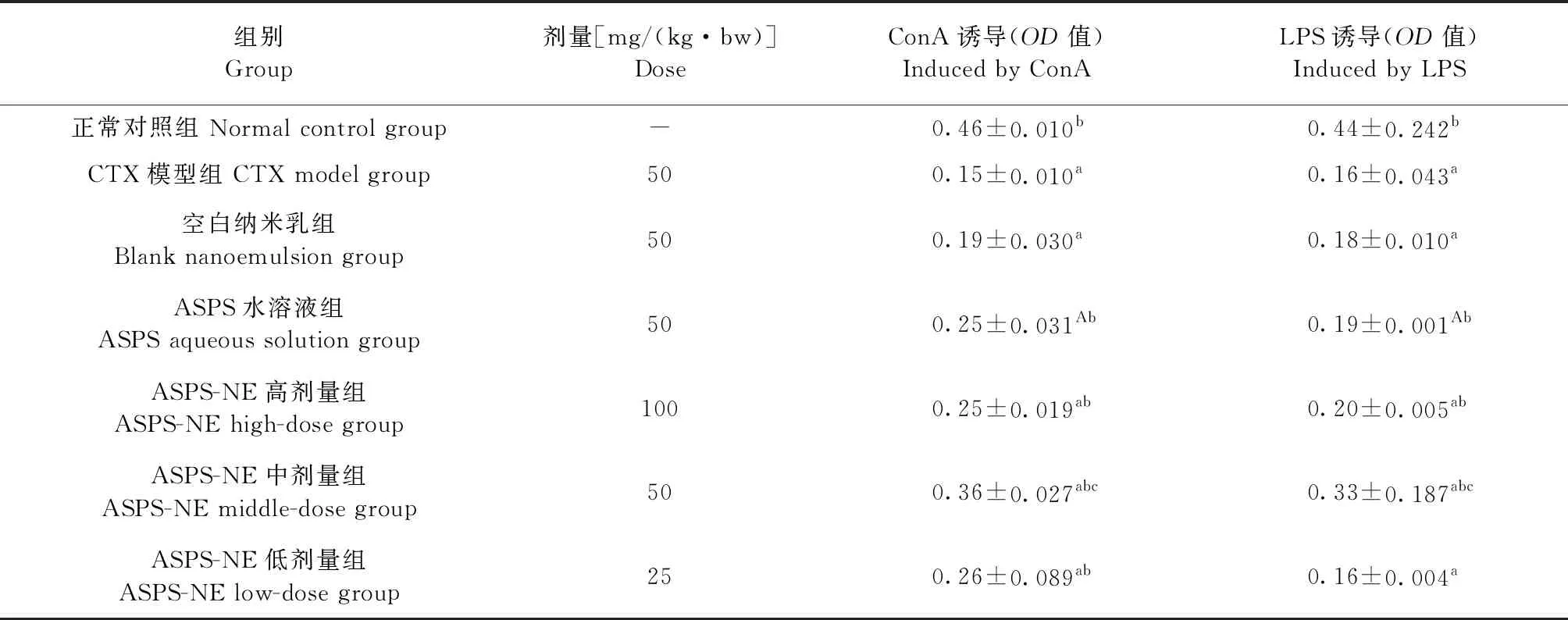
表2 ASPS-NE对免疫抑制小鼠脾淋巴细胞增殖活性的影响
2.3 ASPS-NE对免疫抑制小鼠单核巨噬细胞系统的影响 结果如表3所示,与正常对照组相比,CTX模型组的吞噬指数极显著降低(P<0.01);与 CTX模型组相比,ASPS-NE高剂量组、ASPS-NE中剂量组和ASPS-NE低剂量组的吞噬指数极显著增高(P<0.01),ASPS水溶液组的吞噬指数显著增高(P<0.05);与ASPS水溶液组相比,ASPS-NE中剂量组的吞噬指数极显著增高(P<0.01),ASPS-NE低剂量组的吞噬指数显著增高(P<0.05)。结果表明,ASPS-NE高、中、低剂量组均能显著增强免疫抑制小鼠单核吞噬细胞的指数,尤其是ASPS-NE中剂量的效果更佳。
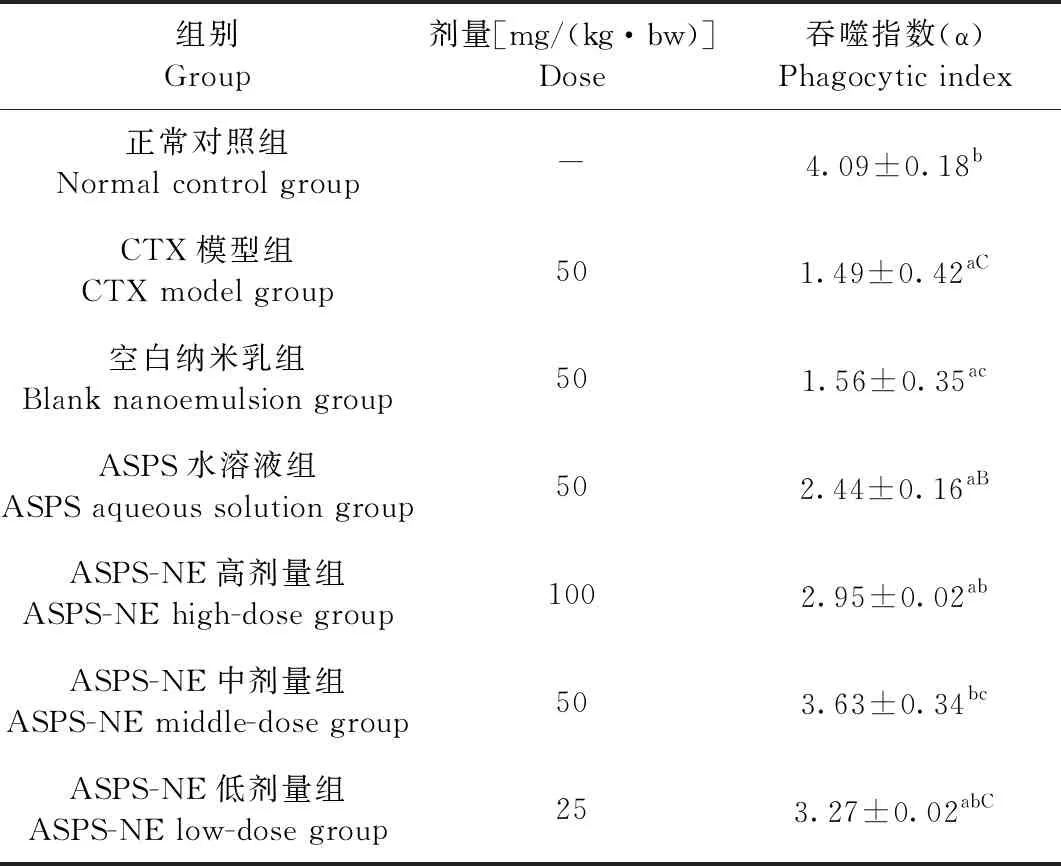
表3 ASPS-NE对免疫抑制小鼠单核巨噬细胞系统的影响
2.4 ASPS-NE对免疫抑制小鼠脾脏NK细胞活性的影响 结果如表4所示,与正常对照组相比,CTX模型组、空白纳米乳组的NK细胞杀伤率均极显著降低(P<0.01),说明小鼠免疫抑制剂模型造模成功;与CTX组模型相比,ASPS水溶液组、ASPS-NE高剂量组、ASPS-NE中剂量组和ASPS-NE低剂量组的NK细胞杀伤率均极显著升高(P<0.01),尤其是ASPS水溶液组、ASPS-NE中剂量组的NK细胞杀伤率升高更快,接近于正常对照组水平;与ASPS水溶液组相比,ASPS-NE中剂量组的NK细胞杀伤率极显著升高(P<0.01),其他组都呈降低水平。结果表明,ASPS-NE可以显著增强免疫抑制小鼠的NK细胞活性,而且ASPS-NE中剂量的效果比ASPS水溶液更佳。
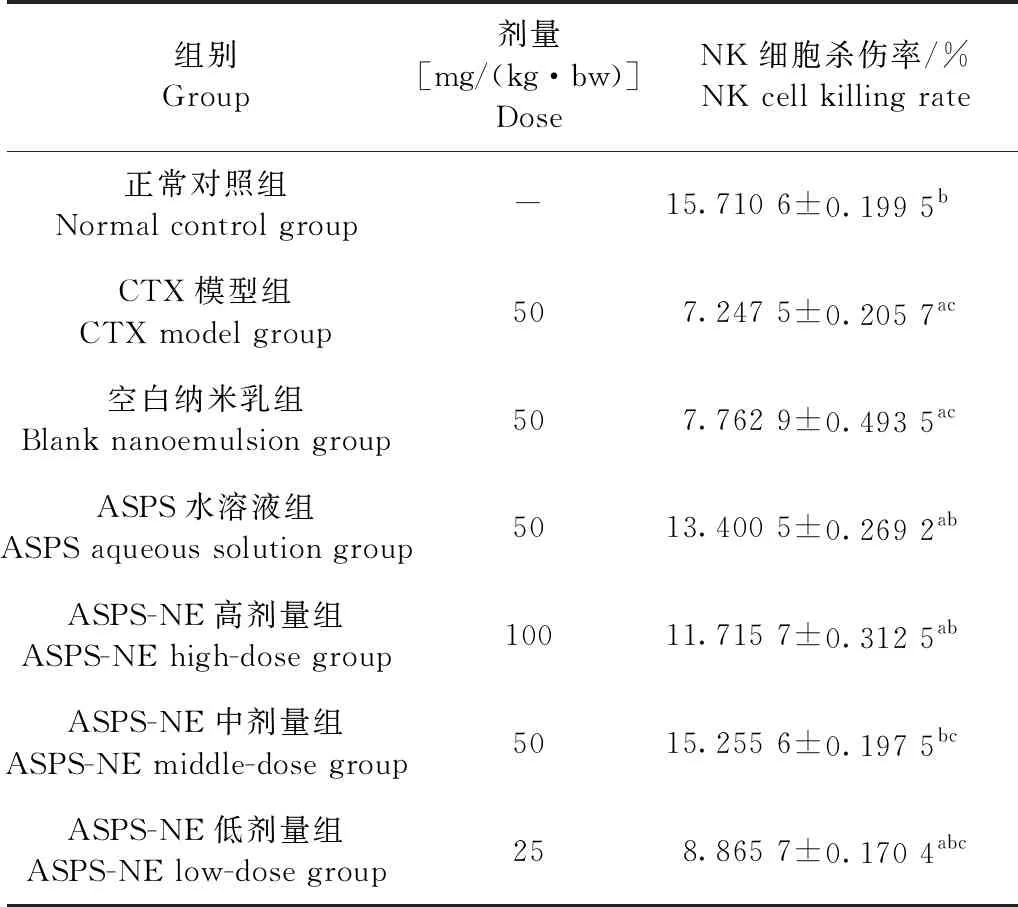
表4 ASPS-NE对免疫抑制小鼠NK细胞活性的影响
3 讨论
脾脏和胸腺是机体发挥免疫作用的关键组织,常用其指数的高低来反映免疫器官发育的程度,脾脏和胸腺发育越好,质量越大,机体的免疫能力越强。环磷酰胺常用来建立免疫抑制动物模型,其会损害小鼠的肝脏,降低小鼠的脾脏和胸腺的免疫指数[9-10]。本试验结果显示,与正常对照组相比,CTX模型组的脾脏和胸腺的脏器指数明显下降;相反,ASPS-NE高、中、低剂量组的脏器指数与CTX模型组相比有不同程度的明显升高。单核-巨噬细胞系统具有免疫防御功能,能够吞噬机体内异常的物质,清除对机体有害的物质。碳廓清试验中,碳粒的清除速率能够表明机体的吞噬能力[11]。本试验结果显示,ASPS-NE 能明显增强免疫抑制小鼠的单核巨噬细胞吞噬指数,增强其吞噬能力,ASPS-NE 中剂量组的单核巨噬细胞的吞噬效果极显著强于ASPS水溶液组。这些结果与翟旭楠等的研究结果相似,该研究小组采用CTX诱发免疫抑制模型来研究刺五加多糖对小鼠免疫功能的影响,发现 ASPS 用药组的脏器指数与模型组相比显著提高(P<0.05),吞噬指数极显著提高(P<0.01)[12]。以上结果表明 ASPS-NE与ASPS水溶液都能促进脏器指数升高,增强巨噬细胞的吞噬活性,ASPS-NE 的效果优于ASPS水溶液,尤其是中剂量ASPS-NE的效果更佳。因此,推断ASPS-NE 可能通过激活巨噬细胞适应性免疫和先天免疫发挥作用。
脾脏是机体免疫系统的主要免疫器官之一,由 T 细胞和 B 细胞组成。脾淋巴细胞增殖是细胞免疫功能最直接的指标。可以通过探讨ASPS-NE对脾淋巴细胞增殖的影响,研究其免疫增强作用。ConA、LPS分别可以刺激不同的淋巴细胞亚型,T 淋巴细胞对 ConA 敏感,B 淋巴细胞对 LPS 敏感[13]。因此,淋巴细胞增殖率是量化多糖免疫增强活性强弱的指标[14]。本试验采用CCK-8法检测脾细胞的增殖情况,在使用ConA和LPS作为诱导剂刺激脾细胞增殖过程中,发现与对照组相比,CTX 处理可以降低小鼠 T 淋巴细胞的增殖。经ASPS-NE处理后,淋巴细胞的增殖反应逐渐恢复到正常水平。ASPS-NE中剂量组脾细胞增殖效果最强,提示 ASPS-NE 通过抗原特异性促进脾细胞和淋巴细胞的增殖。这一结果与Li 等的研究结果相似,该研究小组发现淫羊藿多糖可以显著促进 CTX 诱导的免疫抑制鸡的淋巴细胞增殖,增强免疫应答[15]。此外有研究发现许多中药多糖能够逆转 CTX 诱导的免疫抑制,增强机体的抵抗力[16]。
外周血、肝脏、脾脏是NK细胞常常存在的部位。NK细胞可以清除病变细胞,延缓细胞的衰老,极大的提高机体免疫力。当机体感染病毒以后,NK细胞发生活化,产生细胞毒性作用。NK细胞可以识别靶细胞,活化吞噬细胞,杀伤介质,从而增强机体的免疫能力[17-18]。本试验发现ASPS-NE能够提高NK细胞的杀伤率,即能够增强NK细胞的免疫活性,而且ASPS-NE中剂量的效果比ASPS水溶液更佳。这同样表明ASPS-NE可通过提高NK细胞的杀伤率,增强NK细胞的免疫活性来发挥免疫增强的效果。

