蚯蚓源贝莱斯芽孢杆菌Y1鉴定及生物学特性研究
郭艺伟 , 刘依山 , 包永占 , 潘兴亮 , 王玉田 , 郑瑞峰
(1.河北农业大学动物医学院 , 河北 保定 071000 ; 2. 北京市畜牧总站 , 北京 朝阳 100107)
抗生素治疗动物疾病的高效性使其在养殖过程中占着举足轻重的地位。近年来,抗生素滥用[1]导致耐药菌株出现,破坏生态系统,影响畜禽产品品质,人类作为动物源性食品的终端消费者,身体健康受到损害,因此迫切需要寻找替抗物质。益生菌是近年来的研究热点之一,其主要通过提高饲料营养的利用率、免疫调节能力及调节肠道环境等为宿主动物机体健康发挥益生作用[2-3]。芽孢杆菌作为饲用益生菌[4],具有增殖快、抗逆性强、抗菌谱广、生物安全性高,在恶劣环境中产生孢子,能分泌丰富的酶类及产生抗菌活性很强的次级代谢产物等优势,有促生长、调节肠道微生态平衡、抗菌、提高抵抗力的作用。贝莱斯芽孢杆菌是2005年被西班牙学者发现的一种新型生防菌[5],目前被广泛用于生防[6]、化工、医疗、洗涤等领域[7-8],尤其在植物健康[9]与病虫害防控方面研究较广,但应用于畜禽的研究很少[10]。本试验通过对贝莱斯芽孢杆菌的益生特性研究,分析其成为潜在的益生菌应用于畜禽生产的可能性。
1 材料与方法
1.1 试验材料 指示菌:大肠埃希菌,ATCC25922-G2;金黄色葡萄球菌,ATCC6538-G2。蚯蚓,采自北京市奥林匹克公园;SPF级KM小鼠,购自斯贝福(北京)生物技术有限公司。
1.2 主要仪器 生化培养箱、恒温振荡器,均购自上海博讯实业有限公司医疗设备厂;酶标仪,购自赛默飞世尔(上海)仪器有限公司;PCR仪,购自上海坤科仪器设备有限公司;凝胶成像系统,购自普若森生物科技(上海)有限公司。
1.3 主要试剂 VETEC琼脂粉、药敏试纸片,均购自美国赛默飞世尔科技(中国)有限公司;胃蛋白酶、胰蛋白酶,均购自南京建成生物科技有限公司。
1.4 试验方法
1.4.1 菌株分离纯化及镜检 将蚯蚓置于75%酒精中做体表消毒,沿其体表剪开在LB培养基上涂布,培养12~24 h,将培养出的细菌纯化2~3代,将单菌落接入LB液体培养基培养12~18 h,将该分离菌命名为Y1,观察Y1菌的颜色、形态等。对培养12 h的Y1菌进行革兰染色并在光学显微镜下镜检,利用成像系统拍照;使用扫描电镜Hitachi SU8010进行菌体形态观察。
1.4.2 生理生化鉴定 根据《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》(9版)对Y1菌的种属进行初步鉴定。
1.4.3 分子生物学鉴定 对Y1菌进行16S rRNA基因序列测序,PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,结果在NCBI数据库中进行BLAST比对,利用MEGA 7.0软件构建其系统进化树。
1.4.4 绘制生长曲线 将Y1菌按1%的接种量接种于LB液体培养基,200 r/min培养30 h,每隔3 h取样并检测菌液OD600值,以时间t为横坐标、OD600值为纵坐标绘制Y1菌的生长曲线。
1.4.5 胃肠液耐受试验 人工胃液、人工肠液按照《中国药典》2015年版第四部[11]配制。取菌悬液分别加到人工胃液和人工肠液中,180 r/min培养10 h,每隔2 h取样进行平板菌落计数,计算存活率。存活率(%)=Nt/N0×100%,其中Nt为结束时的活菌数,N0为起始时的活菌数。
1.4.6 胆盐耐受试验 将菌悬液按1%接种量接种到含有0.3%牛胆盐的液体培养基中,以不含牛胆盐的试管作为对照管,培养10 h,每隔1 h取样,测定OD600值,绘制生长曲线。
1.4.7 药敏试验 将含有定量抗生素的药敏纸片(直径为6 mm),放在涂有菌液的培养基表面,培养24 h,观察并测量抑菌圈直径。
1.4.8 体外抑菌试验 试验方法参照牛津杯法[12],37 ℃培养12 h,观察并测量抑菌圈直径。
1.5 动物安全性试验 对照组与试验组各5只小鼠,试验组小鼠饲喂新鲜菌液,对照组常规饲养,观察记录小鼠的精神、行动、体重、食欲、排泄等变化。
2 结果
2.1 菌株分离纯化及镜检 如图1所示,Y1菌在TSA培养基上的菌落呈黄色,圆形,表面湿润,不透明,边缘整齐,在液体培养基形成薄菌膜;镜检菌体为短杆状,可产生芽孢。
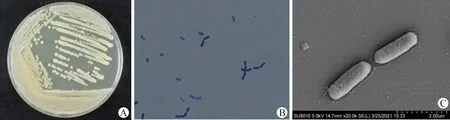
图1 Y1菌的菌落形态、革兰染色镜检和扫描电镜结果
2.2 生理生化鉴定 结果见表1,Y1菌能够利用葡萄糖、甘露醇、D-棉子糖、果糖、麦芽糖、古老糖、D-海藻糖、D-核糖;能水解淀粉和七叶苷,产生明胶酶和过氧化氢酶,能在6.5%的氯化钠中生长;不能产生硫化氢,不能利用L-鼠李糖、D-松三糖和D-半乳糖。

表1 Y1菌生理生化鉴定结果
2.3 分子生物学鉴定 Y1菌的16S rRNA基因序列目的条带电泳结果如图2所示,基因片段约为1 500 bp。 将Y1菌16S rRNA序列在NCBI数据库进行比对发现,Y1菌与多个芽孢杆菌基因序列匹配度较高(图3)。将Y1菌GyrB基因序列进行比对,又与其近种序列进行相似性比较后发现,其与贝莱斯芽孢杆菌(Bacillusvelezensis)的同源性最高,相似率达99.93%(图4)。
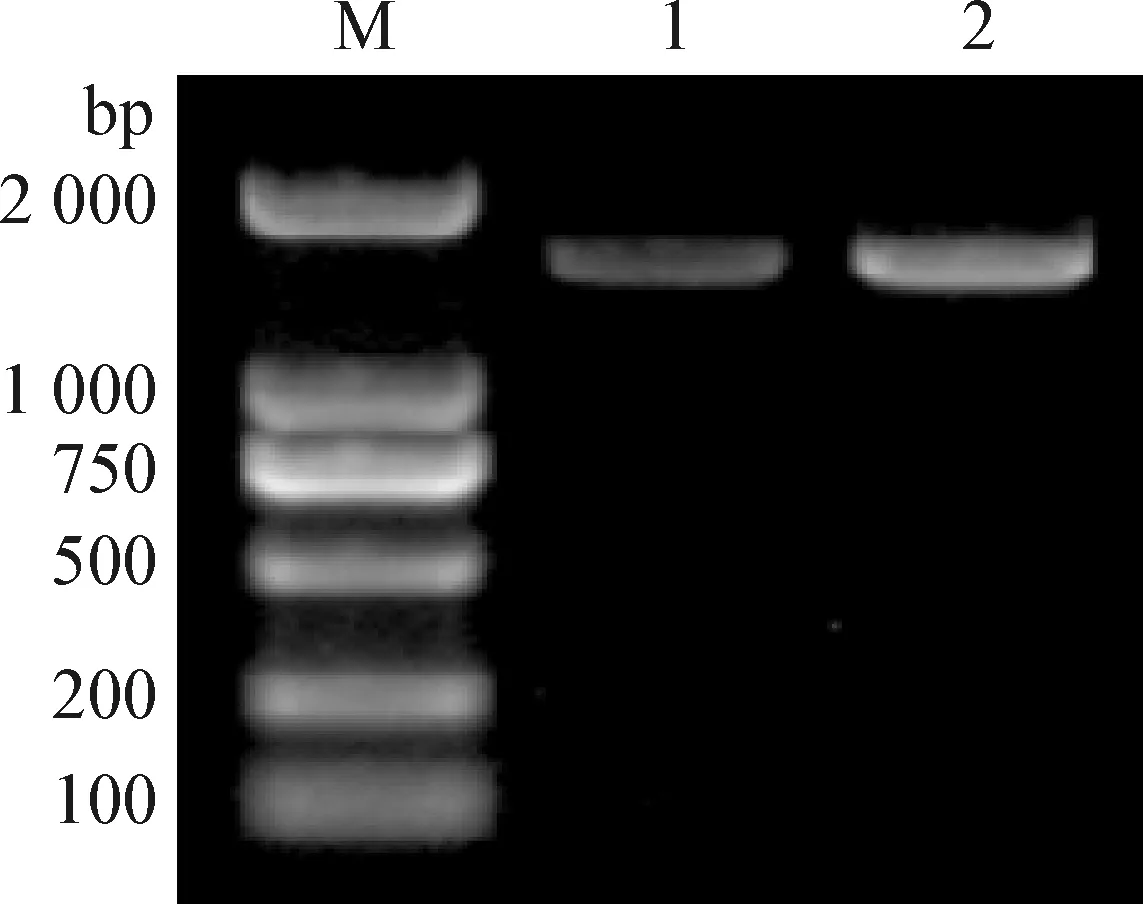
图2 Y1菌16S rRNA基因的PCR扩增

图3 Y1菌16S rRNA序列系统发育树

图4 Y1菌GyrB基因序列系统发育树
2.4 生长曲线分析 对Y1菌生长进行检测,如图5所示,Y1菌迟缓期很短,6~12 h为对数期,15~27 h处于稳定期且时间较长,27 h后进入衰退期。
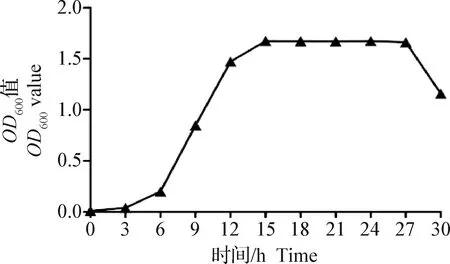
图5 Y1菌生长曲线
2.5 耐胃肠液分析 结果如表2所示,Y1菌在人工胃肠液中活菌数随孵育时间延长呈逐渐递减趋势,孵育10 h的活菌数显著降低(P<0.05),Y1菌在人工胃液、肠液中培养10 h存活率分别达到60.40% 和61.60%,说明Y1菌对人工胃液和人工肠液有较好的耐受性,能够抵御胃蛋白酶和胰蛋白酶的破坏。
表2 Y1菌耐人工胃、肠液结果
2.6 耐胆盐分析 Y1菌在含有0.3%胆盐的培养基中生长呈递增趋势(图6),随着孵育时间延长活菌数显著增高(P<0.05)(表3),表明Y1菌对0.3%胆盐有较好的耐受性,而动物小肠中胆汁盐含量波动范围在0.03%~0.3%,说明Y1菌可以在肠道中存活。
表3 Y1菌耐胆盐结果

图6 Y1菌耐胆盐结果
2.7 药敏试验分析 由表4可知,Y1菌对环丙沙星、头孢羟氨苄、氟苯尼考、替米考星和庆大霉素高度敏感,尤其是头孢羟氨苄,其抑菌直径可达到40 mm;对氨苄西林、羟氨苄青霉素和青霉素G耐药,说明Y1菌对大多数β-内酰胺类药物都有抗性。
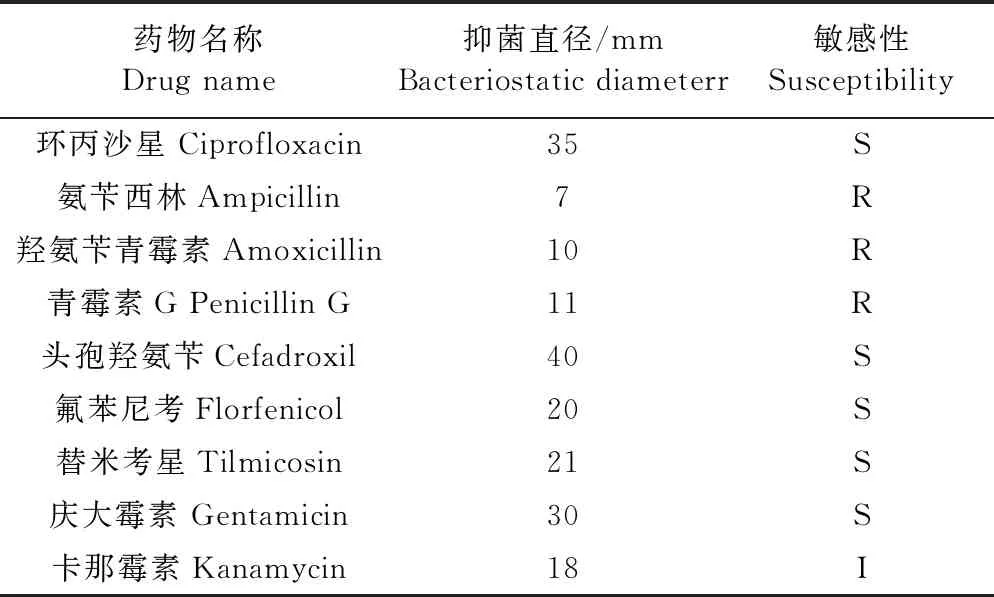
表4 Y1菌药敏试验结果
2.8 抑菌特性分析 Y1菌对大肠埃希菌和金黄色葡萄球菌都有显著抑制效果(图7)。对大肠埃希菌的抑菌圈直径达到(21.33±1.53)mm(P<0.05),对金黄色葡萄球菌可达(15.67±1.53)mm(P<0.05),如表5所示。

图7 Y1菌对大肠埃希菌(A)和金黄色葡萄球菌(B)抑菌结果

表5 抑菌试验结果
2.9 动物安全性试验 试验组小鼠均未出现死亡或患病情况,精神状态和行为活动均正常,被毛良好不粗糙,采食、饮水、排泄均正常,证明分离菌株安全。
3 讨论
本试验从蚯蚓体内筛选细菌时发现1株生长快、菌落大且周围不长霉菌的芽孢杆菌,经16S rRNA基因序列鉴定及生理生化试验确定该菌为贝莱斯芽孢杆菌。动物胃肠道菌群随着胃肠液的pH变化而变化,同时胃肠液内又含有胃蛋白酶、胰蛋白酶、胆盐等物质,贝莱斯芽孢杆菌Y1若在胃肠道增殖,就要耐受胃肠道环境,保证有足够的活菌数发挥作用。本试验结果显示,Y1菌6~12 h增殖较快,12~27 h生长稳定,且对胃肠液和胆盐的耐受效果较好,能抵御消化道胃蛋白酶、胰蛋白酶和胆汁的破坏,保证了Y1菌在肠道内能够迅速增殖,为其在畜禽肠道发挥作用提供时间基础。相比刘韶娜等[13]研究的贝莱斯芽孢杆菌B13在16~24 h处于稳定期,Y1菌的稳定期更长;高艳侠等[14]研究表明贝莱斯芽孢杆菌LF01在不同盐度下均于14~16 h达到稳定期,Y1菌的稳定期比其更长;表明Y1菌在肠道内有足够的时间增殖并产生酶类及次级代谢产物,从而发挥调节肠道微生态环境的作用。
在畜禽养殖过程中,抗生素滥用造成了耐药菌株的产生,益生菌是一种优质饲料添加剂,益生菌与抗生素若要联合使用必须考虑两者有无拮抗作用。本试验结果显示,贝莱斯芽孢杆菌Y1对环丙沙星、头孢羟氨苄、氟苯尼考、替米考星和庆大霉素高度敏感,在饲喂畜禽益生菌添加剂时应避免使用此类敏感药物;对羟氨苄青霉素、青霉素G、氨苄西林不敏感,两者可以配合使用。张小波等[15]分离的鸭源贝莱斯芽孢杆菌GZZY2019同样对青霉素和氨苄西林耐药。贝莱斯芽孢杆菌Y1是否携带对β-内酰胺类抗生素的耐受基因还有待研究。
本试验结果显示,Y1菌能抑制大肠埃希菌、金黄色葡萄球菌的生长繁殖。刘韶娜等[13]研究表明,贝莱斯芽孢杆菌B13不仅能抑制这2种细菌,还对鼠伤寒沙门菌有抑制效果,且能提高猪肠道内乳杆菌属等益生菌的相对丰度,显著降低链球菌属等条件致病菌的相对丰度[16],相比之下Y1菌对大肠埃希菌和金黄色葡萄球菌的抑菌效果要优于B13菌。Nannan等[17]从鸡粪中分离的贝莱斯芽孢杆菌CN026对大肠埃希菌、肠炎沙门菌、空肠弯曲杆菌和李斯特菌均有抑制作用。研究表明,贝莱斯芽孢杆菌发挥抑菌作用的物质主要为脂肽类抗生素、抗菌肽、聚酮类化合物[18],Y1菌的抑菌活性物质还有待发掘。本试验为贝莱斯芽孢杆菌Y1应用于畜禽生产提供理论支持,其有望成为一种潜在的益生菌添加剂。

