二苯乙烯苷对成骨细胞抗氧化损伤的保护机制
范迎赛 , 宫新城 , 杨 倩 , 张 迪 , 赵兴华 , 王晓丹 , 史万玉
(河北农业大学中兽医学院 , 河北 保定 071000)
骨流失类疾病是畜禽常见病,可导致动物生产性能下降、骨骼变形、瘫痪甚至死亡,严重危害动物健康及养殖业发展。研究表明,氧化应激是骨流失类疾病发生的重要病理基础,活性氧对骨功能性细胞(成骨细胞和破骨细胞等)中蛋白质、脂质和核酸等大分子物质具有直接或间接的影响[1]。
正常情况下,机体骨量处于动态平衡中,由成骨细胞骨形成和破骨细胞骨吸收2个过程进行维持,受多条细胞信号转导通路的影响[2]。其中,Wnt/β-连环蛋白(β-catenin)和核因子κB受体活化因子配体(RANKL)/核因子κB受体活化因子(RANK)分别是调节成骨细胞和破骨细胞的关键通路[3]。氧化应激条件下,成骨细胞Wnt/β-catenin通路受到抑制,使成骨细胞生存活性、分化活性和成骨活性均随之下降 ; 此外,氧化应激还会降低成骨细胞表达RANKL/骨保护素(OPG)的比值,间接促进破骨细胞的骨吸收活动[4-5]。
中兽医理论认为“肾主骨”,临床中可通过补肾而抑制机体骨流失。中药制何首乌具有补肝肾、强筋骨的功效,其主要活性成分为2,3,5,4′-四羟基二苯乙烯-2-O-β-D-葡萄糖苷,常简称为二苯乙烯苷(THSG)[6]。有研究报道,THSG在体内外试验中均表现出促成骨活性,且具有较好的抗氧化能力,能够有效减少过氧化氢(H2O2)导致的成骨细胞内活性氧和丙二醛等的生成[7-8]。但是,其在氧化应激条件下促进成骨的作用机制尚待深入探索。本试验使用H2O2和THSG共同作用成骨样细胞MC3T3-E1,通过检测成骨细胞生存活力、对破骨细胞的调控功能及Wnt/β-catenin通路活化水平等,探索THSG对成骨细胞抗氧化损伤的保护作用机制,为其药理研究及临床开发应用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 药物及主要试剂 THSG标准品,购自国家食品药品检定研究院;α-MEM培养基和胰蛋白酶,均购自美国Hyclone公司;胎牛血清(FBS),购自以色列BI公司;细胞总RNA提取试剂盒,购自北京艾德莱生物科技有限公司;反转录试剂盒和qPCR试剂,均购自北京全式金公司;噻唑蓝(MTT)、二甲基亚砜(DMSO)、RIPA裂解液、BCA蛋白浓度测定试剂盒和ECL发光试剂盒,均购自上海碧云天生物技术有限公司;兔源OPG抗体,购自美国Abcam公司;兔源GAPDH抗体、兔源β-tubulin抗体和HRP 标记山羊抗兔二抗,均购自武汉Abclonal公司。引物由生工生物工程(上海)股份有限公司合成。
1.1.2 细胞株 小鼠成骨样MC3T3-E1细胞,购自中国医学科学院基础医学研究所细胞资源中心。
1.2 试验方法
1.2.1 试验分组及处理 MC3T3-E1细胞铺板24 h后,细胞密度为80%~90%时,进行试验分组及加药处理:(1)对照组(使用细胞培养基培养);(2)H2O2组(细胞培养基培养1 h,使用含0.3 mmol/L H2O2的细胞培养基培养);(3)不同浓度THSG保护组(10-3~10-5mg/mL THSG预处理1 h,使用含0.3 mmol/L H2O2及不同浓度THSG的细胞培养基培养)。
1.2.2 细胞生存活性检测 MC3T3-E1细胞培养于96孔板中,THSG和0.3 mmol/L H2O2共同培养细胞3 d后,吸弃培养上清,各孔加入100 μL含1 mg/mL MTT的α-MEM培养基,37 ℃避光培养4 h。然后吸弃上清,各孔加入100 μL DMSO,避光轻柔振荡15 min,于酶标仪570 nm处检测OD值。以对照组为100%,计算各组细胞相对生存活性。
1.2.3 mRNA水平检测 MC3T3-E1细胞培养于6孔板中,THSG和0.3 mmol/L H2O2共同培养细胞3 d后,按照说明书提取各孔细胞总RNA,并将其反转录为cDNA。使用ABI StepOnePlus仪器检测mRNA水平,反应体系:2 × qPCR Mix 5 μL,Rox 0.2 μL,上游引物0.2 μL,下游引物0.2 μL,cDNA 0.3 μL,灭菌双蒸水4.1 μL,总反应体积10 μL。反应程序:95 ℃预变性1 min;95 ℃ 5 s,60 ℃ 15 s,72 ℃ 10 s,共45个循环。以GAPDH为内参,计算各组中目的基因的mRNA表达水平。目的基因引物序列见表1。

表1 引物序列
1.2.4 蛋白水平检测 MC3T3-E1细胞培养于φ100 mm培养皿中,使用THSG和0.3 mmol/L H2O2共培养细胞1 d后,使用RIPA裂解液提取各组细胞总蛋白,使用BCA蛋白浓度测定试剂盒检测蛋白浓度,调整浓度一致后加入适量5×Loading buffer并煮沸。将蛋白进行SDS-PAGE电泳及转膜,室温振荡封闭2 h后,加入相应一抗,在4 ℃冰箱内孵育过夜后洗膜。然后使用二抗室温孵育1 h,洗膜,使用ECL法对蛋白条带进行显色,使用Tanon 5200仪器采集图像,Image J软件分析灰度值。以GAPDH为内参,计算蛋白的表达水平。
1.2.5 统计学处理 使用IBM SPSS Statistics 21软件分析数据,在满足方差齐和正态分布的前提下,进行单因素方差分析和Turkey多重比较,结果以平均数±标准差表示,P< 0.05表示组间差异显著。
2 结果
2.1 THSG对H2O2作用下MC3T3-E1细胞生存活力的影响 结果如图1所示,与对照组相比,H2O2组细胞生存活力显著降低(P<0.05);与H2O2组相比,10-3~10-5mg/mL THSG保护组细胞生存活力显著升高(P<0.05)。
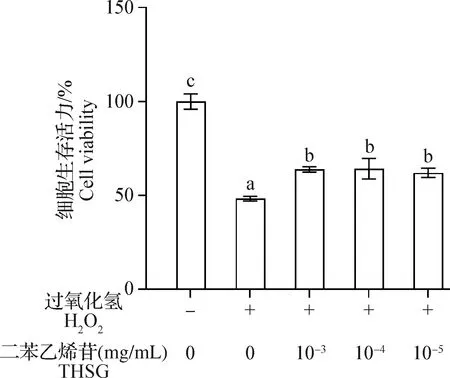
图1 THSG和H2O2对MC3T3-E1细胞生存活力的影响(n=4)
2.2 THSG对H2O2作用下MC3T3-E1细胞BadmRNA表达水平的影响 结果如图2所示,与对照组相比,H2O2组细胞BadmRNA表达水平显著升高(P<0.05);与H2O2组相比,10-4mg/mL THSG保护组细胞BadmRNA表达水平显著降低(P<0.05),10-3mg/mL THSG保护组BadmRNA表达水平无显著变化(P>0.05)。
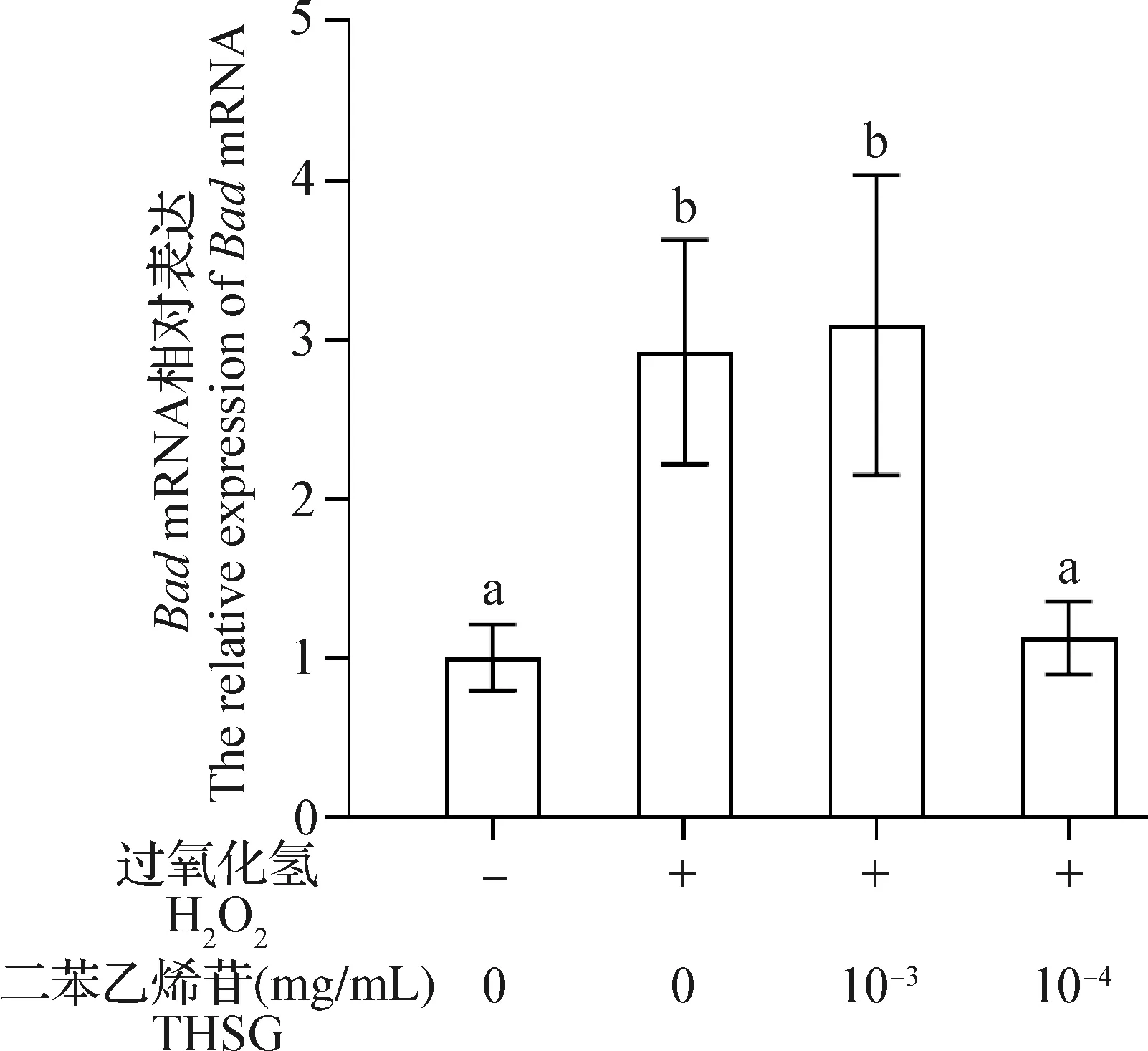
图2 THSG和H2O2对MC3T3-E1细胞Bad mRNA表达水平的影响(n=3)
2.3 THSG对H2O2作用下MC3T3-E1细胞OPG和RANKL表达水平的影响OPGmRNA表达水平结果如图3A所示,与对照组相比,H2O2组细胞OPGmRNA表达水平显著降低(P<0.05);与H2O2组相比,10-4mg/mL THSG保护组细胞OPGmRNA表达水平显著升高(P<0.05),10-3mg/mL THSG保护组细胞OPGmRNA表达水平无显著变化(P>0.05)。OPG蛋白表达水平结果如图3B所示,与对照组相比,H2O2组细胞OPG蛋白表达水平显著降低(P<0.05);与H2O2组相比,10-3mg/mL和10-4mg/mL THSG保护组细胞OPG蛋白表达水平显著升高(P<0.05)。
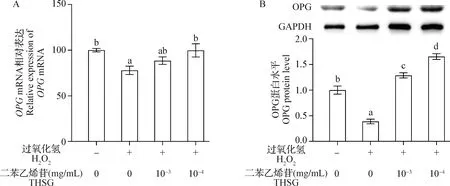
图3 THSG和H2O2对MC3T3-E1细胞OPG mRNA(A)和蛋白(B)表达水平的影响(n=3)
RANKLmRNA表达水平结果如图4A所示,与对照组相比,H2O2组细胞RANKLmRNA表达水平显著升高(P<0.05);与H2O2组相比,10-3mg/mL和10-4mg/mL THSG保护组细胞RANKLmRNA表达水平显著降低(P<0.05)。OPG/RANKLmRNA比值结果如图4B所示,与对照组相比,H2O2组细胞OPG/RANKLmRNA比显著降低(P<0.05);与H2O2组相比,10-3mg/mL和10-4mg/mL THSG保护组细胞OPG/RANKLmRNA比显著升高(P<0.05)。
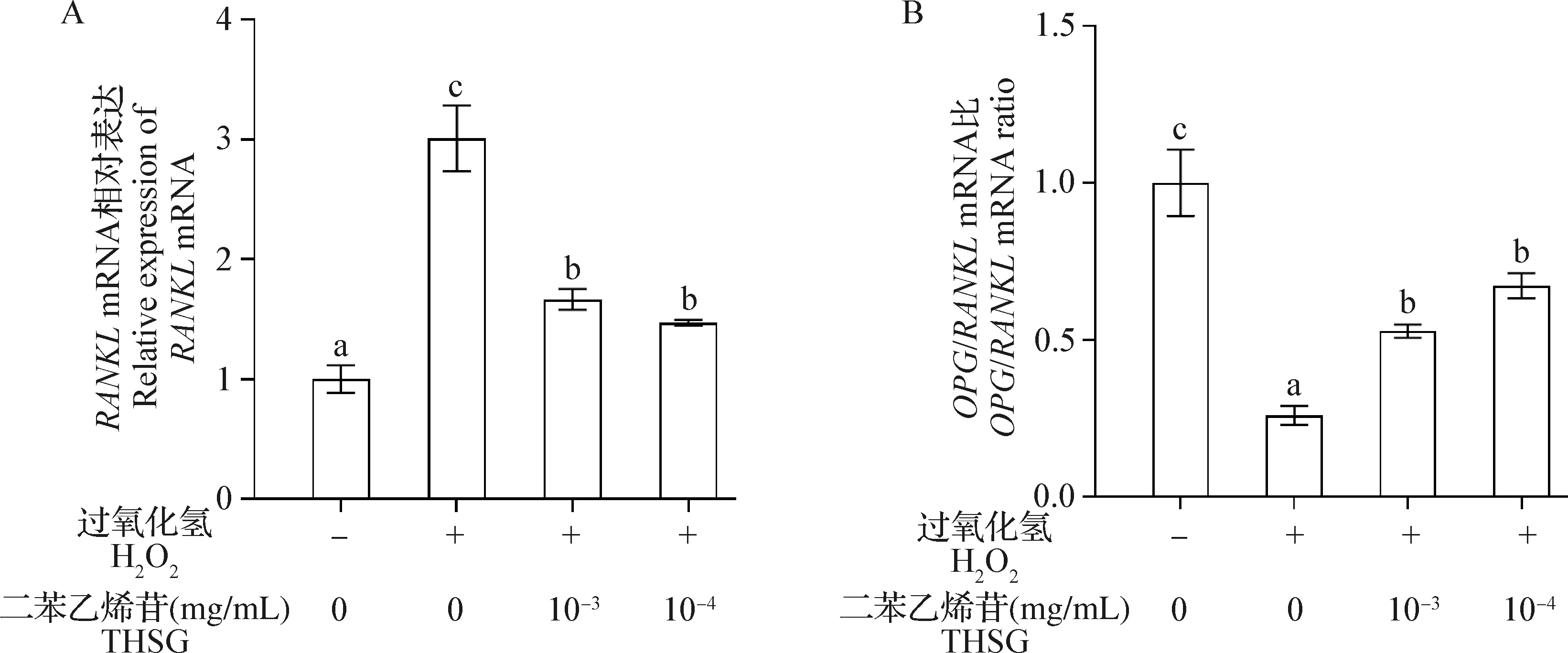
图4 THSG和H2O2对MC3T3-E1细胞RANKL mRNA表达水平(A)和OPG/RANKL mRNA比(B)的影响(n=3)
2.4 THSG对H2O2作用下MC3T3-E1细胞β-catenin表达水平的影响β-cateninmRNA表达水平结果如图5A所示,与对照组相比,H2O2组细胞β-cateninmRNA表达水平显著降低(P<0.05);与H2O2组相比,10-3mg/mL和10-4mg/mL THSG保护组细胞β-cateninmRNA表达水平显著升高(P<0.05)。β-catenin蛋白表达水平结果如图5B所示,与对照组相比,H2O2组细胞β-catenin蛋白表达水平显著降低(P<0.05);与H2O2组相比,10-3mg/mL和10-4mg/mL THSG保护组细胞β-catenin蛋白表达水平显著升高(P<0.05)。
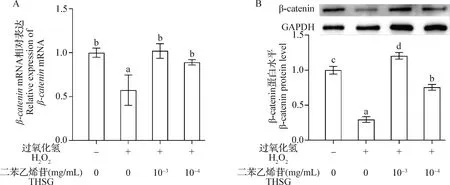
图5 THSG和H2O2对MC3T3-E1细胞β-catenin mRNA(A)和蛋白(B)表达水平的影响(n=3)
3 讨论
THSG具有促成骨、抗炎、抗氧化、抗衰老、调节脂质代谢、抗肿瘤、改善学习和记忆能力等多种功效[9],具有开发成为兽药及饲料添加剂的潜力。已有研究报道THSG可通过抗氧化作用保护成骨细胞生存及功能活性[8-10]。本试验主要通过检测成骨细胞OPG/RANKLmRNA表达比和Wnt/β-catenin通路活化水平等,对THSG保护成骨细胞抗氧化损伤的作用机制进行探索。
氧化损伤可通过抑制细胞增殖和诱导细胞凋亡等途径降低细胞生存活性。根据本试验细胞活性检测结果,10-3~10-5mg/mL THSG均能保护H2O2作用下成骨细胞的生存活力,本试验选取10-3mg/mL和10-4mg/mL浓度THSG进行后续试验。在内源性凋亡途径中,Bax和Bad是重要的促凋亡蛋白,Bcl-2是最具代表性的抑凋亡蛋白。其中,Bax通过增加线粒体膜通透性,释放细胞色素C进入胞质诱发级联反应,促进细胞凋亡;Bcl-2可与Bax形成异源二聚体,抑制Bax介导的细胞凋亡;而Bad能够结合Bcl-2,释放Bax/Bcl-2异源二聚体中的Bax,间接促进细胞凋亡[11]。本试验对BadmRNA表达水平的检测结果显示,10-4mg/mL THSG能够显著抑制H2O2对BadmRNA表达水平的上调作用,说明适宜浓度的THSG可抑制氧化应激诱导的Bad转录。张金康等[10]研究证明,THSG可抑制氧化应激导致的细胞凋亡,降低H2O2作用下成骨细胞Bax mRNA和蛋白表达水平,提高Bcl-2 mRNA和蛋白表达水平。结合本试验结果可以发现,在氧化应激条件下,THSG可能通过下调Bad和Bax基因表达水平,上调Bcl-2基因表达水平,从而抑制成骨细胞凋亡,增加细胞生存活性。
成骨细胞不仅能够形成骨,还通过表达OPG和RANKL等蛋白对破骨细胞进行调控。其中,RANKL与破骨细胞前体表面的RANK结合后,能够使破骨细胞前体融合为成熟的多核破骨细胞,发挥骨吸收活性;OPG能够竞争性结合RANKL,抑制RANKL与RANK结合,进而抑制破骨细胞分化形成及骨吸收活性[12]。有研究报道氧化应激能够导致RANKL表达量升高和OPG表达量下降[5],与本试验结果中H2O2对成骨细胞OPG/RANKLmRNA比的下调作用相符。此外,本试验发现10-3mg/mL和10-4mg/mL浓度THSG可以抑制H2O2对OPG/RANKLmRNA比的调控作用。结合本试验前期研究中THSG能上调成骨细胞生存活力和OPG/RANKL比的结果[13],说明THSG对于正常状态和氧化条件下成骨细胞OPG/RANKL比均具有正向调控功能,从而可能间接抑制破骨细胞的骨吸收活动。
Wnt/β-catenin通路是成骨细胞重要的信号转导通路,能够调节成骨细胞生存、功能活性及抗氧化能力等[3]。Wnt通路激活后,轴蛋白复合体与自身受体复合物结合,抑制糖原合酶激酶 3的活性,进而抑制β-catenin降解,促进β-catenin在胞质内积累并转位入核,调控通路下游靶基因的表达[14]。因此,β-catenin蛋白水平是Wnt/β-catenin通路活化状态的重要标志。本试验结果表明H2O2能够下调成骨细胞β-catenin水平,而THSG可以上调成骨细胞β-catenin水平,说明THSG能够拮抗氧化损伤对细胞Wnt/β-catenin通路的抑制作用。有研究证明THSG能够激活骨质疏松模型小鼠Wnt/β-catenin通路[15],与本试验中THSG对成骨细胞Wnt/β-catenin通路的激活作用相互印证。成骨细胞中β-catenin可正向调控细胞生存活力和OPG/RANKL比[16],结合本试验结果,推测THSG通过Wnt/β-catenin通路保护成骨细胞的生存活力及其对破骨细胞的抑制作用,抵抗H2O2导致的氧化损伤。
综上,THSG能够保护成骨细胞抗氧化损伤,作用机制与上调成骨细胞生存活力、OPG/RANKL比及Wnt/β-catenin通路活化水平等相关。

