牛坏死杆菌对EPH4细胞的增殖抑制和诱导凋亡作用
汪锋锋 , 蒋 凯 , 赵鹏宇 , 王天硕 , 于思雯 , 郭东华
(黑龙江八一农垦大学动物科技学院 , 黑龙江 大庆 163319)
坏死杆菌(Fusobacteriumnecrophorum,Fn)隶属于拟杆菌科(Fusobacteriaceae),梭杆菌属(Fusobacterium),是严格厌氧、无鞭毛、无芽孢和荚膜、多形性的革兰阴性菌[1]。坏死杆菌存在于多种动物和人的口腔、胃肠道以及泌尿生殖道[2],其中以牛、羊、马、猪最易感,禽类易感性较小,在实验动物中,小鼠最易感[3]。坏死杆菌对人的危害常表现为以咽炎、侧颈痛和发热为临床特征的莱米尔综合征(Lemierre′s syndrome,LS)[4];对反刍动物而言,最常见的是腐蹄病(Foot rot),该病在北美洲、南美洲、澳大利亚、新西兰和欧洲均有报道[5-6]。国外奶牛腐蹄病的发病率为4%~55%,我国因腐蹄病而淘汰的奶牛占总淘汰奶牛的15%~30%[7]。因坏死杆菌引发的肝脓肿(Liver abscesses)在不同年龄段的牛只中均有发生,临床可导致动物采食减少、体重减轻、生产性能降低等[8]。此外,坏死杆菌还可引起奶牛子宫内膜炎[9]和乳腺炎[10],尤其在奶牛产后的短时间内细菌的丰富度降低,而包含坏死杆菌在内的多种致病菌呈现急速增殖,引起乳腺炎。奶牛乳腺炎的发生不仅会引起奶牛自身的健康问题,也会影响奶业的发展,通过超基因组焦磷酸测序技术研究乳汁中细菌DNA的多样性,发现坏死杆菌也参与其中[11]。用细菌培养法对子宫积脓时子宫内存在的细菌进行研究,结果表明坏死杆菌和化脓隐秘杆菌是引起子宫积脓的主要病原[12]。
坏死杆菌具有多种毒力因子[13-14],其分泌的白细胞毒素(Leukotoxin,lkt)是重要的毒力因子之一,可以损伤反刍动物的中性粒细胞、肝细胞、瘤胃上皮细胞,以及其他的宿主靶细胞,并且能介导机体产生抵抗坏死杆菌感染的特异性免疫反应[15]。研究表明,坏死杆菌的43K OMP对牛乳腺上皮细胞以及仓鼠肾细胞具有黏附作用[16-17];Narayanan等[18]和郭东华[19]均证实坏死杆菌的主要毒力因子白细胞毒素能够介导中性粒细胞凋亡;汪孙杰[20]验证真核表达的重组白细胞毒素可以诱导小鼠肝上皮细胞的凋亡。但是关于坏死杆菌感染宿主细胞诱导细胞凋亡后的具体变化尚不清楚。
本研究以牛坏死杆菌A25菌株为研究对象,探究其是否参与宿主细胞的增殖和凋亡过程。将坏死杆菌感染小鼠乳腺上皮细胞系(EPH4细胞),分别通过细胞增殖和凋亡两方面试验,探究牛坏死杆菌对宿主细胞增殖和凋亡的影响,旨在为进一步开展坏死杆菌在细胞生长周期以及凋亡机制相关研究和其致病机制研究提供一定的参考依据。
1 材料与方法
1.1 主要试剂 胎牛血清,购自Clark bioscience公司;青链霉素混合液(100×)双抗、麦氏比浊管试剂盒,均购自北京索莱宝科技有限公司;细胞凋亡-Hoechst染色试剂盒、Beyo ClickTMEdU-488细胞增殖检测试剂盒、细胞凋亡-DNA Ladder抽提试剂盒(离心柱式),均购自碧云天生物技术有限公司;DL-2 000 Marker、10×Loading Buffer、SYBRPremixExTaqTMⅡ试剂盒,均购自宝生物工程(大连)有限公司。
1.2 主要仪器 荧光显微镜,德国徕卡公司产品;实时荧光定量PCR仪,美国伯乐公司产品;恒温细胞培养箱,美国赛默飞科技公司产品;厌氧培养箱,上海龙跃公司产品;紫外分析仪,北京君意有限公司产品。
1.3 菌株、细胞、培养基 牛坏死杆菌标准菌株(A25菌株)Fusobacteriumnecrophorumsubsp.necrophorum(Fnn),购自美国菌种保藏中心(ATCC 25286,美国);A25菌株和EPH4细胞,均由黑龙江八一农垦大学兽医分子病理学实验室保存。脑心浸液琼脂(BHI)、厌氧培养液,均购自Hopebiol公司(青岛海博);DMEM高糖培养基,购自Sigma公司。
1.4 方法
1.4.1 细胞培养及试验分组 EPH4细胞培养在10%胎牛血清、100 U/L青霉素、0.1 mg/mL链霉素的高糖DMEM完全培养液,于37 ℃、5% CO2恒温细胞培养箱中培养,2~3 d消化传代1次,取对数生长期细胞用于试验。试验分为对照组和试验组,对照组为未进行任何处理的EPH4细胞,试验组为坏死杆菌处理的EPH4细胞。
1.4.2 坏死杆菌培养及计数 从-80 ℃取出1管坏死杆菌标准菌株A25(甘油与细菌1∶9冻存),接种于5 mL厌氧培养基中,连续传代培养3次,培养于温度为37 ℃,气体坏境为85% N2、10% H2、5% CO2的厌氧箱中,复壮后的细菌按照1∶20的比例接种于BHI培养基中培养至对数生长期进行试验。根据麦氏比浊管试剂盒说明书,使用紫外分析仪测定培养细菌的OD600值,与已知OD600值相比较,计算细菌浓度,见表1。
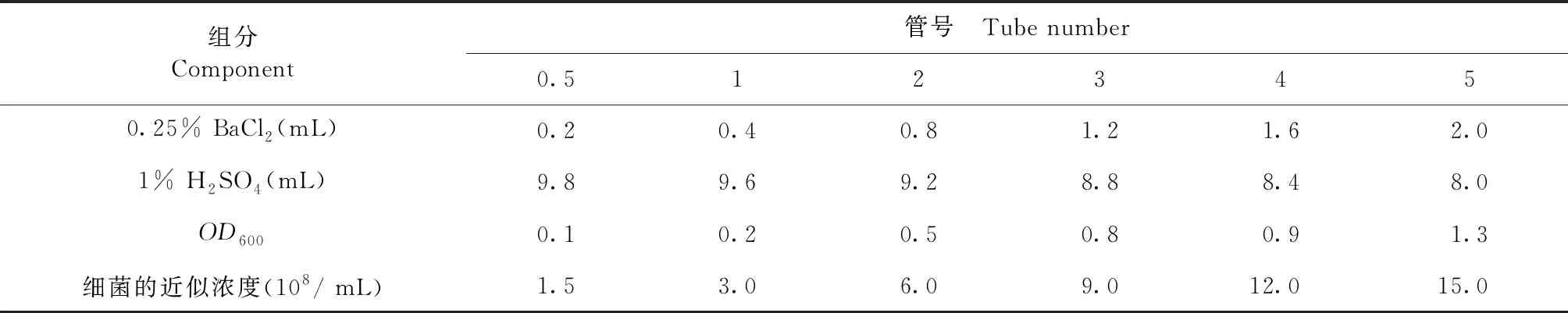
表1 麦氏比浊法
1.4.3 EdU标记法检测细胞增殖 用细胞培养液1∶500倍稀释EdU,使其工作浓度为10 μmol/L,加入到处理后的细胞中,孵育2 h,使用4%多聚甲醛固定细胞,洗涤液洗涤3次,每次5 min,再加入0.3%的Triton X-100孵育15 min,洗涤液洗涤3次,每次5 min,加入反应液避光孵育30 min,洗涤液洗涤3次,每次5 min,加入含DAPI的封片液,随后通过荧光显微镜观察并记录。
1.4.4 Hoechst染色检测细胞凋亡 将处于对数生长期的EPH4细胞用DMEM完全培养基调整至浓度为1×105个/mL的细胞悬液,加入到6孔板中,以感染复数(MOI)为100感染坏死杆菌2、4 h和6 h,感染结束后弃去培养基,加入固定液,10 min后弃去固定液,PBS洗3次,每次3 min,加入Hoechst 33258染色液,染色5 min,弃去染色液,PBS洗3次,每次3 min,滴加抗荧光淬灭封片液,荧光显微镜观察并记录。
1.4.5 DNA Ladder试验 将处于对数生长期的EPH4细胞用DMEM完全培养基调整至浓度为1×105个/mL 的细胞悬液,加入到6孔板中,以MOI为100感染坏死杆菌2、4 h和6 h,按照细胞凋亡-DNA Ladder抽提试剂盒说明书提取DNA,进行2%琼脂糖凝胶电泳分析。
1.4.6 实时荧光定量聚合酶链式反应(RT-qPCR)检测凋亡基因 收集感染后的EPH4细胞,TRIzol法提取样品中的总RNA,分光光度计测定RNA浓度,逆转录合成cDNA。按照SYBRPremixExTaqTMⅡ试剂盒说明书进行RT-qPCR。反应条件:95 ℃ 30 s,95 ℃ 5 s, 60 ℃ 30 s,40个循环;反应体系:TB GreenPremix12.5 μL,上游引物 0.5 μL,下游引物 0.5 μL,cDNA 1 μL, ddH2O 10.5 μL。引物序列见表2,引物由擎科生物有限公司合成,以GAPDH为内参,采用2-△△Ct法计算各基因的mRNA相对表达量。
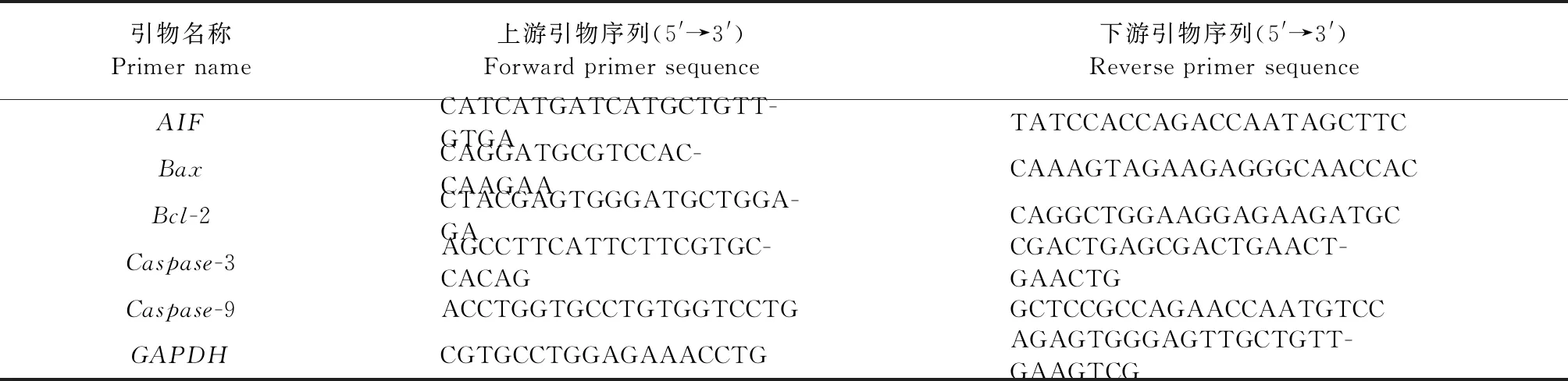
表2 凋亡基因引物序列
2 结果
2.1 坏死杆菌对EPH4细胞增殖的影响 为了研究坏死杆菌对EPH4细胞增殖的影响,采用EdU增殖检测法检测细胞在感染时间为2、4 h和6 h,MOI为0、50、100、200、500、1 000时的细胞增殖率。EdU试验结果如封二彩版图1A所示,随着感染时间与感染浓度的增加,细胞增殖逐渐减弱,对总细胞数(见封二彩版图1B)与EdU的阳性细胞增殖率(见封二彩版图1C)统计分析,结果显示,与对照组相比,试验组在相同感染时间下,坏死杆菌可显著抑制EPH4细胞增殖(P<0.05)。
2.2 坏死杆菌诱导EPH4细胞凋亡 为了研究坏死杆菌对EPH4细胞凋亡的影响,坏死杆菌按照MOI为100感染EPH4细胞2、4 h和6 h,通过Hoechst 33258染色观察细胞形态,通过琼脂糖凝胶电泳分析DNA片段化。Hoechst 33258染色后,活细胞为正常蓝色的圆形或椭圆形,而凋亡细胞因染色质固缩,其细胞核呈致密浓染,颜色为亮蓝色。与对照组相比,随着感染时间的增加,试验组EPH4细胞呈现不同程度的亮蓝色荧光,且呈现时间依赖性(图2A)。坏死杆菌感染后提取EPH4细胞的DNA进行琼脂糖凝胶电泳,与对照组相比,坏死杆菌感染细胞2、4 h和6 h后,分别出现不同程度的DNA“梯状”条带(图2B),表明坏死杆菌可诱导EPH4细胞凋亡。

图2 坏死杆菌对EPH4细胞凋亡的影响
2.3 RT-qPCR检测坏死杆菌感染EPH4细胞后凋亡基因mRNA的相对表达量 将EPH4细胞接种于6孔板中,坏死杆菌按照MOI为100感染EPH4细胞,分别在感染2、4 h和6 h后收集细胞。提取细胞总RNA,逆转录后RT-qPCR检测凋亡基因的mRNA相对表达量。结果显示,与对照组相比,坏死杆菌感染2 h和4 h时,促凋亡基因Bax的mRNA相对表达量显著上调(P<0.001),抑凋亡基因Bcl-2的mRNA的相对表达量无显著性差异(P>0.05),Bax与Bcl-2基因的mRNA相对表达量的比值也显著性上调(P<0.05);而坏死杆菌感染6 h时,促凋亡基因Bax的mRNA相对表达量显著下调(P<0.001),抑凋亡基因Bcl-2的mRNA相对表达量显著上调(P<0.001),Bax与Bcl-2基因的mRNA相对表达量的比值显著性下调(P<0.001)(图3A~3C)。与对照组相比,坏死杆菌感染细胞2 h和4 h时后,促凋亡基因AIF的mRNA相对表达量显著下调(P<0.001),在感染6 h时,其mRNA相对表达量显著上调(P<0.001)。与对照组相比,坏死杆菌感染细胞2 h时,Caspase-3和Caspase-9的mRNA相对表达量显著下调(P<0.05),而感染4 h和6 h时,其mRNA相对表达量显著上调(P<0.001)(图3D~3F)。结果表明坏死杆菌感染细胞后,可引发细胞凋亡,该结果与Hoechst 33258染色和DNA Ladder试验结果一致。
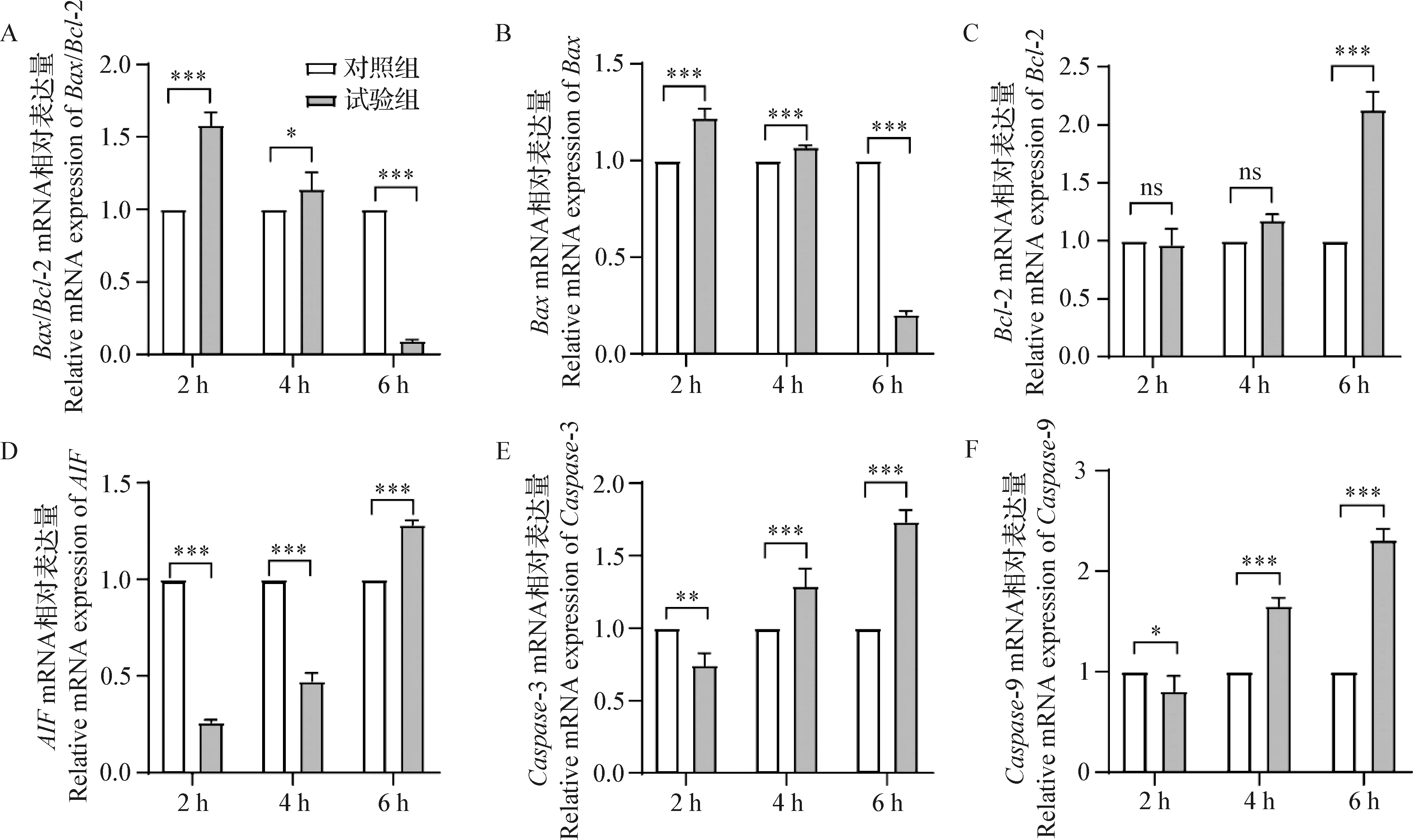
图3 RT-qPCR检测凋亡基因的mRNA表达水平
3 讨论
坏死杆菌是一种多形性杆菌,革兰染色呈阴性,病灶内细菌镜检呈长丝状,着色不均匀,临床引起以坏死性和化脓性感染为主要特征的坏死杆菌病。随着对坏死杆菌的研究逐渐深入,发现坏死杆菌作为机会性病原体参与人和动物的坏死性和化脓性疾病,例如动物的腐蹄病、肝脓肿、乳腺炎和人的Lemierre′s综合征[21]等。坏死杆菌的毒力因子主要有白细胞毒素、溶血素、内毒素、外膜蛋白、皮肤坏死毒素等,大量研究表明这些毒力因子在病原菌黏附宿主细胞、病原菌与宿主细胞相互作用并大量繁殖、病原菌产物导致宿主细胞损伤或死亡等方面起到重要作用[17-21],但坏死杆菌诱导细胞凋亡的研究甚少。
因此,本研究首先通过坏死杆菌A25菌株感染鼠乳腺上皮细胞,采用EdU增殖试验检测坏死杆菌在不同感染复数和不同感染时间条件下对细胞增殖的影响。结果表明,坏死杆菌以时间与浓度依赖性抑制鼠乳腺上皮细胞增殖。细菌感染后,可以通过诱导免疫细胞或上皮细胞凋亡促进细菌感染,细胞凋亡通常不会引起炎症反应[22],因此其是细菌感染的首选途径,此外,细菌感染后,还可以通过促进细胞凋亡进而促进自身的感染与增殖[23]。坏死杆菌同样可以诱导细胞发生凋亡,当细胞发生凋亡时,染色质浓缩,形成凋亡小体,DNA断裂形成180 bp 大小的片段,电泳时形成“Ladder”条带[24],在坏死杆菌感染EPH4细胞后,Hoechst染色观察到凋亡小体的出现,核酸电泳DNA呈现“Ladder”条带。
细胞发生凋亡时,不仅呈现细胞形态上的变化,在基因水平上也会发生变化,因此,本研究在mRNA水平上进一步验证细胞凋亡的发生,RT-qPCR结果显示,与对照组相比,坏死杆菌感染EPH4细胞2 h时,促凋亡基因Bax和Bax/Bcl-2的mRNA相对表达量显著上调;感染4 h时,促凋亡基因Caspase-3和Caspase-9的mRNA相对表达量极显著上调;感染6 h时,促凋亡基因AIF的mRNA相对表达量极显著上调。当细胞发生凋亡时,线粒体膜上的Bcl-2家族的促凋亡基因在死亡刺激信号下,调控线粒体膜的通透性,从而释放AIF等促凋亡因子,在促凋亡因子的作用下,募集Pro-caspase-9,从而激活Caspase-3,启动Caspase级联反应[25]。而对于在感染后期抑凋亡基因Bcl-2的上调以及Bax/Bcl-2的下调,出现抑制细胞凋亡的现象,可能是由于感染时间增加,细胞死亡方式偏向细胞坏死[26],这也与DNA Ladder和Hoechst染色结果一致。本研究证明了牛坏死杆菌能够抑制EPH4细胞增殖且诱导细胞凋亡,为坏死杆菌致病机制的研究提供了一定的理论依据。

