基于数据挖掘和网络药理学探讨中药治疗失眠障碍伴抑郁、焦虑的分子机制
王瑞敏,刘 毅,李 菲,贾跃进,刘 宁
失眠障碍是以一系列昼夜症状为特征的疾病,主要包括以入睡困难、易醒、早醒为主的睡眠满意度差和以疲劳、情绪障碍、认知功能降低为主的日间功能障碍[1]。10%~30%的人口可能受到影响[2],且随着社会环境改变,压力增大,失眠障碍合并抑郁、焦虑日益成为普遍现象[3],给生活带来许多负面影响。西医治疗相关症状多选用苯二氮卓类受体激动剂、选择性5-羟色胺再摄取抑制剂等药物,约40%的病人症状无法持续缓解[4-5],并且可能带来多种不良反应[6-7]。因此,探讨安全有效的治疗失眠障碍合并抑郁、焦虑的方法成为重要的研究课题。中药治疗通过多成分、多靶点、多通路发挥作用,临床应用安全有效,具有一定的优势[8-9]。本研究通过对相关文献进行数据挖掘以探讨中药治疗失眠障碍的用药规律及核心药物的潜在作用机制,以期为临床用药和进一步研究提供参考。
1 资料与方法
1.1 数据挖掘
1.1.1 数据收集与整理 通过检索2016年1月1日—2020年5月12日中国知网、万方、维普数据库中失眠障碍伴抑郁、焦虑的相关文献,检索表达式以中国知网为例:(SU=失眠障碍OR SU=不寐 OR SU=失眠症)AND(SU=抑郁 OR SU=焦虑OR SU=郁证),初步得到中国知网文献290篇,万方文献416篇,维普文献91篇。
1.1.2 纳入与排除标准
1.1.2.1 纳入标准 诊断、安全性、有效性明确的使用中药治疗的医者验案;中药治疗结果有效的临床试验、临床观察、回顾性研究等。
1.1.2.2 排除标准 数据库间文献重复者(取其一);单纯理论研究、综述和动物实验;诊断、疗效、安全性不明确;处方不完整;不同文献处方相同(取其一);以基础方辨证或依症加减(取基础方);干预方式不包括中药。
1.1.3 数据标准化、录入与挖掘 根据纳入与排除标准进行筛选,共得到文献163篇,方剂189首,以双人双录入法将其录入至古今医案云平台V2.2.3提供的模板中,使用软件提供的数据标准化程序并结合2015版《中华人民共和国药典》[10]与第7版《中药学》[11]对中药名称进行规范,如:“炒枣仁”统一为“酸枣仁”。之后使用数据挖掘模块分别对中药进行药物频次、性味归经统计及关联分析、聚类分析和复杂网络分析,并综合获得核心药物组成。
1.2 核心药物组成及网络药理学分析
1.2.1 核心药物有效成分及对应靶点筛选 在中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php)中检索核心组方各药物,按照口服生物利用度(OB)≥30%、血脑屏障(BBB)≥-0.3、类药性(DL)≥0.18筛选,分别获得有效成分和相应靶点,若TCMSP中无某成分靶点则利用SwissTargetPrediction(http://www.swisstargetprediction.ch/)数据库预测靶点。
1.2.2 疾病靶点获取与药物-疾病交集建立 通过GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)、TTD(http://db.idrblab.net/ttd/)等数据库,检索得到失眠障碍的相关靶点,取1.2.1有效成分靶点与失眠障碍靶点的交集。
1.2.3 疾病-组方-药物-成分-靶点及蛋白-蛋白互作(PPI)网络构建 分别以有效成分、靶点及疾病、组方为节点,相互作用为边,通过Cytoscape V3.6.0构建疾病-组方-药物-成分-靶点网络图。将得到的交集靶点导入STRING(https://string-db.org/),设置物种为智人,构建PPI网络,并利用MCODE插件进行分析,并获取其核心靶点。
1.2.4 基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析 将1.2.2得到的交集靶点导入Metascape(https://metascape.org/)或ClueGO插件,分别进行GO生物过程、分子功能、细胞组成和KEGG通路富集分析,之后使用在线作图工具易汉博(http://www.ehbio.com/ImageGP/)绘制GO富集气泡图,并下载关键通路作用图。
1.3 关键有效成分与关键靶点分子对接分析 选择疾病-组方-药物-成分-靶点网络中节点居前7位的有效成分和PPI网络中综合各聚类节点居前5位的关键靶点,通过PDB(http://www.rcsb.org/)和ZINC(http://zinc.docking.org/)数据库分别得到关键靶点和关键成分的3D结构,处理后使用Vina进行分子对接,并使用Pymol进行可视化分析。
2 结 果
2.1 数据挖掘结果
2.1.1 药物频次及属性统计 共筛选出相关文献163篇,方剂189首,涉及中药212味,总应用频次2 273次,其中药物应用百分比≥20%有18味,应用总频次为1 068次,约占总频次半数,其中频次居前5位分别为甘草、柴胡、酸枣仁、茯苓、白芍,详见表1。将212味药物进行属性分析,结果以雷达图表示,详见图1。其中药性分布主要为平、温、微寒、寒;药味主要甘、苦、辛;归经主要归心经、肝经。

图1 四气、五味、归经频次分布雷达图

表1 药物使用情况(百分比≥20%,n=189)
2.1.2 药物关联分析、聚类分析、复杂网络分析及核心成分确定 将189首处方利用云平台数据分析,首先将设置置信度≥0.58,支持度≥0.17,得到17组药物关联分析结果,详见表2。将药物应用百分比≥20%的18味中药进行聚类分析,同时设置距离类型为欧氏距离,聚类方法为最长距离法,将18味中药分为5个聚类处方。C1:黄连、黄芩、半夏;C2:远志、首乌藤、茯神、合欢皮、龙骨、牡蛎;C3:柴胡、白芍、甘草;C4:酸枣仁、茯苓;C5:川芎、栀子、当归、白术等,详见图2。最后设置节点≥138,进行中药-中药复杂网络分析,得到由5味中药组成的核心组合,详见图3。综合以上并结合药物频次得到最核心药物组方:柴胡、白芍、酸枣仁、茯苓、甘草。

表2 药物关联分析

图2 药物聚类分析

图3 复杂网络分析
2.2 网络药理学结果
2.2.1 核心组方有效成分和对应靶点 通过检索TCMSP数据库,规定ADME值,并结合SwissTarget Prediction预测靶点,筛选出柴胡有效成分9种,相关靶点89个;白芍有效成分3种,相关靶点27个;酸枣仁有效成分7种,相关靶点35个;茯苓有效成分6种,相关靶点112个;甘草有效成分69种,相关靶点58个;重复成分2种,分别为白芍、酸枣仁、甘草共有的丁子香萜(mairin)和白芍、甘草共有的谷甾醇(sitosterol)。经过去重排除后,共获得有效成分91种,相关靶点217个。核心药物组成部分成分相关信息详见表3。

表3 核心药物组成部分成分相关信息
2.2.2 疾病靶点和药物-疾病靶点交集结果 在GeneCards、OMIM、TTD数据库中分别检索得到2 281个、673个、28个靶基因,合并数据并去重,共得到失眠障碍靶点基因2 916个。将失眠障碍靶基因与获得的有效成分相关靶点217个靶基因合并取交集,得到66个交集基因,详见图4。

图4 药物-疾病交集基因Venn图
2.2.3 疾病-组方-中药-成分-靶点网络和PPI网络构建 将数据导入Cytoscape软件,构建疾病-组方-中药-成分-靶点网络,详见图5。其中包含150个节点、620条边,从以上网络可得节点度较大的关键有效成分为:花生酸(FL4)、脱氢表皮酸(FL6)、7-甲氧基-2-甲基异黄酮(GC7)、驴食草酚(GC58)、芒柄花黄素(GC8)、β-谷固醇(BS1)和豆甾醇(CH2)。在STRING中导入66个交集靶点基因,进行PPI分析,并使用MCODE插件将靶点分成3个聚类,详见图6。图中共66个节点、313条线,平均节点为9.48,根据节点筛选每个聚类的核心靶点,C1:MAOA、ACHE、HTR1A、HTR3A、CHRNA4;C2:TNF、VEGFA、SLC6A4、ESR1;C3:PARP1、SLC6A2。

图5 疾病-核心组方-药物-成分-靶点网络

图6 PPI靶点网络
2.2.4 GO功能富集分析和KEGG通路富集分析结果 利用Metascape对66个交集靶点进行富集分析,其中GO功能富集分析共获得907条结果,包括GO生物过程745条,GO分子功能104条,GO细胞组成58条。设定P<0.01,最小计数为3,富集因子>1.5,选择排名居前20位、前15位、前10位的富集项,绘制气泡图,详见图7。其中生物过程主要包括血液循环、神经递质水平调节、化学突触传递、有机羟基化合物代谢、细胞分泌调节等;分子功能主要包括G蛋白偶联的胺受体活性、神经递质受体活性、类固醇激素受体活性等;细胞组成主要包括突触膜的组成部分、膜筏、GABA能突触等。KEGG通路富集分析获得69条信息通路,将结果导入ClueGO,绘成关键通路图详见图8。以通路、交集靶点、有效成分为节点,构建成分-通路-靶点网络,详见图9。主要通路涉及神经活性配体-受体相互作用、血清素能突触、癌症中的蛋白聚糖、催乳素信号通路等。其中神经活性配体-受体相互作用通路处于关键地位,提示核心组方可能通过此通路对失眠障碍发挥治疗作用,详见图10。

图7 GO富集分析气泡图

图8 KEGG主要富集通路图

图9 成分-通路-靶点网络

图10 神经活性配体-受体相互作用通路图
2.3 分子对接结果 关键靶点和关键成分分子对接结果均≤-20.90 kJ/mol,提示该7种关键成分均与5种关键靶点形成稳定结构,详见表4。取对接较好的3个组合进行可视化,详见图11。
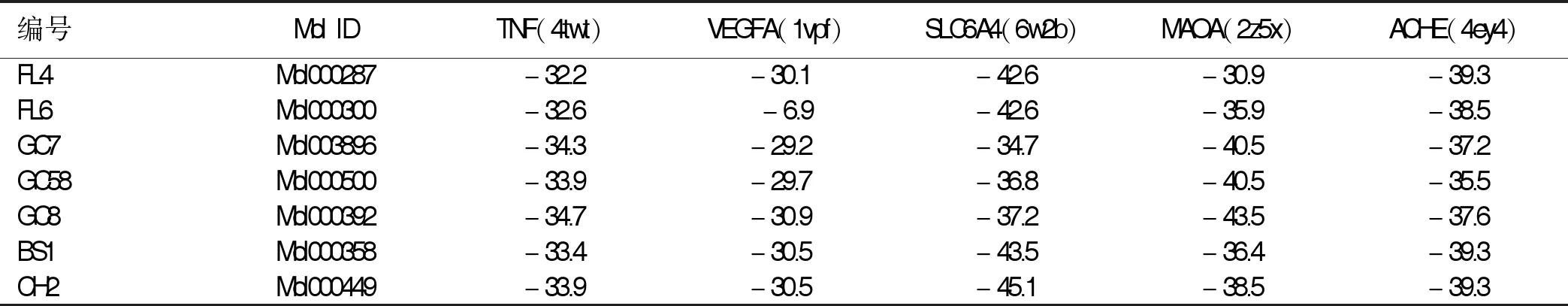
表4 分子对接结果 单位:kJ/mol
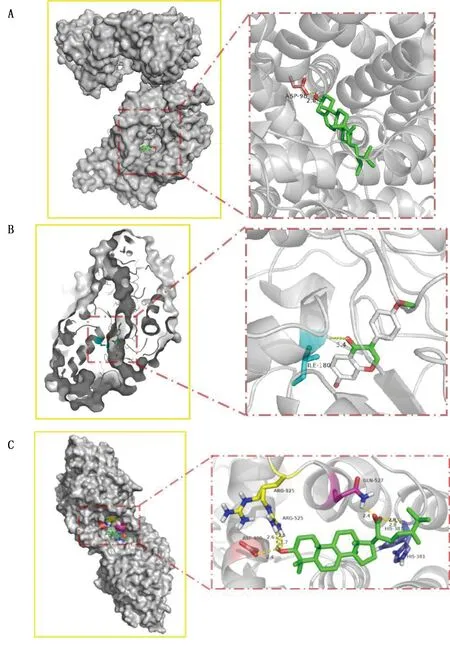
图11 分子对接构象图(A为SLC6A4和CH2;B为MAOA和GC8;C为ACHE和FL4)
3 讨 论
中医学称失眠障碍为“不寐”,认为总病机为“营卫失和、阴阳不交[12]”,《临证指南医案》记载:“不寐之故,总是阳不交阴所致[13]”。对伴随抑郁、焦虑的失眠障碍当从肝论治[14],所谓“凡郁皆肝病也[15]”。中医脏腑理论认为肝主要有主疏泄和藏血的生理功能,故肝郁气滞或肝血不足是导致不寐的重要病机,《辨证录·不寐门》记载:“气郁既久,则肝气不舒,肝气不舒,则肝血必耗,肝血既耗,则木中之血上不能润于心,而则不寐[16]”。因此,治疗失眠障碍伴抑郁、焦虑,主要是从肝论治,证型主要包括两方面,即肝郁气滞和肝血不足。
数据挖掘结果显示,治疗药物中使用频率最高的为甘草、柴胡、酸枣仁、茯苓、白芍。现代药理学研究表明,这些高频药物具有镇静、抗抑郁、抗焦虑或神经保护等作用,其中一些药物兼具对肝脏的保护作用[17-21]。从药性来看,应用最多者为平、温、微寒,可见失眠障碍伴抑郁、焦虑无明显寒热偏向,因肝郁气滞和肝血不足皆表现出寒热,所谓“气有余便是火,气不足便是寒”“血证有四:曰虚,曰瘀,曰热,曰寒”。药味主要为甘、苦、辛,与药性结果一致,另外甘味药可补肝血之不足,补肝脾同病之脾虚,同时可调和诸药,辛味药能散能行,对肝郁之证。药物归经主要归心经、肝经,本病属神志疾病,与心主神明直接相关,而治当从肝论治,故药物多入心经、肝经。药物关联分析中选定同现频次>50次(支持度>0.25)为核心组合,分别为:茯苓→甘草,柴胡→甘草,茯苓→酸枣仁,白芍→柴胡,其中甘草为常用佐使药,柴胡-白芍组合为临床常用药对,可疏肝理气、养血柔肝,是逍遥散、柴胡疏肝散、四逆散等常用方剂中的主要药物,常用于治疗肝郁气滞的病证;酸枣仁-茯苓组合是张仲景治疗“虚劳虚烦不得眠”的酸枣仁汤主要药物,可用于肝血不足的不寐。聚类分析中:C3、C4聚类组合分别是柴胡、白芍、甘草和酸枣仁、茯苓。复杂网络分析中的核心药组为上述5味药物,且此5味药物是使用频次最高的药物,并囊括了失眠障碍伴抑郁、焦虑的两大基本证型,因此确定该5味药物为治疗失眠障碍伴抑郁、焦虑的核心药物组成。
采用网络药理学方法得到核心药物组合发挥作用的7个主要有效成分,其中FL4、FL6属于茯苓中的三萜类化合物,有研究显示其具有一定镇静作用[22];GC7、GC8、GC58是甘草中的黄酮类物质,有研究显示该类物质可增强记忆和保护神经[23],GC8在动物实验中表现为抗焦虑作用[24];BS1可由中枢神经系统(CNS)的5-羟色胺(5-HT)和去甲肾上腺素介导表现出抗抑郁作用[25];CH2是一种植物甾醇,可促进神经调节[26]。根据PPI网络得到核心靶点,其中TNF被证实在生理和病理生理条件下对CNS(包括通过组织再生和神经发生)的减少产生作用[27-28];VEGFA被认为可转导脑源性神经营养因子的抗抑郁和神经营养作用[29];SLC6A4可调节CNS中的5-HT,HTR1A、HTR3A是5-HT的受体,而5-HT在睡眠-觉醒周期及焦虑、抑郁中发挥着重要的作用[30-32];MAOA、MAOB在调节突触功能和单胺代谢中发挥关键作用,其抑制剂常作为抗抑郁或神经退行性疾病的治疗药物[33];ACHE可将神经递质乙酰胆碱水解,从而终止神经传递,服用ACHE抑制剂证实可改善睡眠[34-35],CHRNA4是乙酰胆碱受体亚基,包括睡眠、唤醒、焦虑在内的多种大脑功能与其有关[36]。
由GO功能富集分析得到核心组方对失眠障碍伴抑郁、焦虑治疗作用的主要生物过程为血液循环、神经递质水平调节、化学突触传递。其中神经递质水平调节和化学突触传递已证实是失眠障碍、抑郁、焦虑的主要生物过程。另有研究显示,睡眠-觉醒与人脑血液循环相关,细菌种群与免疫系统内复杂的相互作用通过血液循环影响CNS,而抑郁、焦虑与相互作用有关[37-38],该生物过程与中医证型的肝血途径一致。KEGG通路富集分析主要包括神经活性配体-受体相互作用、血清素能突触。目前已知的食欲素、多巴胺、去甲肾上腺素和组胺等促觉醒物质与GABA、5-HT、褪黑素等促睡眠物质均通过这些通路调控睡眠[39];催乳素在脑中表达,可促进神经发生、发育,对睡眠和神经有保护作用[40]。分子对接结果显示,核心有效成分和核心靶点均可稳定结合,其中与各有效成分对接较好的靶点为SLC6A4、MAOA和AchE,提示核心组方可能通过这3个靶点发挥作用,而CH2和BS1是与关键靶点对接较好的成分,说明这2个成分可能是本方发挥作用的主要成分。
综上所述,通过数据挖掘、网络药理学和分子对接研究,初步得到中药治疗失眠障碍伴抑郁、焦虑的核心组方为柴胡、白芍、酸枣仁、茯苓、甘草,其多成分、多靶点、多通路作用机制涉及的核心成分为β-谷固醇和豆甾醇;核心靶点为SLC6A4、MAOA和ACHE;主要通路为神经活性配体-受体相互作用、血清素能突触、多巴胺能突触。该结论可为进一步研究和临床应用提供参考。

