急性心肌梗死患者外周血NO-PGC1α线粒体生物合成通路相关基因的表达及其临床意义*
壮婷,杨帆
(常州市第二人民医院 急诊科,江苏 常州 213000)
急性心肌梗死(acute myocardial infarction, AMI)是心血管疾病死亡的主要原因,多发于老年人,具有发病急、进展快的特点[1-2]。早期有效预测AMI 的发生、尽早开展防治措施对降低AMI 死亡风险意义重大,但目前临床缺乏新型早期有效预测AMI 发生的高效、客观的生化指标。已有报道显示,血清外连素[3]、高敏C 反应蛋白[4]与多数AMI 发生相关,但目前临床预测AMI 仍不理想[5],迫切需求更多可安全、高效、客观地预测AMI 发生的生化标志物,以便指导早期治疗,改善预后。
AMI 患者冠状动脉供血不足,导致心肌细胞出现不可逆转损伤。近期有研究显示,心肌细胞损伤与过量活性氧有关[6]。一氧化氮-过氧化物酶体增殖物激活受体γ 共激活因子1α(nitric oxideperoxisome proliferator activated receptor γ coactivator 1α, NO-PGClα)线粒体生物合成通路蛋白是线粒体生物发生的重要蛋白质,NO-PGC1α 可通过促进线粒体氧化代谢,生成活性氧[7]。线粒体功能生物合成障碍与多种心血管疾病有关[8-9]。一氧化氮NO 作为维持心血管内环境稳定的重要分子之一,NO 信号通路分子精氨酸酶2(arginase 2,Arg2)、一氧化氮合酶1(nitric oxide synthase 1,NOS1)可通过竞争底物L-精氨酸调节NO,生成的NO 可能通过调节NOPGC1α 表达调控线粒体生物合成,影响AMI 的发生。目前国内尚未见外周血NO-PGC1α 线粒体生物合成通路相关基因表达与AMI 发生关系的报道。
1 资料与方法
1.1 一般资料
选取2019 年5 月—2021 年6 月常州市第二人民医院收治的AMI 患者103 例为AMI 组。其中男性59 例,女性44 例;年龄45~80 岁,平均(63.84±7.01)岁。另取同期该院健康体检者69 例为对照组,男性36 例,女性33 例;年龄47~80 岁,平均(61.95±6.89)岁。本研究经医院医学伦理委员会批准,患者及家属自愿签署知情同意书。
1.2 纳入与排除标准
1.2.1纳入标准①AMI 组符合《急性心肌梗死诊断和治疗指南》[10]AMI 诊断标准,对照组经病史、心电图、心肌标志物及冠状动脉造影等证实无心肌梗死病变;②AMI 组发病至入院时间<12 h。1.2.2 排除标准 ①伴有血管畸形病变、代谢性脑病、中枢神经系统感染、颅内器质性病变;②近期使用糖皮质激素、免疫抑制剂、抗凝药物等;③伴有外周神经疾病、精神性疾病、认知功能障碍者;④肝、肾等重要脏器功能严重障碍;⑤伴有脑卒中史、严重免疫缺陷、传染性疾病、血液系统疾病、恶性肿瘤、胸部外伤史、血液透析史等;⑥妊娠及哺乳期女性;⑦近期出现急性感染;⑦依从性差;⑧无法配合完成本研究者。
1.3 资料收集
收集两组基本资料及AMI 入院治疗前、对照组体检时生化指标,包括性别、年龄、体质量指数(body mass index, BMI)、基础疾病、吸烟史、饮酒史、甘油三酯(Triglycerides, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、总胆红素、血肌酐、尿酸、尿素氮、血乳酸、白细胞计数(white blood cell, WBC)、血小板计数(Platelets,PLT)、纤维蛋白原、基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)、脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2, LP-PLA2)、心肌肌钙蛋白Ⅰ(cardiac troponin Ⅰ,cTnⅠ)。
1.4 实时荧光定量聚合酶链反应检测外周血NOPGC1α、NOS1、Arg2 mRNA的表达
AMI 组入院治疗前、对照组体检时抽取静脉血液5 mL 贮存于肝素抗凝管中,采用QIACEN RNeasy Mini 试剂盒提取血中总RNA,microRNA Isolation Kit 试剂盒(美国Bio-Rad 公司)分离RNA,Superscript RT Kit 试剂盒(上海远慕生物科技有限公司)逆转录成cDNA,SYBR Green PCR master Mix 试剂盒(大连宝生生物工程公司有限公司)进行实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR),在PCR 仪上(美国ABI 公司7500 Fast Real-Time PCR System PCR)测定外周血NO-PGC1α、NOS1、Arg2 mRNA的表达[11]。反应体系20 μL:基因组DNA 1 μL、正反向引物各0.5 μL、PCR 缓冲液10 μL、蒸馏水8 μL。反应条件:95℃预变性3 min,95℃变性15 s,60℃退火30 s,70℃延伸30 s,共40 个循环。以Ct 值为基础,2-ΔΔCt法计算mRNA 相对表达量。内参选用GAPDH,qRT-PCR 引物序列见表1。

表1 qRT-PCR引物序列
1.5 冠状动脉病变狭窄程度积分
AMI 组患者入院后进行冠状动脉造影,采用Gensini 积分[12]系统评价患者冠状动脉血管病变狭窄程度。Gensini积分≤40分为轻度狭窄,>40分~<80分为中度狭窄,≥80 分为重度狭窄。
1.6 统计学方法
数据分析采用SPSS 18.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,进一步两两比较用LSD-t检验;计数资料以构成比或率(%)表示,比较用χ2检验;绘制受试者工作特征(receiver operating characteristic, ROC)曲线;影响因素的分析采用多因素Logistic 回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 AMI 组不同病情严重程度患者外周血NOPGC1α、NOS1、Arg2 mRNA相对表达量比较
103 例AMI 患者中,轻度狭窄患者26 例(25.24%),中度狭窄患者59 例(57.28%),重度狭窄患者18 例(17.48%)。
轻、中、重度狭窄组外周血NO-PGC1α、NOS1、Arg2 mRNA 相对表达量比较,经方差分析,差异有统计学意义(F=10.156、28.529 和17.580,均P=0.000)。进一步两两比较结果:重度狭窄组外周血NO-PGC1α、NOS1、Arg2 mRNA 相对表达量高于中、轻度狭窄组(P<0.05);中度狭窄组NOPGC1α、NOS1、Arg2 mRNA 相对表达量高于轻度狭窄组(P<0.05)。见表2。
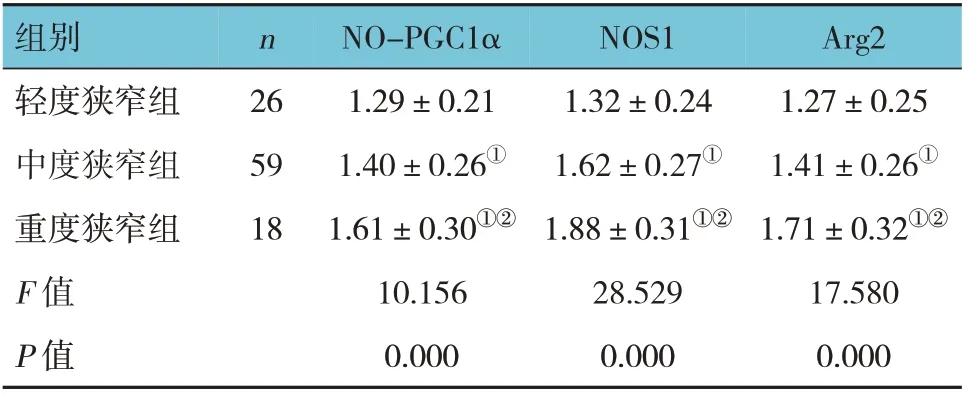
表2 AMI组不同病情严重程度患者外周血NO-PGC1α、NOS1、Arg2 mRNA相对表达量比较 (x±s)
2.2 AMI组与对照组临床资料比较
AMI 组与对照组的性别、年龄、BMI、基础疾病、吸烟史、饮酒史、TG、TC、HDL-C、ALT、AST、总胆红素、血肌酐、尿酸、尿素氮、血乳酸、WBC、PLT、MMP-9 比较,差异无统计学意义(P>0.05)。AMI 组与对照组的LDL-C、纤维蛋白原、LP-PLA2 及NO-PGC1α、NOS1、Arg2 mRNA 相对表达量比较,差异有统计学意义(P<0.05),AMI组LDL-C、纤维蛋白原、LP-PLA2 及NO-PGC1α、NOS1、 Arg2 mRNA 相对表达量高于对照组。见表3。
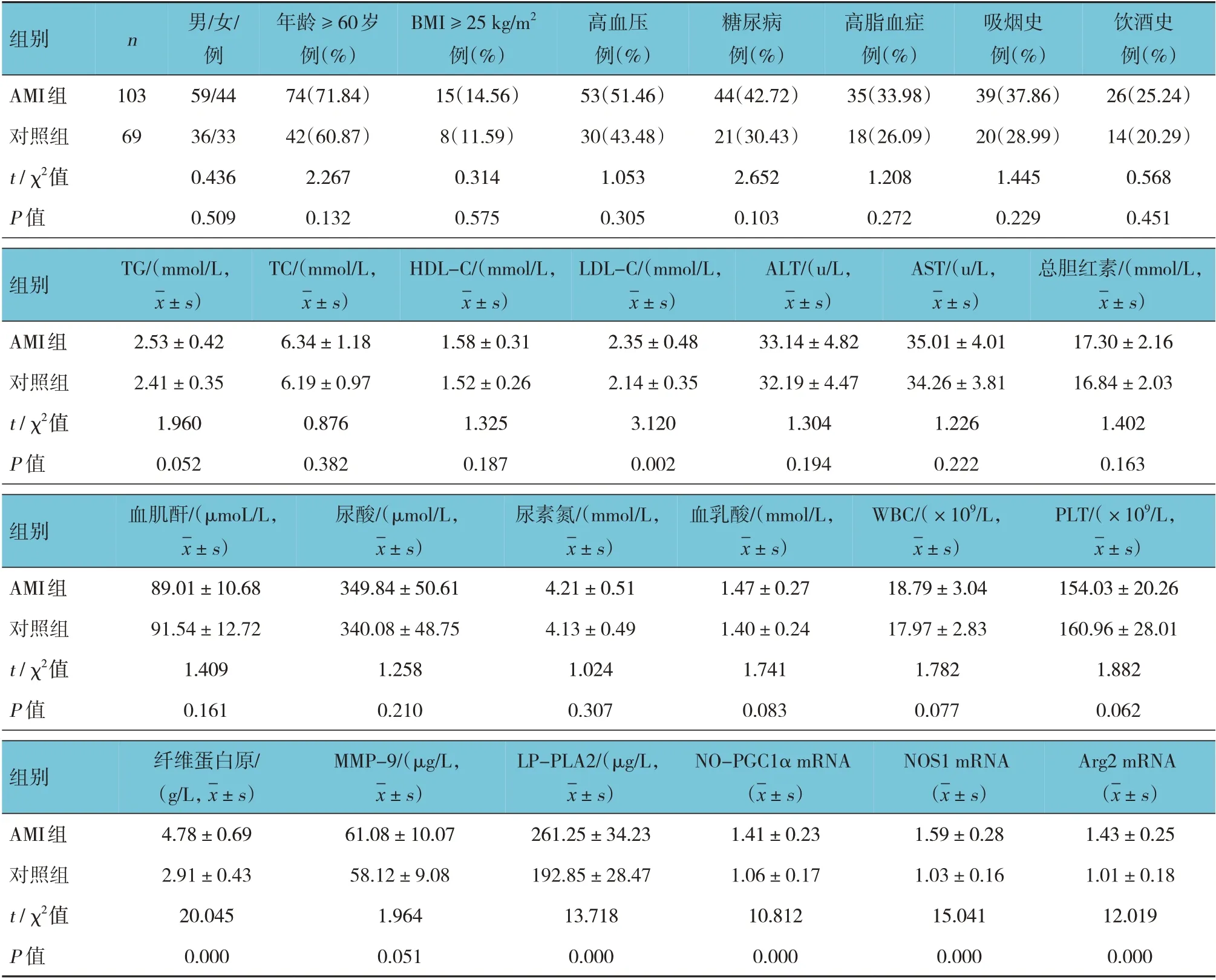
表3 AMI组与对照组临床资料比较
2.3 影响AMI发生的多因素Logistic分析
以AMI 为因变量(否= 0,是= 1),LDL-C、纤维蛋白原、LP-PLA2 及NO-PGC1α、NOS1、Arg2 mRNA 相对表达量为自变量(上述计量资料自变量赋值为连续变量),进行多因素Logistic 回归分析。结果显示:NO-PGC1α mRNA [O^R=3.873(95% CI:1.594,9.412)]、NOS1 mRNA [O^R=4.267(95% CI:1.756,10.371)]、Arg2 mRNA [O^R=4.518(95% CI:1.859,10.979)]是影响AMI 发生的独立因素(P<0.05)。见表4。
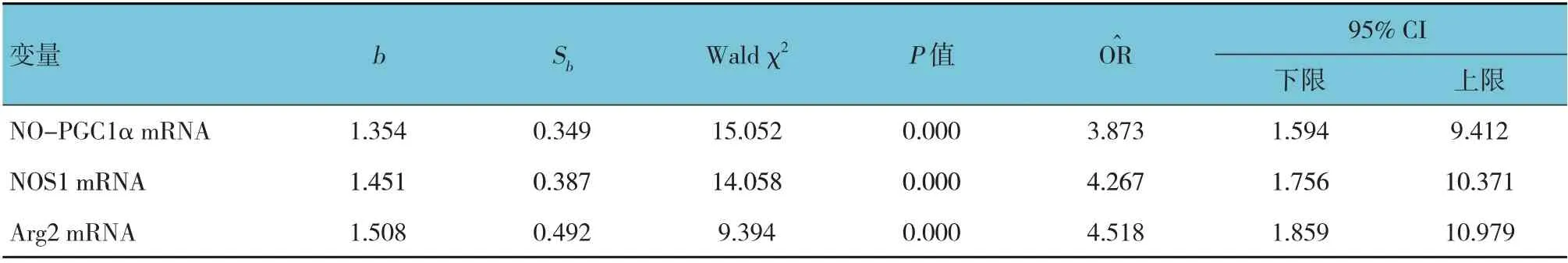
表4 影响AMI发生的多因素Logistic回归分析参数
2.4 外周血NO-PGC1α、NOS1、Arg2 mRNA 预测AMI发生的价值
ROC 曲线结果显示,外周血NO-PGC1α、NOS1、Arg2 mRNA 及3 者联合预测AMI 发生的敏感性分别为70.87%、71.84%、75.73%和70.87%,特异性分别为73.91%、72.46%、71.01%和91.30%,曲线下面积(area under curve, AUC)分别为0.764、0.742、0.759和0.908。见表5 和图1。
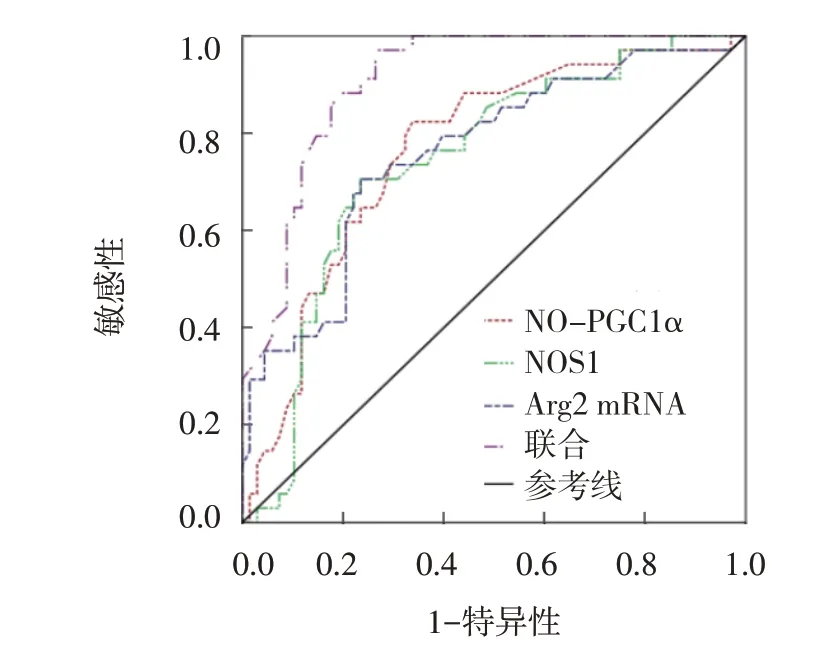
图1 外周血NO-PGC1α、NOS1、Arg2 mRNA相对表达量预测AMI发生的ROC曲线
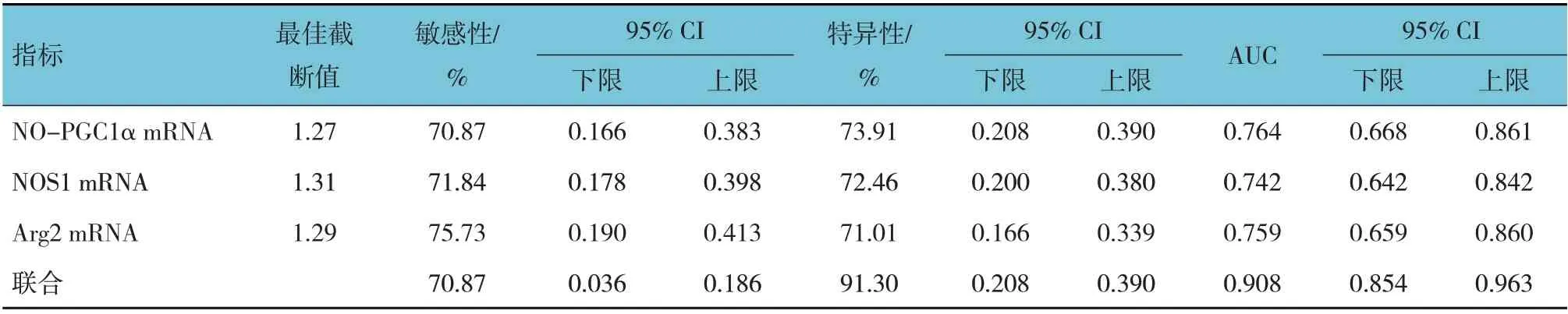
表5 外周血NO-PGC1α、NOS1、Arg2 mRNA相对表达量预测AMI发生的效能分析参数
3 讨论
AMI 是临床常见心血管疾病之一,患者发病急,病死率高[13]。临床早期预测AMI、尽早采取防治措施,有助于降低AMI 死亡风险。近期有研究结果显示,线粒体功能生物合成障碍与多种心血管疾病有关,细胞外多种信号通路可影响线粒体生物合成,其中NO-PGC1α 是重要的调节因子之一,NO 可促使线粒体的生物合成[8-9]。NOS 作为调控L-精氨酸/NO 信号通路的重要限速酶,影响细胞内氧化应激状态、心肌细胞内游离Ca2+浓度等,在血管扩张、心肌收缩抑制等生理过程中发挥重要作用[14]。
本研究中多因素Logistic 回归分析结果显示,外周血NO-PGC1α、NOS1、Arg2 mRNA 相对表达量是影响AMI 发生的独立因素,提示外周血NOPGC1α、NOS1、Arg2 mRNA 相对表达量与AMI 发生有关。Arg2 主要存在于心肌线粒体中,通过L-精氨酸底物影响NOS1 活性,调控NO 生成量,影响心血管组织生物学作用。SAVELIEVA 等[15]研究结果显示,升高的Arg2 可能通过NO 信号通路影响心肌肥厚、缺血再灌注损伤等心血管疾病病理过程。Arg2 mRNA 相对表达量升高,使底物L-精氨酸利用率增大,NO 生成量降低,造成机体心肌细胞线粒体生物合成障碍,增大AMI 发生风险。NOS1 属于含铁生物酶之一,是合成NO 的关键酶,NOS1 mRNA 相对表达量升高可促进L-精氨酸产生大量NO,适量NO 具有保护心血管健康的生理功能,过量NO 则损伤心血管系统。PGC1α 主要存在于心肌等耗氧量大、能量需求量高的组织器官中,是心肌细胞线粒体生物合成的重要辅助激活因子、调控因子,可通过调控核呼吸因子、线粒体转录因子A 介导线粒体生物合成,NO-PGC1α mRNA 相对表达量升高可能导致心肌细胞线粒体生物合成功能异常,影响AMI 发生。聂俊刚等[16]研究结果显示,PGC1α可通过氧化应激参与心肌缺血再灌注损伤过程。Arg2 mRNA 相对表达量升高可抑制NO 生成,而NOS1 mRNA 相对表达量升高可促进NO 生成,是相互矛盾的结果,但是NO-PGC1α mRNA 相对表达量升高可从侧面反映NO 含量增加。ROC 曲线结果显示,NO-PGC1α、NOS1、Arg2 mRNA 3 者联合预测AMI发生的特异性、AUC 最大,提示3 者联合预测AMI 发生效能良好,可作为预测AMI 发生的客观生物标志物。此外,本研究还发现重度狭窄组外周血NOPGC1α、NOS1、Arg2 mRNA 相对表达量高于中、轻度狭窄组,中度狭窄组NO-PGC1α、NOS1、Arg2 mRNA相对表达量高于轻度狭窄组,提示外周血NOPGC1α、NOS1、Arg2 mRNA 不仅与AMI 发生有关,而且与AMI 患者病情也有关,这是笔者后期研究的重点。
综上所述,外周血NO-PGC1α 线粒体生物合成通路的相关基因NO-PGClα、Arg2 、NOS1 mRNA 与AMI 发生有关,3 者联合预测AMI 发生效能良好,且NO-PGClα、Arg2 、NOS1 mRNA 表达可能与AMI患者病情有关,更精准的作用机制有待后续进一步研究阐明。

