铁死亡脂质过氧化机制及其与阿尔茨海默病的联系*
李佳明, 韩雅琪, 吴桐, 张天赐, 董贤慧
铁死亡脂质过氧化机制及其与阿尔茨海默病的联系*
李佳明, 韩雅琪, 吴桐, 张天赐, 董贤慧△
(河北中医学院,河北省心脑血管病中医药防治研究重点实验室,河北 石家庄 050091)
铁死亡;脂质过氧化;阿尔茨海默病;多不饱和脂肪酸
阿尔茨海默病(Alzheimer disease, AD)是多发于65岁及以上老年人群的中枢神经系统退行性疾病,临床表现以记忆、语言及其他认知能力衰退为主,主要病理特征为以β-淀粉样蛋白(amyloid β-protein, Aβ)为核心成分的老年斑及tau蛋白过度磷酸化引起的神经原纤维缠结。在日益增强的老龄化趋势下,由于AD发病机制尚不明确,临床缺乏经济有效的治疗方法,AD正为患者及社会医疗保障领域带来沉重负担。以脂质过氧化为特征的铁依赖性细胞死亡方式铁死亡(ferroptosis)在近期被认为可能参与AD病变过程[1]。已有部分研究证实AD脑中出现铁死亡关键蛋白表达上调,脂质过氧化物含量升高,且铁死亡抑制剂对AD病变有抑制作用。在铁死亡过程中,以多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)为主要底物的脂质过氧化现象是细胞损伤及死亡过程的重要参与者,且该现象与AD脑功能障碍存在联系。本文将综述铁死亡脂质过氧化过程与部分调控信号轴,并整理该过程与AD特征性病理过程的关系。
1 铁死亡中的脂质过氧化
氧化还原稳态失衡是多种病理现象发生的重要机制。生理状态下,氧化与抗氧化过程呈动态平衡状态,维持体内功能正常运作。一旦平衡遭到破坏,抗氧化能力下降或氧化过程加剧,极易引发过氧化连锁反应并导致活性氧积累,造成胞内脂质、蛋白质及核酸等成分被氧化破坏,严重影响细胞结构及功能。2012年,Dixon等[2]在前人研究成果的基础上,将一种显著区别于细胞凋亡、焦亡、自噬及坏死并能被铁螯合剂所抑制的调节性细胞死亡方式命名为铁死亡。铁死亡形态学特征主要表现为线粒体体积缩小、膜密度增高、嵴显著减少及细胞膜破裂;生化特征为铁代谢异常、谷胱甘肽代谢紊乱、活性氧累积及脂质过氧化,其中脂质过氧化是铁死亡复杂机制网络中的关键一环。铁死亡中的脂质过氧化是细胞内脂质在过氧化酶或自由基作用下失去氢原子,导致碳链氧化、断裂及缩短,脂质自由基、脂质氢过氧化物及丙二醛(malondialdehyde, MDA)、4-羟基壬烯醛(4-hydroxy-2-nonenal, 4-HNE)等过氧化中间产物生成,最终使脂质氧化降解,破坏细胞膜脂质双分子层结构的过程[3]。该过程可大致分为含PUFA的磷脂底物合成、自由基引发的过氧化和酶诱导的过氧化3个部分,其中后二者可平行进行,生成磷脂氢过氧化物,引发铁死亡。
1.1 底物合成过程 在铁死亡过程中,脂质过氧化多在富含磷脂的膜结构中进行。参与膜磷脂合成的PUFA因其含有多个碳-碳双键及较为脆弱的碳-氢键而对过氧化过程尤为敏感,其能在长链脂酰辅酶A合成酶4(acyl-CoA synthetase long-chain family member 4, ACSL4)参与下,生成PUFA-CoA,并由溶血磷脂酰基转移酶3(lysophospholipid acyltransferase 3, LPCAT3)酯化后并入膜磷脂,形成铁死亡脂质过氧化底物PUFA-PL,开启下游过氧化反应。
上述过程中,ACSL4已被确认为铁死亡标志物[4]。有关ACSL4的研究显示,在多种PUFA中,已探明其对花生四烯酸(arachidonic acid, AA)及肾上腺素酸(adrenic acid, AdA)作用尤为显著,其与膜磷脂中的磷脂酰乙醇胺(phosphatidylethanolamine, PE)结合后将作为酶促过氧化过程的特异性底物(AA/AdA-PE)[5]。ACSL4对不同种类PUFA的作用是否具有选择性目前尚无定论。
1.2 自由基介导的过氧化过程 由大量自由基引发的PUFA-PL过氧化级联反应可分为始动、传播和终止三个阶段。始动阶段,胞内未以铁蛋白或铁硫簇形式储存的不稳定铁与过氧化氢发生芬顿反应(Fenton reaction)和哈伯-韦斯反应(Haber-Weiss reaction),形成以氧为中心的羟基自由基与过氧自由基。传播阶段,上述自由基攻击PUFA-PL,使其脱去一个氢原子,形成磷脂自由基(PL·);该自由基与氧发生反应,生成磷脂过氧自由基(PLOO·);PLOO·与PUFA-PL中的另一个氢原子结合,生成磷脂氢过氧化物(PUFA-PL-OOH)与另一个PL·,引发过氧化循环。终止阶段,在抗氧化系统失常背景下,过氧化底物被耗尽,级联反应终止,并造成脂质体膜氧化破损及泄漏,严重损伤细胞膜[6]。
除终产物外,上述级联反应过程中还可形成大量碳氢化合物、醇类及醛类中间产物。其中活性醛MDA及4-HNE具有细胞毒性,能异常修饰胞内磷脂、蛋白质及核酸构象,使细胞多项功能受损[7]。
1.3 酶介导的过氧化过程 脂氧合酶(lipoxygenases, LOXs)家族是开启铁死亡中酶促脂质过氧化过程的关键,其中15-LOX能与磷脂酰乙醇胺结合蛋白1(phosphatidyl ethanolamine-binding protein 1, PEBP1)结合,特异性将膜上的AA/AdA-PE氧化为AA/AdA-PE-OOH,引发铁死亡。
除LOXs外,位于内质网的细胞色素P450还原酶(NADPH-cytochrome P450 reductase, POR)与细胞色素b5还原酶(NADH-cytochrome b5 reductase, CYB5R1)可通过电子传递形成大量过氧化氢,为自由基介导的过氧化反应启动提供必要条件[8]。
2 铁死亡脂质过氧化过程的调节方式
对该过程的调节可从控制底物合成、靶向过氧化过程关键因子及干预过氧化物生成和积聚实现。研究较为深入的有以下3条信号轴,分别通过清除过氧化物、控制过氧化自由基生成及保护过氧化脂质底物干预铁死亡,见图1。除此之外,还有多种方式对铁死亡脂质过氧化调控具有重要意义,将在下文简述。
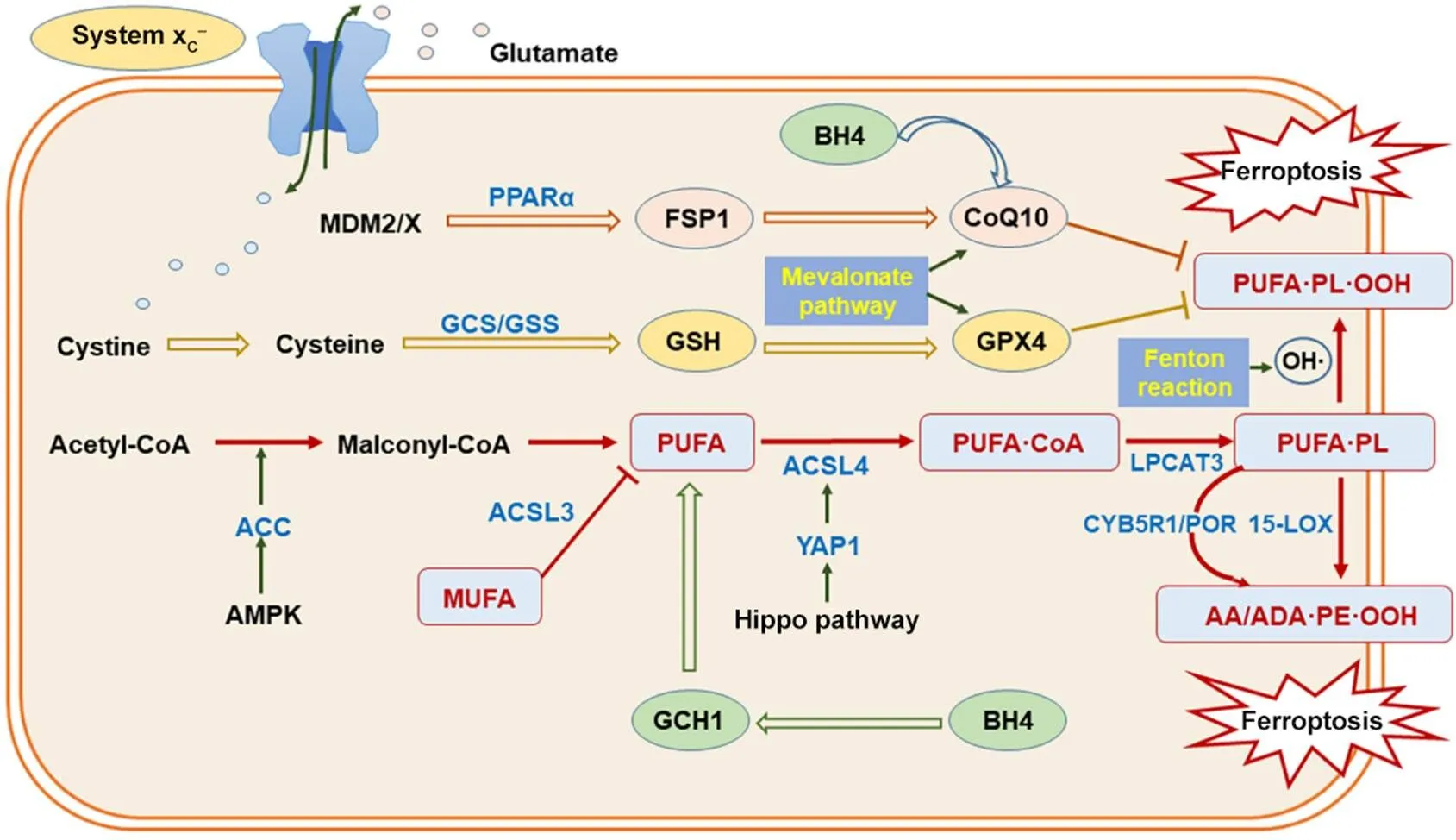
Figure 1. Lipid peroxidation process and regulating axes in ferroptosis. The red arrows represent the process of lipid peroxidation. The light brown hollow arrows represent glutathione (GSH)/glutathione peroxidase 4 (GPX4) axis. The orange hollow arrows represent ferroptosis suppressor protein 1 (FSP1)/coenzyme Q10 (CoQ10) axis. The green hollow arrows represent GTP cyclohydrolase 1 (GCH1)/tetrahydrobiopterin (BH4) axis. The blue curved hollow arrow indicates that BH4 generate reduced CoQ10. The longitudinal black arrows represent other regulating processes of lipid peroxidation. The light blue letters represent key proteins in peroxidation-regulating processes. AA: arachidonic acid; ACC: acetyl coenzyme A carboxylase; ACSL3: acyl coenzyme A synthetase long-chain family member 3; ACSL4: acyl coenzyme A synthetase long-chain family member 4; AdA: adrenic acid; AMPK: AMP-activated protein kinase; CYB5R1: NADH-cytochrome b5 reductase; GCS: glutamyl cysteine synthetase; GSS: glutathione synthetase; LPCAT3: lysophosphatidylcholine acyltransferase 3; MDM2/X: MDM2/X proto-oncogene; MUFA: monounsaturated fatty acid; PE: phosphatidylethanolamine; PL: phospholipid; POR: cytochrome P450 oxidoreductase; PPARα: peroxisome proliferator-activated receptor α; PUFA: polyunsaturated fatty acid; YAP1: Yes-associated protein 1; 15-LOX: 15-lipoxygenase.
2.1 还原型谷胱甘肽(glutathione, GSH)/谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)信号轴 GPX4相关代谢过程异常是较早被明确的铁死亡发生机制,其上游调节路径涉及谷胱甘肽代谢。GPX4是细胞中脂质过氧化物的主要还原剂,其可在GSH的协助下将PUFA-PL-OOH还原为羟基磷脂,抑制过氧化级联反应。GSH是机体重要的抗氧化剂,由谷氨酸、半胱氨酸和甘氨酸合成。其中胞内的半胱氨酸主要由胱氨酸-谷氨酸反向转运体(cystine/glutamate antiporter, system xC-)通过向胞外释放等量谷氨酸摄入。上述关键因素共同组成GSH/GPX4信号轴,通过控制脂质过氧化产物生成干预铁死亡。
靶向该信号轴中的关键因素可实现对铁死亡脂质过氧化过程的调控。system xC-由轻链xCT()与重链4F2hc()两个亚基组成,其中负责氨基酸转运的xCT对system xC-的活性影响较大,实验证实靶向可通过限制胱氨酸摄入减缓GSH的合成,影响GPX4对脂质过氧化物的还原能力,干预铁死亡[9]。GSH合成过程中,谷氨酰半胱氨酸合成酶(glutamyl cysteine synthetase, GCS)与谷胱甘肽合成酶(glutathione synthetase, GSS)作为限速酶发挥作用,靶向GCS与GSS能够干预GSH合成效率,影响细胞对过氧化反应的敏感度[10]。GPX4已是公认的铁死亡调节靶点,除直接干预其活性外,通过抑制甲羟戊酸途径中的代谢产物异戊烯焦磷酸合成,能够干扰硒代半胱氨酸(selenium cysteine, Sec)-tRNA的成熟,进而抑制依赖Sec-tRNA吸附丝氨酸的硒蛋白GPX4的活性,降低机体对铁死亡的抵抗力[11]。
2.2 铁死亡抑制蛋白1(ferroptosis suppressor protein 1, FSP1)/辅酶Q10(coenzyme Q10, CoQ10)信号轴 FSP1于2019年被证实与CoQ10共同组成一条与GPX4途径平行的铁死亡调控途径[12]。该信号轴满足了机体在GPX4缺失时的抗氧化需求。有证据表明,FSP1在被豆蔻酰化修饰后表现出强大的铁死亡调控能力,其表达上调可促进NAD(P)H依赖的CoQ10还原,使还原态CoQ10高效捕获脂质过氧化自由基,打破铁死亡脂质过氧化级联反应。靶向FSP1及CoQ10可干预铁死亡进程。据近期报道,FSP1水平可在癌基因及被抑制时上调,其具体机制与过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor, PPAR)亚型PPARα有关[13]。上述两种癌基因可能成为通过调节FSP1途径影响铁死亡脂质过氧化的靶点。甲羟戊酸途径对于CoQ10的合成至关重要,调控该途径可控制胞内CoQ10含量,干预脂质过氧化自由基清除过程[14]。
2.3 GTP环水解酶1(GTP cyclohydrolase 1, GCH1)/四氢生物蝶呤(tetrahydrobiopterin, BH4)信号轴 GCH1与BH4代谢过程在近期被证实可调控erastin诱导的铁死亡脂质过氧化[15]。调节机体氧化应激的重要因子BH4在胞内通过合成与回收途径生成,其合成途径由关键酶GCH1催化开启,回收途径由二氢叶酸还原酶(dihydrofolate reductase, DHFR)介导[16]。据报道,GCH1过表达能够选择性保护具有两条PUFA尾的膜磷脂,防止其发生过氧化;同时BH4可能通过干预苯丙氨酸向酪氨酸的转化,影响CoQ10前体的合成,从而干预涉及CoQ10的脂质过氧化调控途径[17]。
2.4 涉及底物合成及关键因子活性的其他调节方式 除上述调节信号轴外,不易发生过氧化的外源性单不饱和脂肪酸(monounsaturated fatty acid, MUFA)被长链脂酰辅酶A合成酶3(acyl-CoA synthetase long-chain family member 3, ACSL3)激活后,可抑制PUFA并入膜磷脂并减少脂质过氧化自由基生成[18]。PUFA氘化后在多种方式诱导的铁死亡中显示出较强的过氧化保护作用[19]。乙酰辅酶A羧化酶(acetyl-CoA carboxylase, ACC)可诱导细胞内总游离脂肪酸的积累,增加PUFA含量,为脂质过氧化提供充足底物[20]。AMP活化蛋白激酶(AMP-activated protein kinase, AMPK)在缺乏葡萄糖时被激活,可启动能量压力保护程序,阻断PUFA的异常合成,抑制铁死亡[21]。参与细胞增殖调控的Hippo-Yes相关蛋白1(Yes-associated protein 1,YAP1)信号通路在近期研究中被证实与铁死亡存在联系,实验证明高密度排列的细胞对铁死亡的抵抗力上升,其机制可能与YAP1蛋白靶向ACSL4活性有关[22]。对上述调节方式进一步探究有望完善铁死亡脂质过氧化调控体系。
3 铁死亡脂质过氧化与AD特征性病理过程的联系
脂质是脑的重要组分,占大脑干重的40%~75%,髓鞘中可达80%,在能量代谢、信号传导等方面发挥重要作用[23]。AD脑中高自由基水平环境易诱导脂质过氧化发生[24]。已有研究显示,AD患者海马总游离脂肪酸水平显著降低,ACSL4水平显著升高,在多个脑区可检测到高浓度的游离MDA及4-HNE[25],且GPX4表达下调,为AD脑内确有铁死亡脂质过氧化发生提供了证据。除此之外,AD多种标志性病理产物生成及积聚涉及铁死亡脂质过氧化过程。该过程可能为AD发病的潜在机制。
3.1 铁死亡脂质过氧化过程参与病理性Aβ积聚 脑内出现异常折叠并聚集的Aβ是AD标志性病理变化之一。目前多数观点认为病理性Aβ由脑内神经元或外周器官细胞膜上的β-淀粉样蛋白前体(amyloid β-protein precursor, APP)经β-和γ-分泌酶连续水解而成,其中非脑内形成的Aβ可通过血液循环进入脑组织[26]。Aβ在脑中以单体、寡聚体和纤丝体三种形式存在,其中Aβ寡聚体对AD影响显著[27]。据报道,其能使实验大鼠海马的长时程增强受损,并异常激活小胶质细胞促炎表型和补体系统,诱发神经炎症和突触丢失[28]。
Aβ与铁死亡脂质过氧化过程具有潜在联系。实验显示,脑内富含Aβ寡聚体的区域4-HNE等脂质过氧化物水平显著升高,提示Aβ富集可能涉及脂质过氧化[29]。Aβ寡聚体能够嵌入脂质双分子层,影响自由基合成过程中膜磷脂的脱氢效率,控制铁死亡脂质过氧化非酶促过程的开启[30]。影响FSP1表达的关键因子PPARα在近期被证实可降低部分APP表型的表达,抑制β-分泌酶1活性,减少Aβ寡聚体释放[31]。CoQ10作为铁死亡脂质过氧化通路中重要的抗氧化剂,已被证实可降低AD模型小鼠大脑皮层和海马中的Aβ水平[32]。可知AD重要病理产物Aβ与铁死亡脂质过氧化过程间可能相互影响,具体作用机制尚需研究。
3.2 铁死亡脂质过氧化过程参与tau蛋白过度磷酸化 微管相关蛋白tau过度磷酸化并引发神经原纤维缠结是AD重要的病理标志。已知tau蛋白具有大量易被磷酸化的丝氨酸/苏氨酸及酪氨酸残基[33]。当促进其磷酸化的蛋白激酶与抑制该过程的磷酸酶活性失衡时,将使tau蛋白过度磷酸化,暴露内部微管结合域,增强tau蛋白聚集能力并诱导神经原纤维缠结形成[34]。修饰、聚集后的tau蛋白可引起微管变形退化,使神经细胞物质及信息转运功能受损,严重时可导致其功能丧失[35]。
异常磷酸化的tau蛋白与铁死亡脂质过氧化过程存在一定关联。据报道,老年AD模型小鼠脑内膜质筏中能够观测到磷酸化tau蛋白沉积[36],且部分PUFA能促进tau蛋白构象改变及聚合[37],提示脂质可能参与tau蛋白病变。磷酸化tau蛋白已被证实能够与细胞膜脂质双分子层结合,并与膜磷脂相互作用形成具有细胞毒性的tau-磷脂复合物,但二者间具体作用机制未明[38]。研究显示,铁死亡脂质过氧化过程关键调控因子AMPK表达上调除能够抑制磷脂合成外,对磷酸化tau蛋白同样有抑制作用[39],二者间可能存在联系,其机理是否与tau-磷脂复合物相关需进一步探索。
3.3 载脂蛋白E(apolipoprotein E, ApoE)通过铁死亡脂质过氧化过程参与AD进展 AD风险因素ApoE是调节中枢神经系统脂质代谢的关键蛋白,参与胆固醇跨细胞运输。已有证据表明ApoE通过抑制胆固醇合成途径的关键酶,积累大量胆固醇合成前体乙酰辅酶A。而乙酰辅酶A同样作为PUFA合成前体发挥作用[40]。ApoE上调可能加速胞内PUFA积累,为脂质过氧化及铁死亡发生提供适宜环境。神经胶质细胞功能异常被认为是AD淀粉样蛋白积累及突触缺失的原因之一。近期研究显示随年龄增长,神经胶质细胞内出现大量脂滴积聚,且其修剪突触功能可受等位基因调控。可知神经胶质细胞内出现脂质代谢异常,其机制可能同样涉及ApoE[41]。
4 多靶点干预铁死亡脂质过氧化过程治疗AD的策略探索
针对Aβ的药物aducanumab、gantenerumab、BAN2401及小分子口服药物ALZ-801已于2021年上市。此类药物虽可清除AD脑中的Aβ寡聚体,但具体疗效尚缺乏有效临床数据支持[42]。AD发病机制复杂,单一靶点干预难以取得满意疗效。多靶点干预铁死亡脂质过氧化过程治疗AD是值得探索的方向,已有部分研究取得进展。新型脂酸-烟酸二聚体N2L可减少多种脂质过氧化物生成[43];四羟基二苯乙烯苷(tetrahydroxy stilbene glycoside, TSG)能激活GSH/GPX4信号轴,增强抗氧化系统活性[44];非西汀(fisetin)衍生物CMS121可清除4-HNE等过氧化中间产物,缓解认知能力下降[45]。中药复方天麻钩藤饮可通过干预15-LOX,降低机体对神经退行性疾病的易感性[46];中药复方开心散能通过调节AA代谢和鞘脂代谢减缓脂质过氧化程度,改善认知能力[47]。从上述研究进展可知,通过铁死亡脂质过氧化过程干预AD可行,调控过氧化关键途径是AD药物研发的有效思路。
5 总结与展望
淀粉样蛋白级联假说已在AD发病机制领域占据重要地位多年,但靶向该假说关键病理产物的药物疗效模糊。随着铁死亡研究不断深化,越来越多证据表明AD发生发展涉及铁死亡与氧化应激。铁死亡作为以脂质过氧化物为执行者的细胞死亡方式,其脂质过氧化过程被多项研究证实参与AD脑内病变。铁死亡脂质过氧化过程是极具潜力的AD发病机制研究方向,但目前对该过程认知仍不够明确,难以确定发生过氧化的具体脂质类型,以及酶促与非酶促过氧化之间是否存在关联、是否有其他关键酶参与等。随着脑脂质组学及对铁死亡认知的发展,完善AD病变与铁死亡脂质过氧化机制之间的具体联系,建立AD调控网络是未来明确AD发病机制、研制特效药物的新方向。
[1] Ashraf A, Jeandriens J, Parkes HG, et al. Iron dyshomeostasis, lipid peroxidation and perturbed expression of cystine/glutamate antiporter in Alzheimer's disease: evidence of ferroptosis[J]. Redox Biol, 2020, 32:101494.
[2] Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5):1060-1072.
[3] Ayala A, Muñoz MF, Argüelles S. Lipid peroxidation: production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal[J]. Oxid Med Cell Longev, 2014, 2014:360438.
[4] Doll S, Proneth B, Tyurina YY, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition[J]. Nat Chem Biol, 2017, 13(1):91-98.
[5] Kagan VE,Mao G, Qu F, et al. Oxidized arachidonic and adrenic PEs navigate cells to ferroptosis[J]. Nat Chem Biol, 2017, 13(1):81-90.
[6] Hadian K, Stockwell BR. SnapShot: ferroptosis[J]. Cell, 2020,181(5):1188.
[7] Kiyuna LA, Albuquerque RPE, Chen CH, et al. Targeting mitochondrial dysfunction and oxidative stress in heart failure: challenges and opportunities[J]. Free Radic Biol Med, 2018, 129:155-168.
[8] Yan B, Ai Y, Sun Q, et al. Membrane damage during ferroptosis is caused by oxidation of phospholipids catalyzed by the oxidoreductases POR and CYB5R1[J]. Mol Cell, 2021, 81(2):355-369.
[9] Qiang Z, Dong H, Xia Y, et al. Nrf2 and STAT3 alleviates ferroptosis-mediated IIR-ALI by regulating SLC7A11[J]. Oxid Med Cell Longev, 2020, 2020:5146982.
[10] Ikawa T, Sato M,Oh-Hashi K, et al. Oxindole-curcumin hybrid compound enhances the transcription of γ-glutamylcysteine ligase[J]. Eur J Pharmacol, 2021, 896:173898.
[11] Hassannia B, Vandenabeele P, Vanden Berghe T. Targeting ferroptosis to iron out cancer[J]. Cancer Cell, 2019, 35(6):830-849.
[12] Doll S, Freitas FP, Shah R, et al. FSP1 is a glutathione-independent ferroptosis suppressor[J]. Nature, 2019, 575(7784):693-698.
[13] Venkatesh D, O'Brien NA, Zandkarimi F, et al. MDM2 and MDMX promote ferroptosis by PPARα-mediated lipid remodeling[J]. Genes Dev, 2020, 34(7/8):526-543.
[14] Zaleski AL, Taylor BA, Thompson PD. Coenzyme Q10 as treatment for statin-associated muscle symptoms: a good idea, but…[J]. Adv Nutr, 2018, 9(4):519S-523S.
[15] Hu Q, Wei W, Wu D, et al. Blockade of GCH1/BH4 axis activates ferritinophagy to mitigate the resistance of colorectal cancer to erastin-induced ferroptosis[J]. Front Cell Dev Biol, 2022, 10:810327.
[16] Lee I, Kim S, Nagar H, et al. CR6-interacting factor 1 deficiency reduces endothelial nitric oxide synthase activity by inhibiting biosynthesis of tetrahydrobiopterin[J]. Sci Rep, 2020, 10(1):842.
[17] Kraft VAN, Bezjian CT, Pfeiffer S, et al. GTP cyclohydrolase 1/tetrahydrobiopterin counteract ferroptosis through lipid remodeling[J]. ACS Cent Sci, 2020, 6(1):41-53.
[18] Magtanong L, Ko PJ, To M, et al. Exogenous monounsaturated fatty acids promote a ferroptosis-resistant cell state[J]. Cell Chem Biol, 2019, 26(3):420-432.
[19] Yang WS, Kim KJ, Gaschler MM, et al. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis[J]. Proc Natl Acad Sci U S A, 2016, 113(34):E4966-E4975.
[20] Chen X, Kang R, Kroemer G, et al. Broadening horizons: the role of ferroptosis in cancer[J]. Nat Rev Clin Oncol, 2021, 18(5):280-296.
[21] Lee H, Zandkarimi F, Zhang Y, et al. Energy-stress-mediated AMPK activation inhibits ferroptosis[J]. Nat Cell Biol, 2020, 22(2):225-234.
[22] Qin Y, Pei Z, Feng Z, et al. Oncogenic activation of YAP signaling sensitizes ferroptosis of hepatocellular carcinoma via ALOXE3-mediated lipid peroxidation accumulation[J]. Front Cell Dev Biol, 2021, 9:751593.
[23] Gonzalez-Riano C, Garcia A, Barbas C. Metabolomics studies in brain tissue: a review[J]. J Pharm Biomed Anal, 2016, 130:141-168.
[24] Niki E. Lipid oxidation that is, and is not, inhibited by vitamin E: consideration about physiological functions of vitamin E[J]. Free Radic Biol Med, 2021, 176:1-15.
[25] Dare LR, Garcia A, Soares CB, et al. The reversal of memory deficits in an Alzheimer's disease model using physical and cognitive exercise[J]. Front Behav Neurosci, 2020, 14:152.
[26] Wang J, Gu BJ, Masters CL, et al. A systemic view of Alzheimer disease-insights from amyloid-β metabolism beyond the brain[J]. Nat Rev Neurol, 2017, 13(10):612-623.
[27] Selkoe DJ, Hardy J. The amyloid hypothesis of Alzheimer's disease at 25 years[J]. EMBO Mol Med, 2016, 8(6):595-608.
[28] 张赫,郑焱. β淀粉样蛋白级联假说相关的阿尔茨海默病发病机制及防治策略研究进展[J]. 中国医学科学院学报, 2019, 41(5):702-708.
Zhang H, Zheng Y. β Amyloid hypothesis in Alzheimer's disease: pathogenesis, prevention, and management[J]. Acta Acad Med Sin, 2019, 41(5):702-708.
[29] Butterfield DA, Boyd-Kimball D. Oxidative stress, amyloid-β peptide, and altered key molecular pathways in the pathogenesis and progression of Alzheimer's disease[J]. J Alzheimers Dis, 2018, 62(3):1345-1367.
[30] García-Viñuales S, Sciacca MFM, Lanza V, et al. The interplay between lipid and Aβ amyloid homeostasis in Alzheimer's disease: risk factors and therapeutic opportunities[J]. Chem Phys Lipids, 2021,236:105072.
[31] Zhang H, Gao Y, Qiao PF, et al. PPAR-α agonist regulates amyloid-β generation via inhibiting BACE-1 activity in human neuroblastoma SH-SY5Y cells transfected with APPswe gene[J]. Mol Cell Biochem, 2015, 408(1/2):37-46.
[32] Plascencia-Villa G, Perry G. Preventive and therapeutic strategies in Alzheimer's disease: focus on oxidative stress, redox metals, and ferroptosis[J]. Antioxid Redox Signal, 2021, 34(8):591-610.
[33] Wegmann S, Biernat J, Mandelkow E. A current view on tau protein phosphorylation in Alzheimer's disease[J]. Curr Opin Neurobiol, 2021, 69:131-138.
[34] 周艳,储丹丹. 阿尔茨海默病中tau蛋白的病理改变与治疗策略[J]. 南通大学学报(医学版), 2021, 41(3):245-250.
Zhou Y, Chu DD. Pathological changes and therapeutic strategies of tau protein in Alzheimer's disease[J]. J Nantong Univ (Med Sci), 2021, 41(3):245-250.
[35] DeVos SL, Miller RL, Schoch KM, et al. Tau reduction prevents neuronal loss and reverses pathological tau deposition and seeding in mice with tauopathy[J]. Sci Transl Med, 2017, 9(374):eaag0481.
[36] Kawarabayashi T, Shoji M, Younkin LH, et al. Dimeric amyloid beta protein rapidly accumulates in lipid rafts followed by apolipoprotein E and phosphorylated tau accumulation in the Tg2576 mouse model of Alzheimer's disease[J]. J Neurosci, 2004, 24(15):3801-3809.
[37] King ME, Gamblin TC, Kuret J, et al. Differential assembly of human tau isoforms in the presence of arachidonic acid[J]. J Neurochem, 2000, 74(4):1749-1757.
[38] Bok E, Leem E, Lee BR, et al. Role of the lipid membrane and membrane proteins in tau pathology[J]. Front Cell Dev Biol, 2021, 9:653815.
[39] Wang L, Li N, Shi FX, et al. Upregulation of AMPK ameliorates Alzheimer's disease-like tau pathology and memory impairment[J]. Mol Neurobiol, 2020, 57(8):3349-3361.
[40] Li X, Zhang J, Li D, et al. Astrocytic ApoE reprograms neuronal cholesterol metabolism and histone-acetylation-mediated memory[J]. Neuron, 2021, 109(6):957-970.
[41] Bartels T, De Schepper S, Hong S. Microglia modulate neurodegeneration in Alzheimer's and Parkinson's diseases[J]. Science, 2020, 370(6512):66-69.
[42] Tolar M, Abushakra S, Hey JA, et al. Aducanumab, gantenerumab, BAN2401, and ALZ-801-the first wave of amyloid-targeting drugs for Alzheimer's disease with potential for near term approval[J]. Alzheimers Res Ther, 2020, 12(1):95.
[43] Peng W, Zhu Z, Yang Y, et al. N2L, a novel lipoic acid-niacin dimer, attenuates ferroptosis and decreases lipid peroxidation in HT22 cells[J]. Brain Res Bull, 2021, 174:250-259.
[44] Gao Y, Li J, Wu Q, et al. Tetrahydroxy stilbene glycoside ameliorates Alzheimer's disease in APP/PS1 mice via glutathione peroxidase related ferroptosis[J]. Int Immunopharmacol, 2021, 99:108002.
[45] Ates G, Goldberg J, Currais A, et al. CMS121, a fatty acid synthase inhibitor, protects against excess lipid peroxidation and inflammation and alleviates cognitive loss in a transgenic mouse model of Alzheimer's disease[J]. Redox Biol, 2020, 36:101648.
[46] Jiang Y, Guo Y, Lu D, et al. Tianma gouteng granules decreases the susceptibility of Parkinson’s disease by inhibiting ALOX15-mediated lipid peroxidation[J]. J Ethnopharmacol, 2020, 256:112824.
[47] Gao H, Zhang A, Yu J, et al. High-throughput lipidomics characterize key lipid molecules as potential therapeutic targets of Kaixinsan protects against Alzheimer's disease in APP/PS1 transgenic mice[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2018, 1092:286-295.
Lipid peroxidation in ferroptosis and its relationship with Alzheimer disease
LI Jia-ming, HAN Ya-qi, WU Tong, ZHANG Tian-ci, DONG Xian-hui△
(,,050091,)
Lipid peroxidation is one of the commonest pathological processes of Alzheimer disease (AD) and a key player in a novel form of regulated cell death named ferroptosis. The products of lipid peroxidation are considered as executors of ferroptosis. Recent studies reveal that signature proteins of ferroptosis and products of lipid peroxidation accumulate in AD brains. Peroxidation process also involves amyloid β-protein deposition and pathological hyperphosphorylation of tau protein. Therefore, lipid peroxidation mechanism of ferroptosis might play a role in AD progression. This review summarizes the recent progress in lipid peroxidation mechanism and its regulated axis of ferroptosis, collating evidences of the relationship between lipid peroxidation and characteristic pathological processes of AD.
Ferroptosis; Lipid peroxidation; Alzheimer disease; Polyunsaturated fatty acid
R749.1+6; R363
A
10.3969/j.issn.1000-4718.2022.06.023
1000-4718(2022)06-1142-06
2022-03-21
2022-05-09
国家自然科学基金资助项目(No. 81803935);河北省自然科学基金资助项目(No. H2019423095);河北省中医药管理局课题(No. 2022085);河北省卫健委重点科技研究计划(No. 20200129)
Tel: 0311-89926252; E-mail: dongxianhuitj@126.com
(责任编辑:宋延君,罗森)

