醛缩酶B在果糖耐受与血糖稳态中的作用研究*
冯滢樱, 史亚男, 麻献华, 陈玉霞, 章卫平,△
醛缩酶B在果糖耐受与血糖稳态中的作用研究*
冯滢樱1, 史亚男1, 麻献华2, 陈玉霞2, 章卫平1,2△
(1天津医科大学朱宪彝纪念医院,天津市内分泌研究所,国家卫健委激素与发育重点实验室,天津市代谢性疾病重点实验室,天津 300134;2海军军医大学病理生理学教研室,上海 200433)
建立全身性醛缩酶B(aldolase B,)基因敲除小鼠模型,探讨基因缺陷对小鼠果糖耐受和血糖稳态的影响。利用敲除优先策略和胚胎干细胞基因打靶技术,建立全身性基因敲除小鼠模型,并通过Western blot验证敲除效果;监测普食喂养小鼠生长发育过程中的体重、体长、血糖和血脂水平;检测果糖灌胃前后小鼠血糖及血浆天冬氨酸转氨酶(aspartate aminotransferase, AST)和丙氨酸转氨酶(alanine aminotransferase, ALT)水平,取材分析肝、肾等器官的大小及形态学变化。缺陷小鼠普食喂养时出现生长迟滞和低血糖;果糖灌胃后血糖呈降低趋势,血浆AST和ALT水平升高,并伴有肝肾肿大和肝脏病理性损伤。Aldob在维持小鼠生长、血糖稳态和果糖耐受性中发挥重要作用。
醛缩酶B;基因敲除;生长发育;果糖耐受;血糖稳态
体内的果糖主要从膳食中摄入,少量由山梨醇途径产生。果糖摄入过量与肥胖、糖尿病和非酒精性肝病等代谢性疾病的发生发展密切相关[1-3]。内源性果糖产生过多也参与代谢性疾病的病理生理过程[4]。醛缩酶B(aldolase B, Aldob)是介导果糖分解代谢的关键酶,主要负责催化1-磷酸果糖(fructose-1-phosphate, F-1-P)裂解为磷酸二羟丙酮和甘油醛。Aldob在肝脏、肾脏以及小肠组织中高表达,其表达水平受激素和营养因素的影响,是转录因子碳水化合物反应元件结合蛋白(carbohydrate response element-binding protein, ChREBP)的直接靶基因[5-7]。
人基因突变可导致遗传性果糖不耐受(hereditary fructose intolerance, HFI),属于常染色体隐性遗传病,患者主要表现为果糖摄入后恶心、呕吐、腹痛、黄疸等症状,哺乳期患儿还可出现低血糖、昏迷和肝肾衰竭,严重时可危及生命,其机制推测与F-1-P积聚、糖原分解和葡糖异生功能障碍有关[8-9]。为深入探讨缺陷的病理学意义及其相关机制,我们建立了基因敲除小鼠模型,并重点观察了缺失对小鼠个体生长、糖代谢和果糖耐受性的影响。
材料和方法
1 材料
基于敲除优先(knockout first, KF)基因打靶策略建立含Aldob等位基因的胚胎干细胞(embryonic stem cell, ESC),克隆号为EPD0830-3-H05,从剑桥-苏大基因组资源中心获得,并委托该中心进行囊胚注射,获得杂合子小鼠(Aldob)。Aldob等位基因由于第2个内含子中插入报告基因和新霉素抗性基因()而失活;和基因可通过FLP介导的FRT同源重组而被剔除。Aldob小鼠引入后经交配获得全身性敲除(knockout, KO)的纯合子小鼠Aldob;用同窝同性别野生型(wild-type, WT)小鼠作为对照。小鼠饲养于SPF级动物房,环境温度25 ℃,湿度40%~70%,12 h光照/12 h黑暗。幼鼠于4周龄离乳,此后给予普通饲料喂养。
2 方法
2.1PCR基因型鉴定用蛋白酶K消化法提取鼠尾基因组DNA,并进行PCR基因型鉴定[10]。野生等位基因的PCR扩增引物为5'-GTTTGGACCTGCTGCTAAGGAGAAT-3'(正义链)和5'-GCCAGCCAGTGCTATACTGTTGTCT-3'(反义链),AldobF等位基因的扩增引物为5'-GTTTGGACCTGCTGCTAAGGAGAAT-3'(正义链)和5'-ACTGACCTTGGGCAAGAACATAAAG-3'(反义链);其扩增产物分别为475 bp和329 bp。PCR扩增条件为:95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,35个循环。
2.2血生化检测随机血糖于上午10~11点尾尖采血,用血糖仪检测。采血过程中尽量保持周围环境安静,避免刺激小鼠。血浆甘油三酯用Sigma生化检测试剂盒检测。肝脏甘油三酯含量经丙酮提取后测定,并用肝重进行标化[6]。肝脏糖原经提取后用BioAssay Systems的试剂盒测定[7]。血浆天冬氨酸转氨酶(aspartate aminotransferase, AST)和丙氨酸转氨酶(alanine aminotransferase, ALT)活性用全自动生化仪(Mindray BS-240)检测。
2.3果糖耐受性试验及组织取材7周龄成年小鼠禁食4 h后尾尖采血,用血糖仪检测空腹血糖,然后在清醒状态下给与30%果糖水灌胃(2 mg/g体重),于灌胃后15 min、30 min、60 min检测血糖水平。小鼠经4%水合氯醛麻醉后,眼眶抗凝采血,离心后留取血浆于-80 ℃保存;留取部分肝脏、肾脏及空肠,经液氮速冻后保存于-80 ℃,并留取部分组织经4%多聚甲醛固定后石蜡包埋,进行形态学分析。
2.4Western blot干冰上取10~20 mg组织,加入尿素裂解液(25 mmol/L Tris-HCl, 8 mol/L尿素, 1% SDS, 1 mmol/L EDTA, 0.7 mol/L DTT, pH 7.4)后进行低温匀浆,离心收集裂解液上清[11];并加入上样缓冲液进行SDS-PAGE,随后冰上进行转膜。转膜结束后将PVDF膜用5%的脱脂牛奶室温封闭1 h。用抗Aldob兔多克隆抗体或抗β-actin小鼠单克隆抗体(Proteintech)孵育过夜(抗体稀释比例为1∶5 000),TBST缓冲液漂洗3遍,分别加入辣根过氧化物酶标记的羊抗兔或羊抗小鼠(Jackson)多克隆抗体(抗体稀释比例为1∶5 000),室温孵育1 h,TBST缓冲液漂洗3遍,加入化学发光ECL试剂(Pierce)显影后,用LAS-4000化学发光检测仪(Fuji)进行曝光。
2.5HE染色取小鼠肝脏组织用4%多聚甲醛溶液进行固定,脱水包埋后于4 ℃保存。脱腊后,使用苏木精染核5 min,随后ddH2O冲洗,用0.1%氨水碱化10 s后再次ddH2O冲洗,随后浸入95%乙醇1 min后,用伊红细胞染色2 min,再依次浸入95%乙醇、无水乙醇、二甲苯,各2次,每次1 min。封片后进行显微镜拍照。
3 统计学处理
数据处理及作图采用GraphPad软件。数据以均数±标准误(mean±SEM)来表示。实验数据统计推断采用配对检验。以<0.05为差异有统计学意义。
结果
1 全身性Aldob基因敲除小鼠模型的建立
利用KF策略,首先获得携带插入失活Aldob等位基因的杂合子小鼠(图1A)。经杂合子小鼠获得Aldob纯合子,即全身性基因敲除小鼠。小鼠基因型通过基因组的PCR分析进行鉴定(图1B)。Western blot结果显示,Aldob蛋白在WT小鼠的肝脏和空肠组织中表达,而在KO小鼠组织中则完全消失(图1C),表明成功建立了全身性基因敲除小鼠模型。
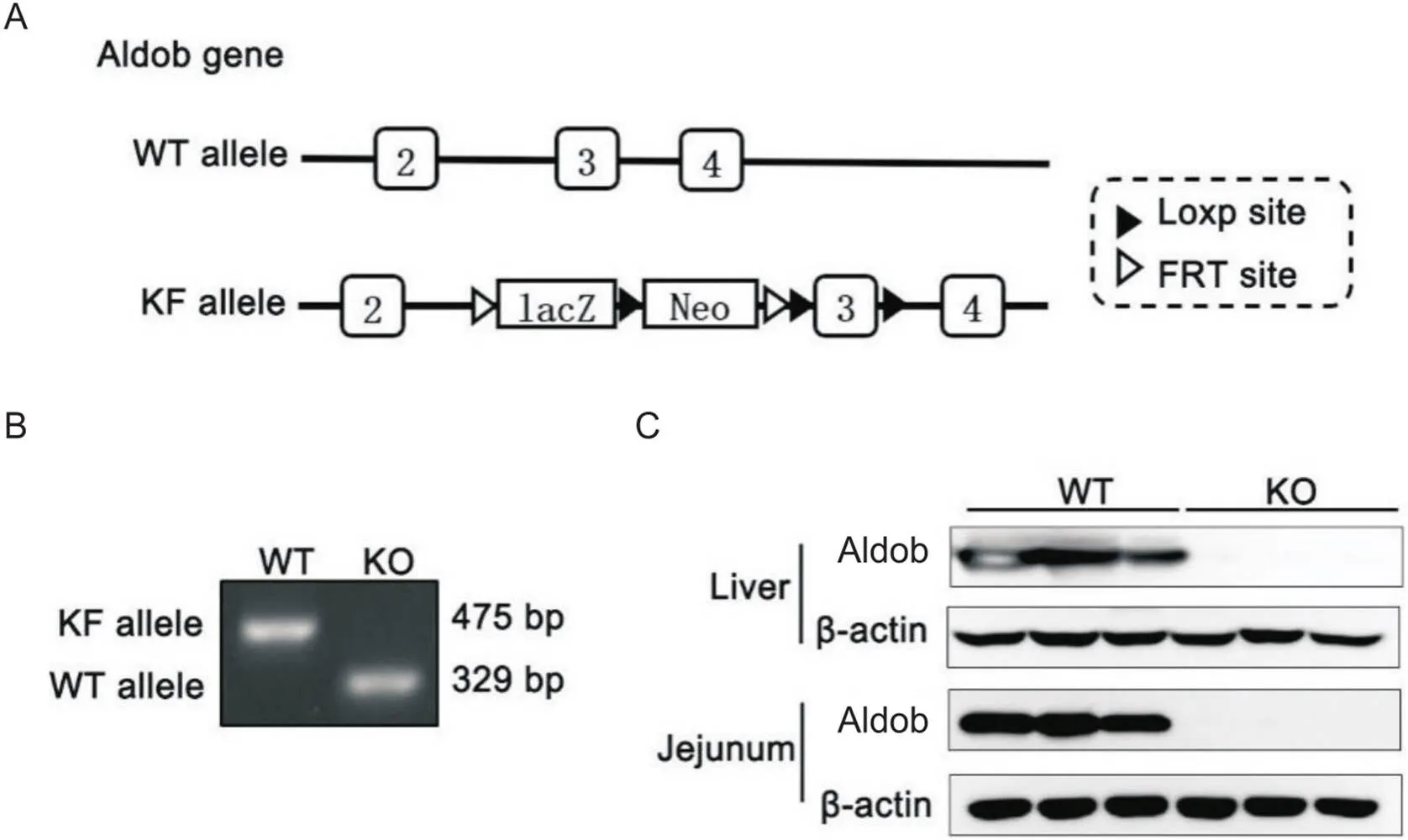
Figure 1. Generation of the global Aldob gene knockout mouse model. A: schematic demonstration for the generation of Aldob gene knockout mouse model; B: representative demonstration for PCR-based genotyping with tail genomic DNA; C: Western blot analysis for Aldob protein expression in the liver and jejunum.
2 Aldob基因敲除导致小鼠生长迟缓和低血糖
为观察缺陷对小鼠生长发育的影响,我们从哺乳期开始动态监测了小鼠体重的变化。与同窝野生对照相比,哺乳期3周龄的KO幼鼠体重即明显降低;幼鼠于4周龄离乳后给予普通饲料喂养,对照小鼠体重呈现快速增长趋势,而KO小鼠体重并没有显著增加(图2A),鼻肛间体长也显著变短(图2B);至8周龄成年时体重基本维持在7 g以下,仅为对照小鼠的1/3左右(图2C)。这表明缺陷小鼠生长严重迟滞。
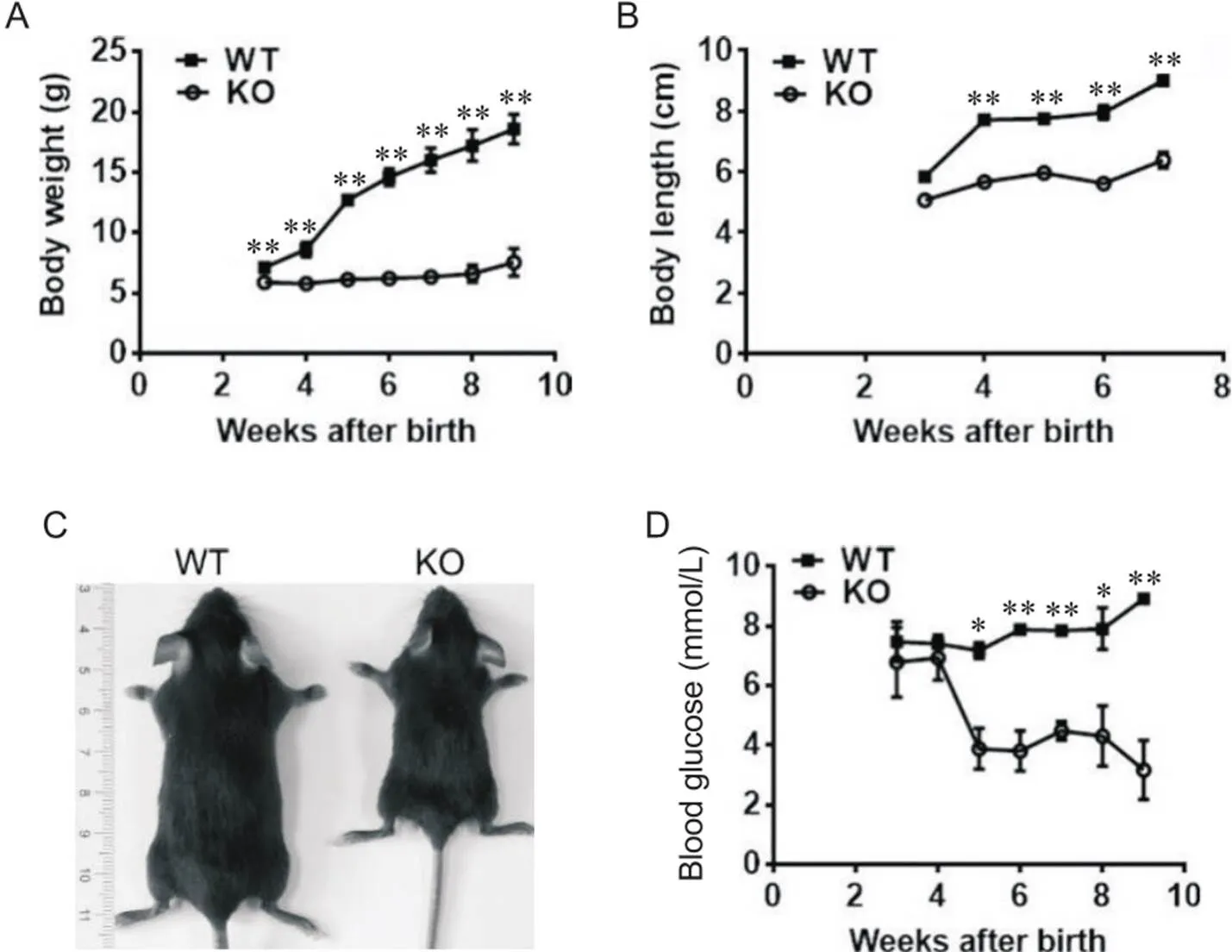
Figure 2. The chow-fed Aldob-null mice exhibited growth retardation and hypoglycemia. A: body weight; B: body length; C: representative mouse photo at 6 weeks of age; D: blood glucose level under the fed condition. Mean±SEM. n=4. *P<0.05,**P<0.01 vs WT group.
为分析敲除小鼠生长迟滞的可能原因,我们检测了小鼠糖脂代谢稳态的变化。结果显示,离乳前的3~4周龄KO小鼠随机血糖维持在5~8 mmol/L,与WT对照小鼠相比无显著差异;然而在离乳后的5~8周龄,KO小鼠表现为持续性严重低血糖,随机血糖水平维持在4 mmol/L左右,仅为对照小鼠的一半,甚至更低(图2D)。饥饿4 h后取材分析结果显示,成年KO小鼠的空腹血糖明显低于对照组,两组小鼠的肝糖原均未检测到,血浆和肝脏甘油三酯水平无显著差异,KO小鼠的血浆ALT和AST水平显著升高(表1),提示存在肝损伤。这些结果提示离乳后的低血糖可能与KO小鼠生长迟滞有关。
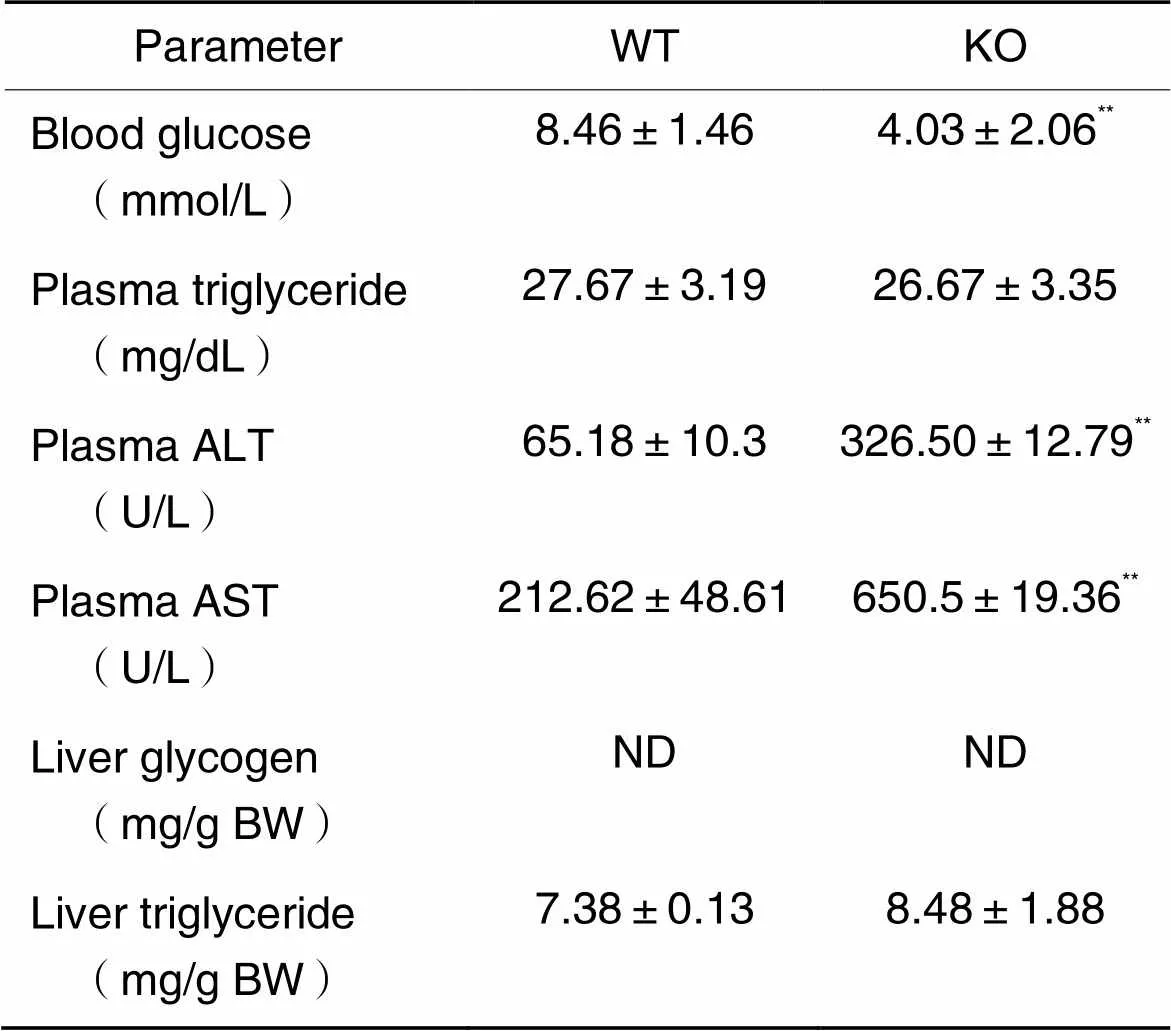
表1 普食成年小鼠饥饿4 h后血和肝脏指标
BW: body weight; ND: undetected.**<0.01WT group.
3 Aldob基因敲除导致小鼠对果糖不耐受
我们进一步分析了缺陷对成年小鼠果糖耐受性的影响。如图3A所示,对照小鼠在经果糖水灌胃后15 min血葡萄糖水平明显升高,提示果糖经肠道吸收后,经葡糖异生为葡萄糖;而KO小鼠在果糖灌胃后血糖反而呈下降趋势,部分KO小鼠在果糖灌胃后90 min内死亡,提示其对果糖不耐受。生化分析显示,灌果糖水后的KO小鼠血浆AST和ALT水平进一步升高,远高于WT小鼠(图3B),提示果糖负荷进一步加重KO小鼠的肝损伤。与WT小鼠相比,KO小鼠肝和肾的外表失去正常鲜红色,略发黄(图4A),绝对重量有降低趋势,但差异无统计学意义(图4B),经体重标化后的肝体重比和肾体重比均明显增加(图4C),提示存在肝肾肿大;HE染色显示,KO小鼠肝小叶结构紊乱,肝索结构破坏,局部病灶炎症细胞浸润(图4D);生化分析显示,肝糖原含量[WT:(21.16±6.12) mg/g BW; KO:(22.5±5.71) mg/g BW]和肝甘油三酯含量[WT:(15.13±3.8) mg/g BW; KO:(19.63±10.27) mg/g BW]均无显著变化。上述结果表明缺陷导致小鼠对果糖不耐受。
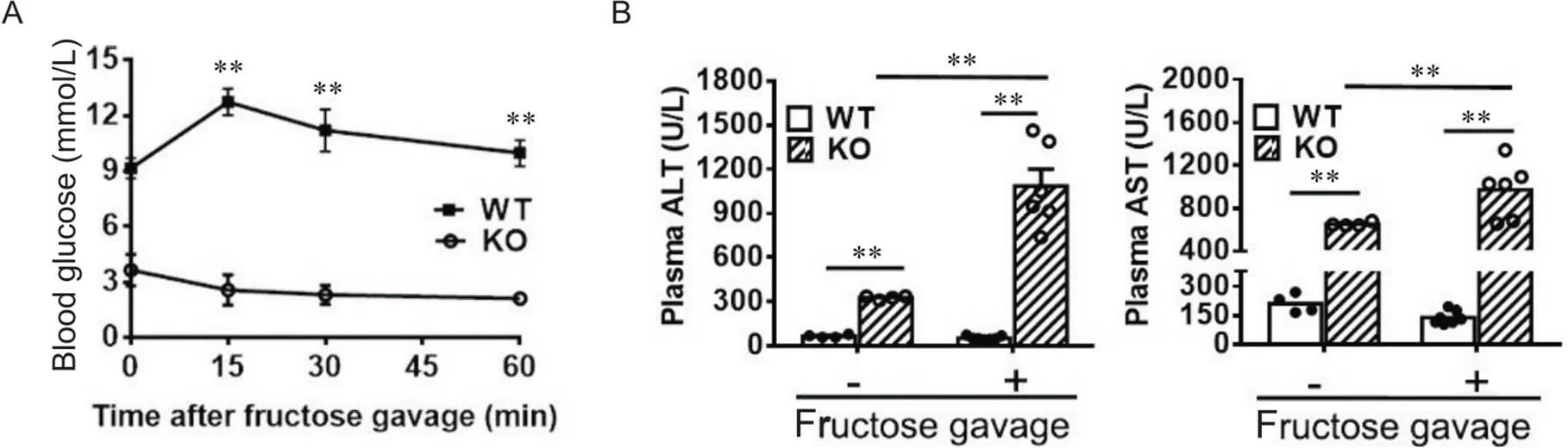
Figure 3. Aldob-null mice were fructose intolerant. Seven-week-old male mice were challenged with fructose by gavage, and sacrificed 60 min later. A: blood glucose level; B: plasma ALT and AST levels. Mean±SEM. n=4~5. **P<0.01.
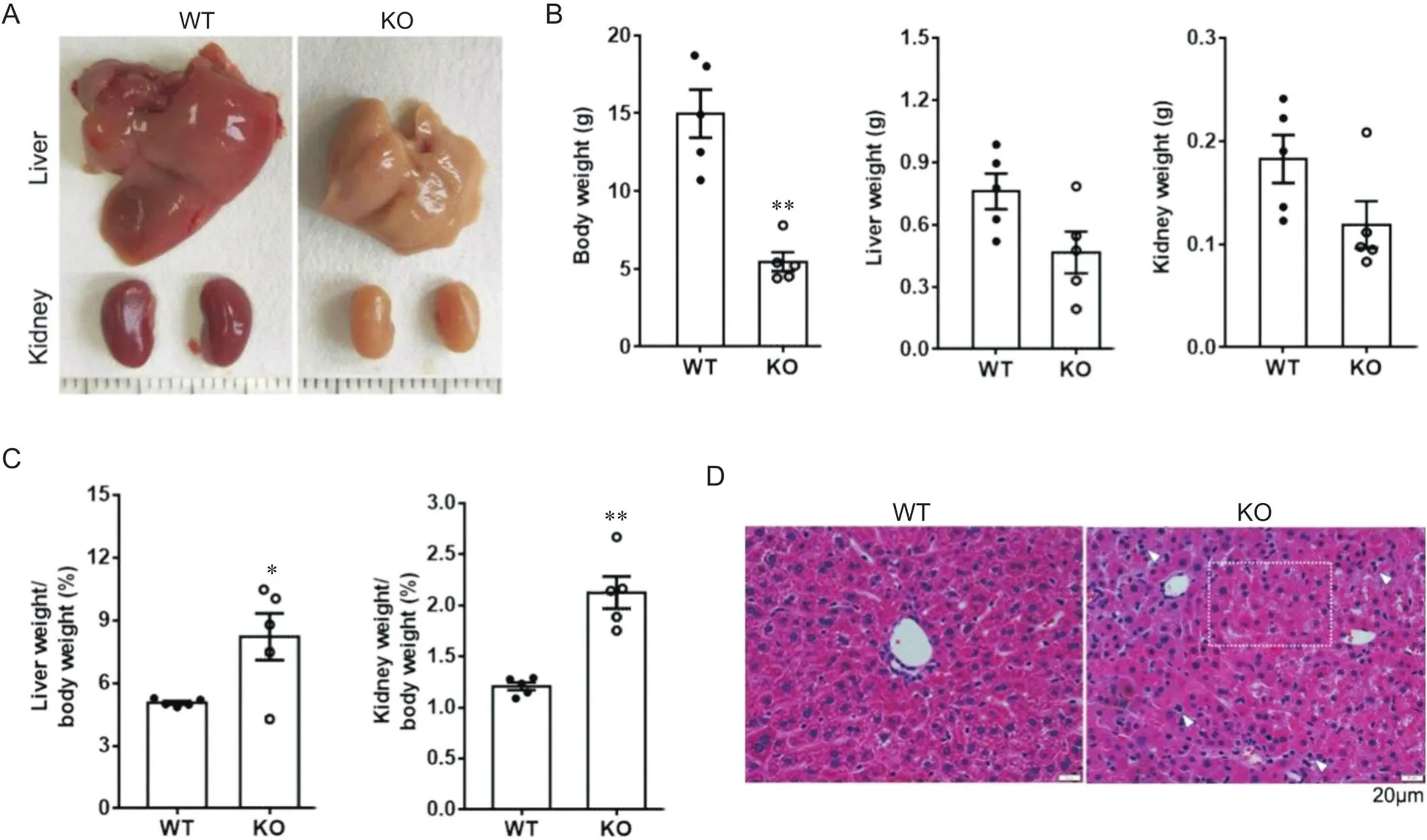
Figure 4. Pathological changes of the liver and kidney in Aldob-null mice after fructose challenge. A: the photos of the liver and kidney; B: body and organ weight; C: the ratio of liver or kidney weight to body weight; D: the representative images of HE staining for the liver, with the pathological change indicated by dotted box, and inflammatory cell infiltration indicated by white arrow heads. Mean±SEM. n=5. *P<0.05,**P<0.01 vs WT group.
讨论
本研究建立了全身性基因敲除小鼠,发现缺陷小鼠在普食喂养过程中出现严重的生长迟滞和低血糖,并且对果糖不耐受,这些表型特征与HFI患儿的临床表现相符[12],表明该小鼠模型对研究HFI致病机制具有应用价值。既往文献中发现基因敲除幼鼠在离乳时体重有下降的趋势,离乳后在无果糖饲料喂养时体重基本恢复正常,但没有交代离乳后普食喂养时小鼠生长发育的变化[8]。我们发现,缺陷不仅导致哺乳期幼鼠体重明显低于同窝对照,而且在离乳后普食喂养时生长严重迟滞,推测该表型可能与普通饲料中含有微量的果糖有关,提示生长发育期的缺陷幼鼠对果糖的病理损伤作用非常敏感,因此HFI患儿生长发育迟滞也可能与果糖暴露有关。除膳食果糖暴露以外,鉴于机体尤其在大量摄入碳水化合物时可产生内源性果糖[4],内源性果糖暴露也需引起重视。值得注意的是,敲除小鼠在生长发育期就表现为严重低血糖,这可能是导致其生长发育障碍的部分原因,但是3~4周龄敲除幼鼠在血糖还基本正常时就出现体重下降的表型,提示低血糖以外的原因可能在生长发育障碍中发挥了重要作用。因此,该小鼠模型的建立为进一步深入研究缺陷影响生长发育的细胞分子机制提供了重要手段。
我们的结果也证实了在果糖代谢中的重要作用。既往研究显示缺陷小鼠在高果糖饮食条件下可出现严重肝损伤,甚至死亡[8]。我们发现普食喂养的成年敲除小鼠在给与一次性果糖负荷后,血糖呈下降趋势,并可在90 min内导致小鼠死亡,表明其果糖代谢存在明显障碍。高剂量的果糖经肠道上皮Glut5转运子吸收后,一方面可激活肠道ChREBP通路和果糖吸收能力,通过葡糖异生途径直接在小肠上皮细胞中转化为葡萄糖吸收入血[13],而肠道ChREBP也可通过果糖反应性激活小肠上皮细胞表达Glut5[14];另一方面经门静脉吸收的果糖在肝脏和肾脏中通过葡糖异生产生葡萄糖,从而导致血糖升高[15-16]。Aldob是介导F-1-P裂解的唯一醛缩酶,其缺陷导致F-1-P的大量蓄积,造成细胞毒性和肝损伤。我们观察到的血浆转氨酶ALT和AST水平升高也得到了证实。尽管糖原过度蓄积也可能导致果糖代谢应激相关的肝脏损伤[7],我们在果糖负荷的敲除小鼠肝脏中并未检测到糖原含量升高。缺陷小鼠在高果糖喂养时可出现脂肪肝[8],我们观察到少部分敲除小鼠在普食喂养时也会出现脂肪肝和肝损伤。我们推测普食喂养时敲除小鼠的肝损伤和生长迟滞可能主要与细胞内F-1-P蓄积有关,而抑制其体内F-1-P的产生可望缓解果糖导致的细胞毒作用[17]。
鉴于体内果糖代谢涉及肠道、肝脏和肾脏等多个器官,阐明缺陷导致果糖代谢障碍的细胞分子机制无疑需要利用其组织特异性敲除小鼠模型。我们利用敲除优先策略构建的Aldob小鼠可通过与FLP转基因小鼠交配[18],获得Aldob小鼠及后续的条件基因打靶研究。另外,Aldob等位基因携带LacZ报告基因,可直接通过X-Gal染色检测启动子活性,间接分析基因在果糖代谢中的时空表达激活特征。此外,近年来发现Aldob及其介导的果糖代谢与结肠癌、肝癌等恶性肿瘤的发生发展密切相关[19-20],我们所获得的Aldob小鼠在肿瘤研究中也具有潜在的应用价值。
总之,我们成功建立了基因敲除小鼠模型,研究发现Aldob是维持小鼠在普食环境下的正常生长发育、糖脂代谢稳态和果糖耐受性所必需的,为进一步深入研究其细胞分子机制奠定了基础。
[1] Herman MA, Birnbaum MJ. Molecular aspects of fructose metabolism and metabolic disease[J]. Cell Metab, 2021, 33(12):2329-2354.
[2] Shi YN, Liu YJ, Xie Z, et al. Fructose and metabolic diseases: too much to be good[J]. Chin Med J (Engl), 2021, 134(11):1276-1285.
[3] Febbraio MA, Karin M. "Sweet death": fructose as a metabolic toxin that targets the gut-liver axis[J]. Cell Metab, 2021, 33(12):2316-2328.
[4] Lanaspa MA, Ishimoto T, LI N, et al. Endogenous fructose production and metabolism in the liver contributes to the development of metabolic syndrome[J]. Nat Commun, 2013, 4:2434.
[5] Iizuka K, Bruick RK, Liang G, et al. Deficiency of carbohydrate response element-binding protein (ChREBP) reduces lipogenesis as well as glycolysis[J]. Proc Natl Acad Sci U S A, 2004, 101(19):7281-7286.
[6] Liu G, Zhou L, Zhang H, et al. Regulation of hepatic lipogenesis by the zinc finger protein Zbtb20[J]. Nat Commun, 2017, 8:14824.
[7] Shi JH, Lu JY, Chen HY, et al. Liver ChREBP protects against fructose-induced glycogenic hepatotoxicity by regulating L-type pyruvate kinase[J]. Diabetes, 2020, 69(4):591-602.
[8] Oppelt SA, Sennott EM, Tolan DR. Aldolase-B knockout in mice phenocopies hereditary fructose intolerance in humans[J]. Mol Genet Metab, 2015, 114(3):445-450.
[9] Pinheiro FC, Sperb-ludwig F, Schwartz IV D. Epidemiological aspects of hereditary fructose intolerance: a database study[J]. Hum Mutat, 2021, 42(12):1548-1566.
[10] Xie Z, Zhang H, Tsai W, et al. Zinc finger protein ZBTB20 is a key repressor of alpha-fetoprotein gene transcription in liver[J]. Proc Natl Acad Sci U S A, 2008, 105(31):10859-10864.
[11] Wei C, Ma X, Su K, et al. ChREBP-β regulates thermogenesis in brown adipose tissue[J]. J Endocrinol, 2020, 245(3):343-356.
[12] Baerlocher K, Gitzelmann R, Steinmann B, et al. Hereditary fructose intolerance in early childhood: a major diagnostic challenge. Survey of 20 symptomatic cases[J]. Helv Paediatr Acta, 1978, 33(6):465-487.
[13] 张晶,李昊,师建辉,等. 果糖与代谢性疾病[J]. 中国病理生理杂志, 2020, 36(4):735-740.
Zhang J, Li H, Shi JH, et al. Fructose and metabolic diseases[J]. Chin J Pathophysiol, 2020, 36(4):735-740.
[14] 张晶,陆俊宇,闫学德,等. 肠道ChREBP缺陷导致小鼠对果糖不耐受[J]. 中国病理生理杂志. 2021, 37(4):586-592.
Zhang J, Lu JY, Yan XD, et al. Fructose intolerance induced by intestinal ChREBP deficiency in mice[J]. Chin J Pathophysiol, 2021, 37(4):586-592.
[15] Jang C, Hui S, Lu W, et al. The small intestine converts dietary fructose into glucose and organic acids[J]. Cell Metab, 2018, 27(2):351-361.
[16] Kim M, Astapova II, Flier SN, et al. Intestinal, but not hepatic, ChREBP is required for fructose tolerance[J]. JCI Insight, 2017, 2(24):e96703.
[17] Lanaspa MA, Andres-hernando A, Orlicky DJ, et al. Ketohexokinase C blockade ameliorates fructose-induced metabolic dysfunction in fructose-sensitive mice[J]. J Clin Invest, 2018, 128(6):2226-2238.
[18] Rodriguez CI, Buchholz F, Galloway J, et al. High-efficiency deleter mice show that FLPe is an alternative to Cre-loxP[J]. Nat Genet, 2000, 25(2):139-140.
[19] Bu P, Chen KY, Xiang K, et al. Aldolase B-mediated fructose metabolism drives metabolic reprogramming of colon cancer liver metastasis[J]. Cell Metab, 2018, 27(6):1249-1262.
[20] Li M, He X, Guo W, et al. Aldolase B suppresses hepatocellular carcinogenesis by inhibiting G6PD and pentose phosphate pathways[J]. Nat Cancer, 2020, 1(7):735-747.
Role of aldolase B in fructose tolerance and glucose homeostasis in mice
FENG Ying-ying1, SHI Ya-nan1, MA Xian-hua2, CHEN Yu-xia2, ZHANG Wei-ping1,2△
(1,,,300134,;2,,200433,)
To generate a mouse model of global aldolase B () gene knockout, and to examine its phenotypes of glucose homeostasis and fructose tolerance.The knockout-first gene targeting strategy was used to generategene knockout mice, and the deletion efficiency was verified by Western blot. The chow-fed mice were dynamically monitored for the body weight and blood glucose level. After fructose challenge by gavage, the changes of blood glucose and plasma aspartate aminotransferase (AST) and alanine aminotransferase (ALT) levels were biochemically analyzed, and the liver and kidney were examined for the mass and morphological alterations.Theknockout mice showed a complete loss of Aldob protein in the liver and jejunum, and exhibited severe growth retardation and hypoglycemia on chow diet. Adult-null mice were intolerant to fructose challenge, as manifested by decreased blood glucose level as well as elevated plasma AST and ALT levels, and even lethality. The mutant mice had enlarged liver and kidney as well as overt liver injury.The Aldob is required for the growth, glucose homeostasis and fructose tolerance in mice.
Aldolase B; Gene knockout; Growth and development; Fructose tolerance; Glucose homeostasis
Q591.4; R363.2
A
10.3969/j.issn.1000-4718.2022.06.011
1000-4718(2022)06-1040-06
2022-05-05
2022-06-02
国家自然科学基金重大研究计划(No. 91857203)
Tel: 021-81871018; E-mail: zhangwp@tmu.edu.cn
(责任编辑:余小慧,李淑媛)

