硫氢化钠通过抑制经典细胞焦亡信号通路减轻巨噬细胞焦亡*
张旭琳, 田香勤, 贾珍丽, 刘博蔚, 梁高远, 张子辰, 李玲△, 张亮,△
硫氢化钠通过抑制经典细胞焦亡信号通路减轻巨噬细胞焦亡*
张旭琳1, 田香勤2,3▲, 贾珍丽1, 刘博蔚1, 梁高远1, 张子辰1, 李玲1△, 张亮1,2△
(1石河子大学新疆地方与民族高发病教育部重点实验室,新疆 石河子 832003;2国家卫生健康委中亚高发病防治重点实验室,新疆 石河子 832008;3新乡医学院,河南 新乡 453003)
:探讨硫化氢(hydrogen sulfide, H2S)供体硫氢化钠(sodium hydrosulfide, NaHS)对巨噬细胞焦亡的作用。人髓系白血病单核细胞THP-1经佛波酯刺激并分化为巨噬细胞后,采用不同浓度的氧化低密度脂蛋白(oxidized low-density lipoprotein, ox-LDL)和NaHS对其进行干预,并分为空白对照组、ox-LDL刺激组和NaHS+ox-LDL干预组。采用CCK-8法检测THP-1巨噬细胞活力;采用油红O染色和光镜分别观察THP-1巨噬细胞脂质蓄积和焦亡细胞形态;采用Hoechst 33342/碘化丙啶(propidium iodide, PI)荧光染色和乳酸脱氢酶(lactate dehydrogenase, LDH)活性检测评估细胞焦亡程度;采用H2S检测试剂盒测定细胞内的H2S水平;采用试剂盒测定细胞中的caspase-1活性;采用Western blot分析细胞中焦亡关键蛋白的表达水平。与空白对照组相比,ox-LDL(100和150 mg/L)可显著增加THP-1巨噬细胞中的PI阳性细胞比例、LDH释放、caspase-1活性以及核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)、caspase-1 (p20)、gasdermin D(GSDMD)、GSDMD-N和IL-18的蛋白表达(<0.05或<0.01),且ox-LDL(100 mg/L)可使THP-1巨噬细胞出现明显脂质沉积和典型的细胞焦亡形态。而NaHS(100和200 μmol/L)干预则可显著改善巨噬细胞的脂质沉积和焦亡,并可抑制ox-LDL诱导的caspase-1活性增加及焦亡信号通路关键蛋白的表达上调(<0.05或<0.01)。H2S供体NaHS可通过抑制经典焦亡信号通路而减轻ox-LDL诱导的巨噬细胞焦亡。
硫化氢;氧化低密度脂蛋白;巨噬细胞;细胞焦亡
细胞焦亡作为机体应对病原微生物感染和细胞应激的一种促炎性细胞程序性死亡,其最初发现于巨噬细胞[1-3]。研究表明巨噬细胞的适度焦亡是各种传染性、自身免疫性和炎症性疾病发病过程中的重要先天免疫应答机制,且其有利于宿主通过招募各种免疫细胞以清除病原体或修复受损组织,并增强宿主细胞的免疫防御反应[2,4-5]。然而,免疫稳态失衡引起的由核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)/胱天蛋白酶1(caspase-1)/消皮素 D(gasdermin D, GSDMD)介导的经典焦亡信号通路的过度激活及巨噬细胞的过度焦亡则可加剧组织损伤及自身免疫性或炎症性疾病的发生发展[2,6]。目前研究已证实血管内膜下的泡沫巨噬细胞焦亡在炎症性血管疾病——动脉粥样硬化(atherosclerosis, AS)的发病过程中发挥着关键作用,泡沫巨噬细胞焦亡可造成AS斑块中脂质坏死核心的形成扩大、AS斑块的不稳定性,以及动脉血栓的形成[7-9]。而细胞焦亡信号通路中关键蛋白的药理特异性阻断和基因缺失则可有效缓解巨噬细胞焦亡及AS斑块的形成病变[10-13],因此,细胞焦亡中涉及的关键分子可为防治AS提供新思路和新靶点。
硫化氢(hydrogen sulfide, H2S)作为一种继一氧化氮和一氧化碳之后的新型气体信号分子,其供体药物在心血管疾病治疗中具有重要的应用价值[14],但H2S对AS发病中巨噬细胞焦亡的作用尚不明确。在本研究中,我们采用AS发病危险因素——氧化低密度脂蛋白(oxidized low-density lipoprotein, ox-LDL)刺激人髓系白血病单核细胞系THP-1起源的巨噬细胞,构建泡沫巨噬细胞焦亡模型,旨在探讨外源性H2S供体硫氢化钠(sodium hydrosulfide, NaHS)对泡沫巨噬细胞焦亡的调节作用。
材料和方法
1 材料
1.1 细胞 人髓系白血病单核细胞THP-1购自ATCC。
1.2 药物和试剂 THP-1细胞专用培养液购自Procell;佛波酯(phorbol 12-myristate 13-acetate, PMA)和细胞蛋白抽提试剂盒购自Solarbio;ox-LDL购自Yiyuan Biotechnology;NaHS购自Sigma;CCK-8试剂购自Dojindo;Hoechst 33342/PI荧光染料及乳酸脱氢酶(lactate dehydrogenase, LDH)试剂盒购自南京建成生物工程研究所;caspase-1活性测定试剂盒购Beyotime;小鼠抗人β-actin抗体和Ⅱ抗(包括辣根过氧化物酶标记的山羊抗兔和山羊抗小鼠抗体)均购自北京中杉金桥生物技术有限公司;兔抗人NLRP3、pro-caspase-1和GSDMD抗体购自Abcam;GSDMD-N抗体购自Cell Signaling Technology;兔抗人caspase-1 (p20)抗体和IL-18抗体购自Proteintech;化学发光试剂盒和PVDF膜购自Millipore。
1.3主要仪器设备细胞培养箱(赛默飞世尔公司);荧光显微镜(奥林巴斯公司);低温高速离心机(赛默飞世尔公司);酶标仪(赛默飞世尔公司);电泳仪和转膜仪(北京六一生物科技有限公司)。
2 方法
2.1细胞培养将THP-1细胞以1×109L-1接种于含THP-1专用培养液[RPMI-1640、10%胎牛血清、0.05 mmol/L β-巯基乙醇和1%双抗(1×105U/L青霉素和100 mg/L链霉素)]的细胞培养瓶置于CO2培养箱(37 ℃饱和湿度环境、5% CO2)中培养,待细胞密度为3×108~2×109L-1时进行传代铺板,并进行后续药物干预实验。
2.2药物干预与实验分组将THP-1细胞接种于含1%胎牛血清培养液的细胞培养板中,使用浓度为100 μg/L PMA处理THP-1细胞24 h,以诱导单核细胞分化为巨噬细胞。将细胞密度调整为1×108~2×109L-1之后使用ox-LDL或/和NaHS对THP-1细胞进行处理,并分为以下3组:(1)空白对照组:正常THP-1细胞培养液培养THP-1巨噬细胞24 h;(2)ox-LDL处理组:根据文献[15]采用终浓度为25、50、100和150 mg/L的ox-LDL处理THP-1巨噬细胞24 h;(3)NaHS+ox-LDL干预组:根据文献[16]采用50、100和200 μmol/L NaHS预处理THP-1巨噬细胞30 min,再加入ox-LDL(100 mg/L)后培养细胞24 h。
2.3细胞活性检测PMA诱导分化的THP-1巨噬细胞(每孔1×104细胞)经不同浓度NaHS(0、50、100、200和400 μmol/L)干预24 h后向各孔加入100 µL含CCK-8溶液(体积比10%)的基础培养液,在37 ℃条件下孵育1~3 h后用酶标仪测定各孔在450 nm波长处的吸光度。最后参照CCK-8试剂盒中的公式计算细胞的相对活力。
2.4Hoechst 33342/PI染色Hoechst 33342是具有一定细胞膜通透性的荧光染料,能进入正常细胞中与DNA结合使细胞染上深蓝色荧光;PI是一种DNA结合性染料,不能透过正常完整的细胞膜,但当细胞焦亡形成膜穿孔时可进入细胞内使其染上红色荧光。本实验参照文献[17]中的方法检测各组细胞在3个随机视野下的PI阳性染色的细胞数目,并根据公式PI阳性染色的细胞比例(%)=PI阳性染色细胞数/细胞总数×100%计算分析各组细胞焦亡情况。
2.5LDH释放测定参照文献[18]使用LDH活性检测试剂盒于450 nm波长测定各组细胞培养液上清的吸光度(),并根据公式LDH活性(U/L)=(测定孔值-对照孔值)/(标准孔值-标准对照孔值)×0.2×1 000,计算出培养液上清中的LDH活性。
2.6油红O染色THP-1巨噬细胞经指定药物干预24 h后,用PBS漂洗3次后于4%多聚甲醛溶液中固定15 min;随后经PBS漂洗后于37 ℃条件下用油红O染液染色10 min;再经双蒸水漂洗后用苏木素复染2 min;最后经双蒸水冲洗分色返蓝后甘油封片,并于显微镜下观察拍照。
2.7H2S含量测定胰酶消化收集经特定药物干预处理24 h后的细胞,并向其中加入600 μL磷酸缓冲液(pH 6.8)裂解匀浆,随后采用H2S检测试剂盒测定细胞中的H2S水平。
2.8caspase-1活性测定各组细胞经不同药物干预24 h后,胰酶消化细胞,并在600×、4 ℃下离心5 min收集细胞,PBS漂洗离心后往细胞团块中加入100 μL裂解液,于冰浴条件下孵育裂解15 min;随后在4 ℃、18 000×条件下将细胞匀浆液离心15 min,并吸取上清检测细胞中的蛋白含量。之后根据caspase-1活性检测试剂盒中提供的的试剂和方法,使用酶标仪检测各组样品405 nm处的吸光度,并根据标准曲线计算各组细胞中的caspase-1活性。
2.9免疫印迹实验向经不同药物处理24 h的细胞中加入120 μL预冷的RIPA细胞裂解液,冰浴裂解20 min;之后将细胞裂解液转移至离心管中,将其在4 ℃、12 000 r/min离心15 min并吸取上清,对各组总蛋白进行蛋白定量。随后用5×蛋白上样缓冲液稀释蛋白样品并取40 µg蛋白上样,在恒压条件下完成SDS-PAGE。采用恒流湿转法将总蛋白转移至PVDF膜上,并将PVDF膜移至封闭液中室温孵育2 h;随后用1∶1 000稀释的一抗溶液将PVDF膜在4 ℃下孵育12~16 h;翌日用TBST溶液洗膜后,向PVDF膜上加入Ⅱ抗溶液(1∶10 000)于室温孵育1.5~2 h。Ⅱ抗孵育后用TBST溶液漂洗,并向膜上加入化学发光显色液,采用X射线胶片对目的蛋白条带进行曝光。对曝光胶片扫描后使用ImageJ软件对各蛋白表达条带进行蛋白积分吸光度分析,以内参照蛋白β-actin表达条带的灰度值对目的蛋白的表达水平进行半定量分析。
3 统计学处理
应用GraphPad Prism 8软件进行统计分析。实验结果采用均数±标准差(mean±SD)表示。采用单因素方差分析进行组间均数比较,多重比较采用LSD-检验。以<0.05为差异有统计学意义。
结果
1 ox-LDL诱导THP-1巨噬细胞发生焦亡
为建立ox-LDL诱导的巨噬细胞焦亡模型,本实验评估了不同浓度ox-LDL对THP-1巨噬细胞焦亡及焦亡关键蛋白表达水平的影响。与空白对照组相比,100和150 mg/L ox-LDL可使THP-1巨噬细胞中的PI阳性染色细胞比例和LDH释放显著升高(<0.05或<0.01),见图1;且100和150 mg/L ox-LDL可使THP-1巨噬细胞中焦亡关键蛋白[NLRP3、caspase-1(p20亚单位)、GSDMD]及焦亡相关炎性介质IL-18的表达水平显著上调(<0.05或<0.01),见图2。

Figure 1. Effect of different concentrations of ox-LDL on the pyroptosis of THP-1-derived macrophages. A: double staining of Hoechst 33342 (blue) and PI (red) in THP-1-derived macrophages (scale bar=50 μm); B: LDH activity in the cell culture supernatants. Mean±SD. n=4. *P<0.05,**P<0.01 vs 0 mg/L group.
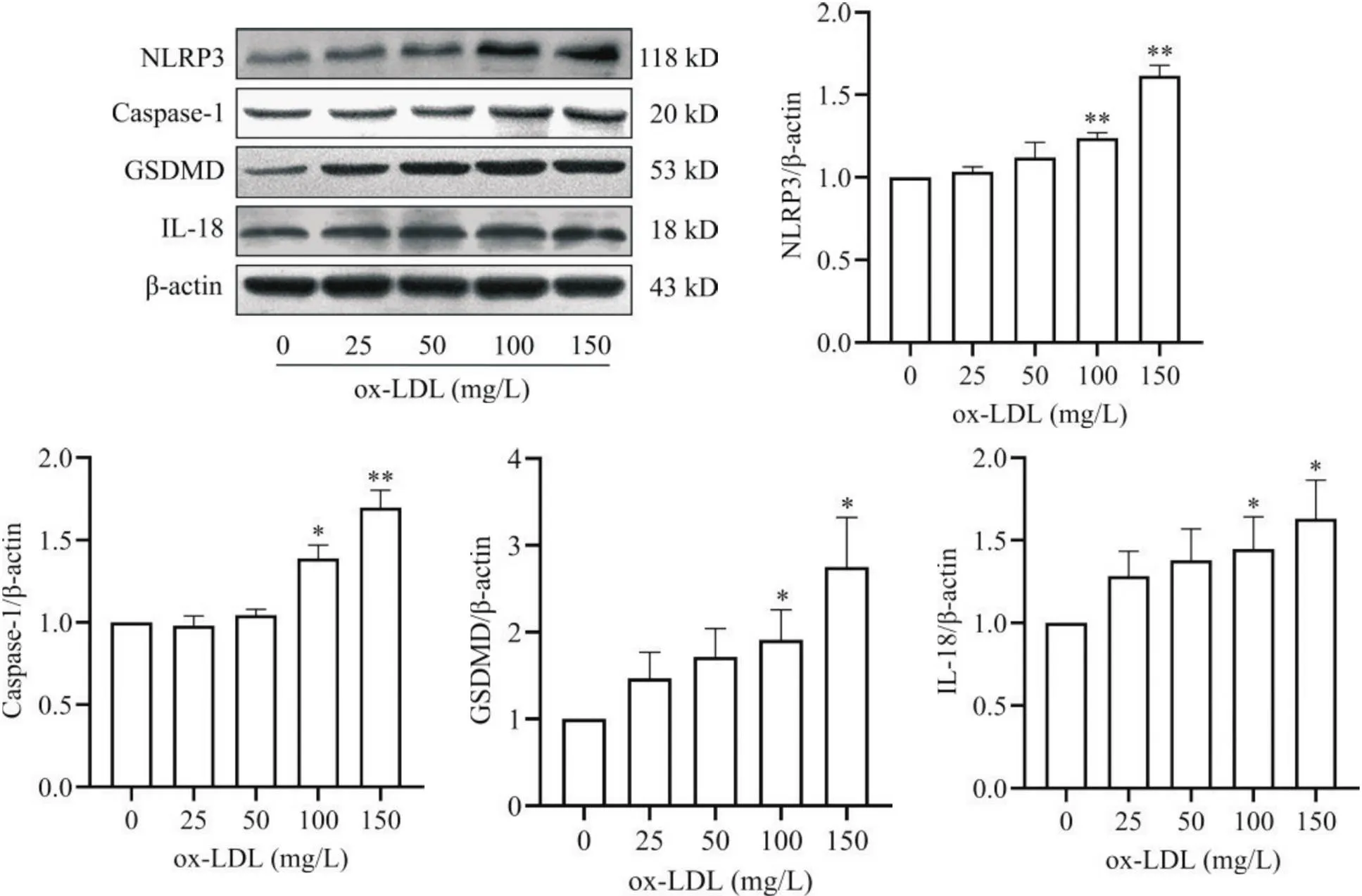
Figure 2. Effect of different concentrations of ox-LDL on the expression of pyroptosis-related proteins in THP-1-derived macrophages. β-actin was used as an internal control. Mean±SD. n=5. *P<0.05,**P<0.01 vs 0 mg/L group.
2 NaHS减轻ox-LDL刺激的THP-1巨噬细胞脂质沉积和细胞焦亡
为初步研究NaHS对ox-LDL诱导的巨噬细胞焦亡的影响,我们采用不同浓度NaHS(50、100、200和400 μmol/L)或/和100 mg/L ox-LDL干预THP-1巨噬细胞,检测了不同浓度NaHS对细胞活力的影响,以及各组THP-1巨噬细胞中的H2S含量、脂质沉积、焦亡细胞形态、PI阳性细胞比例和LDH释放。如图3A所示,与空白对照相比,不同浓度NaHS对THP-1巨噬细胞无毒性作用;而ox-LDL处理的THP-1巨噬细胞中的H2S含量显著减少(<0.01;图3B),并出现明显脂质沉积和以细胞肿胀膨大及气泡状突出物为特点的细胞焦亡(<0.01),且ox-LDL处理可使THP-1巨噬细胞PI阳性细胞比例和LDH释放显著升高(<0.01),见图4~6。与ox-LDL处理组相比,不同浓度NaHS干预则可使THP-1巨噬细胞中的H2S含量显著升高(<0.05或<0.01;图3B),并减轻ox-LDL诱导的THP-1巨噬细胞脂质沉积和细胞焦亡(<0.05或<0.01),见图4、5。此外,中、高浓度(100和200 μmol/L)NaHS干预还可显著降低THP-1巨噬细胞的焦亡细胞比例和LDH释放(<0.01),见图6。
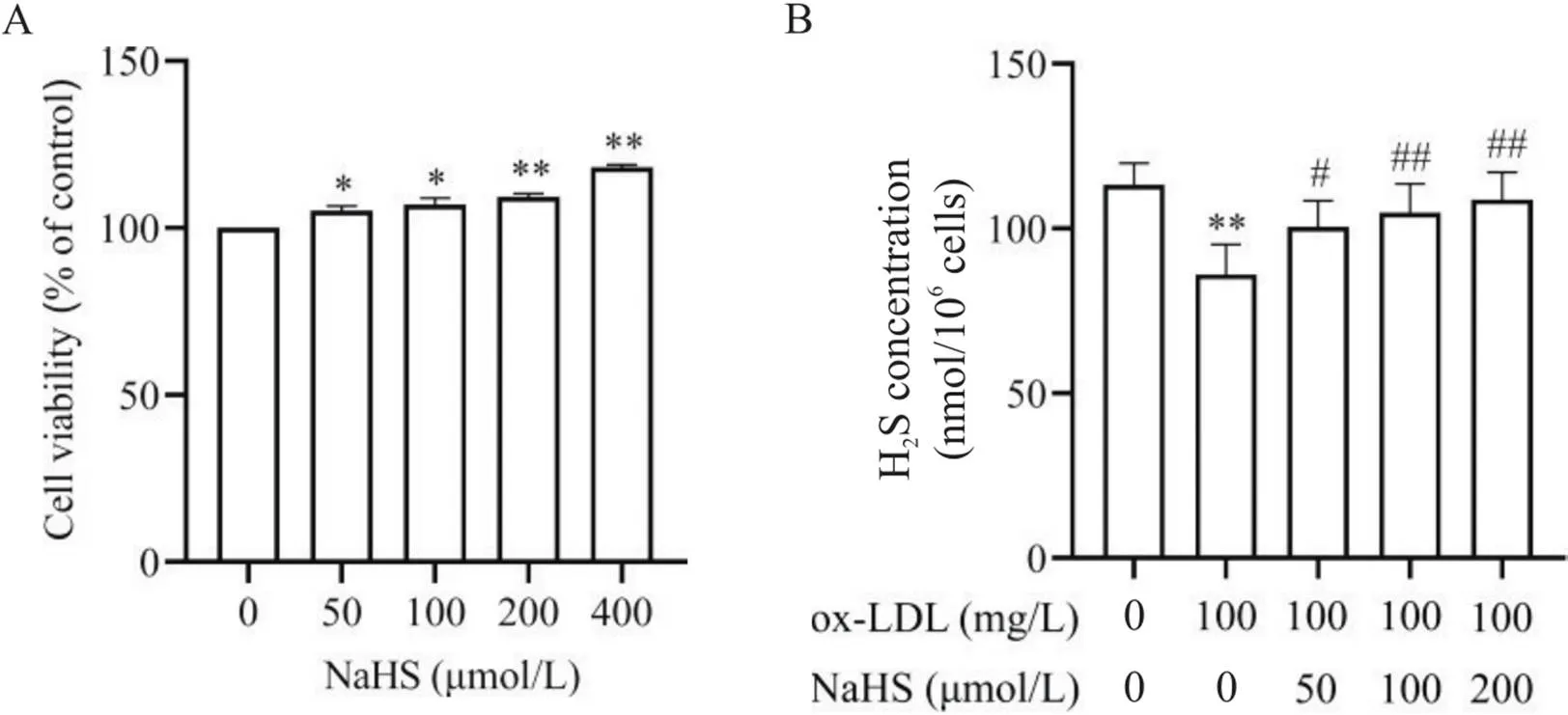
Figure 3. Effect of gradient concentrations of NaHS on the viability (A) and H2S level (B) in THP-1-derived macrophages. Mean±SD. n=5. *P<0.05,**P<0.01 vs control group (0 μmol/L NaHS or 0 μmol/L NaHS+0 mg/L ox-LDL);#P<0.05,##P<0.01 vs ox-LDL (100 mg/L) group.
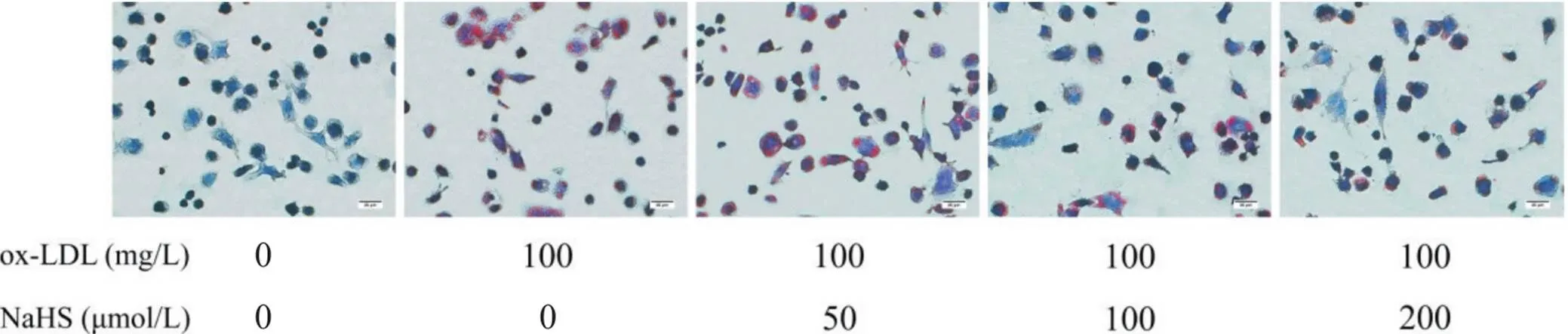
Figure 4. Effect of gradient concentrations of NaHS on lipid accumulation in ox-LDL incubated THP-1-derived macrophages (oil red O staining, scale bar=25 μm).
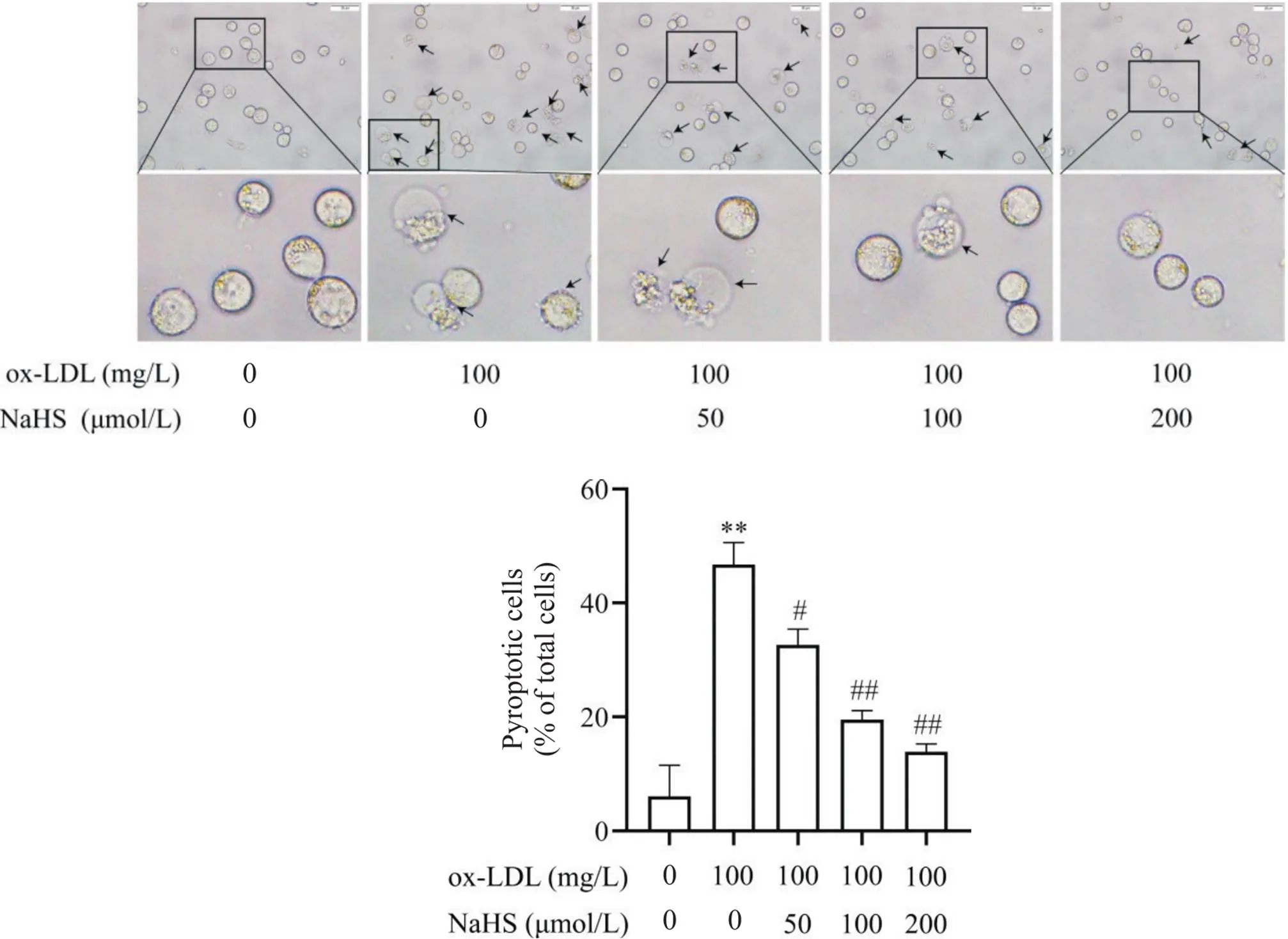
Figure 5. Effect of gradient concentrations of NaHS on morphological characteristics of pyroptosis in ox-LDL-incubated THP-1-derived macrophages. The scale bar=25 μm in the upper panel, and high-power fields with magnified details were shown in the lower panel. The arrowheads indicate typical pyroptotic cells with cell swelling, and large bubbles extending from the plasma membrane with plasma membrane rupture. Mean±SD. n=4. **P<0.01 vs control group (0 μmol/L NaHS+0 mg/L ox-LDL);#P<0.01,##P<0.01 vs ox-LDL (100 mg/L) group.
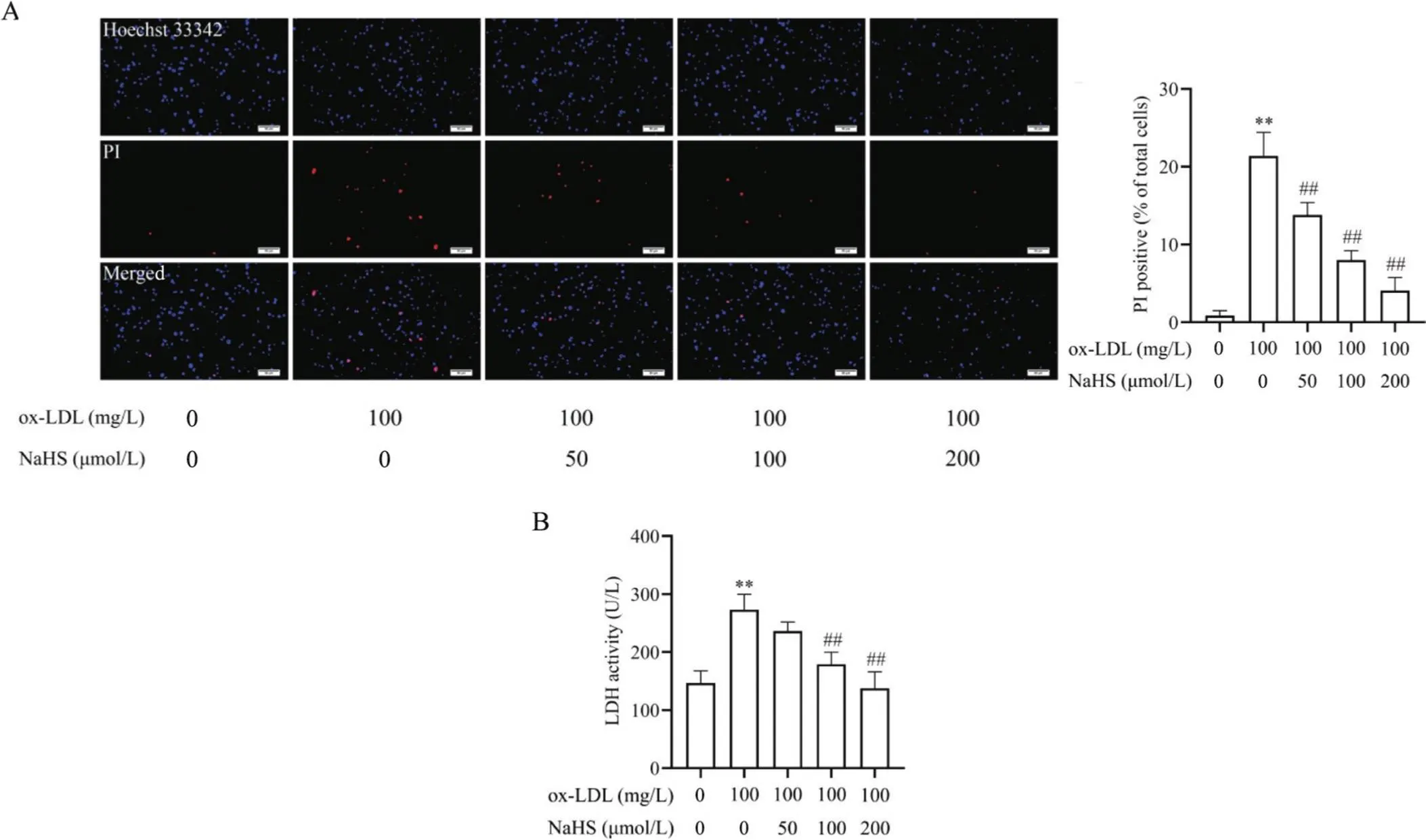
Figure 6. Effect of gradient concentrations of NaHS on ox-LDL-induced pyroptosis of THP-1-derived macrophages. A: double staining of Hoechst 33342 (blue) and PI (red) in THP-1-derived macrophages (scale bar=50 μm); B: LDH activity in the cell culture supernatants. Mean±SD. n=4. **P<0.01 vs control group (0 μmol/L NaHS+0 mg/L ox-LDL);##P<0.01 vs ox-LDL (100 mg/L) group.
3 NaHS抑制ox-LDL处理的THP-1巨噬细胞中焦亡关键酶caspase-1活性和焦亡关键标志蛋白的表达
为进一步探讨NaHS抑制THP-1巨噬细胞焦亡的作用,我们检测了不同浓度NaHS对ox-LDL处理的THP-1巨噬细胞中细胞焦亡关键酶caspase-1活性及焦亡关键蛋白表达水平的影响。结果显示,与空白对照相比,ox-LDL处理可使THP-1巨噬细胞中的caspase-1活性及焦亡关键蛋白的表达水平(<0.01)显著升高;而中、高浓度的NaHS可显著抑制ox-LDL处理的THP-1巨噬细胞中的caspase-1活性(<0.05或<0.01),并显著下调上述焦亡关键标志蛋白的表达(<0.05或<0.01),见图7、8。
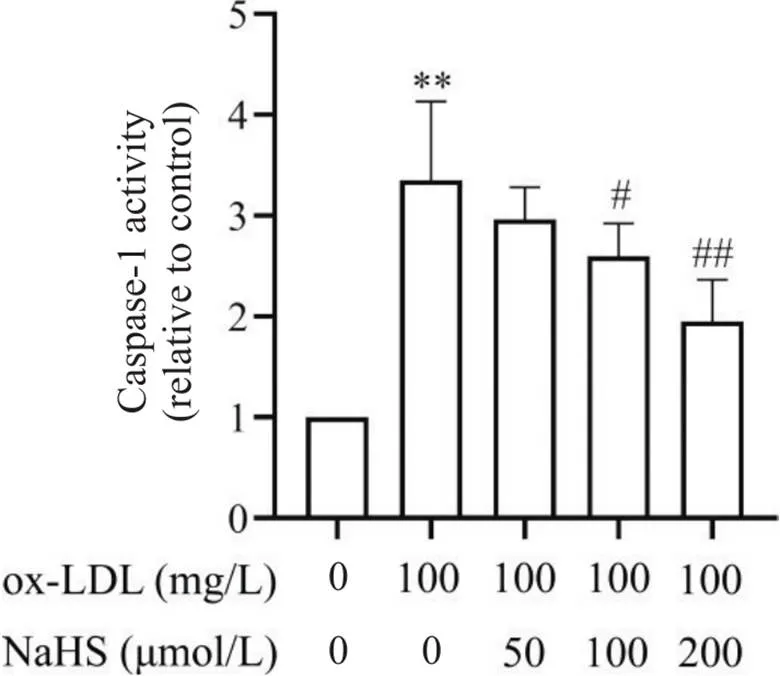
Figure 7. Effect of gradient concentrations of NaHS on the enzymatic activity of caspase-1 in ox-LDL-incubated THP-1-derived macrophages. Mean±SD. n=6. **P<0.01 vs control group (0 μmol/L NaHS+0 mg/L ox-LDL);#P<0.05,##P<0.01 vs ox-LDL (100 mg/L) group.

Figure 8. Effect of gradient concentrations of NaHS on the expression of pyroptosis-related proteins in ox-LDL-incubated THP-1-derived macrophages. β-actin was used as an internal control. Mean±SD. n=5. **P<0.01 vs control group (0 μmol/L NaHS+0 mg/L ox-LDL);#P<0.05,##P<0.01 vs ox-LDL (100 mg/L) group.
讨论
巨噬细胞作为先天免疫和组织修复中的关键免疫细胞,其所形成的泡沫巨噬细胞介导的慢性炎症应答在AS发生发展过程中具有决定性作用[5,7]。因此,抑制巨噬细胞介导的慢性炎症反应对于防治AS具有重要意义。研究表明,AS致病危险因素包括ox-LDL、胆固醇结晶、甘油三酯和同型半胱氨酸诱导巨噬细胞形成泡沫细胞导致AS发生发展[3,5,19]的同时,还可诱导泡沫巨噬细胞发生一种促炎性细胞程序性死亡—细胞焦亡[5, 19],其典型细胞形态特征为膜孔形成、细胞肿胀及其渗透性裂解[17, 20]。在本研究中我们采用光镜观察和细胞焦亡鉴定的金标准[7](PI染色和LDH释放)初步证实了中、高浓度的ox-LDL可显著诱导THP-1巨噬细胞发生以细胞肿胀裂解、PI阳性细胞比例和LDH释放升高为主要特征的细胞焦亡。在体动物和细胞体外研究表明上述AS致病危险因素均可上调并激活细胞焦亡信号通路中的关键蛋白而使巨噬细胞发生焦亡[3, 5, 9, 21]。这与本研究中、高浓度的ox-LDL可明显上调THP-1巨噬细胞中NLRP3、caspase-1、GSDMD、GSDMD-N和IL-18的表达相一致。因此,本研究结果进一步证实了ox-LDL对巨噬细胞焦亡的诱导作用。近期有研究表明阻断NLRP3或caspase-1可有效抑制巨噬细胞焦亡及其介导的AS的发生发展[10-13]。因此,探讨NLRP3-caspase-1-GSDMD介导的巨噬细胞焦亡可为防治AS提供新思路。
近十年来对于信号分子H2S的心血管保护和抗炎作用[14,22]已达成共识,且本研究中也再次证实了不同浓度的H2S供体NaHS对ox-LDL诱导的THP-1巨噬细胞中脂质沉积的抑制作用。然而,H2S是否可抑制ox-LDL诱导的巨噬细胞焦亡尚不清楚。在本文中,我们深入探索了不同浓度NaHS对ox-LDL诱导的THP-1巨噬细胞焦亡和焦亡关键蛋白表达或活性的影响,结果显示ox-LDL在诱导THP-1巨噬细胞焦亡的同时可降低巨噬细胞中的H2S水平。而中、高浓度NaHS处理可显著增加细胞内的H2S水平,且其可通过抑制THP-1巨噬细胞中的caspase-1活性、下调焦亡关键蛋白(NLRP3、Pro-caspase-1、caspase-1、GSDMD、GSDMD-N)和焦亡相关炎性介质(IL-18)的表达而抑制经典焦亡信号通路的激活,进而减轻ox-LDL引发的巨噬细胞焦亡。这与本课题组已发表成果中关于H2S缓释性供体GYY4137可通过下调经典焦亡信号通路而对内皮细胞焦亡发挥抑制作用的研究结果[17]相一致,因此,本研究进一步证实了H2S对细胞焦亡及其信号通路的调控作用。
虽然已有研究表明H2S及其供体可通过下调巨噬细胞中NLRP3炎症小体的表达而发挥抗炎作用[23-27],但这些研究主要聚焦于H2S对巨噬细胞中NLRP3炎症小体激活的抑制作用,因缺少焦亡关键指标的检测而未能充分说明H2S对巨噬细胞焦亡的抑制作用。而本研究不但验证了H2S对NLRP3炎症小体激活的抑制作用,且通过细胞焦亡关键检测指标(光镜观察、PI阳性染色、LDH释放、焦亡关键酶caspase-1活性、焦亡执行者GSDMD蛋白及打孔蛋白GSDMD-N的表达)明确了H2S对巨噬细胞焦亡的抑制效应及其可能机制。然而,本研究结果及当前国内外研究仍局限于H2S供体抑制细胞焦亡信号通路关键蛋白的表达而发挥抗细胞焦亡或抗AS效应的表象认识,而对于H2S通过何种分子机制抑制细胞焦亡并发挥抗AS作用尚不清楚。目前研究认为H2S对功能蛋白的硫巯基化修饰是其发挥生物学功能、影响蛋白质二硫键形成和调节众多功能蛋白活性的关键机制,且硫巯基化修饰与心血管系统稳态维持及AS的发生发展密切相关[28]。因此,H2S是否可通过硫巯基化修饰焦亡关键蛋白而发挥抗细胞焦亡和抗AS效应仍有待于进一步研究。
综上所述,本研究在已有相关研究结果的基础上,在巨噬细胞中进一步提供了H2S通过下调经典焦亡信号通路而对细胞焦亡发挥抑制效应的实验证据。
[1] Zou YP, Luo X, Yi F, et al. Luteolin prevents THP-1 macrophage pyroptosis by suppressing ROS production via Nrf2 activation[J]. Chem Biol Interact, 2021, 345:109573.
[2] Yuan YY, Xie KX, Wang SL, et al. Inflammatory caspase-related pyroptosis: mechanism, regulation and therapeutic potential for inflammatory bowel disease[J]. Gastroenterol Rep, 2018, 6(3):167-176.
[3] He X, Fan XH, Bai B, et al. Pyroptosis is a critical immune-inflammatory response involved in atherosclerosis [J]. Pharmacol Res, 2021, 165:105447.
[4] Sanz AB, Sanchez-Niño MD, Izquierdo MC, et al. Macrophages and recently identified forms of cell death[J]. Int Rev Immunol, 2014, 33(1):9-22.
[5] Wang Q, Wu JF, Zeng YC, et al. Pyroptosis: a pro-inflammatory type of cell death in cardiovascular disease[J]. Clin Chim Acta, 2020, 510:62-72.
[6] Huang SS, Guo DY, Jia BB, et al. Dimethyl itaconate alleviates the pyroptosis of macrophages through oxidative stress[J]. BMC Immunol, 2021, 22(1):72.
[7] Zeng ZL, Li GH, Wu SY, et al. Role of pyroptosis in cardiovascular disease[J]. Cell Prolif, 2019, 52(2):e12563.
[8] Jia C, Chen HW, Zhang J, et al. Role of pyroptosis in cardiovascular diseases[J]. Int Immunopharmacol, 2019, 67:311-318.
[9] Xu YJ, Zheng L, Hu YW, et al. Pyroptosis and its relationship to atherosclerosis[J]. Clin Chim Acta, 2018, 476:28-37.
[10] Hendrikx T, Jeurissen ML, van Grop PJ, et al. Bone marrow-specific caspase-1/11 deficiency inhibits atherosclerosis development in-/-mice[J]. FEBS J, 2015, 282(12):2327-2338.
[11] Zeng WY, Wu DB, SunYX, et al. The selective NLRP3 inhibitor MCC950 hinders atherosclerosis development by attenuating inflammation and pyroptosis in macrophages [J]. Sci Rep, 2021, 11(1):19305.
[12] Sharma A, Choi JSY, Stefanovic N, et al. Specific NLRP3 inhibition protects against diabetes-associated atherosclerosis [J]. Diabetes, 2021, 70(3):772-787.
[13] Abderrazak A, Couchie D, Mahmood DF, et al. Anti-inflammatory and antiatherogenic effects of the NLRP3 inflammasome inhibitor arglabin in ApoE2.Ki mice fed a high-fat diet[J]. Circulation, 2015, 131(12):1061-1070.
[14] Zhang L, Wang YN, Li Y, et al. Hydrogen sulfide (H2S)-releasing compounds: therapeutic potential in cardiovascular diseases[J]. Front Pharmacol, 2018, 9:1066.
[15] Ni J, Li Y, Guo R. Salidroside protects against foam cell formation and apoptosis, possibly via the MAPK and AKT signaling pathways[J]. Lipids Health Dis, 2017, 16(1):198.
[16] Wu D, Li J, Zhang Q, et al. Exogenous hydrogen sulfide regulates the growth of human thyroid carcinoma cells [J]. Oxid Med Cell Longev, 2019, 2019:6927298.
[17] 何婷婷,张旭琳,贾珍丽,等. 硫化氢通过下调NLRP3/caspase-1信号通路抑制氧化型低密度脂蛋白诱导的血管内皮细胞焦亡[J]. 中国病理生理杂志, 2021, 37(10): 1738-46.
He TT, Zhang XL, Jia ZL, et al. Hydrogen sulfide inhibits oxidized low-density lipoprotein-induced pyroptosis in vascular endothelial cells by down-regulating NLRP3/caspase-1 signaling pathway[J]. Chin J Pathophysiol, 2021, 37(10):1738-1746.
[18] Wu XX, Zhang HY, Qi W, et al. Nicotine promotes atherosclerosis via ROS-NLRP3-mediated endothelial cell pyroptosis[J]. Cell Death Dis, 2018, 9(2):171.
[19] Zeng C, Wang RQ, Tan HM. Role of pyroptosis in cardiovascular diseases and its therapeutic implications[J]. Int J Biol Sci, 2019, 15(7):1345-1357.
[20] 赵梦繁,苏日娜,毛钦,等. 犀角地黄汤合银翘散通过干预mtROS-NLRP3通路抑制流感病毒感染的巨噬细胞焦亡[J]. 中国病理生理杂志, 2021, 37(6):1049-1054.
Zhao MF, Su RN, Mao Q, et al. Xijiao-Dihuang decoction with Yinqiao powder inhibits pyroptosis of macrophages caused by influenza virus via interfering with mtROS-NLRP3 pathway[J]. Chin J Pathophysiol, 2021, 37(6):1049-1054.
[21] Martinet W, Coornaert I, Puylaert P, et al. Macrophage death as a pharmacological target in atherosclerosis[J]. Front Pharmacol, 2019, 10:306.
[22] Zhang HH, Bai ZJ, Zhu LQ, et al. Hydrogen sulfide donors: therapeutic potential in anti-atherosclerosis[J]. Eur J Med Chem, 2020, 205:112665.
[23] Wang HG, Shi XZ, Qiu MY, et al. Hydrogen sulfide plays an important role by influencing NLRP3 inflammasome[J]. Int J Biol Sci, 2020, 16(14):2752-2760.
[24] Qin M, Long F, Wu WJ, et al. Hydrogen sulfide protects against DSS-induced colitis by inhibiting NLRP3 inflammasome[J]. Free Radic Biol Med, 2019, 137:99-109.
[25] Lin Z, Altaf N, Li C, et al. Hydrogen sulfide attenuates oxidative stress-induced NLRP3 inflammasome activation via-sulfhydrating c-Jun at Cys269 in macrophages[J]. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(9):2890-2900.
[26] Castelblanco M, Lugrin J, Ehirchiou D, et al. Hydrogen sulfide inhibits NLRP3 inflammasome activation and reduces cytokine production both in vitro and in a mouse model of inflammation[J]. J Bio Chem, 2018, 293(7):2546-2557.
[27] Luo ZL, Ren JD, Huang Z, et al. The role of exogenous hydrogen sulfide in free fatty acids induced inflammation in macrophages[J]. Cell Physiol Biochem, 2017, 42(4):1635-1644.
[28] Gupta R, Sahu M, Tripathi R, et al. Protein-sulfhydration: unraveling the prospective of hydrogen sulfide in the brain, vasculature and neurological manifestations[J]. Ageing Res Rev, 2022, 76:101579.
Sodium hydrosulfide attenuates pyroptosis of macrophages by inhibiting classical pyroptosis signaling pathway
ZHANG Xu-lin1, TIAN Xiang-qin2,3▲, JIA Zhen-li1, LIU Bo-wei1, LIANG Gao-yuan1, ZHANG Zi-chen1, LI Ling1△, ZHANG Liang1,2△
(1,,832003,;2,,,,832008,;3,,453003,)
To investigate the effect of hydrogen sulfide (H2S) donor sodium hydrosulfide (NaHS) on the pyroptosis of macrophages.Human acute monocytic leukemia cell line THP-1 was induced to differentiate into macrophages by phorbol 12-myristate 13-acetate (PMA) stimulation. The PMA-induced THP-1 cells were treated with oxidized low-density lipoprotein (ox-LDL) or/and NaHS at different concentrations and then were divided into control group, ox-LDL (25, 50, 100 and 150 mg/L) treatment groups and different concentrations (50, 100 and 200 μmol/L) of NaHS+ox-LDL (100 mg/L) treatment groups. The viability of THP-1 cells was detected by CCK-8 assay. Lipid accumulation and pyroptotic morphological changes in THP-1 cells were observed by oil red O staining and light microscopy, respectively. Pyroptosis of the THP-1 cells was evaluated by Hoechst 33342/propidium iodide (PI) fluorescence staining and measurement of lactate dehydrogenase (LDH) activity in the cell supernatants. The level of H2S in THP-1 cells was detected by H2S detection assay kit. The enzymatic activity of caspase-1 in THP-1 cells were measured by caspase-1 activity assay kit. The expressional levels of pyroptosis-related proteins in THP-1 cells were analyzed by Western blot.Compared with control group, percentage of PI positive cells, LDH release, caspase-1 activity, and the protein levels of nucleotide-binding oligomerization domain-like receptor protein 3 (NLRP3), caspase-1 (p20), gasdermin D (GSDMD), GSDMD-N and interleukin-18 (IL-18) were markedly increased by stimulation with 100 and 150 mg/L of ox-LDL (<0.05 or<0.01). In addition, ox-LDL (100 mg/L) induced lipid accumulation and typical pyroptotic death in THP-1 cells. However, pre-treatment with NaHS (100 and 200 μmol/L) significantly reduced ox-LDL-induced lipid accumulation and pyroptosis in THP-1 cells, and suppressed caspase-1 activity and the up-regulation of specific markers of pyroptosis signaling pathway in ox-LDL-stimulated THP-1 cells (<0.05 or<0.01).The H2S donor NaHS attenuates pyroptotic cell death induced by ox-LDL in macrophages by inhibiting classical pyroptosis signaling pathway.
Hydrogen sulfide; Oxidized low-density lipoprotein; Macrophages; Pyroptosis
R543.5; R363.2
A
10.3969/j.issn.1000-4718.2022.06.008
1000-4718(2022)06-1015-09
2022-03-25
2022-05-26
国家自然科学基金资助项目(No. 81600325);中国医学科学院中央级公益性科研院所基本科研业务费专项资金(No. 2020-PT330-003);国家卫生健康委中亚高发病防治重点实验室开放课题(No. KF202107);兵团“强青科技领军人才”项目(No. 2022CB002-10);自治区研究生创新计划项目(No. XJ2021G130);国家级大学生创新创业训练计划(No. 202110759023)
张亮 Tel: 0993-2058775; E-mail: zxn20171220@126.com;李玲 Tel: 18209058319; E-mail: 550856991@qq.com
▲并列第1作者
(责任编辑:卢萍,罗森)

